普外科膽管手術患者細菌感染分布特征及藥敏分析
彭曉飛 陳凌娟
【摘要】? 目的? ? 探討普外科膽管手術患者細菌感染分布特征及藥敏情況,為臨床合理使用抗菌藥物提供重要參考。方法? ? 選取2017年1月—2020年12月清遠市人民醫院行膽管手術治療的100例患者作為研究對象,術中均無菌操作下抽取5 mL膽汁作為送檢標本。統計病原菌分布情況,并對主要病原菌進行耐藥性分析。結果? ? 100例普外科膽管手術患者共分離出66株細菌,其中革蘭陰性菌48株,占比72.73%;革蘭陽性菌18株,占比27.27%。大腸埃希菌、肺炎克雷伯菌及陰溝腸桿菌對亞胺培南、美羅培南耐藥性最低,大腸埃希菌對左氧氟沙星耐藥性最高,肺炎克雷伯菌對環丙沙星耐藥性最高,陰溝腸桿菌對氨芐西林耐藥性最高;腸球菌屬、表皮葡萄球菌、金黃色葡萄球菌對利奈唑胺、萬古霉素耐藥性最低,腸球菌屬對四環素耐藥性最高,表皮葡萄球菌對紅霉素、四環素耐藥性最高,金黃色葡萄球菌對紅霉素耐藥性最高。結論? ? 膽管手術患者體內病原菌分布以革蘭陰性菌為主,其次為革蘭陽性菌,且兩類病原菌耐藥現象均較為嚴重,臨床需依據藥敏試驗結果選取適宜抗菌藥物,并提高臨床合理用藥意識,以減少耐藥菌產生。
【關鍵詞】? 膽管手術;細菌感染;病原菌分布;藥敏分析
Bacterial infection distribution characteristics and drug sensitivity analysis of patients undergoing biliary tract surgery in general surgery
Peng Xiaofei,Chen Lingjuan.The Sixth Affiliated Hospital of Guangzhou Medical University,The People's Hospital of Qingyuan City,Qingyuan,Guangdong? 511518
【Abstract】? Objective? ? To investigate the distribution characteristics and drug sensitivity of bacterial infections in patients undergoing biliary tract surgery in general surgery, and to provide important references for the rational use of antimicrobials in clinical practice.Methods? ? A total of 100 patients who underwent biliary tract surgery in our hospital from January 2017 to December 2020 were selected as the research objects. During the operation, 5 mL of bile was taken as the specimen for examination under aseptic operation.Count the distribution of pathogens and analyze the resistance of the main pathogens.Results? ? A total of 66 strains of bacteria were isolated from 100 patients undergoing biliary tract surgery in general surgery, of which 48 were Gram-negative bacteria, accounting for 72.73%; 18 Gram-positive bacteria, accounting for 27.27%; Escherichia coli, Cree pneumoniae Burberry and Enterobacter cloacae have the lowest resistance to imipenem and meropenem; Escherichia coli has the highest resistance to levofloxacin, Klebsiella pneumoniae has the highest resistance to ciprofloxacin, and Enterobacter cloacae has the highest resistance to levofloxacin Ampicillin has the highest resistance; Enterococcus, Staphylococcus epidermidis, and Staphylococcus aureus have the lowest resistance to linezolid and vancomycin; Enterococcus has the highest resistance to tetracycline, and Staphylococcus epidermidis is resistant to erythromycin , Tetracycline has the highest resistance, and Staphylococcus aureus has the highest resistance to erythromycin.Conclusion? ? The distribution of pathogenic bacteria in patients undergoing biliary tract surgery is mainly gram-negative bacteria, followed by gram-positive bacteria. The drug resistance of the two types of pathogenic bacteria is relatively serious. It is necessary to select appropriate antibacterial drugs based on the results of drug susceptibility tests and improve clinical practice. Reasonable medication awareness to reduce the generation of drug-resistant bacteria.
【Key Words】? Biliary tract surgery;Bacterial infection;Pathogen distribution;Drug sensitivity analysis
中圖分類號:R639? ? ? ? 文獻標識碼:A? ? ? ? 文章編號:1672-1721(2023)05-0004-03
DOI:10.19435/j.1672-1721.2023.05.002
膽管疾病臨床發病率較高,依據發病急緩可分為急性、亞急性及慢性三大類,嚴重威脅身體健康[1-2]。目前,臨床認為膽管疾病多是由膽汁淤滯、膽管梗阻等多種因素所致,抗菌藥物在膽管疾病治療中使用較為頻繁,屬于僅次于手術的重要治療措施。即使是采用手術治療,在膽管疾病患者術前也多予以經驗性抗菌藥物治療,以加快膽管周圍炎癥消退,為手術創造良好條件。但隨著抗菌藥物的廣泛應用,諸多不合理用藥現象出現,使得病原菌耐藥性不斷增強,給臨床治療帶來極大困難[3-4]。因此,及時進行病原菌培養,掌握膽管疾病患者體內病原菌分布特點,并進行藥敏試驗,了解病原菌耐藥情況,對臨床合理選用抗菌藥物具有重要意義[5-6]。本研究旨在分析普外科膽管手術患者細菌感染分布特征及藥敏情況,為指導臨床合理用藥提供參考。
1? ? 資料與方法
1.1? ? 一般資料? ? 選取2017年1月—2020年12月清遠市人民醫院行膽管手術治療的100例患者為研究對象。其中男58例,女42例;年齡28~65歲,平均年齡(43.28±4.36)歲;疾病類型:急性結石性膽囊炎51例,慢性結石性膽囊炎20例,急性膽管炎29例。納入標準:行膽管手術治療;經B超、CT等影像學手段確診膽管系統疾病;患者及家屬知情同意。排除標準:嚴重精神障礙;伴有惡性腫瘤;心肺功能欠佳。
1.2? ? 方法? ? 所有研究對象均于術中無菌操作下抽取5 mL膽汁作為送檢標本,立即注入無菌培養瓶內,送至實驗室進行病原菌培養及分離。培養方法:將膽汁標本接種于梅里埃需氧血培養瓶內,置于自動培養儀,待儀器報告陽性后,參照《全國臨床檢驗操作規程》進行轉種分離純化。采用VITEK 2 Compact全自動微生物分析系統鑒定分離菌株的菌種,并采用全自動微生物分析系統及K-B擴散法對分離出的病原菌進行藥敏試驗。藥敏試驗結果參照美國臨床實驗室標準化協會M100-S27標準進行判讀。質控菌株包括大腸埃希菌ATCC 25922、肺炎克雷伯菌ATCC 700603、金黃色葡萄球菌ATCC 25923、銅綠假單胞菌ATCC 27853、糞腸球菌ATCC 29212。
1.3? ? 觀察指標? ? 統計膽管手術患者細菌感染分布特征及藥敏情況。
2? ? 結果
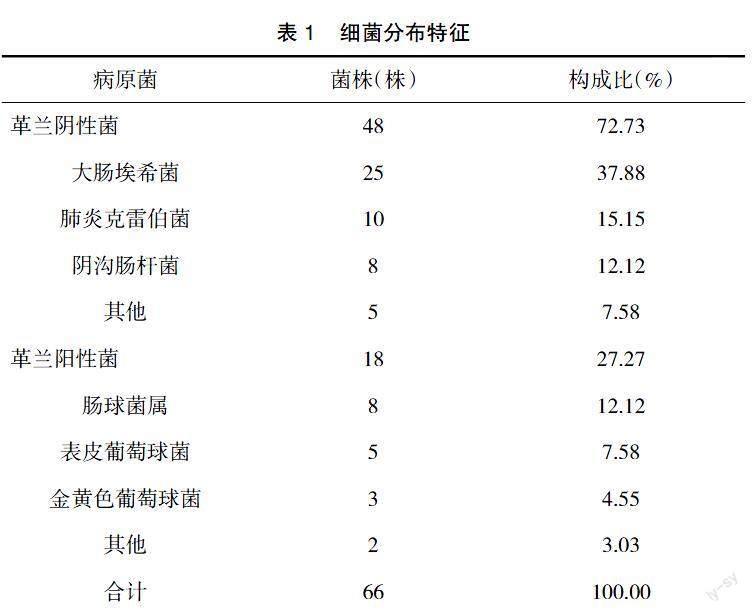
2.1? ? 細菌分布特征? ? 100例普外科膽管手術患者共分離出66株細菌,其中革蘭陰性菌48株,占比72.73%;革蘭陽性菌18株,占比27.27%,見表1。
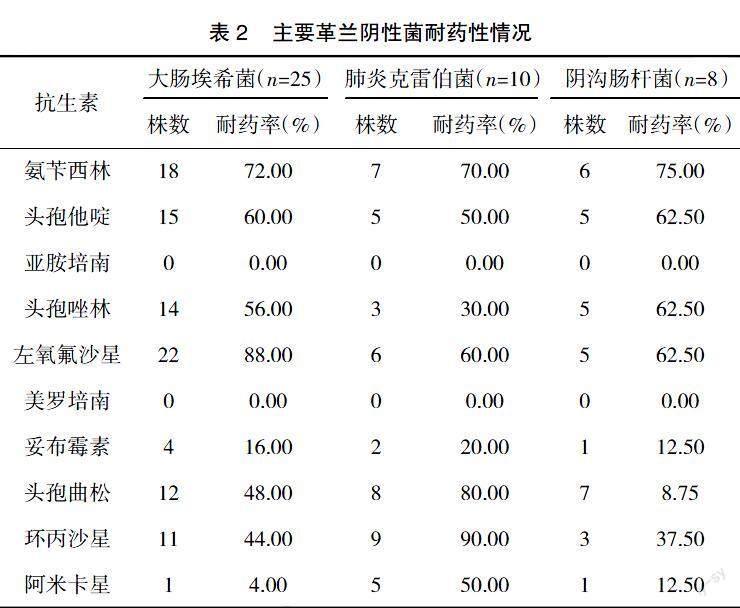
2.2? ? 主要革蘭陰性菌耐藥性情況? ? 大腸埃希菌、肺炎克雷伯菌及陰溝腸桿菌對亞胺培南、美羅培南耐藥性最低;大腸埃希菌對左氧氟沙星耐藥性最高,肺炎克雷伯菌對環丙沙星耐藥性最高,陰溝腸桿菌對氨芐西林耐藥性最高;其他抗菌藥物耐藥性不一,見表2。
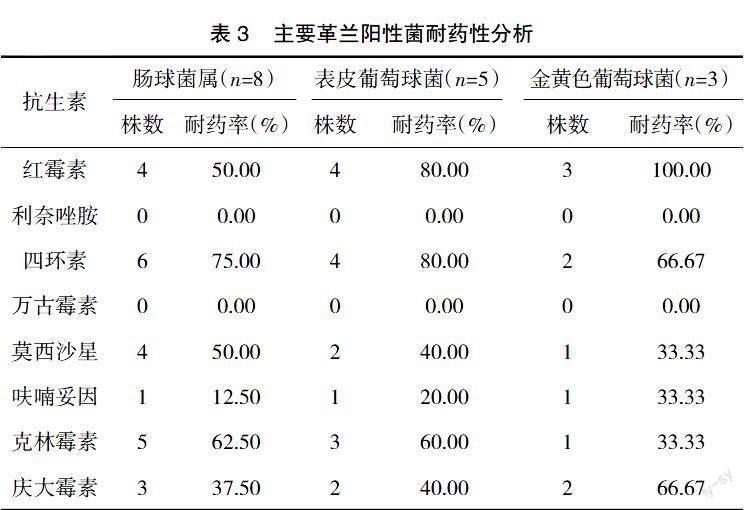
2.3? ? 主要革蘭陽性菌耐藥情況? ? 腸球菌屬、表皮葡萄球菌、金黃色葡萄球菌對利奈唑胺、萬古霉素耐藥性最低;腸球菌屬對四環素耐藥性最高,表皮葡萄球菌對紅霉素、四環素耐藥性最高,金黃色葡萄球菌對紅霉素耐藥性最高;其他抗菌藥物耐藥性不一,見表3。
3? ? 討論
正常情況下膽汁處于無菌狀態,而膽管結石、增生性狹窄、腫瘤等會引起膽管梗阻,導致膽汁大量淤滯,腸道病原菌易逆行經血液等途徑進入膽管,誘發膽管感染,故膽管感染的細菌分布特征與腸道細菌種類存在高度相似性[7-8]。抗菌藥物是治療膽管感染性疾病的重要手段,合理選用抗菌藥物能加快局部細菌清除,減輕膽管周圍炎癥反應,且對于重癥需行手術患者而言,早期抗菌藥物使用可促進膽管周圍炎性水腫消退,為手術治療提供良好條件。
隨著抗菌藥物濫用現象日益增多,細菌耐藥性及分布特征也發生了一定變化,需及時進行病原菌監測,掌握其分布特征,并通過藥敏試驗了解其耐藥性情況,以選取敏感性高的抗菌藥物治療,促使疾病快速好轉[9-10]。本研究結果顯示,100例普外科膽管手術患者共分離出66株細菌,其中革蘭陰性菌48株,占比72.73%;革蘭陽性菌18株,占比27.27%。提示革蘭陰性菌為膽管手術患者體內主要病原菌,且革蘭陰性菌以大腸埃希菌、肺炎克雷伯菌及陰溝腸桿菌為主,革蘭陽性菌以腸球菌屬、表皮葡萄球菌、金黃色葡萄球菌為主,與臨床認為的膽管感染細菌與腸道細菌種類高度相似這一理論相符合[11-12]。同時,本研究結果顯示,大腸埃希菌、肺炎克雷伯菌及陰溝腸桿菌對亞胺培南、美羅培南耐藥性最低;大腸埃希菌對左氧氟沙星耐藥性最高,肺炎克雷伯菌對環丙沙星耐藥性最高,陰溝腸桿菌對氨芐西林耐藥性最高。提示革蘭陰性菌整體耐藥現象較為嚴重,需引起臨床高度重視,且碳青霉烯類抗菌藥物對其敏感性高。其原因為碳青霉烯類抗菌藥物通過抑制細菌細胞壁合成而滅殺細菌,且具有較強的細胞膜穿透性,加之亞胺培南、美羅培南對絕大多數β2內酰胺酶穩定,故不易受細菌耐藥機制影響,可取得理想抗菌效果。
本研究結果顯示,腸球菌屬、表皮葡萄球菌、金黃色葡萄球菌對利奈唑胺、萬古霉素耐藥性最低;腸球菌屬對四環素耐藥性最高,表皮葡萄球菌對紅霉素、四環素耐藥性最高,金黃色葡萄球菌對紅霉素耐藥性最高。提示革蘭陽性菌耐藥情況也不容樂觀,對廣譜抗菌藥物普遍存在一定程度耐藥現象,僅對利奈唑胺、萬古霉素未出現耐藥菌株。其原因為利奈唑胺屬于惡唑烷酮類抗生素,主要用于治療革蘭陽性菌引起的感染,可直接作用于細菌50S核糖體亞單位,阻止mRNA與核糖體連接,從而減少70S起始復合物形成,抑制細菌蛋白質合成,以加快細菌凋亡。且該藥作用部位及方式獨特,即使在獲得耐藥特征的陽性細菌中,也不易與其他抑制蛋白合成的抗菌藥物產生交叉耐藥,體外也不易誘導細菌耐藥性的生成,故可取得理想抗菌效果[13]。萬古霉素亦屬于窄譜抗菌藥物,僅用于革蘭陽性菌引起的感染,臨床應用存在較高局限性,被稱為人類生命的最后一道防線,不易產生耐藥性,故仍存在較高敏感性[14]。臨床需規范醫師用藥,定期開展抗菌藥物使用相關知識培訓,提高整體專業素養,并進行合理用藥監測,以確保抗菌藥物合理選用,減少耐藥菌株生成。
綜上所述,革蘭陰性菌為膽管手術患者體內主要病原菌,臨床在經驗性給藥時可優先選取革蘭陰性菌敏感抗菌藥物治療,若一定時間內療效不佳,則需考慮革蘭陽性菌感染,應加用或更換革蘭陽性菌敏感藥物,以加快病原菌清除。
參考文獻
[1]? ? 李靜,吳廣利,牛瓊,等.梗阻性黃疸患者膽汁病原菌培養及藥敏分析[J].中國內鏡雜志,2018,24(2):94-99.
[2]? ? 鄭秀玲,江平,廖鉑,等.不同疾病膽道感染患者的膽汁菌群分布及影響因素分析[J].武漢大學學報(醫學版),2020,41(5):786-790.
[3]? ? 陳圣開,吳曉春,劉永.細菌性肝膿腫與膽道感染的病原菌及藥敏試驗比較分析[J].安徽醫藥,2020,24(5):981-985.
[4]? ? 殷銳,錢娟,蘇煒,等.老年膽道感染患者膽汁中菌群情況及耐藥性[J].中國臨床研究,2020,33(2):207-210.
[5]? ? 鄧天芝,陳曉梅,龍洪航,等.膽總管結石患者膽汁病原菌分布特點及耐藥性分析[J].現代生物醫學進展,2018,18(17):3301-3305,3254.
[6]? ? 徐紅云,陳弟,袁文麗,等.膽結石合并膽道感染病原菌譜及耐藥機制分析[J].中國抗生素雜志,2018,43(10):1252-1256.
[7]? ? 趙嘉美,郭丹丹,李文利,等.膽總管結石合并感染患者鼻膽管引流前后膽汁細菌分布及其耐藥性[J].中國感染控制雜志,2018,17(6):512-516.
[8]? ? 汪倩鈺,李從榮,郭靜,等.膽道疾病患者膽汁病原菌譜與耐藥監測[J].肝膽胰外科雜志,2019,31(7):417-421.
[9]? ? 龐紹春,吳國忠,黃永亨.膽囊切除術患者膽汁培養和藥敏分析[J].肝膽胰外科雜志,2019,31(8):489-492.
[10]? ? 陳明慧,陳莎燕,房杰,等.2016—2018年臨床常見膽道感染病原菌分布及耐藥性變遷[J].中國實驗診斷學,2019,23(12):2081-2085.
[11]? ? 李松財,湯武亨,金海,等.膽道疾病患者膽道感染的病原學特征及危險因素[J].中華醫院感染學雜志,2020,30(21):3321-3325.
[12]? ? 呂昊澤,呂國悅.405例膽汁分離細菌的分布及耐藥性分析[J].中國實驗診斷學,2019,23(12):2140-2141.
[13]? ? 王梁敏,季坤,史利卿,等.2015—2017年醫院臨床分離菌分布特征及耐藥情況動態分析[J].中華醫院感染學雜志,2018,28(24):3738-3741,3754.
[14]? ? 劉立彬,楊連營,杜慶云,等.膽總管結石合并急性膽管炎患者PTCD膽汁與血培養病原菌分布及耐藥性分析[J].中華醫院感染學雜志,2019,29(5):726-729.
(收稿日期:2022-11-12)

