藏藥七十味珍珠丸治療阿爾茨海默病研究進展
趙健黎 張夢如 鄭博文 閆清偉 劉銅華 孫芳云*
1.西藏民族大學藏藥檢測技術教育部工程研究中心,陜西 咸陽 712082;2.西藏民族大學體育學院,陜西 咸陽 712082;3.西藏藏醫藥大學,西藏 拉薩 850007
阿爾茨海默病(alzheimer disease,AD)是老年癡呆的主要亞型,約占全部癡呆類型的60%[1],是老年人群中一種常見的神經退行性疾病,主要表現為認知功能障礙和記憶力下降,其發病率隨年齡增長而增加。我國作為人口大國,老齡化日益加重,而AD作為一種最為常見的老年疾病,其不可治愈的現狀已經成為社會關注的熱點。截止2015年,我國AD患者已達1200萬,且人數呈不斷增高態勢,預計2050年將達到3000萬[2]。因此,尋找安全有效的AD治療方法具有非常重要的意義。
藏醫藥理論經歷代藏醫藥學家的不斷實踐與研究,已形成相對完善的醫療理論體系。作為高原地區的特色民族醫學,藏醫藥理論經過幾千年的發展與傳承,在疾病治療中發揮著獨特作用,尤其在某些疑難雜癥中更是起到了顯著效果。七十味珍珠丸(Ratanasampil,RNSP)作為藏民族傳統醫學的瑰寶,最早源于《四部醫典》中的二十五味珍珠丸,后經藏醫藥學家不斷的改進與完善研制而成,主要用于癲癇、腦出血、腦梗死、中風等疾病的治療[3-4]。近年來研究發現,RNSP在治療AD等神經退行性疾病中具有較好療效。但目前對于RNSP臨床研究尚未完善,且RNSP改善AD具體藥理作用機制尚未明晰,制約了RNSP的臨床使用與推廣。基于此,本文將梳理RNSP在治療AD方面的作用,找到RNSP改善AD病理的可能機制,為RNSP防治AD研究提供理論依據與參考。
1 AD病因研究
1.1 現代研究觀點 β淀粉樣蛋白(β-amyloid,Aβ)沉積以及Tau蛋白過度磷酸化(p-Tau)是造成AD發病的重要因素。Aβ是由淀粉樣前體蛋白(amyloid precursor protein,APP)經β-分泌酶(β-site APP cleaving enzyme,BACE-1)和γ-分泌酶水解后產生[5],其可與細胞表面受體及細胞中重要細胞器共定位,誘發胞內導致氧化應激、內質網應激以及線粒體功能障礙等現象,進而導致神經細胞的凋亡[6-7]。Tau蛋白是一種微管神經元蛋白,正常情況下可參與微管的裝配與穩定。當機體發生病變時,p-Tau會形成神經纖維纏結,降低其與微管的親和力,進而影響細胞功能(突觸傳遞、軸突運輸、信號轉導)[8]。此外,研究[6,9]發現AD患者腦內還存在能量代謝障礙以及自噬異常等現象。上述病理表現均嚴重損害AD患者認知與記憶能力,加重患者病情。而如何對上述病理表現進行針對性治療可能是治療AD的關鍵。
1.2 傳統藏醫研究觀點 阿爾茨海默病的藏文名為“昏露”,是一種以記憶力衰退(即杰泄癥,又稱健忘癥)為主要表現的的神經性疾病[10]。藏醫學認為,疾病的發生是由外源及內因導致的,其中外源是指疾病發生條件和原因,包括情緒變化、生活習慣、季節環境、年齡性別、飲食因素、生物因素、外部損傷等;內因則包含隆、赤巴和培根三種要素,這既是人體進行生理活動的能量與物質基礎,也是疾病發生機制以及治療原理的重要理論依據[11]。藏醫認為,機體隨著年齡的增長會使隆功能失調,從而影響赤巴與培根,導致人體精力不足,而當機體長時間處于心力衰弱以及焦慮抑郁等隆失調狀態時會導致健忘癥的產生與加重[12]。隆紊亂包括“緊久隆、恰不欺隆、索增隆、吐塞隆以及麥娘姆隆等”。其中“緊久隆”主要表現為記憶力減退、口吃喑啞、體力減弱、口眼歪斜等,與AD核心癥狀記憶力衰退相似;而“恰不欺隆”主要表現為暈厥,妄言譫語,常欲行走,產生恐懼等,部分表現與AD患者認知功能障礙較為相似[13]。此外,“恰不欺隆”主要運行于心臟,心臟作為隆運轉的中心,主管人的意識活動,具有增強記憶的能力[14]。《月王藥診》中記載:心臟病分為瘋癲癥和癔病兩類,其病因包括隆、赤巴、培根三者,而隆型癔病癥狀主要包括心悸、健忘以及胸部刺痛[15]。因此傳統藏醫認為,AD的發病原因與心臟功能的損傷具有重要聯系。且現代醫學研究[16-17]表明,心臟的損傷與AD的發生發展聯系密切,這與傳統藏醫觀點相一致。因此從藏醫角度來看,治療AD方法主要以調節“緊久隆”與“恰不欺隆”為主。
2 RNSP主要成分與作用
根據相關文獻以及《中國藥典》(2020版)記載,RNSP主要組成包括植物類、動物類、礦物寶石類、金屬類以及混合物等相關藥材,其中植物類主要包含檀香、降香、西紅花、柯子、肉桂、甘草;動物類包括牛黃、麝香;礦物寶石類包括珍珠、九眼石、瑪瑙、珊瑚;金屬類主要包括Au、Cu、Fe、Pb、Hg、Zn、Mn、Ba、Al、Ca、K、Mg、Na等金屬元素[18-21];混合物主要是佐太,其主要原料為汞,是一種經過多種復雜炮制工藝煅碳存性而成的混合物類藥材,能夠起到提升治療效果的作用[22]。在化學成分方面,當前研究[23-24]表明,RNSP中成分主要包括沒食子酸、柯里拉京、沉香四醇、鞣花酸、西紅花苷Ⅰ、西紅花苷Ⅱ、亞油酸、丁香酚、亞麻酸和肉豆蔻酸等。
RNSP成方至今已有500余年的應用歷史,具有安神、鎮靜、通經活絡、調和氣血以及醒腦開竅的功效,因此在藏醫中經常用于治療“黑白脈病”和“龍血”不調等疾病[25]。而在近年來臨床研究[26-30]中表明,RNSP對于心臟病、高血壓、腦震蕩、腦卒中、癱瘓、癲癇、半身不遂、小兒驚厥、偏頭痛、老年癡呆等疾病具有較好療效。
3 RNSP在AD領域的臨床研究
RNSP作為傳統藏藥大組方藥品的典型代表,常被用于治療各種心腦血管疾病以及神經功能障礙等疾病[20]。在臨床研究方面,劉志琴等[31]發現51例AD患者在12周RNSP治療后,其簡易精神評定量表總分以及定向力、計算能力、記憶力、回憶和語言5個子項顯著提高,阿爾茨海默病評價量表-認知量表評分顯著降低,日常生活活動能力量表總分以及工具使用、生活自理能力2個子項均顯著改善。廖寶霞等[32]研究發現,12周RNSP治療可顯著改善AD患者認知與記憶能力,其機制與RNSP提高AD患者血液中超氧化物歧化酶(superoxide dismutase,SOD)活性,從而減輕體內氧自由基對于神經細胞的損傷有關。朱愛琴等[33]研究發現,RNSP改善AD患者認知功能,可能與RNSP下調患者體內炎性細胞因子白介素1β、白介素6及腫瘤壞死因子-α水平,降低Aβ42/Aβ40比值,減少Aβ沉積有關。上述臨床研究初步表明,RNSP治療可改善AD患者認知與記憶功能,且機制可能與RNSP抑制氧化應激水平和炎癥因子有關。目前對于RNSP改善AD的臨床研究相對較少,且研究方法相對單一,在后續研究中,可根據已知的AD發病機制,針對性的增加檢查手段。例如,通過影像學方法檢查AD患者海馬體積變化、腦部血流量變化以及能量代謝水平等,通過檢測腦脊液以及血液等判斷Aβ、p-Tau以及其他AD病理特征的變化等。此外,由于RNSP成分中含有一部分金屬離子,因此在臨床試驗中,還需對其安全性進行系統的評價。
4 RNSP改善AD藥理機制研究
4.1 RNSP減少AD腦內Aβ沉積 由于Aβ沉積所致的老年性斑塊 (senile plaques,SPs)被認為是AD早期發病的典型標志,因此許多藥物將清除Aβ作為治療AD的靶點。有研究[34]對16月齡Tg2576轉基因AD小鼠血清及行為學能力進行檢測,結果發現,小鼠血清中BACE-1與Aβ蛋白表達明顯升高,學習記憶能力明顯下降,而通過8周RNSP干預可有效降低血清中BACE-1與Aβ蛋白表達,改善其學習記憶能力。α-羧基末端片段(α-Cterminal fragment,α-CTF)和β-CTF分別是APP兩條不同途徑的水解產物,其中α-CTF屬于非Aβ途徑產物,β-CTF屬于Aβ途徑產物[35-36]。研究[37]發現,與AD模型組相比,8周RNSP給藥組小鼠腦組織中α-CTF蛋白表達以及α-CTF/β-CTF比值顯著升高,Aβ含量顯著降低,且學習和記憶能力得到顯著改善;AD模型小鼠接受12周RNSP治療后,其海馬區域BACE-1表達顯著下降,致使Aβ生成減少,從而降低Aβ對于腦部的損害,改善其學習記憶與空間探索能力。綜上所述,RNSP改善AD機制可能為RNSP抑制Aβ產生的關鍵酶BACE-1表達,促進APP非淀粉樣酶切的代謝過程,進而抑制Aβ沉積,減少Aβ對于腦內神經細胞的損傷。但也有研究[38]發現,Aβ可能并不是AD病理的始發原因,并提出神經細胞的死亡早于Aβ沉積的形成。因此,關于RNSP減少AD腦內Aβ沉積進而改善AD的藥理學機制還待進一步研究。
4.2 RNSP改善AD腦內氧化應激 廣泛的氧化應激是AD腦內的特征之一,腦內氧化應激水平的異常升高可導致DNA損傷并促進Aβ的生成[39],因此如何降低氧化應激水平可能是改善AD的關鍵。RNSP成分較多,其中藏紅花已被證明具有良好的抗氧化應激效果[40-41]。此外,以往研究中,RNSP在相關腦損傷模型大鼠中表現出顯著的的抑制氧化應激作用[42-43],因此推測RNSP可能通過抑制氧化應激改善AD。動物研究[44]發現,頸背部皮下注射D-半乳糖及側腦室注射Aβ25-35的AD模型大鼠經過8周的RNSP治療后,血清中SOD含量顯著升高,丙二醛(Malondialdehyde,MDA)含量顯著下降,且學習記憶能力得到顯著改善。小鼠腹腔注射東莨菪堿可導致氧化應激水平增高進而影響其學習記憶能力,RNSP灌胃給藥2周可顯著促進小鼠腦內抗氧化酶谷胱甘肽過氧化物酶的表達,并抑制MDA的表達,從而降低氧化應激水平,改善其學習記憶能力[45]。上述研究初步表明RNSP可抑制AD腦內氧化應激水平進而改善AD。研究[46]表明,氧化應激可激活p38絲裂原活化蛋白激酶-細胞外信號調節激酶1/2通路誘導細胞凋亡。而在細胞實驗中發現,RNSP可抑制p38絲裂原活化蛋白激酶-細胞外信號調節激酶1/2通路,從而降低氧化應激介導的細胞凋亡[47]。綜上研究所述,RNSP可有效降低AD腦內氧化應激水平,并抑制氧化應激所介導的神經細胞凋亡,從而減少神經細胞的損傷,改善AD。
4.3 RNSP改善AD腦內能量代謝 有研究[48-50]顯示,AD腦內表現出葡萄糖利用率降低、線粒體融合分裂失衡以及三磷酸腺苷(Adenosine triphosphate,ATP)生成效率降低等現象,表明能量代謝障礙是AD發病的又一重要誘因。有研究[51]發現,APP/PS1小鼠接受12周RNSP治療后學習記憶能力得到顯著改善,其原因可能與RNSP抑制小鼠海馬區域線粒體融合分裂失衡,減輕線粒體結構損傷,進而改善小鼠能量代謝水平有關,表明RNSP可通過減輕AD腦內的線粒體結構損傷,增強其能量代謝水平。在AD腦內,葡萄糖代謝水平下降可引起酮體代謝水平代償性增強,進而導致腦白質損傷,而腦白質損傷被認為與學習記憶能力的下降密切相關[51-53]。有研究[54]發現,AD模型小鼠腦內海馬區域酮體代謝能力增強,進而導致海馬白質和海馬髓鞘完整性受損,影響其學習記憶能力,而經過3個月的RNSP干預可顯著抑制小鼠海馬區域的酮體轉運與代謝,進而減輕小鼠海馬白質損傷,改善其學習記憶能力。綜上,RNSP可顯著改善AD腦內能量代謝障礙,進而減少AD腦部損傷,改善其學習記憶能力,但目前關于RNSP在AD能量代謝方面研究較少,且缺少相關臨床實驗,還需要后續的深入研究。
5 小結與展望
AD作為一種常見于老年人群的神經退行性疾病,近年來大量學者對其發病機制以及干預手段進行了廣泛的研究,但目前對于其具體發病機制仍未明晰。近年來隨著我國對于傳統醫藥的重視,藏醫和藏藥在治療AD等神經退行性疾病方面逐漸受到研究人員關注。筆者梳理文獻發現,RNSP在臨床上對于治療AD患者具有顯著療效。此外,相關動物及細胞研究表明,RNSP改善AD機制主要表現在減少Aβ沉積、抑制氧化應激水平以及改善能量代謝等方面,如圖1所示。但目前對于RNSP在AD領域研究還存在較多不足:首先在臨床研究方面,大多研究較為單一,且缺少相應安全性評價,不能很好反映與推廣RNSP在臨床領域的應用價值;而在動物以及細胞研究方面,目前關于RNSP改善AD的具體作用機制研究較少且探究不夠深入,如RNSP改善AD的上述三種機制是否存在協同效應?RNSP減少Aβ的具體機制是什么?RNSP在改善AD腦內氧化應激及能量代謝中線粒體又發揮了什么作用,介導機制如何?還有待在今后研究中進一步探討,以期為后續RNSP治療AD提供新的參考與借鑒。
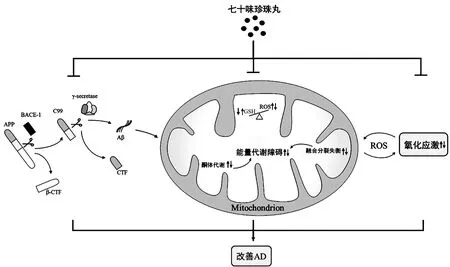
圖1 RNSP改善AD機制示意圖

