高級別膠質瘤靶向及免疫治療的現狀與新進展*
鄭林林,羅成,郎錦義,陰駿
610041 成都,四川省腫瘤臨床醫學研究中心,四川省腫瘤醫院·研究所,四川省癌癥防治中心,電子科技大學附屬腫瘤醫院 放射腫瘤學四川省重點實驗室 放療中心
膠質瘤是指起源于神經膠質細胞的腫瘤,是中樞神經系統最常見的原發腫瘤。第五版WHO中樞神經系統腫瘤分類已經發布,但本文引用文獻數據大部分采用2016 版分類法。第四版WHO中樞神經系統腫瘤分類2016 修訂版將膠質瘤分為 WHO I~IV 級,WHO I、II 級為低級別膠質瘤,III、IV 級為高級別膠質瘤(high-grade glioma,HGG)[1],其中膠質母細胞瘤 (glioblastoma, GBM)(WHO IV 級)的發病率最高,占46.1%,具有高發病率,高復發率,高致死率,低自愈率的特點[2]。目前HGG 的標準治療方案為安全并最大范圍手術切除,術后盡早(<6 周)[3]放療同步替莫唑胺(temozolomide, TMZ)化療,隨后給予6 周期TMZ 輔助化療[4]。但HGG 預后仍較差,間變性膠質瘤和GBM的5 年生存率分別為29.7%和5.5%[2]。近年來靶向及免疫治療在實體腫瘤中的應用開啟了腫瘤治療的新局面,其在膠質瘤治療中的臨床應用和研究也相繼被報道。本文就HGG 靶向及免疫治療的現狀及新進展進行綜述。
1 分子靶向治療
靶向治療是在分子水平上,針對特異性靶點設計相應的藥物從而阻斷腫瘤生長、播散的治療方式。在HGG 綜合治療中,基于其高異質性的特點,分子靶向治療一直是臨床研究的熱點(表1)。

表1 HGG 靶向治療的臨床試驗進展Table 1.Current Clinical Trials of Targeted Therapy for High-grade Glioma
1.1 血管內皮生長因子(vascular endothelial growth factor, VEGF)抑制劑
血管生成是HGG 的主要特征。目前臨床上應用最多的VEGF 抑制劑是貝伐珠單抗(bevacizumab,BEV),其可與VEGF 結合,抑制血管生成,從而抑制腫瘤生長。既往兩項Ⅲ期隨機臨床試驗AVAglio和RTOG0825 結果顯示,BEV 能夠適當延長新診斷GBM(newly diagnosed glioblastoma, nGBM)患者的無進展生存期(progression-free survival, PFS),減少糖皮質激素的使用,改善患者生活質量,但并不能改善總生存期(overall survival, OS)[5-6]。但RTOG0825 最新隨訪數據表明BEV 組較對照組出現更明顯的神經認知功能惡化和生活質量下降,表明BEV 在nGBM 中的神經毒性值得關注[7]。關于其安全性,有研究表明BEV 增加的不良事件發生率不會影響患者接受標準治療,也不會增加放療毒性[8]。因此,Wirsching 等[9]開展了一項II 期臨床試驗,比較BEV 聯合低分割放療(40 Gy/15 F)與單純放療治療老年nGBM 患者的療效,結果顯示在受體酪氨酸激酶I 甲基化亞型和前神經基因表達的患者中可觀察到PFS 延長(7.6 個月),但依然不能延長老年nGBM 患者的OS。因此在選擇BEV 治療時要充分權衡其獲益和神經毒性。
安羅替尼是我國自主研發的新型小分子多靶點酪氨酸激酶抑制劑(tyrosine kinase inhibitor, TKI),能有效抑制VEGFR、PDGFR、FGFR、c-Kit 等,從而抑制腫瘤血管生成和腫瘤生長。有研究表明安羅替尼治療復發性HGG 的不良事件發生率低,安全性好,并且還顯示出良好的短期療效,顯著延長了患者的PFS[10]。2021 年美國臨床腫瘤學會(American Society of Clinical Oncology,ASCO)上一項II 期預試驗結果表明:安羅替尼對nGBM 患者也有良好的安全性和耐受性,33 例患者的中位OS(median OS,mOS)為17.4 個月,1 年PFS 和OS 率分別為84.0%和100.0%,值得在擴大樣本的前瞻性臨床試驗中進一步驗證其安全性和療效[11]。
1.2 表皮生長因子受體(epidermal growth factor receptor,EGFR)抑制劑
EGFR 突變在GBM 中普遍存在,長期以來一直是一個合理的治療靶點,其自激活缺失突變體EGFRvIII 是HGG 內最常見的突變類型[12]。尼妥珠單抗是一種人源化抗 EGFR 單克隆抗體。Wang 等[13]報道了中國nGBM 患者在標準治療中加入尼妥珠單抗的首次結果,結果顯示尼妥珠單抗具有良好的安全性和耐受性,26 例nGBM 患者中位PFS(median PFS,mPFS)和mOS 分別為10.0 和15.9 個月,與標準治療的歷史數據相似,但療效與EGFR 表達無相關性,這與既往一項大型III 期臨床試驗結果一致[14]。進一步研究發現Akt 和mTORC1 信號可能作為GBM尼妥珠單抗治療的預測性生物標志物,可作為選擇患者的參考[15]。Du 等[16]開展了尼妥珠單抗治療36例nGBM 的單臂、多中心II 期臨床試驗,結果顯示PFS 延長至11.9 個月,OS 延長至24.5 個月,O6-甲基鳥嘌呤-DNA 甲基轉移酶(O6-methylguanine-DNA methyltransferase, MGMT)啟動子甲基化陽性與陰性兩組間無明顯生存差異。此外多個國家已開展尼妥珠單抗治療兒童HGG 的臨床研究,并獲得一定臨床療效。彌漫內生型橋腦膠質瘤(diffuse intrinsic pontine glioma, DIPG)是一種發生在兒童橋腦的高度侵襲性腦膠質瘤,約占兒童腦干膠質瘤的80%。由于腫瘤位置深,手術困難,化療總體療效不佳,放療是DIPG 的標準治療方案,但預后極差,中位總生存期從診斷開始低于1 年[17]。一項來自德意俄的單臂Ⅲ期臨床試驗采用放療聯合尼妥珠單抗治療42 例初診兒童青少年DIPG,結果發現放療聯合尼妥珠單抗與放療聯合化療療效相當,但毒性更低,安全性更好[18]。
盡管EGFR 及EGFRvIII 突變在HGG 發病機制中發揮著重要的作用,但是既往研究發現,即使在瘤內達到有效藥物濃度,靶向EGFR 的TKI 和中和抗體并未改善膠質瘤患者的生存期[19]。Greenall 等[20]利用表達內源性EGFRvIII 的膠質瘤患者細胞評估目前臨床上應用的EGFR 抗體的效果,結果發現大多數EGFRvIII 靶向抗體不能中和EGFRvIII,而帕尼單抗可同時中和野生型EGFR 和EGFRvIII,在體內、體外實驗中均表現出良好的抗腫瘤效果,可在EGFRvIII 突變的膠質瘤患者中開展進一步臨床試驗驗證。
1.3 哺乳動物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)抑制劑
mTOR 是PI3K-AKT 通路的下游靶點,在細胞的增殖、分化和血管形成過程中起到重要的作用。Paxalisib 是一種能穿過血腦屏障的PI3K/AKT/mTOR 通路小分子抑制劑。一項paxalisib 輔助治療MGMT 啟動子甲基化陰性的nGBM 患者的II 期臨床試驗(NCT03522298)的最終結果發表于2022 ASCO 年會,確定了60 mg 的最大耐受劑量,PFS 和OS 分別為8.4 個月和17.7 個月,優于標準治療療效[21]。FDA 已授予paxalisib 治療GBM 的快速通道資格,其進一步確認療效的臨床試驗(GBM AGILE,NCT03970447)正在進行中。
1.4 絲裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)通路抑制劑
MAPK 級聯是調控細胞存活、增殖和分化的關鍵信號通路。MAPK 信號通路有4 條主要的分支路線,其中一條即RAS-RAF-MEK-ERK 信號通路(MAPK/ERK 通路),BRAF 基因是這條通路的一部分,負責編碼一個傳遞細胞信號的RAF 激酶蛋白。BRAF V600E突變會導致MAPK 信號通路持續性激活,驅動腫瘤發生,其存在于約6%的GBM 中[22]。在2016 年WHO GBM 分類中,異檸檬酸脫氫酶(isocitrate dehydrogenase,IDH)野生型GBM 添加了一種新的變體,即上皮樣GBM。這種變體以高達一半的比例攜帶BRAF V600E突變而命名[1,23],攜帶該突變的GBM 患者OS 短,目前報道的mOS 僅為10 個月左右。張春滿等[24]開展細胞試驗,發現BRAF 抑制劑維莫非尼聯合放療可以顯著抑制攜帶BRAF V600E 突變細胞的增殖,使細胞凋亡數顯著增加。攜帶VE-BASKET 研究的初步結果也表明,維莫非尼對BRAF V600E 突變的GBM 患者具有抗腫瘤活性[25]。有報道1 例上皮樣GBM BRAF V600E突變患者使用BRAF 抑制劑達拉非尼治療后,達到病情穩定,10 個月后發現腫瘤進展,在開始使用達拉非尼的16 個月后死亡[26]。一項聯合BRAF 抑制劑達拉非尼和MEK 抑制劑曲美替尼治療BRAF V600E 突變的復發/難治性膠質瘤患者的多中心、單臂、II 期臨床試驗,納入45 名HGG 患者,其中期分析結果顯示15名患者表現出客觀緩解,其中3 名患者為完全緩解,mPFS 和mOS 分別為3.8 個月和17.6 個月,表明兩種靶向藥物聯用對攜帶BRAF V600E 突變的膠質瘤患者有較為積極的治療作用,需要納入更多的患者和更長時間的隨訪來驗證研究結果[27]。
1.5 IDH1 靶向藥物
IDH1 突變見于超過70%的WHO II 級、III 級膠質瘤以及由這些低級別病變轉化而來的GBM,并且與同一腫瘤級別的IDH 野生型膠質瘤相比,其預后更好[28]。在第五版WHO 膠質瘤分類中,IDH 突變型彌漫性星形細胞腫瘤被認為是同一類型,再分為 WHO 2 級、3 級或4 級,不再根據組織學特征分為彌漫性星形細胞瘤、間變性星形細胞瘤和GBM,而IDH 突變的GBM 現被稱為IDH 突變的星形細胞瘤 WHO 4 級[29]。Ivosidenib(艾伏尼布)是一種口服的突變型IDH1(mutant isocitrate dehydrogenase1,mIDH1)抑制劑,在膽管癌、軟骨肉瘤的治療中已有相關報道[30-31]。Mellinghoff 等[32]開展了mIDH1 抑制劑ivosidenib 治療66 例IDH1突變晚期GBM 患者的I 期臨床試驗,發現ivosidenib 500 mg 每天1 次具有良好的安全性,并且可減少MRI 成像上無強化的腫瘤體積和生長速度。
迄今為止,盡管許多靶向治療的臨床試驗沒有顯示出顯著的療效,但部分小樣本的研究仍顯示出了初步的療效。隨著基因二代測序技術的進步,未來能夠更好地認識膠質瘤的分子表型和核心通路,特異性的分子靶向治療依然可能發揮重要的作用。
2 免疫治療
如今免疫治療通過特異性識別和殺傷腫瘤細胞在實體性腫瘤中應用越來越廣泛,但HGG 的免疫治療卻面臨眾多挑戰。血腦屏障、高度抑制的腫瘤免疫微環境、免疫耐藥是HGG 免疫治療的主要障礙。如何突破這些障礙,是膠質瘤免疫治療的研究重點。HGG 的免疫治療可分為腫瘤疫苗、溶瘤病毒、免疫檢查點抑制劑和嵌合抗原受體T 細胞免疫療法(chimeric antigen receptor T-cell immunotherapy,CAR-T)(表2)。
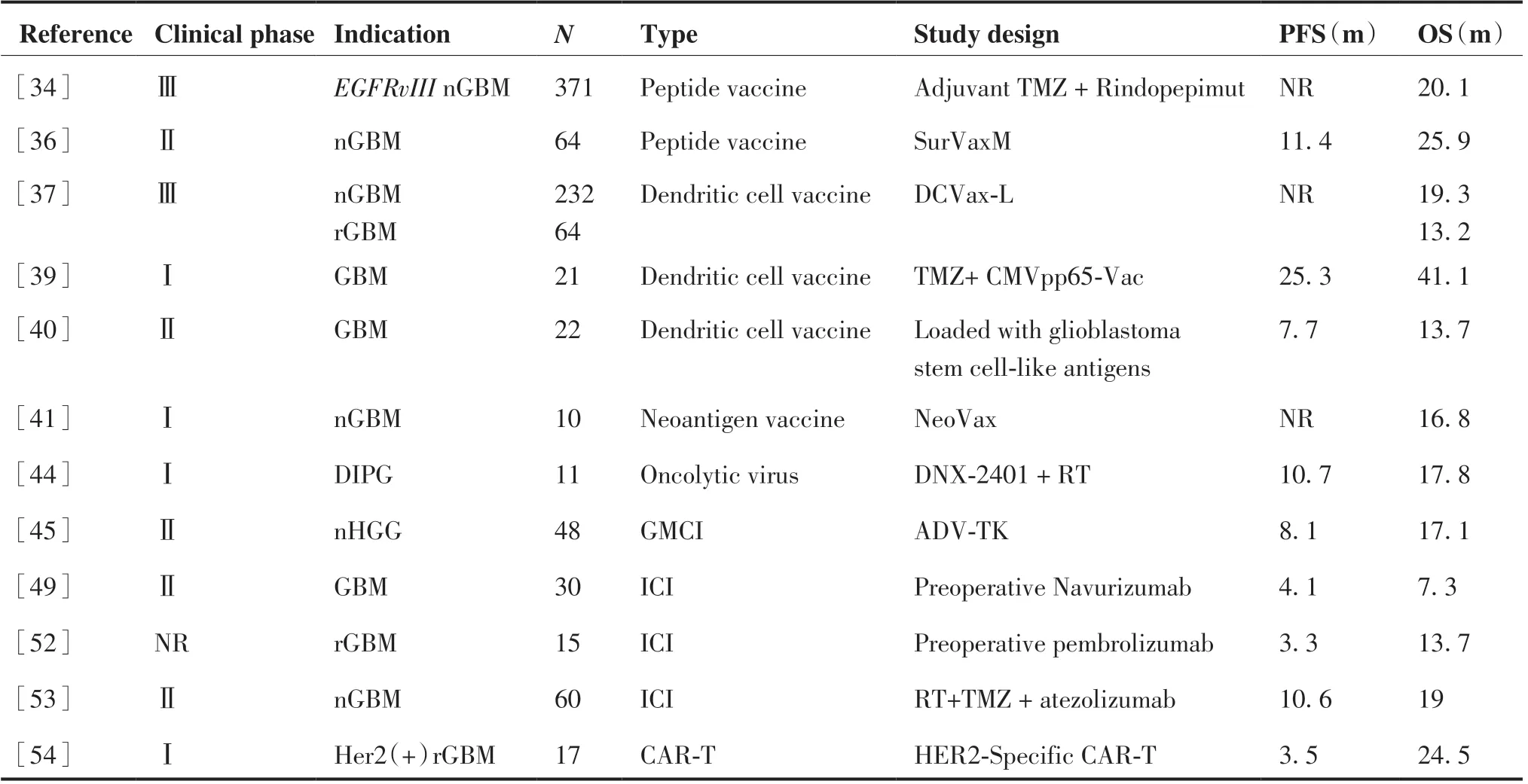
表2 HGG 免疫治療的臨床試驗進展Table 2.Current Clinical Trials of Immunotherapy for High-grade Glioma
2.1 腫瘤疫苗
腫瘤疫苗可利用適應性免疫系統產生腫瘤特異性抗體從而發揮抗腫瘤作用,主要分為肽疫苗、樹突狀疫苗和腫瘤新抗原疫苗。
Rindopepimut 是肽類腫瘤疫苗,作用靶點為EGFRvIII。早期已開展過一項II 期臨床試驗ACT III[33],65 名表達EGFRvIII 的nGBM 患者接受輔助rindopepimut 聯合TMZ 治療,結果顯示有PFS 和OS 獲益。但隨后開展的隨機、雙盲、安慰劑對照的III 期臨床試驗ACT IV 共745 例患者,中期分析卻顯示試驗組與對照組的mOS 無差異(20.1 個月 vs 20.0 個月),導致該研究被提前終止[34]。但另一項Ⅱ期研究結果(ReACT)表明BEV 聯合rindopepimut 治療EGFRvIII陽性復發GBM(recurrent glioblastoma, rGBM)患者,可能有PFS 獲益[35],這表明聯合治療方法可能很重要。SurVaxM 是針對survivin 靶點的模擬肽疫苗。一項SurVaxM 治療nGBM 患者的多中心II 期臨床試驗中,mPFS 和mOS 分別達到了11.4 和25.9 個月,優于標準治療,擴大樣本的III 期臨床試驗將進一步評價該疫苗的臨床效果[36]。
Liau 等[37]開展了一項多中心、隨機、雙盲、安慰劑對照的III 期外部對照前瞻性臨床試驗,評估自體樹突狀疫苗DCVax-L 治療nGBM 和rGBM 患者的療效和安全性,232 例nGBM 患者的mOS 為隨機分組后19.3 個月,而接受標準治療的對照組患者為16.5 個月。64 例rGBM 患者復發后的mOS 為13.2 個月,對照組為7.8 個月。在標準治療中加入DCVax-L 可使nGBM 和rGBM 患者的生存期延長,具有臨床意義和統計學意義。另外有研究表明人類巨細胞病毒(cytomegalovirus, CMV)在超過90%的GBM 中表達,而在周圍正常腦組織中未檢測到CMV表達[38],這提示CMV 抗原可作為治療GBM 的特異性靶點。Batich 等[39]進行了一項大劑量TMZ 聯合靶向CMV 抗原pp65 的樹突狀疫苗治療GBM 患者的I 期臨床試驗,PFS 和OS 分別為25.3 和41.1 個月,3 名患者在診斷之后超過7 年保持無進展。Yao等[40]也開展了樹突狀細胞(dendritic cell,DC)疫苗的II 期臨床試驗,結果表明GBM 干細胞樣抗原負載的DC 疫苗能夠延長GBM 患者的生存時間,并且B7-H4 低表達患者的OS 顯著延長,這表明B7-H4可能是膠質瘤免疫治療的一個新靶點。
一項使用個體化新抗原腫瘤疫苗(NeoVax)治療nGBM 患者的Ib 期研究顯示OS 為16.8 個月,證實了新抗原疫苗可激活腫瘤內T 細胞反應,并且可顯著改善生存期[41]。Platten 等[42]開展了靶向IDH1突變的腫瘤疫苗(IDH1-vac)治療nGBM 的多中心I 期臨床試驗,結果顯示3 年PFS 和OS 率分別為63%和84%,可顯著延長患者的PFS 和OS,初步證實了IDH1-vac 疫苗的安全性和有效性。
一項關于ERC1671 的雙盲、安慰劑對照、隨機II 期臨床試驗的初步結果發表于2020SNO 會議上。ERC1671 是一種同種異體/自體治療性疫苗,由完整的滅活腫瘤細胞與腫瘤細胞裂解物混合而成。ERC1671 在未使用BEV 及BEV 耐藥的rGBM 患者中均有顯著效果,13 例患者在首次治療后的平均OS 為328 天,且患者外周血中CD4+T 淋巴細胞計數與生存有一定相關性。
以上研究的進一步開展和隨訪將可能對膠質瘤免疫治療產生重要的影響。
2.2 溶瘤病毒
溶瘤病毒主要通過兩種機制殺傷腫瘤:(1)感染腫瘤細胞并復制,產生直接的細胞毒性;(2)激活免疫細胞,產生抗腫瘤免疫反應,可能會將其從免疫上的“冷腫瘤”轉為“熱腫瘤”。重組溶瘤性脊髓灰質炎病毒(oncolytic polio/rhinovirus recombinant, PVSRIPO)可靶向結合多種實體瘤和抗原提呈細胞(antigen-presenting cells, APCs)表面CD155,導致腫瘤細胞溶瘤性壞死,并通過APCs 激活免疫。PVSRIPO 的Ⅰ期臨床試驗納入61 例rGBM 患者,結果表明腫瘤內接種PVSRIPO 對部分rGBM 患者具有明顯的生存獲益,21%的患者存活期超過3 年,生存期最長可達70 個月[43],現已被 FDA 授予“突破性療法”的稱號。其后續多中心II 期臨床試驗正在進行中。溶瘤病毒研究大多針對成人HGG,關于溶瘤病毒治療DIPG 患者的數據尚缺乏。條件復制型溶瘤腺病毒DNX-2401 腫瘤內給藥可引起腫瘤微環境中免疫細胞浸潤,誘導不同程度的腫瘤應答。對11 例初診DIPG 患兒腫瘤內注射DNX-2401 后進行放療,結果顯示部分患者腫瘤縮小或穩定,mPFS 為10.7 個月,mOS 為17.8 個月,顯著改善了DIPG 患兒的生存,但與不良事件相關,有3 起嚴重不良事件報告[44]。
目前,一種新的免疫治療技術正在開展臨床研究,即基因介導的細胞毒性免疫療法(gene-mediated cytotoxic immunotherapy, GMCI)。GMCI 以經過改造后不能復制的腺病毒為載體,攜帶單純皰疹胸苷激酶基因到達腫瘤細胞,同時服用一種細胞毒前藥(如伐昔洛韋),胸苷激酶在腫瘤細胞中將前藥活化,產生細胞毒作用,死亡的腫瘤細胞釋放腫瘤相關性抗原,進而引發免疫反應。ADV-TK 就是一種新型重組腺病毒-胸苷激酶基因制劑,通過“自殺效應”和“旁觀者效應”特異性殺滅腫瘤細胞。其治療HGG 的前瞻性、對照、多中心II 期臨床試驗中,GMCI 治療組和標準治療組的OS 分別為17.1 和13.5 個月,全切除術后殘余腫瘤少的患者生存率提高最為顯著[45]。成人的臨床試驗證明了其安全性和潛在療效,因此Kieran 等[46]首次在兒童中開展了Ⅰ期臨床試驗,顯示GMCI 可以安全用于兒童HGG患者。這些結果將有助于指導未來的免疫治療研究,并有力地支持HGG 接受GMCI 的進一步評估。
2.3 免疫檢查點抑制劑
PD-1/PD-L1 是腫瘤逃逸的重要免疫抑制靶點。目前PD-1/PD-L1 單抗治療GBM 的Ⅲ期臨床試驗均未達到預期目標,需要更好地闡明免疫檢查點阻斷的耐藥機制。CheckMate 498[47]結果顯示,對于MGMT啟動子甲基化陰性nGBM 患者,PD-1 單抗納武利尤單抗未延長OS;CheckMate 548[48]結果顯示,對于MGMT 啟動子甲基化陽性nGBM 的患者,納武利尤單抗未延長PFS,仍在繼續評估OS。但值得注意的是:新輔助PD-1 單抗治療能夠改變rGBM 的腫瘤免疫微環境,增強局部及全身的抗腫瘤免疫應答,提高局部免疫細胞浸潤。Schalper 等[49]在1 項單臂Ⅱ期臨床試驗中對27 例rGBM 和3 例nGBM 患者于術前2 周使用納武利尤單抗,術后每2 周給予相同劑量治療,結果顯示PFS 為4.1 個月,OS 為7.3 個月,其中2例nGBM 患者在28.5 和33.3 個月后依然存活。因此研究腫瘤免疫微環境對于確定免疫檢查點阻斷反應至關重要。另一種PD-1 單抗帕博利珠單抗也在rGBM 中展開了研究。由于GBM 具有高度抑制的免疫微環境,單一免疫療法尚未能產生足夠的抗腫瘤功效,一項I 期研究顯示大分割立體定向再放療與帕博利珠單抗和BEV 聯合治療復發性 HGG 患者安全且耐受性良好[50]。但另一項II 期研究評估帕博利珠單抗和BEV 聯合治療并未改善rGBM 患者的生存[51]。因此免疫治療的時機選擇也至關重要。可手術切除rGBM 患者接受帕博利珠單抗新輔助治療并在術后繼續輔助治療,與僅接受術后輔助帕博利珠單抗治療相比,mPFS 分別為3.3 個月和2.4 個月,mOS 分別為13.7 個月和7.5 個月,可顯著改善OS 和PFS,并且發現帕博利珠單抗可增強局部和全身抗腫瘤免疫反應,如T 細胞的克隆擴增增強、外周血T 細胞上PD-1 表達降低等[52]。免疫檢查點抑制劑的新輔助治療可能為GBM 的治療開辟新道路。除了抗PD-1 單抗,2020年ASCO 上首次報道了抗PD-L1 阿替利珠單抗聯合標準治療用于60 例nGBM 患者的安全性和有效性的II 期臨床試驗,結果mPFS 和mOS 分別為10.6 個月和19 個月,其中18 例MGMT 甲基化和33 例非甲基化患者的mOS 分別為29.9 個月和16.3 個月,表明阿替利珠單抗安全可耐受,并顯示出適度的療效,尤其是MGMT 甲基化患者,目前該研究還在進行中[53]。
2.4 CAR-T
CAR-T,即通過基因工程的方法,對患者血液中的T 細胞進行處理,使T 細胞表面表達嵌合抗原受體,從而特異性識別和結合腫瘤細胞表面的抗原并裂解腫瘤細胞。針對GBM 的常用靶點包括HER2 和IL-13Rα2 等。Ahmed 等[54]使用抗HER2 CAR-T 治療rGBM 的Ⅰ期試驗中,OS 為第1 次T細胞輸注后11.1 個月和診斷后24.5 個月,提示有OS 獲益。Brown 等[55]報道了 1 例多病灶GBM 患者在標準治療后復發,再次手術切除掉其中3 個較大的病灶后,在剩余2 個較小病灶中顱內和全身靜脈輸注IL-13Rα2 CAR-T,病灶均退縮,病情穩定達7.5 個月,顯示CAR-T 治療HGG 的初步療效。另一種針對GBM 的新型靶點為雙唾液酸神經節苷脂(disialoganglioside,GD2),其在GBM 干細胞表面特異性過表達。1 項I 期臨床試驗中,8 例GD2 陽性rGBM 患者接受GD2 特異性第四代嵌合抗原受體T 細胞(fourth-generation safety-designed chimeric antigen recptor T-cells,4SCAR-T)治療后安全且耐受性良好,mOS 為輸注后10 個月。此外,GD2 特異性4SCAR-T 細胞可部分介導抗原丟失,并激活腫瘤微環境中的免疫反應。有必要在更大規模的前瞻性試驗中驗證該研究結果[56]。CAR-T 在HGG 中的研究僅開展了Ⅰ期或Ⅱ期臨床試驗,樣本量小,但目前的結果支持后續進一步深入和擴大樣本量的研究。
雖然近幾年HGG 的免疫治療發展迅速并取得初步成效,但在實際臨床應用中仍面臨著諸多挑戰,相信隨著對膠質瘤致病機制和免疫相關原理的認識加深,對膠質瘤免疫耐藥機制的進一步探索,免疫治療將會給HGG 患者帶來更長期生存的希望。
3 結 語
HGG 的治療一直以來是一個具有挑戰性的難題,STUPP 方案作為重要的里程碑,已經在臨床應用了近二十年,但其療效仍無法令人滿意。隨著醫學的進步,分子靶向藥物和免疫治療藥物的成功研發和臨床研究的開展為HGG 的治療提供了更多思路。但如何個體化地用藥以及選擇特定患者人群還需要進一步地了解膠質瘤的分子機制和免疫微環境特點;如何選擇藥物、確定藥物應用時機、理清中樞神經系統免疫耐藥機制、控制藥物不良反應以及聯合治療等方面,還需要開展更加深入的研究,也需要開展更多前瞻性隨機對照臨床試驗以期提供更高質量的證據。
作者聲明:本文全部作者對于研究和撰寫的論文出現的不端行為承擔相應責任;并承諾論文中涉及的原始圖片、數據資料等已按照有關規定保存,可接受核查。
學術不端:本文在初審、返修及出版前均通過中國知網(CNKI)科技期刊學術不端文獻檢測系統的學術不端檢測。
同行評議:經同行專家雙盲外審,達到刊發要求。
利益沖突:所有作者均聲明不存在利益沖突。
文章版權:本文出版前已與全體作者簽署了論文授權書等協議。

