多重耐藥鮑曼不動桿菌外排泵與外膜蛋白表達水平分析
黃育波 周宇麒 鄭文爭 朱家馨 楊海玲 吳文斌 張天托
中山大學附屬第三醫院呼吸與危重癥醫學科(廣州 510630)
鮑曼不動桿菌是醫院內重要的病原菌,由于其在醫院環境中的生存能力和迅速獲得抗生素耐藥性的傾向,已成為臨床和耐藥菌流行的重要原因[1]。鮑曼不動桿菌在危重患者中可引起各種感染,包括肺炎、血流感染和尿路感染,其中呼吸機相關性肺炎和血液感染最為常見,病死率可達35%[2-3]。2017年,世界衛生組織提出,開發針對耐碳青霉烯類鮑曼不動桿菌的新型抗生素是當務之急[4]。多重耐藥鮑曼不動桿菌的出現和傳播對全球的健康已經構成了重大的威脅,對臨床抗感染治療提出了重大挑戰[5]。既往研究表明,外排泵和外膜蛋白的表達和鮑曼不動桿菌出現多重耐藥(MDR)具有高度密切的關系[6-7]。因此,本研究旨在了解本院鮑曼不動桿菌外排泵(efflux pump)和外膜蛋白(outer membrane proteins,OMPs)基因的表達情況,探討其在本地區鮑曼不動桿菌耐藥中的變化和影響,為臨床診治提供理論依據。
1 材料與方法
1.1 菌株來源收集中山大學附屬第三醫院住院患者下呼吸道標本分離的鮑曼不動桿菌共213 株(2009年1月至2014年3月),上述菌株由呼吸與危重癥醫學科實驗室-80 ℃冰箱低溫保存。根據菌株對不同抗生素的敏感性分為不敏感組(NS 組)和敏感組(S 組)。
1.2 菌種鑒定上述臨床下呼吸道樣本分離培養的213 株鮑曼不動桿菌菌株常規經API 20NE 初步鑒定后,再用分子生物學方法對其進行菌種鑒定,具體方法參照HIGGINS 等[8-9]建立的gyrB 多重PCR 方法進行。以大腸埃希菌ATCC 25922、鮑曼不動桿菌ATCC 17978 作為研究的對照。
1.3 主要試劑和儀器抗生素藥敏紙片:阿米卡星(Amikacin,AMK),亞胺培南(Imipenem,IPM),頭孢哌酮(Cefoperazon,CFP),頭孢吡肟(Cefepime,FEP),哌拉西林/他唑巴坦(Piperacillintazobactam,TZP),頭孢他啶(Ceftazidime,CAZ),復方新諾明(SXT),環丙沙星(Ciprofloxacin,CIP),頭孢哌酮/舒巴坦(Cefoperazone-sulbactam,SCF),慶大霉素(Gentamicin,CN),多粘菌素B(Polymyxin B,PB),替加環素(Tigecycline,TGC)等,以上抗生素紙片均購自英國OXOID 公司。主要試劑:LightCycler 480 SYBR GreenⅠMaster(Roche 公司,瑞士);Transcriptor cDNA Synth.Kit 1(Roche 公司,瑞士);RNAiso Plus(TaKaRa 公司,中國大連)。主要儀器:PCR 擴增儀9700 型(Applied Biosystems公司,美國);核酸蛋白分析儀DU 730 型(BECKMAN 公司,美國);RT-PCR 儀LightCycler 480 型(Roche 公司,瑞士)。
1.4 方法
1.4.1 藥敏試驗藥敏試驗采用紙片擴散法(K-B法)。根據美國臨床實驗室標準化研究所(CLSI)公布的2012年版標準對藥物的敏感性進行判斷,以大腸埃希菌ATCC 25922、銅綠假單胞菌ATCC 27853 作為藥敏對照質控菌株[10]。所有操作均嚴格按照標準規程進行。部分抗生素敏感性參考EUCAST2012 標準。
1.4.2 RNA 提取及cDNA 的合成按照RNA 提取試劑盒(RNAiso Plus,TaKaRa,Code No.9108/9109)提供的方法進行總RNA 提取,結合預實驗結果作適當的改進。按照試劑盒(Cat.No.04 897 030 001)提供的方法進行cDNA 的合成(逆轉錄)。根據下列表1 中相關研究提供的方法,結合預實驗結果選擇引物序列進行熒光定量PCR。其中引物的合成委托英濰捷基(上海)貿易有限公司進行。以基因rpoB 作為內參基因,檢測外排泵基因(adeB、adeJ、adeG、craA、abeM、amvA)、外膜蛋白基因(omp25、omp33-36、carO)的表達水平,參考引物序列具體見下列表1。
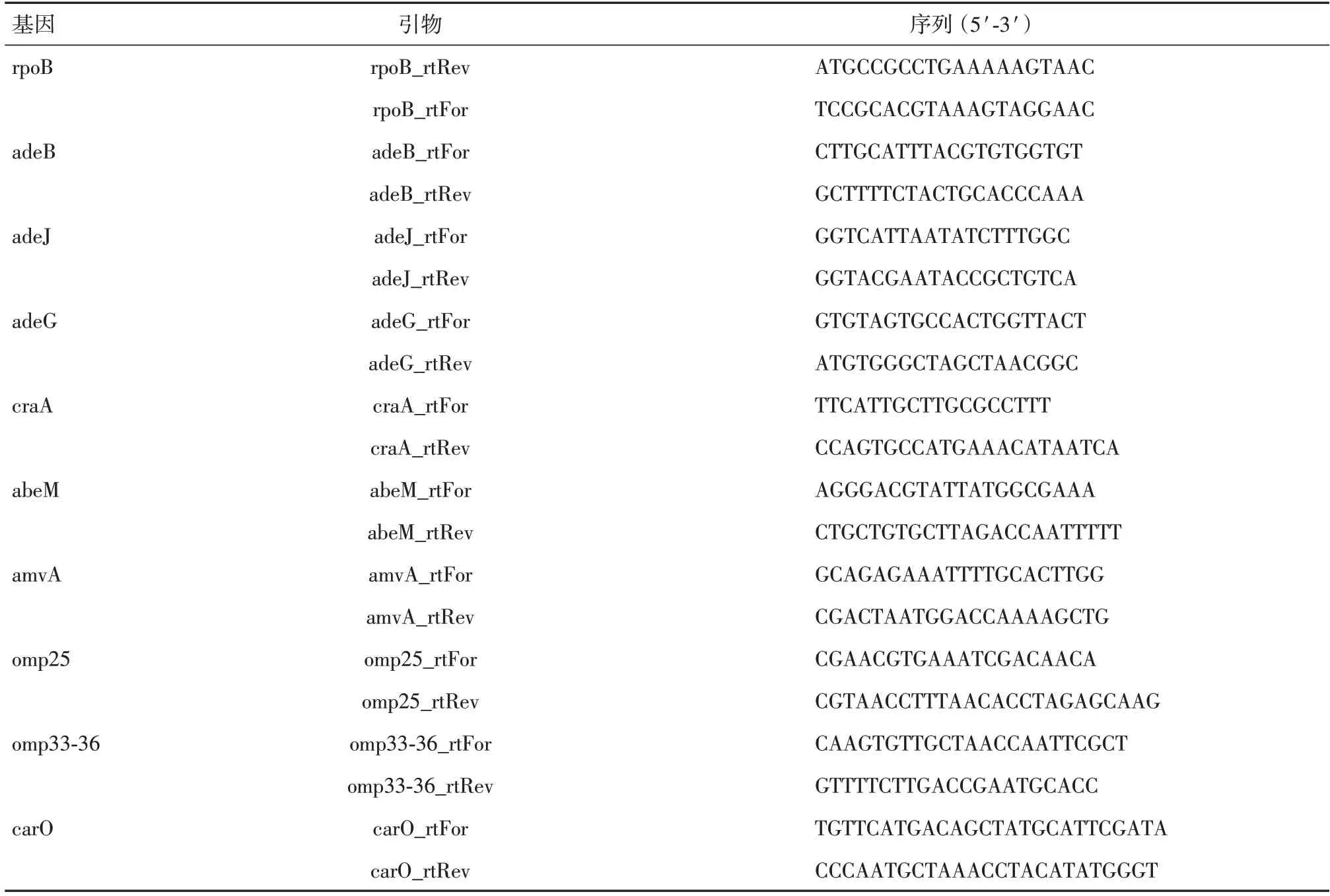
表1 熒光定量PCR 引物序列表[11-14]Tab.1 Primers for fluorescent quantitative PCR
1.4.3 相關基因mRNA相對表達量的計算根據熒光定量PCR 試劑盒(LightCycler?480 SYBR GreenⅠ Master)提供的方法進行操作。內參基因rpoB及各目的基因擴增曲線與溶解曲線均為單峰曲線,表明實驗重復性良好且沒有非特異性擴增。以鮑曼不動桿菌ATCC 17978 標準株相應基因mRNA 表達量作為參考對照。具體計算公式為mRNA 相對表達量(relative expression,RE)=2-△△Ct,△△Ct=(CtTarget-CtrpoB)目的菌株-(CtTarget-CtrpoB)對照菌株。
1.5 統計學方法本研究使用Excel 表建立研究的數據庫,以SPSS 22.0 版軟件進行統計學處理和分析。正態分布的計量資料描述采用均數±標準差(),采用獨立樣本t檢驗或者單因素方差分析(One-way ANOVA)進行比較;非正態分布的計量資料的描述采用中位數(median,M),采用秩和檢驗進行比較。定性資料采用χ2檢驗進行比較。P< 0.05 為差異有統計學意義。
2 結果
2.1 菌株的藥敏結果經分離培養鑒定的213 株鮑曼不動桿菌對主要抗生素的耐藥情況如下(見表2):上述菌株對阿米卡星、亞胺培南不敏感率分別為89.2%、81.2%,對頭孢哌酮、頭孢吡肟、哌拉西林/他唑巴坦、頭孢他啶、復方新諾明、環丙沙星、頭孢哌酮/舒巴坦、慶大霉素的不敏感率均超過92%,對多粘菌素B 和替加環素均敏感。
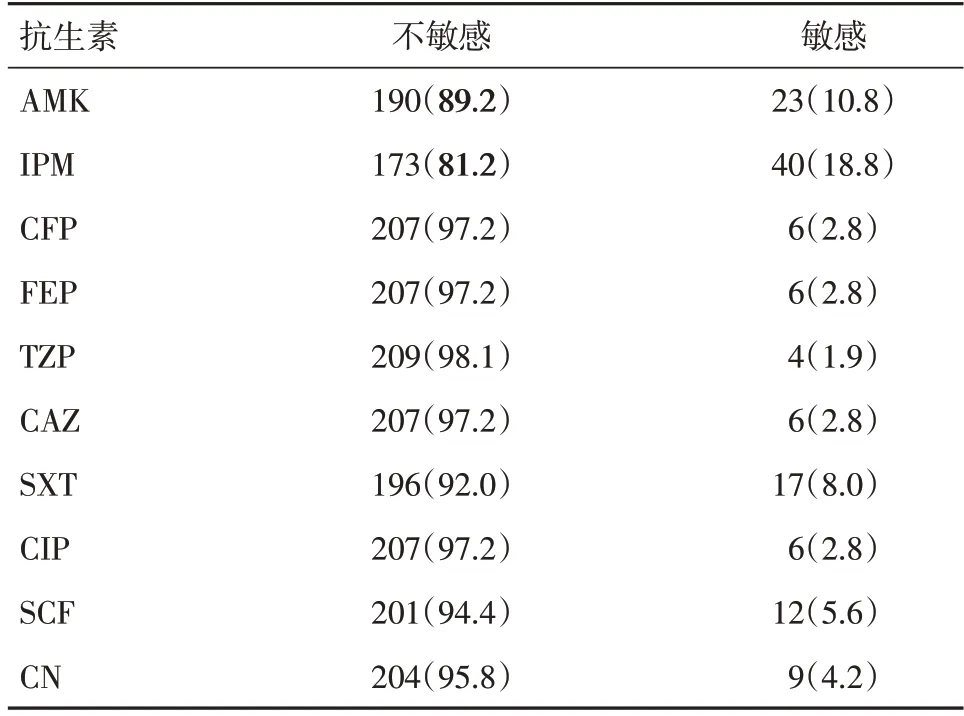
表2 213 株鮑曼不動桿菌耐藥情況Tab.2 Susceptibility of 213 strains of A.baumannii to antimicrobial agents株(%)
2.2 外排泵和外膜蛋白基因表達水平研究外排泵基因、外膜蛋白基因表達水平與抗生素耐藥之間的關系,檢測外排泵基因(adeB、adeJ、adeG、craA、abeM、amvA)、外膜蛋白基因(omp25、omp33-36、carO)的mRNA 的表達水平。根據各菌株對抗生素的敏感性分組,比較不敏感組(NS 組)與敏感組(S 組)在上述基因表達水平的差異。根據各菌株外排泵基因表達量與標準鮑曼不動桿菌ATCC 17978比較,計算上述基因mRNA相對表達量(relative expression,RE),具體算法見1.4.3。由于各組數據為非正態分布資料,以中位數(M)表示其平均水平。結果顯示:除adeB 外,其他外排泵如adeJ、adeG、craA、abeM、amvA 各組RE 平均值均小于1。omp25、omp33-36、carO 各組RE 平均值均大于1。見表3。
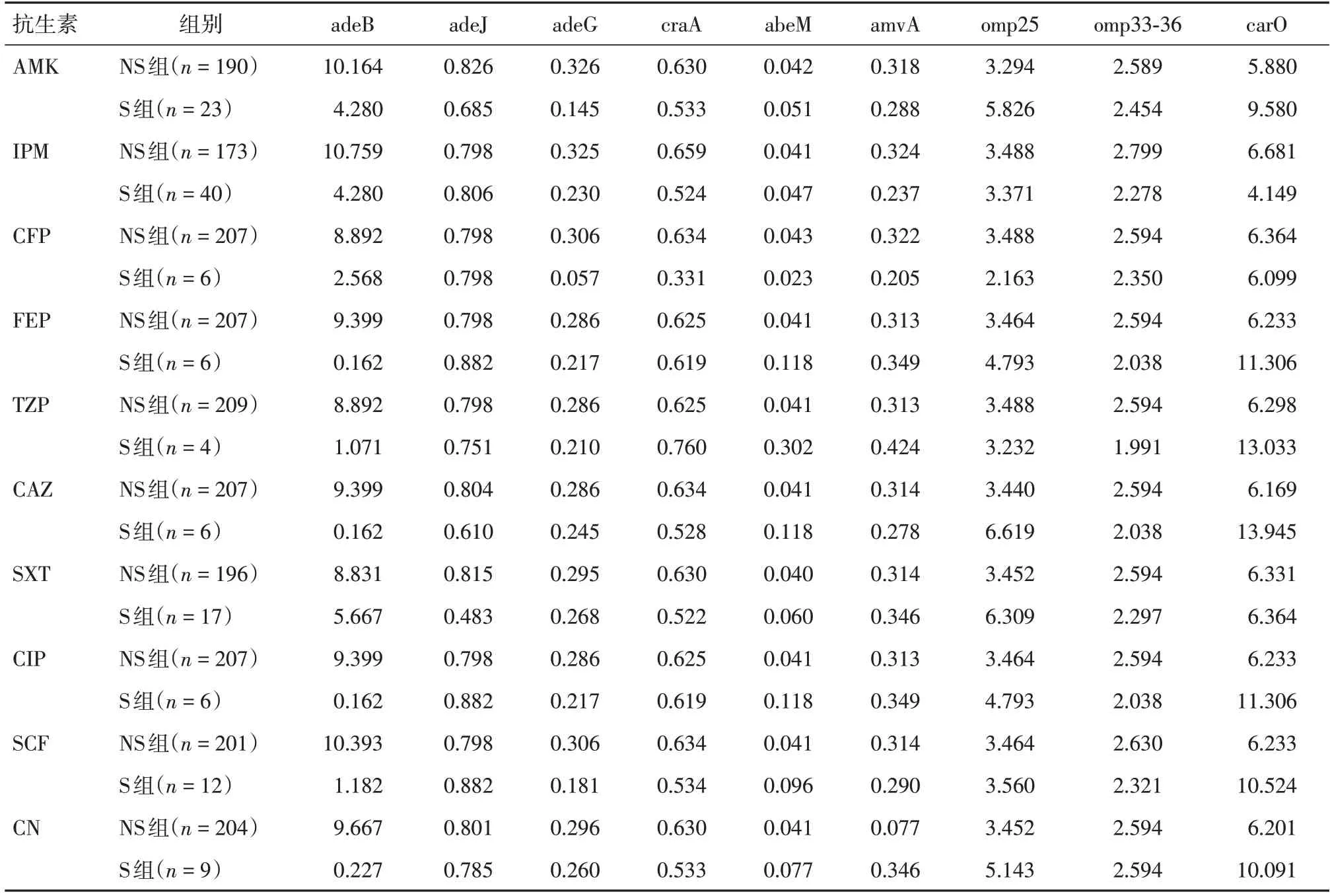
表3 各抗生素組外排泵基因、外膜蛋白基因RE 值[中位數(M)]Tab.3 Relative expression of efflux pump genes and OMP genes in different antibiotic groups[median(M)]
2.3 各抗生素組RE 分析比較
2.3.1 外排泵adeB基因RE的分析(1)adeB基因RE 的分布情況:由于adeB 基因表達升高(RE ≥ 1)提示可能與抗生素耐藥有關,于是根據RE 值是否高于1 對RE 原始數據進行整理,并對抗生素耐藥性進行分組統計分析。結果提示:adeB 基因相對表達量(RE ≥ 1)在各抗生素(AMK、IPM、CFP、FEP、TZP、CAZ、SXT、CIP、SCF、CN)不敏感組和敏感組的具體分布情況表明,在多數抗生素不敏感組RE ≥ 1 的分布比例高于敏感組,差異有統計學意義(P< 0.05)。提示adeB 過度表達與上述抗生素耐藥性密切相關。見表4。(2)adeB 基因相對表達量的結果比較分析:外排泵adeB 基因mRNA的RE 值在AMK、IPM、CFP、FEP、TZP、CAZ、CIP、SCF、CN 不敏感組和敏感組之間有統計學差異[統計量分別為AMK(χ2=1551.5,P=0.023);IPM(χ2=2611.5,P=0.016),CFP(χ2=309.0,P=0.036)、FEP(χ2=67.0,P< 0.01)、TZP(χ2=73.0,P< 0.01)、CAZ(χ2=60.0,P< 0.01)、CIP(χ2=67.0,P< 0.01)、SCF(χ2=359.0,P< 0.01)、CN(χ2=294.0,P< 0.01)],不敏感組adeB 基因的RE值平均水平較高,則該基因過度表達,提示與耐藥性關系密切。SXT 不敏感組和敏感組adeB 的RE比較差異無統計學意義(χ2=1 539.0,P=0.602)。見圖1。(3)外排泵adeJ、adeG、craA、abeM、amvA 基因RE 值比較分析:為明確其余外排泵如adeJ、adeG、craA、abeM、amvA 是否與本研究所涉及的抗生素有關,檢測其基因的mRNA 水平。結果上述基因的RE 值在各個抗生素組(不敏感組與敏感組)大多數(67.1%~99.1%)在0~1.0 之間,且經比較分析無統計學差異。提示這些基因在本研究的鮑曼不動桿菌耐藥中不起作用。見表4。
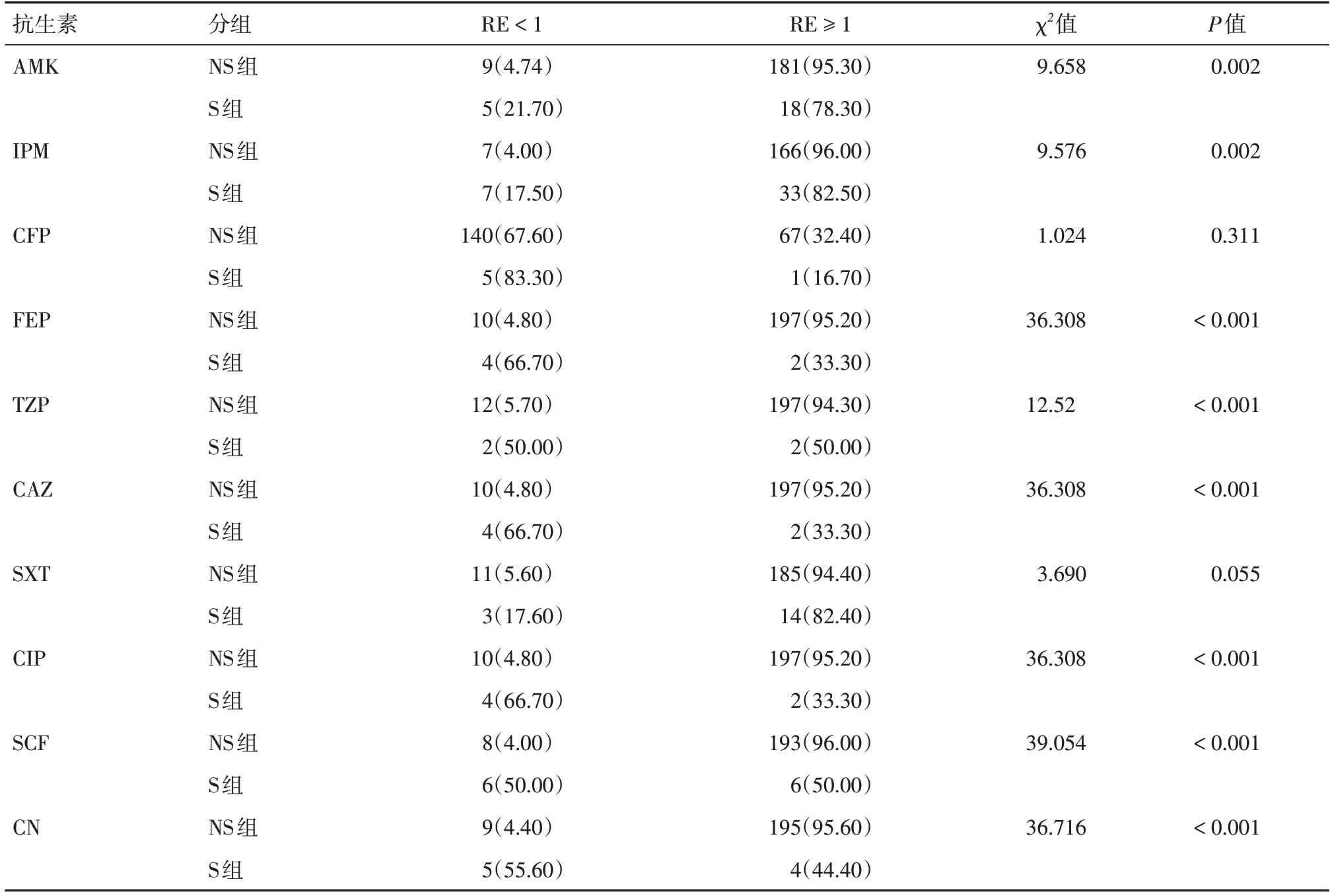
表4 adeB 基因相對表達量(RE≥1)在不同抗生素組分布情況Tab.4 Distribution of adeB gene(RE≥1)in different antibiotic groups株(%)
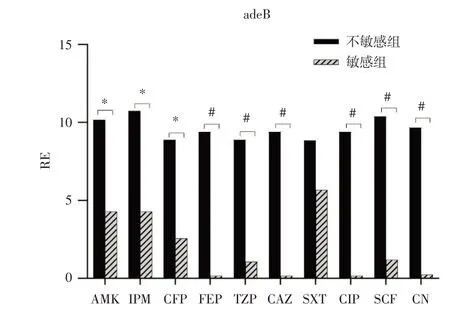
圖1 不同抗生素組adeB 基因相對表達水平比較Fig.1 Comparison of relative expression of adeB gene in different antibiotic groups
2.3.2 外膜蛋白omp25、omp33-36、carO 基因RE比較分析外膜蛋白omp25、omp33-36、carO 基因的表達量,經標準化處理后以相對表達量RE 表示(見表3)。結果顯示:外膜蛋白omp25、omp33-36、carO 基因RE 值在各抗生素(AMK、IPM、CFP、FEP、TZP、CAZ、CIP、SCF、CN)的不敏感組和敏感組,其RE 值均超過1.0,提示相對表達量升高。omp25 在AMK(χ2=1 574.5,P=0.029)表達差異有統計學意義。omp33-36 在IPM(χ2=2 635.5,P=0.019)組差異有統計學意義。carO 在AMK(χ2=1 554.5,P=0.024)、FEP(χ2=306.5,P=0.035)、CAZ(χ2=158.0,P=0.002)、CIP(χ2=306.5,P=0.035)組表達差異有統計學意義,其余各組比較差異有統計學意義。主要結果具體見圖2-4。
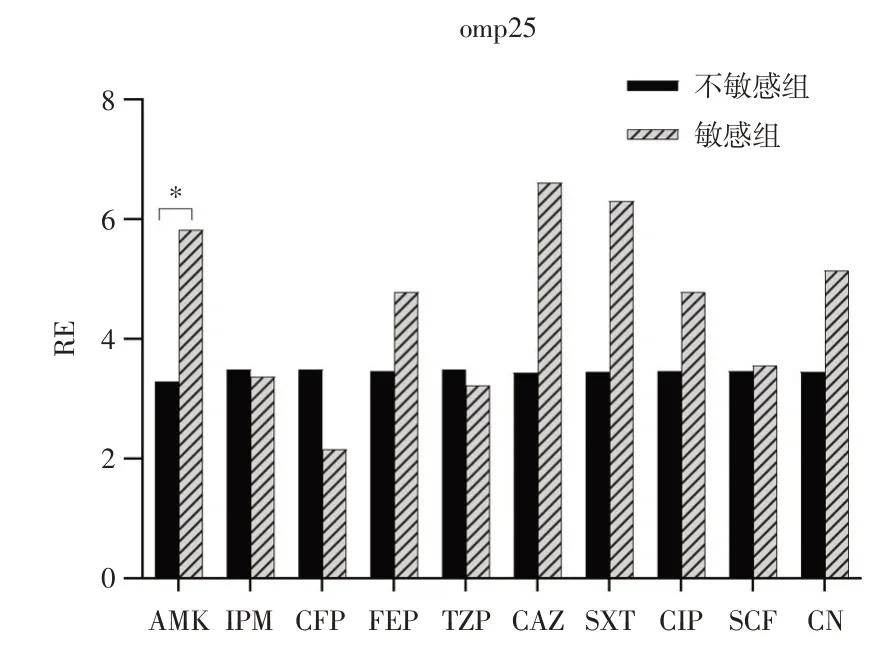
圖2 不同抗生素組omp25 基因相對表達水平比較Fig.2 Comparison of relative expression of omp25 gene in different antibiotic groups
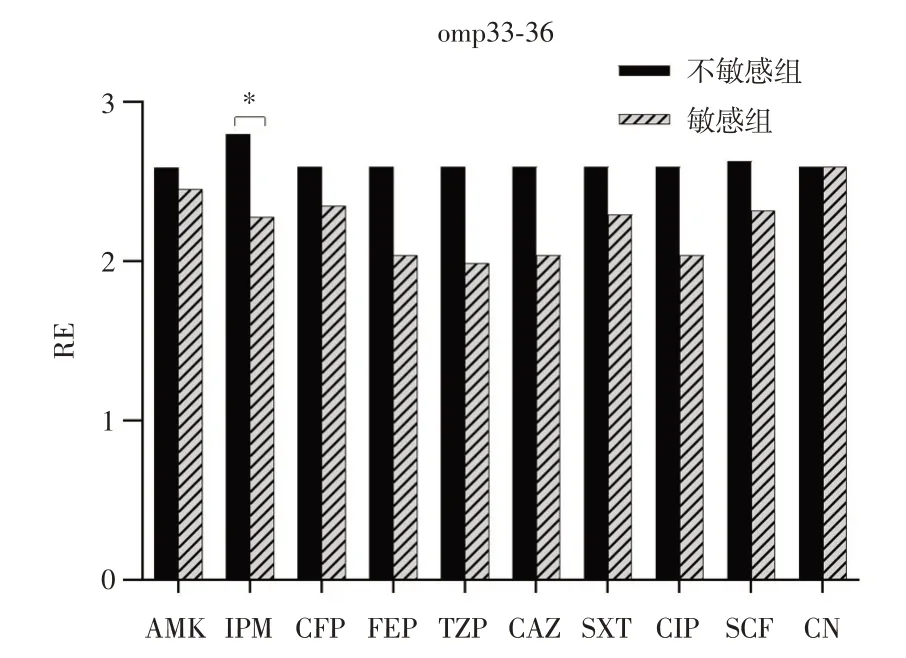
圖3 不同抗生素組omp33-36 基因相對表達水平比較Fig.3 Comparison of relative expression of omp33-36 gene in different antibiotic groups
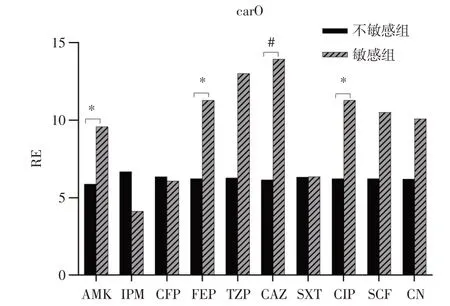
圖4 不同抗生素組carO 基因相對表達水平比較Fig.4 Comparison of relative expression of carO gene in different antibiotic groups
3 討論
鮑曼不動桿菌是一種革蘭陰性、非發酵的機會致病菌,曾經被認為是良性的鮑曼不動桿菌現在被認為是醫療保健領域的全球威脅,主要是因為它傾向于比以前未曾預見的速度獲得多重耐藥以及廣泛的耐藥表型[15]。全球感染的鮑曼不動桿菌約有近45%為多重耐藥菌株[16]。盡管碳青霉烯類抗生素被認為是治療的最后手段,但全球鮑曼不動桿菌對這些抗生素的耐藥率仍急劇上升[17]。
據中國耐藥監測網報道,2014年不動桿菌屬(主要是鮑曼不動桿菌占比93.0%)對亞胺培南和美羅培南的耐藥率分別為62.4% 和66.7%[18]。2021年不動桿菌屬對亞胺培南和美羅培南的耐藥率分別為65.6% 和66.5%,而對頭孢哌酮-舒巴坦的耐藥率為48.8%[19]。本研究報告的213 株菌株對阿米卡星、亞胺培南不敏感率分別為89.2%、81.2%,對頭孢哌酮、頭孢吡肟、哌拉西林/他唑巴坦、頭孢他啶、復方新諾明、環丙沙星、頭孢哌酮/舒巴坦、慶大霉素的不敏感率均超過92.0%。本院鮑曼不動桿菌耐藥率高,可能是重癥監護病房來源的多重耐藥菌株的比例較高有關,還有可能是多種耐藥機制參與了高耐藥的發生。目前耐藥形勢嚴峻,多耐藥菌株的存在,給臨床治療帶來了巨大的壓力和挑戰。
研究表明,鮑曼不動桿菌多重耐藥的機制主要是由以下因素共同形成,包括β-內酰胺酶產生、外膜通透性降低、孔蛋白的下調和外排泵表達增加等。細菌外排泵是鑲嵌于細胞膜的一組蛋白質,具有識別有毒物質或有毒代謝產物并將其排出胞外的功能,同時增加了鮑曼不動桿菌的致病性[20-21]。RUMBO 等[13]、COYNE 等[12]、DAMIERPIOLLE等[22]多個研究團隊的結果表明,鮑曼不動桿菌外排泵系統通過將β-內酰胺類、氟喹諾酮類、氨基糖苷類等多種抗生素泵出細胞外從而導致耐藥的發生。亦有研究表明AdeABC 外排泵系統在碳青霉烯類抗生素耐藥中沒有起作用[23]。
然而,由于不同研究菌株的背景、來源、耐藥譜不盡相同,研究發現各外排泵系統作用的抗生素底物也各不相同,因此相關研究結論也存在差異。一系列相關的研究發現,外排泵adeB 基因在70%~100%的臨床鮑曼不動桿菌中有表達。例如WIECZOREK 等[24]研究發現adeB 基因在全部收集的鮑曼不動桿菌(100 株)中表達,該菌株大部分對亞胺培南、美羅培南、等抗生素耐藥率高。COYNE等[25]發現外排泵系統存在于80%(約53%~97%)的臨床菌株中。LIN 等[26]研究甚至發現僅在75%的臨床多重耐藥菌株中有表達。上述研究提示,adeB 表達與包括碳青霉烯在內的多種抗生素耐藥有關。更有研究表明,AdeABC 外排泵的過表達與碳青霉烯類水解酶(OXA)表達結合時導致高水平的碳青霉烯類抗生素耐藥[27-28]。本研究發現在213 株鮑曼不動桿菌中,adeB 基因表達明顯升高(RE ≥ 1)所占比例為93.4%。通過比較發現,在多種抗生素不敏感組比敏感組的adeB 基因表達升高的比例更高,提示adeB 表達升高可能是導致其產生多重耐藥的重要因素之一。本研究結果與上述研究結果一致,說明adeB 過度表達在本院鮑曼不動桿菌的耐藥性方面起到了非常重要的作用。
RUMBO 等[13]研究亦發現adeG、craA、abeM 和amvA 在所研究的菌株中沒有升高(RE 值介于0.003~1 之間)。在本研究的臨床菌株中,adeJ、adeG、craA、abeM、amvA 基因的相對表達量(RE值)多數(67.1%~99.1%)在0~1.0 之間。本研究結果與其部分較一致,提示上述外排泵系統與鮑曼不動桿菌耐藥的產生沒有明顯相關性。然而,國內HOU 等[29]研究發現,adeJ 和 abeM 在耐碳青霉烯組過度表達,adeB 表達水平亦耐藥組較高,該研究推測AdeABC、AdeIJK 和AbeM 三種外排泵系統共同參與了臨床菌株耐藥的發生。本研究與之相似之處是adeB 的表達增高與碳青霉烯耐藥有關,而adeJ、abeM 在本研究抗生素耐藥中不起作用,這與上述研究有明顯不同。提示可能是研究的臨床菌株的來源不同和(或)地區差異所致,亦有其他耐藥機制參與的可能。
外膜蛋白表達減少或突變在多重耐藥鮑曼不動桿菌中起著重要作用[30]。BOU 等[31]研究發現鮑曼不動桿菌兩個外膜蛋白(22 kDa 和33 kDa)表達下降參與了對碳青霉烯抗生素的耐藥產生,而不僅僅由于產生OXA 酶導致耐藥。DEL 等[32]通過N-末端肽測序研究耐碳青霉烯酶鮑曼不動桿菌外膜蛋白omp33-36,提示該蛋白表達缺失與碳青霉烯耐藥有關。RUMBO 等[13]根據OXA-58 和OXA-24 表達陽性分為兩組,carO 和omp25 在OXA-58 組觀察到有明顯降低,但據研究者推測這種降低與亞胺培南耐藥無關,而與β-內酰胺類抗生素耐藥有關。MUSSI 等[33]研究證實carO 基因失活導致鮑曼不動桿菌對碳青霉烯抗生素耐藥,該研究亦分析CarO 參與了碳青霉烯類抗生素的流入,而自然分解破壞carO 基因導致抗生素流入減少可以解釋鮑曼不動桿菌CarO 蛋白的缺失導致了碳青霉烯耐藥的發生。FERNáNDEZ-CUENCA 等[34]通過熒光定量PCR 檢測全耐藥鮑曼不動桿菌CarO的表達,與鮑曼不動桿菌ATCC 19606 比較發現CarO 表達顯著下降,從一定程度提示該蛋白表達缺失與多重耐藥關系密切。然而本研究發現外膜蛋白基因omp25、omp33-36、CarO 相對表達量的平均水平較對照菌株呈現明顯升高,并未發現文獻報道表達顯著降低的現象。本研究結果提示,外膜蛋白基因的表達在我院大部分鮑曼不動桿菌耐藥中可能并未發揮作用。可能的原因是研究菌株來源存在地區差異,并且菌株所攜帶的其他耐藥基因(OXA 酶、金屬酶等)可能存在不同。
綜上所述,本課題研究結果表明,外排泵adeB基因過度表達在鮑曼不動桿菌耐藥中可能起著非常重要的作用;其余外排泵基因(adeJ、adeG、craA、abeM、amvA)和外膜蛋白基因(omp25、omp33-36、CarO)與在耐藥菌的耐藥機制中可能不起作用。不足之處是需要進一步研究其深層次耐藥機制。因此,對于本院感染鮑曼不動桿菌的患者,充分了解其耐藥的背景特征,有針對性選擇抗生素進行治療,例如使用替加環素治療可能是比較好的選擇。
【Author contributions】HUANG Yubo collected data,performed the experiments and wrote the article.ZHOU Yuqi revised the article and provided funding support.ZHENG Wenzheng collected data and performed the experiments.ZHU Jiaxin provided strains and methodology.YANG Hailing and WU Wenbin provided experimental equipment and performed the experiments.ZHANG Tiantuo designed the study and reviewed the article.All authors read and approved the final manuscript as submitted.

