基于苯并噻二唑結構的近紅外二區有機小分子在生物成像和治療中的研究進展
景靳彭, 陳世棱, 王宗樟, 陳洪敏,2*
(1. 廈門大學 分子疫苗學與分子診斷學國家重點實驗室, 分子影像暨轉化醫學研究中心, 福建 廈門 361102;2. 南京郵電大學 有機電子與信息顯示國家重點實驗室, 信息材料與納米技術研究院, 江蘇 南京 210023)
1 引 言
目前體內成像技術已被廣泛應用于生物醫學研究和臨床實踐,其中熒光成像具有時空分辨率高、實時檢測速度快、非侵入安全等特點[1],借助特異性的熒光探針對特定的細胞或分子進行標記,進而實現對各種生理和病理過程的監測,以滿足診斷和治療的需求。波長700 ~1 700 nm是一個相對清晰的體內熒光成像區域,其中700 ~1 000 nm被稱為近紅外一區(NIR-Ⅰ)窗口,1 000 ~1 700 nm被稱為近紅外二區(NIR-Ⅱ)窗口,基于光子反射、散射和自發熒光的減弱,近紅外二區窗口能夠實現高分辨率和信噪比的生物熒光成像,在各種生物醫學應用中發揮著重要作用[2-3]。特別地,在NIR-Ⅱb區(1 500 ~1 700 nm),生物組織的自發熒光和光散射、光吸收引起的光衰減更低,因此提供了最佳的穿透深度和時空圖像分辨率。目前NIR-Ⅱb區被認為是深度成像最佳的光學窗口,并且在脈管系統成像、體內血液循環追蹤以及腦血管成像等領域取得了顯著進展[4]。
近紅外二區熒光團主要分為單壁碳納米管(Single-walled carbon nanotubes,SWCNTs)、量子點(Quantum dots, QDs)、稀土摻雜納米粒子(Rareearth-doped nanoparticles,RENPs)和有機熒光團(Organic fluorophores,OFs)幾大類[5-6]。盡管無機熒光團具有最小的光漂白、較高的量子產率、較大的斯托克斯位移和可調諧的光學性質[7],但是無機金屬離子的安全性問題,例如在肝臟和脾臟的滯留和積累,以及給藥后潛在的免疫原性反應[8]都是不容忽視的問題。對于有機熒光團,其光物理性質可以通過結構設計來特異性調控,并且具有相對低的毒性和優越的生物相容性,使得其更適合于生物應用和臨床轉化[9-10]。
有機分子的光物理過程遵循雅布倫斯基能級圖[11],當有機分子吸收特定能量的光子后會從基態S0躍遷至激發態,隨后通過內轉換弛豫至激發態最低能級,處于最低激發態的分子會經歷三個過程:分子弛豫、振動弛豫和系間竄躍。
分子弛豫過程發射光子,是產生熒光的主要原因。有機熒光分子的光致發光主要依賴于分子內電荷轉移(Intramolecular charge transfer, ICT)過程,當分子在光激發下到達激發態時,分子內電子從供體轉移到受體形成電荷分離,進而產生電荷轉移狀態。當分子內電荷轉移作用增強,發射波長紅移;當分子內電荷轉移作用減弱,發射波長藍移[12-14]。構建供體-受體-供體(Donor-acceptor-donor,D-A-D)結構是設計近紅外二區有機分子的有效方法之一,在D-A-D結構骨架中,最高占據分子軌道(Highest occupied molecular orbital,HOMO)沿著整個分子離域,而最低未占據分子軌道(Lowest unoccupied molecular orbital, LUMO)幾乎全部集中在受體核心。在分子從基態躍遷到激發態(S0→S1)的過程中發生HOMO至LUMO的ICT過程,隨后通過輻射過程從S1弛豫至S0產生熒光發射。電子供體可以提高HOMO能級,而電子受體能夠降低LUMO能級,HOMO和LUMO之間的能帶間隙影響分子的光學性質,通過調節不同的電子供體和受體,能夠將發射波長拓展至近紅外二區窗口[15]。
振動弛豫是一種非輻射機制,分子通過振動弛豫將自身能量傳遞給周圍環境,是光熱產生的主要原因。系間竄躍(Intersystem crossing, ISC)是指處于激發態單重態的分子躍遷至激發態三重態的過程,隨后通過弛豫發射磷光回到基態或者發生三重態-三重態湮滅以及產生各種活性氧。因此,D-A-D結構的近紅外二區有機分子在實現近紅外二區熒光成像的同時,還能夠被用于光熱治療(Photothermal therapy, PTT)和光動力治療(Photodynamic therapy,PDT)[16-17]。對于PTT,激發態單重態分子的部分能量通過非輻射躍遷以熱的形式耗散,從而產生光熱效應誘導腫瘤消融。對于PDT,激發態三重態的分子通過兩種不同的途徑引起光化學反應(Ⅰ型和Ⅱ型PDT)產生活性氧,導致腫瘤細胞死亡[18-19]。診療一體化是將疾病診斷和治療手段結合起來,在診斷的同時實現疾病治療的新手段,提高了疾病治療的精準度和有效性。因此,D-A-D結構的近紅外二區有機小分子在成像引導的光學治療領域引起廣泛關注,同時光療與化療和免疫治療相結合的協同治療也得到了快速發展[20-21]。
一般來講,D-A-D結構中的受體部分決定了分子的激發態性質,對于熒光分子的性能有著更為顯著的影響。如圖1所示,Zhou等[22]對一系列噻二唑及其衍生物結構的受體進行理論計算,確定了噻二唑的超價結構使得分子成為強烈的電子受體,能夠有效降低分子的能帶間隙,延長熒光發射波長。
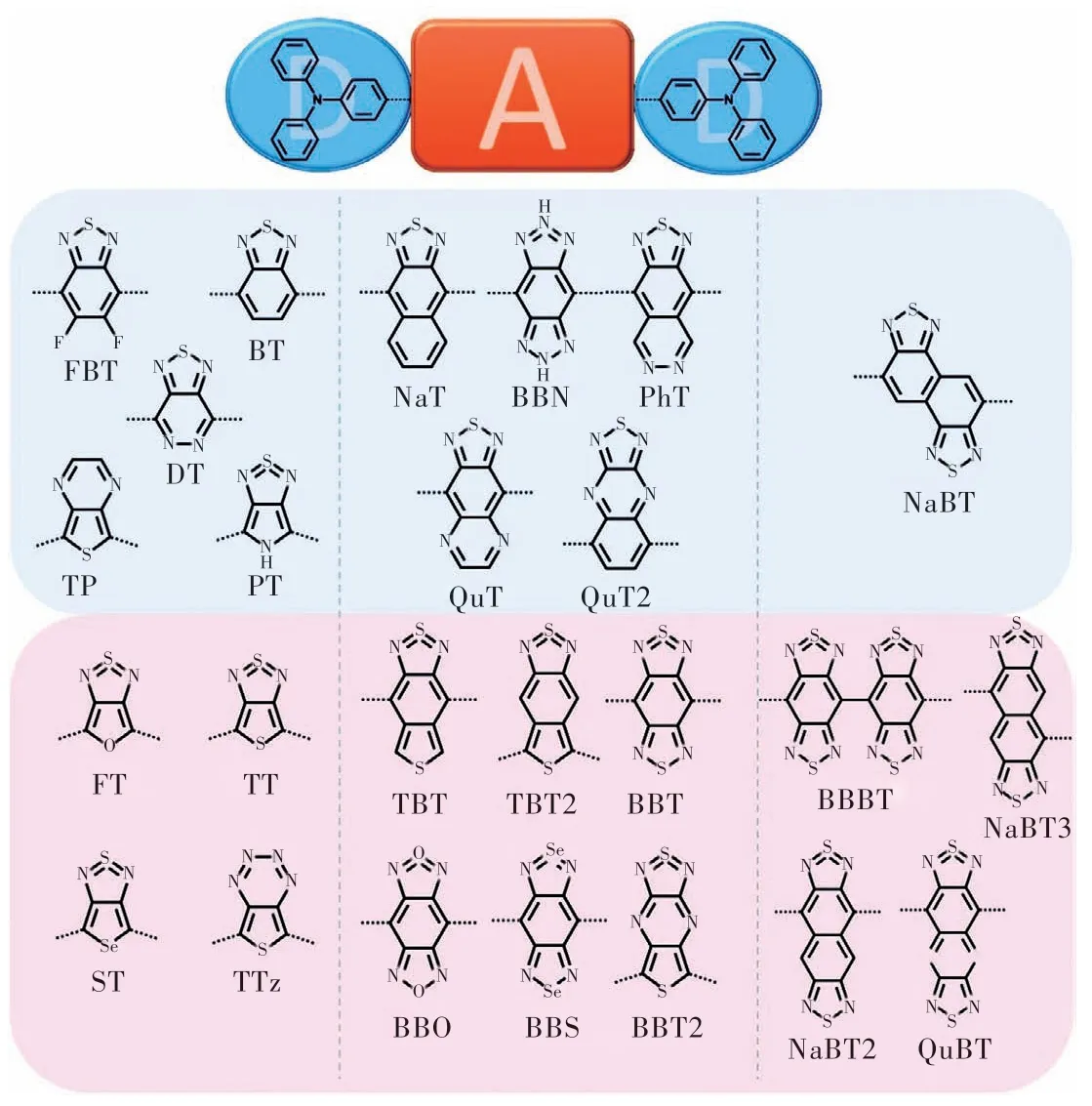
圖1 基于供體-受體-供體(D-A-D)模型(供體為三苯胺),由噻二唑、苯并雙(噻二唑)及其雜環衍生物組成的25個受體的化學結構[22]。Fig.1 The chemical structures of 25 acceptors consisting of thiadiazole, benzobis(thiadiazole) and their hetero-annulated derivatives based on the donor-acceptor-donor(D-A-D) model (Triphenylamine as donor)[22].
近年來,苯并雙噻二唑(Benzobisthiadiazole,BBT)和[1,2,5]噻二唑[3,4-g]喹喔啉([1,2,5]thiadiazolo[3,4-g]quinoxaline, TQ)是兩種最受歡迎的苯并噻二唑結構的受體單元,以BBT和TQ為核心構建了諸多近紅外二區光學診療探針,并且在疾病診斷和治療領域蓬勃發展。因此,本文綜述了基于BBT和TQ結構的近紅外二區有機小分子在生物成像和成像引導的治療中的研究進展,并對未來近紅外二區有機小分子的設計和應用進行展望。
2 基于BBT結構的分子用于生物成像
2.1 解剖學成像
臨床中廣泛使用顯微計算機斷層掃描(micro-CT)和磁共振成像(MRI)用于解剖學成像,然而掃描時間長和電離輻射損傷等因素一定程度上限制了其發展,同時由于時間分辨率低,難以評估血流動力學[23-24]。目前NIR-Ⅱ成像能夠清楚地區分包括脈管系統、內臟器官、骨骼、淋巴結和腫瘤在內的解剖結構,有利于研究體內生物學活動。
2016年,Antaris等[25]以N,N-二(4-甲酰苯基)苯胺為供體單元合成近紅外二區有機小分子染料CH1055(0.97 ku),為了提高水溶性,將CH1055中的4個羧基與聚乙二醇氨基(PEG2000-NH2)進行共價偶聯得到CH1055-PEG(8.9 ku)。CH1055-PEG的最大吸收峰位于750 nm,最大發射峰位于1 055 nm,尾峰延伸到1 300~1 400 nm,熒光量子產率為0.3%(以IR-26的0.5%為參考)。藥代動力學結果表明約90%的CH1055-PEG在24 h內能夠通過腎臟排出,其代謝水平與FDA批準的ICG相當。CH1055-PEG對小鼠淋巴血管和淋巴結的近紅外二區成像效果優于ICG,此外通過非特異性的腫瘤攝取,能夠在保持小鼠頭皮和顱骨完整的條件下,對4 mm深的原位腦膠質瘤實現高信噪比(大于5倍)的無創成像。CH1055-PEG是第一個水溶性近紅外二區發射的分子,其高水平的腎臟清除率足以與ICG相媲美,但是0.3%的熒光量子產率并不令人滿意。因此,Antaris等[26]通過酰胺縮合的方法將CH1055與牛磺酸連接得到磺化的有機小分子CH-4T(1.4 ku),含有磺酸基的CH-4T能夠完全溶于水,與血漿蛋白形成超分子組裝體能夠顯著提高熒光強度(相比于PBS中增加約50倍),具有高達5%的熒光量子產率,在血清中將染料加熱至70 ℃能夠將量子產率提高到11%。CH-4T蛋白復合物能夠對約5 ~8 mm深的淋巴結實現清晰的近紅外二區成像,此外每秒50幀的超快動態成像還能明確地分辨血管血流動力學。
Yang等[27]以3,4-乙烯基二氧噻吩(EDOT)為供體、二烷基芴為屏蔽單元(Shielding Unit, S),構建了S-D-A-D-S結構的IR-FE,通過理論計算對分子基態S0和激發態S1進行構象優化。IR-FE與噻吩作供體的IR-FT相比,S1優化構象中BBT與EDOT之間的二面角(31°)大于BBT與噻吩之間的二面角(0.7°),EDOT增大了主鏈扭曲程度,同時調節靜電勢分布。此外,屏蔽單元二烷基芴的烷基側鏈比IR-FT更多地處于整個共軛平面外,因此可以防止主鏈聚集,抑制共軛主鏈之間發生相互作用,減弱了S1態的非輻射衰減途徑,提高S1態穩定性,增加輻射躍遷幾率,從而提高IR-FE的熒光量子產率。IR-FE和衍生物IR-FEP在甲苯和水溶液中的量子產率分別為31%和2.0%,IRFEP能夠通過被動攝取進入腫瘤,進而區分腫瘤和背景組織。
疏水性的小分子往往需要裝載到聚合物中以實現良好的生物相容性,然而大多數熒光分子在聚集狀態下會發生熒光猝滅,具有聚集誘導發光(Aggregation-induced emission,AIE)性質的近紅外有機小分子在開發明亮的探針方面具有巨大的前景[28-30]。Sheng等[31]以N,N-二苯基-4-(1,2,2-三苯乙烯基)苯胺(DPTPEA)為供體合成AIE分子TB1,封裝入DSPE-PEG2000后得到TB1點,在740 nm處具有10.2 L·g-1·cm-1的吸收率,最大發射波長為975 nm,熒光量子產率為6.2%。除了近紅外二區成像,TB1點對近紅外光的高吸收率有助于實現近紅外光聲成像,進一步將靶向膠質瘤中過表達的αVβ3整合素受體的腫瘤特異性c-RGD肽共價連接到TB1點上,TB1-RGD能夠實現近紅外二區熒光和近紅外一區光聲雙模態成像,用于高度特異性和靈敏度的腦腫瘤診斷,信號背景比達到4.4。
Fang等[32]以噻吩為供體、硒原子取代的BBT為受體,同時在外側屏蔽單元芴上引入氨基,合成了最大發射波長為1 210 nm的FM1210。納米化的FM1210不僅能夠滿足對小鼠全身每秒100幀的近紅外二區成像,還能用于腫瘤和脈管系統的高信噪比成像。
2.2 病理生理學成像
精準醫學需要準確和全面的病理生理信息,NIR-Ⅱ成像具有優越的時空分辨率和深層組織穿透能力,可以實時提供解剖信息和血流動力學信息。其中腦血管對創傷性腦損傷(Traumatic brain injury,TBI)引起的生物力學損傷十分脆弱和敏感,細微的血管變化就可能影響到正常細胞的功能,從而導致神經失調。腦微血管活體成像能夠有效監測TBI后的腦血管反應,血管病理學可以作為TBI的生物標志物。Zhang等[33]以噻吩基單元為供體、以EDOT為橋聯基團,并將親水的PEG鏈連接到分子中合成了IR-E1(4.5 ku),其中EDOT的大位阻能夠保護共軛主鏈免受分子間和分子內相互作用的影響,提高熒光量子產率。IRE1在水中的最大吸收峰位于830 nm,最大發射峰位于1 071 nm,熒光量子產率約為0.7%(約為單壁碳納米管的2倍)。IR-E1的水合粒徑為3.6 nm,注射后24 h內約83%通過腎代謝。利用IRE1對小鼠大腦進行近紅外二區高時空分辨率的無創成像,以研究TBI引起的血流動力學異常和腦血管損傷,大腦血管損傷導致的短暫灌注不足是TBI后血管的主要特征,基于這些生物標志物能夠幫助我們更深入地研究腦病理學。
如圖2(a)所示,Shou等[34]以噻吩取代的三苯胺為供體合成D-A-D結構的近紅外二區小分子,并包封進磷脂囊泡中制備了探針CQS1000,其最大吸收波長為830 nm,最大發射波長為1 000 nm。CQS1000的血液循環半衰期為(88.76±2.90)min,因此能夠無創、動態地可視化和監測循環系統,包括淋巴引流、腫瘤血管生成、缺血以及動脈血栓等,進一步通過區分腫瘤的血液供應以及淋巴引流進行精確和完整的腫瘤切除。
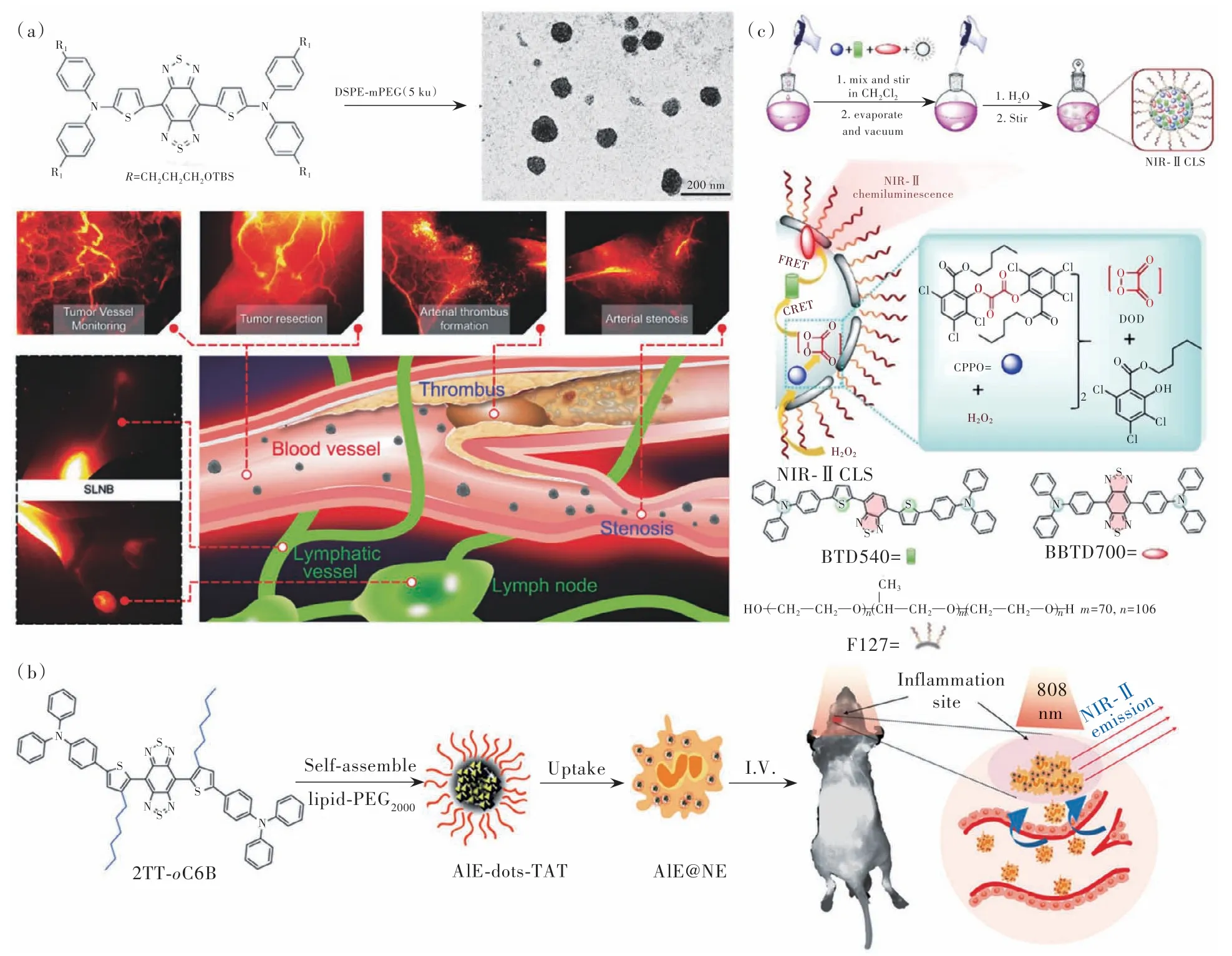
圖2 (a)CQS1000生物應用示意圖[34];(b)NE介導的NIR-Ⅱ AIE點用于大腦炎癥成像示意圖[35];(c)在H2O2的存在下,NIR-Ⅱ CLS產生NIR-Ⅱ化學發光原理圖[36]。Fig.2 (a)Schematic illustration of the biological application using CQS1000[34]. (b)The illustration of the NE-mediated NIR-ⅡAIE dots for brain inflammation imaging[35]. (c)The illustration of principle for generating NIR-Ⅱ CL emission in the presence of H2O2[36].
如圖2(b)所示,Liu等[35]以噻吩為供體和橋聯基團、三苯胺為分子轉子,通過骨架扭曲和轉子扭曲的組合進行結構異構,得到具有優異AIE性能的2TT-oC6B。分子重組能反映光激發時固有幾何結構的變化,重組能與相應簡正模式波數的關系表明多種分子內運動引起的激發態失活,低頻區域的簡正模式對應扭轉運動,高頻區域對應鍵伸展。在溶液中2TT-oC6B的低頻扭轉運動促進了非輻射衰減過程,導致溶液中的熒光量子產率較低;在聚集狀態下2TT-oC6B中扭曲主鏈和扭曲三苯胺的存在減弱了分子間的相互作用,促進了輻射衰減過程,使得熒光量子產率提高。2TT-oC6B的熒光量子產率為11%,最大發射峰位于1 030 nm處,對小鼠后肢和頭部血管近紅外二區成像質量遠遠優于ICG。利用中性粒細胞(Neutrophils, NEs)能夠穿透血腦屏障(Blood-brain-barrier, BBB)并在炎癥區域聚集的特性,將2TT-oC6B納米粒子裝載至中性粒細胞中得到AIE@NE,能夠實現對小鼠大腦約3 mm深處炎癥區域的無創診斷,近紅外二區成像信噪比為30.6,表明其可用于高度敏感的腦部炎癥診斷。
如圖2(c)所示,Yang等[36]基于經典的過氧草酸酯化學發光(Peroxyoxalate-based CL,POCL)原理,使用兩種D-A-D結構的熒光染料BTD540和BBTD700,構建近紅外二區化學發光傳感器NIR-Ⅱ CLS,通過級聯化學發光共振能量轉移和熒光共振能量轉移,將化學發光供體的能量轉化為近紅外二區光子,克服了化學發光發射波長短、穿透深度低的缺點。在生理條件下,NIR-Ⅱ CLS能夠被過氧化氫選擇性地激活,進而檢測小鼠淋巴結和關節部位過氧化氫誘導的局部炎癥。與單獨的近紅外二區成像相比,近紅外二區化學發光成像信噪比提高了4.5倍,表明這種級聯產生的近紅外化學發光具有重要的體內生物傳感意義。Shen等[37]通過調整供體部分的取代基團,設計并合成了近紅外二區有機小分子TPE-BBT,由于優化的D-A相互作用和分子聚集狀態下較高的剛性,TPE-BBT晶體的絕對量子產率達到10.4%。F127制備的TPE-BBT納米粒子在水中的相對量子產率為31.5%(以IR-26的0.5%為參考),超高的量子產率使得TPE-BBT成為理想的近紅外二區熒光成像探針。此外,通過連續的化學發光共振能量轉移和熒光共振能量轉移過程,TPE-BT構建的近紅外二區化學發光納米粒子能夠實現小鼠局部關節炎癥區域的響應性成像,炎癥區域最高信號背景比達到130,表明TPE-BBT在化學發光成像和生物傳感方面具有巨大的應用潛力,同時為開發高量子產率的近紅外二區疾病診斷探針提供了新的策略。
2.3 分子成像
分子成像可以在細胞和分子水平非侵入檢測和監測體內生理或病理過程,為疾病的發生、發展和結果提供有價值的信息。Wan等[38]通過調整S-DA-D-S結構中屏蔽單元側鏈的碳原子數目,篩選出的IR-BGP6表現出快速的腎臟代謝和相對高的熒光量子產率(約1.5%),與PD-L1 mAb綴合得到的抗PD-L1-BGP6能夠成功靶向MC38腫瘤表達的PD-L1,從而實現近紅外二區PD-L1分子成像,腫瘤與正常組織信噪比約為9.5。此外,該探針還能夠有效區分MC38和4T1腫瘤中PD-L1的表達差異,為免疫學機制的研究提供了有力的顯像探針。
3 基于BBT結構的分子用于治療
3.1 成像引導的光熱治療
光熱治療能夠精確可控地殺死腫瘤細胞,近紅外二區有機分子是實現成像引導的光熱治療的絕佳平臺。如圖3(a)所示,Alifu等[39]以N,N-二苯基-1-萘胺(BPN)為供體單元合成BPN-BBTD納米粒子,其發射波長由800 nm延伸至1 300 nm,在近紅外二區范圍內具有較高的熒光量子產率(約1.8%),同時具有較高的光熱轉換效率(39.8%)。兼具近紅外二區熒光和光熱效應的單分子AIE納米粒子能夠用于熒光成像引導的皮下和原位膀胱腫瘤的光熱治療,靜脈注射的BPN-BBTD納米粒子能夠通過高通透長滯留效應(Enhanced permeability and retention, EPR)被動靶向皮下和原位腫瘤。785 nm激光照射下的光熱治療能夠完全根除皮下腫瘤不再復發,并且一定程度地抑制原位腫瘤的生長,此外還能實現對皮下和原位腫瘤長達32 d的追蹤能力。BPN-BBTD納米粒子能夠實現對膀胱腫瘤的高效診斷、光熱治療和長期追蹤,為構建高效的臨床應用治療平臺提供了一種有前景的方法。

圖3 (a)用于體內熒光成像、光熱治療和腫瘤長期追蹤的單分子和NIR-Ⅱ發射有機AIE NPs示意圖[39];(b)腦靶向ApoEPh 納米粒子的制備,在1 550 nm的NIR-Ⅱb區成像以及小鼠原位膠質母細胞瘤的光熱治療示意圖[40]。Fig.3 (a)Schematic illustration of single-molecular and NIR-Ⅱ emitted organic AIE NPs for in vivo fluorescence imaging, photothermal therapy and long-term tracing of tumors[39]. (b)Schematic illustration of the fabrication of brain-targeting ApoEPh NPs, NIR-Ⅱb imaging at 1 550 nm and photothermal therapy of mice bearing orthotopic glioblastoma[40].
如圖3(b)所示,Wang等[40]采用骨架扭曲+分子轉子的設計策略合成新型AIE分子Ph,制備的Ph納米粒子具有優越的NIR-Ⅱb區體內成像和近紅外光熱治療的能力。用腦靶向載脂蛋白E肽(ApoE)修飾得到ApoE-Ph納米粒子,其表現出更強的血腦屏障穿越能力。在注射后6 h能夠在腦膠質母細胞腫瘤部位穩定富集,并且能夠通過光熱治療高效地消融腫瘤。
Zeng等[41]以二甲胺取代的四苯乙烯為電子供體和分子馬達、長烷基鏈修飾的噻吩為π橋和屏蔽單元合成了2DMTT-BBTD,噻吩上的長烷基鏈不僅可以增強TICT態的形成,還可以阻止緊密的分子間堆積作用并保持聚集狀態下分子內的運動。使用DSPE-PEG2000-Mal包封2DMTT-BBTD制備的納米粒子在808 nm激光照射下光熱轉換效率達到74.8%,優于大多數光熱治療劑(ICG,IR780@TBMPA等)。為了避免對周圍正常組織的熱損傷,進一步使用熱休克蛋白90(HSP90)抑制劑藤黃酸(GA)與2DMTT-BBTD共載以促進低溫熱療,隨后將RGD多肽修飾在納米粒子表面來提高腫瘤靶向能力,得到的BBTD+GA/PEG-RGD納米粒子在肌層浸潤性膀胱癌(Muscle-invasive bladder cancer, MIBC)中表現出較好的富集,并且光熱治療(小于45 ℃)后對腫瘤生長具有良好的抑制作用。2DMTT-BBTD分子優異的光熱性能和GA的摻入也有助于減少藥物和激光照射劑量以及全身毒性。通過調節分子的幾何形狀、TICT和分子內運動,為設計高效的近紅外吸收光熱治療劑提供新的見解,也為MIBC的非侵入治療提供了新的策略。
3.2 協同治療
單一的成像方式不能獲得全面的成像信息[42-43],單獨的光動力治療或光熱治療也難以獲得滿意的治療效果[44]。通過將不同成像技術與治療方法相結合,構建多模態光學診療平臺,可以提供精確的診斷和有效的治療。如圖4(a)所示,Wang等[45]以噻吩和三苯胺為基本單元構建AIEgens,在水溶液中AIEgens能夠自組裝為形狀規則、細菌靶向的AIE納米粒子,并且在808 nm激光照射下,AIE納米粒子可以將低功率的近紅外激光(0.1 W/cm2和0.2 W/cm2)的光能轉化為熱能或者活性氧,進而同時實現光熱治療和光動力治療。基于AIE納米粒子的PTT/PDT雙模態協同治療能夠有效清除革蘭氏陽性菌(金黃色葡萄球菌),并且加速全層皮膚創傷模型中金黃色葡萄球菌感染處傷口的愈合。所構建的AIE NPs為近紅外抗菌光診療劑提供了新的可選策略,同時也是無需抗生素處理細菌感染的新手段。
如圖4(b)所示,Wang等[46]以苯并[c]噻吩為供體單元核心,合成多功能近紅外二區激發的光熱劑 TPE-BT-BBTD,在980 nm處具有較高的摩爾吸光系數,同時具有出色的近紅外二區熒光發射性能。制備的TPE-BT-BBTD納米粒子能夠用于近紅外二區熒光成像引導的胰腺癌光熱治療。進一步在表面修飾免疫檢查點抑制劑αPD-L1,得到的αPD-L1@TPE-BT-BBTD納米粒子能夠特異性附著在腫瘤上,在980 nm激光照射下誘導免疫原性細胞死亡(Immunogenic cell death,ICD),導致腫瘤相關抗原和損傷相關分子模式(Damage-associated molecular patterns,DAMP)的釋放,從而增強全身抗腫瘤免疫反應并向腫瘤招募T淋巴細胞。αPD-L1能夠減少FoxP3+Treg細胞和M2樣巨噬細胞的浸潤,同時防止PD-L1依賴的細胞毒性T細胞免疫逃逸,從而逆轉腫瘤微環境的免疫抑制,有效地靶向消除腫瘤和抑制轉移。
如圖4(c)所示,Jiang等[47]以二苯胺取代的四苯乙烯為供體單元,合成了具有近紅外發射的AIE分子DDTB,制得的DDTB-DP納米粒子在973 nm處發射強烈的近紅外熒光,同時具有良好的活性氧產生能力和高的光熱轉換效率。利用DDTBDP納米粒子能夠實現近紅外二區熒光成像引導的小鼠宮頸癌手術、光動力和光熱協同治療,最大程度地殺死腫瘤細胞和組織,以達到最大化的治療結果和存活率。另外,結合DDTB-DP納米粒子介導的PTT/PDT和PD-L1抗體的腫瘤免疫療法對小鼠原發性腫瘤表現出顯著的抑制效果,因此基于DDTB-DP納米粒子的整合一體的治療方法在實際和臨床應用中具有巨大潛力。
4 基于TQ結構的分子用于生物成像
4.1 血管成像
雙光子熒光(Two-photon fluorescence, TPF)指的是分子同時吸收兩個長波長(低能量)光子產生激發態,然后釋放一個短波長(高能量)光子的非線性光學過程。雙光子熒光顯微技術是實現深層組織成像和高分辨生物成像的重要方法,廣泛應用于主要器官的三維重建、生物學過程和疾病的監測[48-49]。Qi等[50]合成了具有平面核和數個扭曲苯環/萘環結構的TQ-BPN,利用表面活性劑制備的AIE點的最大發射峰位于810 nm處。由于TQBPN AIE點在650 nm處具有較高的雙光子吸收截面(1.22×103GM),因此在1 300 nm的近紅外光激發下,能夠實現對小鼠大腦白質以外(大于840 μm)甚至到海馬區(大于960 μm)的超高空間分辨率雙光子熒光顯微成像,并能夠清晰地可視化大腦1 065 μm深處約5 μm左右的小血管,表明近紅外二區激發的雙光子熒光成像在深部組織的高分辨成像方面具有巨大的應用前景。Wang等[51]以扭曲的四苯乙烯為供體合成近紅外一區發射的AIE分子BTPETQ,制備的BTPETQ點最大發射波長約為700 nm,熒光量子產率為(19±1)%,同時在1 200 nm處具有較大的雙光子吸收截面(7.63×104GM)。BTPETQ點在腫瘤血管中顯示出增強的雙光子熒光,有助于區分腫瘤血管和正常血管,進一步實現了深度670 μm、信噪比120的深層腫瘤血管網絡的體內成像,表明雙光子熒光成像在腫瘤血管結構監測方面具有巨大優勢。
如圖5所示,Ji等[52]以TQ為母體衍生出新型電子受體TQT,并以9,9’-二烷基芴為屏蔽單元、噻吩為第二供體合成FT-TQT,可在體內實現快速、高分辨率和實時的血管成像,優化后的蛋白復合物FT-TQT@FBS能夠用于動態血管過程(腦血管、腫瘤血管和CA4P治療后的腫瘤血管破壞)的靜態或持續成像。FT-TQT為監測血管相關疾病和評估血管相關治療效果提供了強有力的工具。
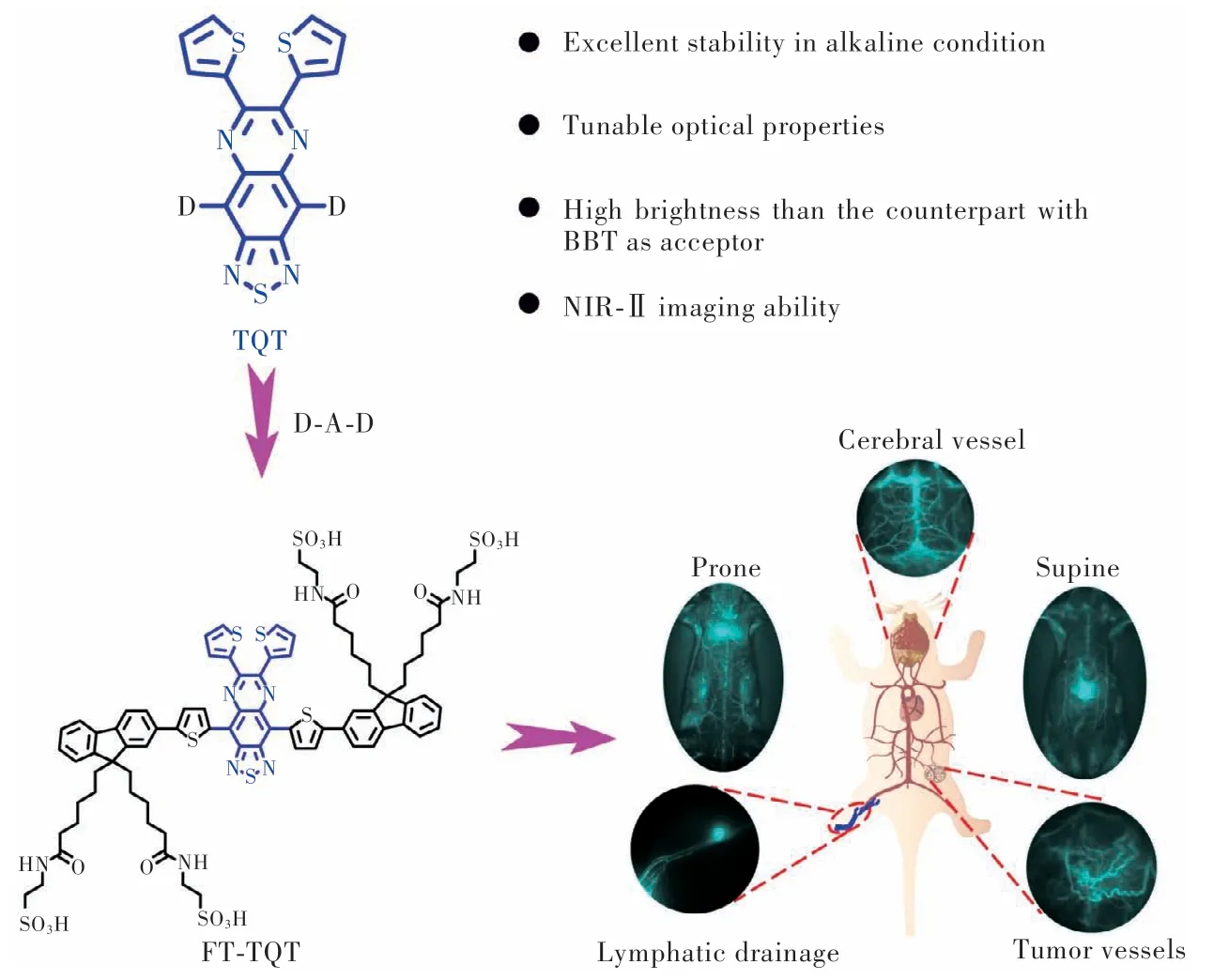
圖5 基于TQT受體的D-A-D NIR-Ⅱ熒光團結構[52]Fig.5 D-A-D NIR-Ⅱ fluorophore structures based on TQT acceptor[52]
4.2 炎癥成像
Chen等[53]將TQ與兩個四苯乙烯轉子連接,然后在左右兩端引入硝基苯基氧代乙酰胺單元作為識別基團和熒光猝滅基團,合成響應性分子探針BTPE-NO2,使用兩親性聚合物普朗尼克F127包封得到納米探針BTPE-NO2@F127。疾病部位病理水平的H2O2能夠切割硝基苯基氧代乙酰胺基團并激活探針,從而在950 ~1 200 nm產生熒光發射和光聲信號用于炎癥疾病的多模式成像,利用BTPE-NO2@F127成功實現對曲唑酮誘導的肝損傷、缺血再灌注肝損傷和間質性膀胱炎的監測和成像,BTPE-NO2@F127為病理區域特異性激活響應的近紅外二區熒光探針的設計和應用提供了新的見解。
5 基于TQ結構的分子用于治療
5.1 手術導航
手術切除通常是惡性腫瘤最常見和最有效的治療方法之一,然而觸診和目視檢查并不能精準區分惡性和正常的組織類型,因此可能導致不完全的切除或健康組織的不必要切除。NIR-Ⅱ成像技術由于其即時性、高分辨率、高特異性等檢測優勢,在精準手術導航領域有著極高的應用價值[54]。Jia等[55]以辛烷基取代的酚噻嗪為供體單元合成了PTZ-TQ,使用DSPE-PEG3400-NH2為包封基質制備PTZ-TQ-AIE點。與ICG相比,PTZ-TQ-AIE點在1 250 nm處表現出明亮而銳利的近紅外二區發射并且延伸至1 600 nm,PTZ-TQ-AIE點能夠有效地產生ROS用于光動力治療,通過熒光成像引導的手術切除和光動力治療能夠完全抑制原位肝腫瘤。因此,PTZ-TQ-AIE點既可以用于熒光成像引導的早期腫瘤手術,也可用于“降期”以減小腫瘤大小。
Gao等[56]以三苯胺(TPA)為供體,以含有不同取代基的TQ為受體,合成了TPA-TQ1、TPA-TQ2和TPA-TQ3,含有轉子的分子的扭曲構象有利于提高AIE性能和熒光亮度,分子內的運動則有利于促進熱聲轉換從而提高光聲信號。TPA-TQ3納米粒子能夠在術前通過近紅外熒光和光聲成像確定原位乳腺癌的位置、幾何形狀和深度,進而為手術提供明確的指導,在術中通過近紅外熒光成像快速、靈敏地勾勒出殘留的微小腫瘤輪廓,顯著提高手術效果。
5.2 多模態成像引導的治療
Chen等[57]基于連續的噻吩單元設計并合成了有機小分子TTQ-TC,TTQ-TC在1 300 ~1 400 nm內具有較強的近紅外二區熒光發射,同時也是良好的光熱治療劑。利用小分子染料合成了遙爪糖聚合物TTQ-TC-PFru,其中的果糖聚合物與抗癌藥物硼替佐米(BTZ)能夠形成穩定的硼酸-兒茶酚綴合物,而BTZ是一種含有二肽基硼酸的蛋白酶體抑制劑,具有獨特的腫瘤微環境響應特性;隨后引入共聚物POEGMA-co-PBOB,通過和PFru含糖共聚物形成動態共價鍵,保護BTZ不與葡萄糖相互作用,進一步提高體系的穩定性。構建的刺激響應性PFru-BTZ-PBOB納米粒子具有高載藥量(31%)、良好的生理穩定性以及可控的藥物釋放。在酸性腫瘤微環境中,PFru-BTZ-PBOB能夠有效釋放高濃度的抗癌藥物BTZ,同時與近紅外二區熒光成像引導的光熱治療協同促進了腫瘤的消退。該納米載藥平臺對于實現精確NIR-Ⅱa區熒光成像引導的化學-光熱聯合治療具有良好的應用前景。
如圖6(a)所示,Yan等[58]設計并合成了D-π-A-π-D結構的DPBTA-DPTQ,引入大位阻的富電子D/π橋單元苯并[c]噻吩,使得DPBTA-DPTQ具有扭曲構象,抑制其聚集態時的π-π堆積作用。因此能夠將DPBTA-DPTQ最大發射波長延長至超過1 000 nm并進一步提高熒光量子產率,此外可移動轉子和振子的引入也使得DPBTA-DPTQ具有較高的光熱轉換能力。DSPE-PEG2000-FA包裹制備的DPBTA-DPTQ納米粒子表現出優異的穩定性、良好的光熱轉換能力和可接受的水溶液量子產率。在HepG2和B16-F10異種移植腫瘤小鼠中,成功實現熒光/光聲/光熱三模態成像引導的光熱治療用于消融腫瘤,顯示出優越的成像和腫瘤殺傷能力,為設計和構建高性能診療一體化探針提供了新的思路。
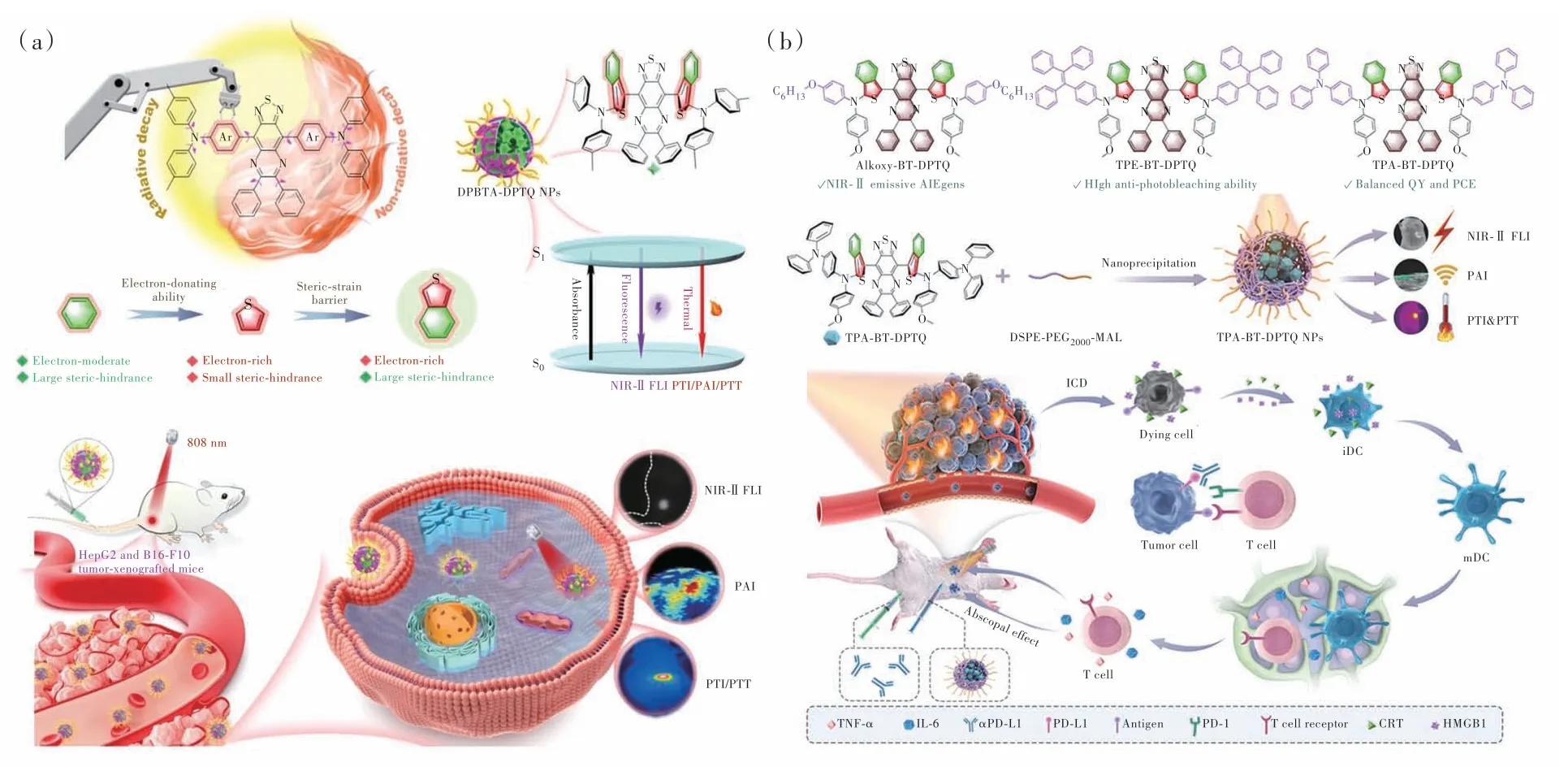
圖6 (a)DPBTA-DPTQ納米粒子的設計原理及在熒光/光聲/光熱成像引導的癌癥治療中的應用示意圖[58];(b)TPA-BTDPTQ納米粒子介導的光熱協同免疫治療示意圖[59]。Fig.6 (a)Schematic illustration of the design principle of DPBTA-DPTQ NPs and its application in trimodal FLI/PAI/PTI imaging-guided cancer treatment[58]. (b)Schematic illustration of TPA-BT-DPTQ NPs in synergistic immunotherapy NP-mediated PTT tumor treatment[59].
如圖6(b)所示,Yan等[59]進一步基于苯并[c]噻吩單元,通過調控不同的分子結構,篩選出平衡成像和治療性能的分子TPA-BT-DPTQ。DSPEPEG2000-MAL包封TPA-BT-DPTQ后制備的納米粒子具有良好的生物相容性、較高的近紅外二區熒光量子產率、光穩定性和光熱轉換效率,近紅外二區熒光/光聲/光熱三模態成像證明了納米粒子抑制腫瘤的效果。最后,將PD-L1抗體的免疫治療與TPA-BT-DPTQ納米粒子介導的光熱治療結合,在4T1原位乳腺癌模型中根治腫瘤并阻止腫瘤轉移。
6 結論與展望
近紅外二區熒光成像不僅具有前所未有的時空分辨率和成像深度,而且能夠可視化活體內的分子或生物靶標,有利于研究詳細的病理生理信息和機制,從而建立生物學水平和分子水平之間的病理聯系,用于臨床前的病理研究以及臨床診斷和治療。成像技術的發展很大程度上依賴于近紅外熒光團的開發,與無機熒光團相比,有機分子結構設計的多樣性和相對較低的毒性為近紅外二區熒光成像開辟了道路。此外,基于有機分子的光物理和光化學過程,有機分子在實現成像的同時往往還具有治療的效果,進而實現高度的診療一體化。
基于受體工程原理,通過調節不同的供體和受體結構能夠得到不同性能的近紅外二區有機小分子,目前苯并雙噻二唑(BBT)和[1,2,5]噻二唑[3,4-g]喹喔啉(TQ)是構建D-A-D結構最常用的兩種受體單元。在成像方面,基于BBT結構的分子常用于解剖學成像、病理生理學成像和分子成像,而基于TQ結構的分子常用于雙光子熒光成像、炎癥成像等;在治療方面,基于BBT結構的分子常用于熒光成像引導的光熱治療和協同治療,而基于TQ結構的分子常用于手術導航和多模態成像引導的治療。盡管基于受體和供體的排列組合能夠開發出各種各樣的近紅外二區有機小分子,但是目前受體種類依舊很缺乏,亟待開發更穩定、更優質的受體核心。同時,基于受體工程的近紅外二區有機小分子在成像和治療中仍然面臨著以下幾個難題:
(1)如何提高熒光強度:在熒光分子中引入平面結構可以提高分子的吸光系數,但是分子在聚集態時的π-π相互作用會導致聚集引起的熒光猝滅,具有扭曲結構的AIE發光團能夠顯著抑制分子間的相互作用、促進輻射衰減過程,提高熒光強度,然而扭曲帶來的分子畸變不可避免地破壞了共軛體系,從而導致吸光系數的降低。因此,平衡分子結構的彎曲程度對于分子的吸光系數和熒光強度至關重要。
(2)如何延長發射波長:延長共軛長度、引入給電子基團、硫族原子取代等方法能夠獲得更大的發射波長,然而目前最大發射波長大于1 300 nm的近紅外二區有機小分子還很少,并且π-共軛結構的分子中通常含有脆弱的化學鍵或結構單元,制備這些分子往往需要復雜的合成路線和嚴峻苛刻的條件。因此迫切需要探索新的近紅外二區小分子框架,研究一種有效的分子內電子轉移模式,開發出一系列最大發射波長位于NIR-Ⅱa/Ⅱb區的高效熒光分子。
(3)如何合理設計多功能的單一近紅外二區染料:單一近紅外二區染料能夠實現高分辨率和靈敏度的體內熒光/光聲雙模態成像,同時作為PTT和PDT的診療劑。在雙模態成像的過程中,熒光和光聲信號能夠很好地匹配而不會相互干擾,圖像引導的治療可以實現更高的效率以及保證安全性,然而如何確保每個成像模式和治療單元的最佳效果依然面臨著嚴峻的挑戰。
在未來的基礎研究中,通過結合多種內源性和外源性的近紅外二區有機熒光探針,開發多種光譜成像方法,能夠全面分析腫瘤的發生、發展和轉移以及各種生理學活動。在臨床實踐中,近紅外二區熒光成像最有前景的應用是圖像引導的腫瘤手術,通過超快的實時反饋和超高的信號噪聲比,能夠大大提高腫瘤手術的精度和預后;而成像引導的光學治療以及協同治療也可能進一步用于臨床試驗,以實現更準確、安全、有效的腫瘤治療。總之,未來基于受體工程的近紅外二區有機小分子將會得到快速發展,并在基礎研究和臨床實踐中得到更加廣泛的應用。
本文專家審稿意見及作者回復內容的下載地址:http://cjl.lightpublishing.cn/thesisDetails#10.37188/CJL.20230075.
- 發光學報的其它文章
- A Ratiometric Fluorescent Polystyrene Microsphere Hybrid Probe for Highly Selective Detection of Anthrax Markers
- Construction of Quantum Dot-modified Ln-ZIF Hybrid Materials and Fluorescence Detection of Tannic Acid
- 半透明鈣鈦礦太陽能電池的技術關鍵
- 基于超薄透明Ag2O/Ag陽極的高效有機電致發光器件
- 苯乙胺鈍化鈣鈦礦埋底界面提高太陽能電池性能
- 紅外波段超輻射發光二極管研究進展

