電刺激對早期失神經性肌萎縮HDAC4蛋白細胞定位的影響及其相關機制
潘錄錄,林蘇進,蔣旭堅,陳文煜,章國偉,支英豪
浙江中醫藥大學附屬溫州市中醫院,浙江 溫州 325000,1.康復科3;2.康復治療部
肌萎縮可出現在各種疾病的恢復期,如骨折后制動、腦卒中后癱瘓、肺功能受損后肺活量減少、周圍神經損傷后失神經支配等[1],可導致肌力下降、運動功能減退、胰島素抵抗、基礎代謝率下降等[2-3],嚴重影響患者的恢復及日常生活活動能力。目前的研究主要關注長期、慢性的肌萎縮,對于早期、急性期肌萎縮的研究不多。一項研究[4]發現僅在廢用早期存在泛素蛋白酶體途徑誘導的快速、短暫的肌蛋白降解,隨著時間延長這種現象消失,肌蛋白降解率重新回到基礎水平,所以中晚期廢用性肌萎縮速率反而較早期減低。這項研究為我們打開了一個新視角:既然肌萎縮速率在失神經支配早期更加顯著,那么從早期入手研究肌萎縮機制和治療方法可能具有重要的臨床意義。
目前對于肌萎縮機制的研究主要圍繞著肌蛋白合成與降解,IIa類組蛋白去乙酰化酶(histone deacetylase,HDACs)被證明在骨骼肌蛋白降解中發揮重要作用,其中HDAC4與骨骼肌障礙關系密切[5]。HDAC4在細胞質和細胞核之間穿梭,充當轉錄抑制因子,在細胞核內結合并抑制肌細胞增強因子-2(myocyte enhancer factor 2,MEF2)的轉錄,從而影響骨骼肌的發育及骨骼肌的再生,HDAC4的細胞定位由激酶和磷酸酶的相互作用控制,蛋白激酶A(protein kinase A,PKA)和鈣調蛋白依賴性蛋白激酶II(calmodulin-dependent protein kinaseII,CaMKII)是其中的兩個典型代表[6],并且這兩者對HDAC4 的細胞定位具有拮抗作用[7-8]。研究表明HDAC4 核內聚集可能是造成肌萎縮的一個重要因素[6]。因此,通過HDAC4的細胞定位來研究早期肌萎縮是一個比較有意義的方向。
我們前期的研究發現慢性廢用性肌萎縮中存在HDAC4的細胞定位異常,而通過電刺激能部分逆轉這種改變,同時改善肌萎縮情況[9-10],但影響HDAC4細胞定位的信號通路尚不清楚。本研究通過觀察電刺激對失神經性肌萎縮的影響,分析環磷酸腺苷(cyclic adenosine monophosphate,cAMP)/PKA信號通路和Ca2+/CaMKII信號通路關鍵因子的變化,探究這兩條信號通路與HDAC4細胞定位之間的關系。
1 材料和方法
1.1 主要試劑與儀器 CaMKII抗體(4436S,美國CST公司)、PKA抗體(5842S,美國CST公司)、HDAC4抗體(7628S,美國CST公司)、cAMP酶聯免疫吸附測定(enzyme-linked immunosorbent assay,ELISA)試劑盒(KGE012B,美國R&D Systems公司)、層粘連蛋白(laminin)抗體(ab11575,英國Abcam公司)、Ca2+濃度檢測測試盒(C004-2-1,南京建成生物工程研究所)。電刺激儀(Twin Stim?Plus 3rd Edition Combo Stimulator,Compass Health Brands Corp.Middleburg Heights,OH 44130)。
1.2 實驗動物 清潔級成年雄性SD大鼠,初始體質量200~250 g,購自浙江中醫藥大學動物實驗研究中心,實驗動物使用許可證號:SYXK(浙)2021-0012,飼養和實驗遵守浙江中醫藥大學動物實驗研究中心管理和使用規定,并遵守中國實驗動物管理條例。
1.3 實驗分組及干預 將24只大鼠編號后按照隨機數字表法分成4組:正常對照組(NC組)、單純肌萎縮模型組(MA組)、肌萎縮+低頻率電刺激組(LE組)和肌萎縮+高頻率電刺激組(HE組),每組6只。以大鼠的右后肢作為實驗側,造模成功后第2天開始電刺激治療,在造模后第8天電刺激后取大鼠右后肢腓腸肌。電刺激流程:將所有大鼠固定好,右側小腿腓腸肌肌腹部局部去毛,放置表面電極片(1.5 cm×1.5 cm)使之完全覆蓋肌肉,只有電刺激組大鼠(LE和HE)應用電刺激儀器進行刺激。參數:頻率選擇根據實驗需要(LE組:20 Hz,HE組:100 Hz),斜坡時間(Ramp)選擇1 s,脈沖寬度(Width)為300 μs,運作時間(On)為5 s,停止時間(Off)為10 s,輸出強度以最大耐受強度為標準(可見局部肌肉收縮,而大鼠無明顯煩躁不安),每天持續電刺激時間為30 min,見圖1。

圖1 大鼠腓腸肌電刺激示意圖
1.4 大鼠失神經肌萎縮模型建立 本研究采用大鼠坐骨神經完全損傷模型,以達到小腿及足部肌肉完全癱瘓,造成失神經性肌萎縮狀態。需造模的各組大鼠均用10%的水合氯醛(3 mL/kg)經腹膜腔內注射麻醉成功后,取右后肢外側縱向切口,顯露坐骨神經,在坐骨結節處切除長約5 mm的神經纖維,然后在顯微鏡下用11-0尼龍線將近遠端神經外膜縫合至橡膠套管上,間斷縫合3~4針,中間缺損的神經纖維給予曠置,最后縫合局部肌肉。NC組除外切除神經部分,其余操作與造模組相同。實驗結束后配置10%的水合氯醛,稱量每只大鼠的體質量后,按照0.4 mL/100 g的劑量,經腹腔注射麻醉藥,待大鼠進入麻醉狀態后,迅速分離腓腸肌。分離后的組織一部分迅速放入配置好的4%多聚甲醛固定液中固定24 h,后經梯度蔗糖脫水后用OCT包埋,另一部分組織不經處理迅速放入-80 ℃冰箱保存。大鼠最后經過量的水合氯醛注射處死,實驗過程符合實驗動物倫理學標準。
1.5 免疫熒光染色檢測平均肌纖維橫截面積(crosssectional area,CSA)將多聚甲醛固定的腓腸肌制成8 mm厚的冰凍切片。將切片置于玻片上,用封閉劑浸泡60 min,然后將切片與層粘連蛋白抗體在4 ℃孵育過夜,切片用PBS沖洗,與山羊抗兔IgGH&L多克隆二抗在室溫下孵育2 h,在熒光顯微鏡下觀察圖像。隨機選取5個視野進行層粘連蛋白染色,計算CSA。
1.6 透射電鏡觀察肌纖維和線粒體的超微結構在大鼠被處死后,立即解剖腓腸肌,并在枸櫞酸鹽緩沖液中沖洗。取體積為1 mm3的肌肉切片,用2.5%的戊二醛預冷固定,然后用1%的四氧化二臭氧后固定,將固定后的肌肉制成超薄切片,用透射電子顯微鏡(HT7700,日本Olympus公司)觀察圖像,分析肌纖維和線粒體的超微結構變化。
1.7 ELISA法檢測cAMP濃度 選取適量的組織,用預冷的PBS(0.01 mol/L,pH=7.4)沖洗組織,去除殘留血液(勻漿中裂解的紅細胞會影響測量結果),稱重后將組織剪碎。將剪碎的組織與對應體積的PBS(一般按1:9的重量體積比,比如1 g的組織樣品對應9 mL的PBS,具體體積可根據實驗需要適當調整,并做好記錄。推薦在PBS中加入蛋白酶抑制劑)加入玻璃勻漿器中,于冰上充分研磨。為了進一步裂解組織細胞,可以對勻漿液進行超聲破碎,或反復凍融。最后將勻漿液于5 000×g離心5~10 min,取上清液檢測。從室溫平衡20 min 后的鋁箔袋中取出所需板條,剩余板條用自封袋密封放回4 ℃。設置標準品孔和樣本孔,標準品孔各加不同濃度的標準品50 μL;樣本孔中加入待測樣本50 μL;空白孔不加。除空白孔外,標準品孔和樣本孔中每孔加入HRP標記的檢測抗體100 μL,用封板膜封住反應孔,37 ℃水浴鍋或恒溫箱溫育60 min。棄去液體,吸水紙上拍干,每孔加滿洗滌液(350 μL),靜置1 min,甩去洗滌液,吸水紙上拍干,如此重復洗板5次(也可用洗板機洗板)。每孔加入底物A、B各50 μL,37 ℃避光孵育15 min。每孔加入終止液50 μL,15 min內,在450 nm波長處測定各孔的OD值。以所測標準品的OD值為橫坐標,標準品的濃度值為縱坐標,在坐標紙上或用相關軟件繪制標準曲線,并得到直線回歸方程,將樣品的OD值代入方程,計算出樣品的濃度。
1.8 比色法檢測Ca2+濃度 準確稱取組織按重量(g):體積(mL)=1:9的比例加入去離子水,冰水浴勻漿,2 500 r/min,離心10 min,取10%的勻漿上清液待測;細胞樣本收集好后按106個細胞加0.3~0.5 mL的去離子水,超聲破碎后,漩渦混勻,2 500 r/min,離心10 min,取上清液待測。按照試劑盒說明書要求混勻各種試劑,靜置5 min后,波長610 nm,酶標儀比色,測各孔OD值。用去離子水將2.5 mmol/L鈣標準液稀釋成不同的濃度:0.062 5 mmol/L、0.125 mmol/L、0.25 mmol/L、0.5 mmol/L、0.625 mmol/L、1 mmol/L、2 mmol/L。按照說明書要求混勻,靜置5 min后,波長610 nm,酶標儀比色,測各孔OD值獲得鈣標準曲線。最后根據說明書提供的公式計算出組織中的Ca2+含量。
1.9 蛋白質印跡(Western blot)法檢測CaMKII、PKA、HDAC4蛋白表達 腓腸肌組織放在組織勻漿器中,冰上勻漿后,加入蛋白裂解液及PMSF,冰上放置40 min,4 ℃下12 000 r/min離心40 min,取上清液。以BSA為標準,用BCA法對上清液進行蛋白定量。取20 μg蛋白樣品,10% SDS-PAGE電泳,100 V轉移1 h至硝酸纖維素薄膜,放入封閉液中37 ℃封閉1 h;一抗4 ℃過夜。同時,另1張用不含抗體PBS液孵育,作為陰性對照。反復洗膜后,將膜與堿性磷酸酶標記的抗IgG抗體孵育,室溫輕搖1 h洗膜后,用Western blot觀察,用圖像分析測定各帶吸光度(A)值作定量分析。
1.10 統計學處理方法 采用SPSS25.0統計軟件進行分析。首先對數據進行正態性檢驗和方差齊性檢驗,正態分布的計量資料采用±s進行統計描述,多組比較采用單因素方差分析,組間兩兩比較采用LSD(方差齊)或Dunnett’T3(方差不齊)法進行分析。P<0.05為差異有統計學意義。
2 結果
2.1 各組大鼠腓腸肌相對重量比較 根據公式:腓腸肌相對重量=肌肉濕重(mg)/體質量(g),計算出每只大鼠的比值。MA組(3.50±0.59)較NC組(4.82±0.43)減少,差異有統計學意義(P<0.05),HE組(4.59±0.83)較MA組增加,差異有統計學意義(P<0.05),且HE組相比LE組(3.47±0.19)增加,差異有統計學意義(P<0.05)。見圖2。

圖2 各組大鼠腓腸肌相對重量比較
2.2 各組大鼠腓腸肌平均肌纖維CSA和線粒體超微結構比較 大鼠腓腸肌超微結構顯示,MA組肌纖維排列紊亂,線粒體空泡變性明顯,LE組和HE組都能緩解去神經引起的線粒體異常,且HE組效果更顯著。統計分析顯示,MA組的平均肌纖維CSA較NC組減少,HE組較MA組增加,差異均有統計學意義(P<0.05),而LE組與MA組相比差異無統計學意義(P>0.05)。見圖3。
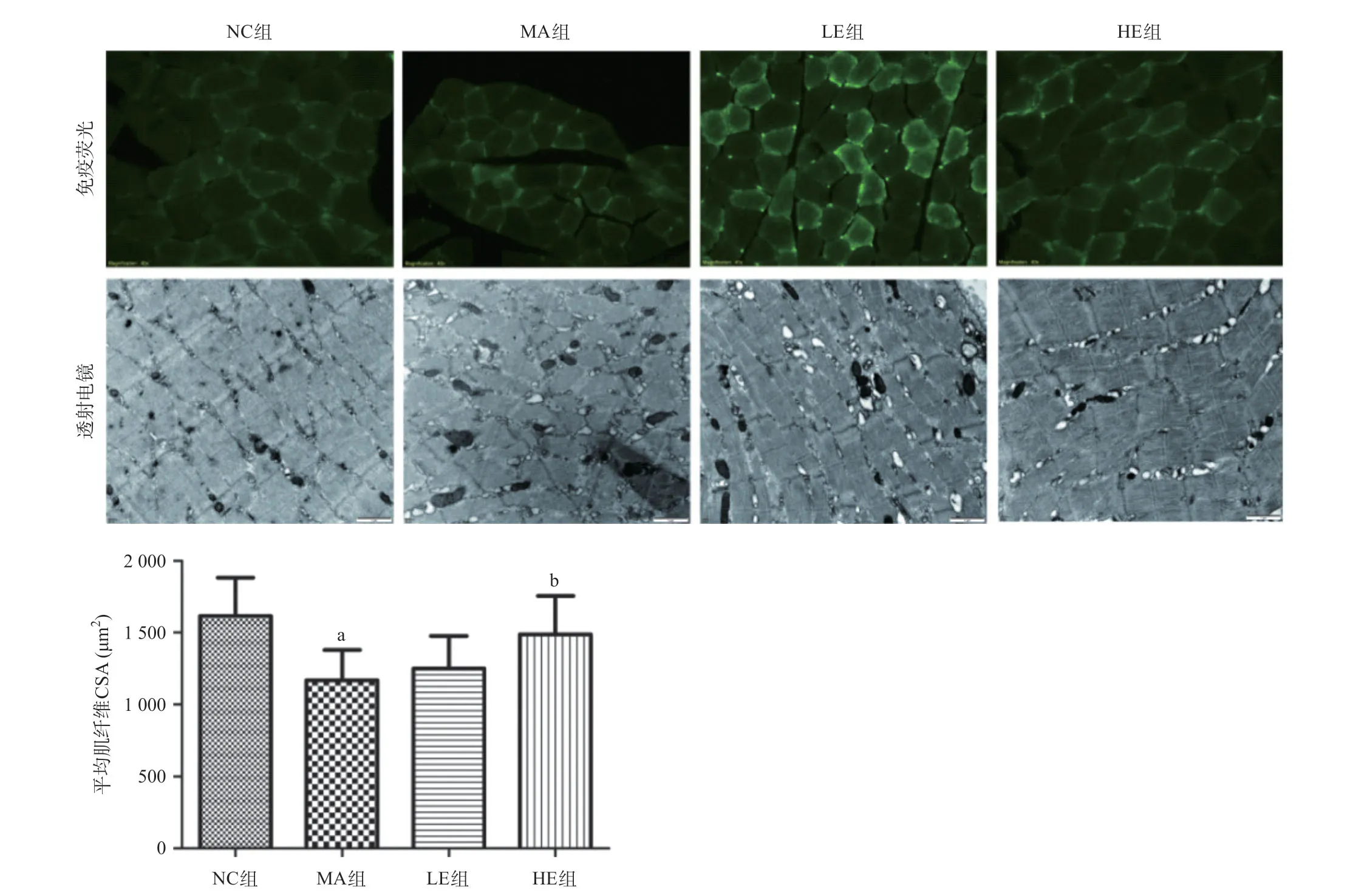
圖3 平均肌纖維CSA(免疫熒光,標尺為20 μm)和線粒體超微結構(透射電鏡,標尺為1 μm)
2.3 各組大鼠HDAC4蛋白表達及其核內外轉移比較在結果中觀察到HDAC4總蛋白在MA組較NC組表達增加,差異有統計學意義(P<0.05),余各組之間表達差異無統計學意義(P>0.05)。HDAC4胞漿蛋白在HE組的表達較MA組增加(P<0.05),較LE組也增加(P<0.05),余各組間比較差異無統計學意義(P>0.05)。HDAC4胞核蛋白在MA組的表達較NC組增加,差異有統計學意義(P<0.05),在HE組的表達較MA組減少,差異有統計學意義(P<0.05)。見圖4。

圖4 HDAC4總蛋白、胞漿蛋白、胞核蛋白表達情況
2.4 各組大鼠HDAC4 相關信號通路表達的比較Ca2+含量在MA組表達較NC組減少,差異有統計學意義(P<0.05),LE組和HE組的表達較MA組均增加,差異有統計學意義(P<0.05);CaMKII蛋白表達與Ca2+類似,在MA組表達較NC組減少(P<0.05),在LE組和HE組較MA組增加;而cAMP含量在MA組表達較NC組增加(P<0.05),差異有統計學意義(P<0.05),在HE組表達較MA組(P<0.01)和LE組(P<0.05)均減少,PKA蛋白在MA組的表達較NC組增加,差異有統計學意義(P<0.05),在HE組的表達較MA組減少,差異有統計學意義(P<0.05)。見圖5。

圖5 各組大鼠HDAC4相關信號通路表達情況比較
3 討論
一般的觀念認為肌萎縮是一個長期、慢性的過程。而在本研究中觀察到8 d的失神經支配就可以讓大鼠腓腸肌出現較明顯的肌萎縮,說明肌萎縮的發生可能是很早期的。此外還觀察到HDAC4蛋白表達升高,許多研究可證明肌肉中HDAC4蛋白表達與肌萎縮密切相關。一項研究發現,經過10 d的制動,可以觀察到大鼠腓腸肌出現了明顯的肌萎縮(-27.3%),同時檢測到存在HDAC4的核內聚集現象,HDAC4相關的靶基因如Myogenin、MyoD和Atrogin-1的mRNA水平也明顯升高,而這些基因在誘導骨骼肌萎縮中起著重要作用,因此作者認為HDAC4蛋白的核內表達增加可能與肌萎縮相關[6]。在另一項研究中,發現失神經骨骼肌中HDAC4的表達顯著增加,而特異性的敲低骨骼肌HDAC4基因(HDAC4 shRNA)后發現HDAC4表達降低的同時失神經誘導的蛋白水解、線粒體自噬和肌纖維類型轉化受到了抑制,從而緩解了肌萎縮[11]。綜合上述兩項研究,我們推測HDAC4高表達可導致肌萎縮,不論是制動引起的廢用性肌萎縮還是失神經誘導的肌萎縮。在本研究中觀察到MA組的HDAC4總蛋白在造模后出現了明顯的高表達,同樣高表達的還有HDAC4胞核蛋白,而胞漿蛋白表達無明顯增加,說明肌肉失神經支配確實可誘導HDAC4蛋白的高表達,并且HDAC4蛋白表達方式以核內增加為主,因此我們推測這種特異性的HDAC4核內聚集現象可能是加劇早期肌萎縮的重要因素。
在失神經誘導的肌萎縮中,Ca2+/CaMKII是介導HDAC4核外流的主要因子,研究中指出缺乏CaMK磷酸化位點的HDACs對CaMK介導的核外流具有抗性,說明阻斷Ca2+/CaMKII信號通路會導致HDAC核外流減少[7]。而β-腎上腺素能通過cAMP激活PKA的主要作用是產生HDAC4的核內流[12-13]。這兩條信號通路的變化可能對早期肌萎縮時HDAC4的細胞定位起到關鍵作用。本研究中觀察到MA組的Ca2+/CaMKII信號通路較NC組表達減低,說明在MA組可能存在著因該通路表達減低導致的HDAC4核外流減少;而cAMP/PKA信號通路表達則較NC組增高,這可能導致HDAC4核內流增加。兩條信號通路變化的疊加結果可能導致了MA組出現HDAC4核內聚集現象。
目前針對肌萎縮的治療方式主要是運動療法和飲食療法,其中運動療法可有效地改善肌萎縮[14-15],但是對于心肺功能受損的患者、老年患者、早期需要局部制動的患者以及無法主動活動肢體的患者,它顯然無法起到很好的作用。電刺激是康復治療中一種重要的局部訓練方式,它可以模擬肌肉運動誘發出主動的肌肉收縮,對呼吸系統影響很小,并且在訓練時不會對心臟產生過多的負擔[16],可在疾病早期就介入治療,基于此電刺激非常適合在臨床推廣使用,具有良好的治療前景和研究價值。
本研究通過給予肌肉不同頻率電刺激的方式研究電刺激介入早期肌萎縮的治療效果。在本研究中發現,100 Hz的高頻率電刺激組(HE組)的CSA的明顯增加、線粒體結構的改善,提示高頻率電刺激可能有助于改善早期肌萎縮,同時觀察到HE組的HDAC4核內聚集明顯減少,提示高頻率電刺激的抗肌萎縮作用可能與其影響HDAC4細胞定位有關。而在LE組不管是對CSA、線粒體結構還是HDAC4核內聚集都沒有明顯的改善作用。
電刺激影響HDAC4細胞定位的作用機制可能與Ca2+/CaMKII軸和cAMP/PKA軸有關。一項研究[8]發現在C2C12成肌細胞中應用PKA激活劑可導致HDAC4大量核內聚集,隨后應用PKA抑制劑后可逆轉這種效果;而在大鼠腓腸肌中直接注射磷酸二酯酶抑制劑以增加細胞內cAMP表達后發現肌肉中PKA水平也升高了,伴隨著明顯的HDAC4核內聚集以及MEF2活性的顯著降低。該實驗說明了cAMP介導的細胞內PKA激活能導致HDAC4核內聚集效應增強。在本研究中發現高頻率電刺激能降低cAMP/PKA軸的表達,從而減少HDAC4的核內聚集。磷酸化II類HDACs的兩個關鍵上游激酶是CaMK和AMPK[17]。在失神經誘導的肌萎縮中,Ca2+/CaMKII軸是介導HDAC4核外流的主要候選因子[6]。一項研究[18]發現CaMKII和PKA依賴的磷酸化改變能協同調節成人心肌細胞中HDAC4的細胞定位。在這項研究中發現心肌細胞中的CaMKII限制了HDAC4的核內聚集,而PKA傾向于保留HDAC4核內聚集,該研究證明了CaMKII和PKA依賴性信號之間存在多方面的串擾,它協調了HDAC4在靜止心肌細胞和電刺激心肌細胞中細胞核和細胞質之間的整體分布。那么在骨骼肌細胞是否也存在CaMKII和PKA依賴性信號之間的串擾呢?另一項研究[19]給出了答案:重復電刺激可激活肌肉纖維中的CaMKII,導致HDAC4核外流。而在重復電刺激時應用二丁酰基cAMP(Db cAMP)以激活cAMP/PKA軸則顯著減緩了由電刺激引發的CaMKII的激活以及由此引發的HDAC4的核外流,證實了這兩條通路在骨骼肌細胞中的確也存在相互拮抗的關系[20]。本研究的結果也驗證了這兩者的關系,當應用高頻率電刺激后,Ca2+/CaMKII軸的表達明顯增加,從而導致了HDAC4的核外流,與前面所述的cAMP/PKA軸的表達減少,HDAC4的核內流減少相對應。因此本研究得出結論,高頻率電刺激可能通過協調Ca2+/CaMKII軸和cAMP/PKA軸之間的表達,使得Ca2+/CaMKII軸表達增加,cAMP/PKA軸表達減少,從而使HDAC4核內流減少,核外流增加,以達到減少HDAC4核內聚集、緩解肌萎縮的作用。而20 Hz的低頻率電刺激僅對Ca2+/CaMKII軸有影響,使其表達有所增加,但對cAMP/PKA軸表達無明顯影響,表明了在LE組可能存在一定程度的HDAC4核外流,但無法抵消因cAMP/PKA軸高表達帶來的核內流。這也許就解釋了LE組的HDAC4核內聚集現象仍然較為顯著,以及逆轉肌萎縮效果不顯著的原因。同時也間接提示我們,也許HDAC4核內流而非核外流才是導致早期失神經性肌萎縮的關鍵機制。
綜上所述,本研究結果表明,失神經性肌萎縮可能與HDAC4核內聚集有關,高頻率電刺激可能通過增加Ca2+/CaMKII軸表達以及減少cAMP/PKA軸的表達影響HDAC4的細胞定位導致其核內聚集減少,達到逆轉肌萎縮的作用。本研究尚存在許多不足和需要改進之處:①樣本量偏少可能會導致統計誤差增大,因此在后續研究中盡可能增加樣本量以提高研究結果的可靠性;②本研究中僅設置了兩組不同頻率的電刺激,不利于深入研究不同電刺激頻率之間的差異,后續的研究可該按照一定梯度設置多個頻率的電刺激(例如2、20、50 Hz等),以更全面地研究電刺激對結果的影響;③本研究僅設置了8 d的觀察點,限制了對早期肌萎縮發展的動態觀察,后續的研究應該在早期時間窗口內設置更多的觀察時間點(例如24 h、72 h、5 d等),以更好地觀察肌萎縮發展的變化;④本研究未進行相關信號通路的敲低表達或阻斷處理,無法很好地反向驗證結果,后續的研究可以進行相關的研究或增加體外細胞實驗,以多重驗證結果并提高其可靠性。

