葛根素干預軟骨氧化應激和Nrf2/HO-1通路改善PTOA大鼠軟骨退變的機制
陳 鴻,阮紅日,馬天文,李亞楠,苗 雪,楊雯越,高 利,魏成威
(東北農業大學動物醫學學院,黑龍江省動物疾病致病機制與比較醫學重點實驗室,哈爾濱 150030)
骨關節炎是獸醫臨床中常見的退行性骨關節病,該病的主要特征是軟骨退變導致的關節穩態失衡[1],臨床表現為疼痛、關節畸形和活動受限等癥狀[2]。正常的衰老、性別、遺傳的生理現象以及肥胖、代謝障礙、飼養管理不規范和外傷等多因素可驅使其發生,有時單因素存在,但常見的骨關節炎是由多種因素聯合導致的結果[3]。目前,獸醫臨床上骨關節炎常使用非甾體類抗炎藥治療,但僅能減輕疼痛并不能逆轉疾病,并且副作用多[4]。因此,篩選有效、安全高效的骨關節炎防治藥物尤為重要。
機體氧化應激是骨關節炎軟骨中活性氧(reactive oxygen species,ROS)過量積累的結果,能夠導致軟骨細胞穩態失衡,誘導炎癥和軟骨細胞凋亡的發生[5]。將軟骨細胞暴露于過氧化氫(hydrogen peroxide,H2O2)、甲萘醌和3-嗎啉基苯胺等促氧化劑可上調其炎癥因子和趨化因子水平[6],這表明氧化應激能夠誘導軟骨細胞的炎癥反應。核轉錄因子E2相關因子2(nuclear transcription factor E2 related factor 2,Nrf2)是一種負責調控細胞氧化還原平衡的核轉錄因子。正常狀態下,Nrf2保持低轉錄水平,而在氧化應激條件下,活化的Nrf2會與抗氧化元件結合,調控抗氧化酶血紅素氧合酶1(heme oxygenase 1,HO-1)、丙二醛(malondialdehyde,MDA)表達及多種抗氧化酶的活性,發揮抗氧化作用,從而提高機體抗氧化應激的防御能力[7]。研究發現,使用曲古抑菌素A靶向激活Nrf2/HO-1信號通路能夠有效抑制IL-1β誘導的軟骨細胞外基質(extracellular matrix,ECM)代謝標志物基質金屬蛋白酶3(matrix metalloproteinase 3,MMP3)、基質金屬蛋白酶13(matrix metalloproteinase 13,MMP13)和血小板反應蛋白解整合素金屬肽酶4(a disintegrin and metalloproteinase with thrombospondin 4,ADAMTS4)的表達[8]。促炎細胞因子在骨關節炎的發病機制中起核心作用,可以誘導軟骨ECM降解并增加II型膠原酶的表達,促進軟骨細胞凋亡[9]。近期研究發現,激活Nrf2能夠靶向抑制NF-κB通路防止LPS誘導軟骨細胞中IL-1β和IL-6的上調[10]。因此,基于Nrf2/HO-1通路對于解析骨關節炎致病機制及開發臨床骨關節炎靶點藥物具有潛在價值。
葛根素是從葛根的根部分離的一種異黃酮,其藥用價值得益于其廣泛的藥理學特性,包括抗炎、抗氧化、抗腫瘤、緩解疼痛和免疫調節等[11]。目前發現葛根素對骨關節炎軟骨退變具有改善作用,但具體機制尚不明確。研究認為葛根素能夠激活AMPK通路,通過促進骨關節炎大鼠軟骨細胞的線粒體生物發生減輕線粒體功能障礙[12]。在碘乙酸誘導的小鼠骨關節炎模型中,使用葛根素干預可抑制受累關節單核細胞聚集并降低C-C趨化因子配體2的表達[13]。然而,葛根素對創傷后骨關節炎(post-traumatic osteoarthritis,PTOA)大鼠的軟骨氧化損傷作用和具體分子機制尚未可知。因此,本試驗通過前十字韌帶切斷(anterior cruciate ligament transection,ACLT)方法建立大鼠PTOA模型,以Nrf2/HO-1通路為切入點,擬探究葛根素改善PTOA大鼠骨關節炎軟骨退變的作用機制,為葛根素治療骨關節炎的機制提供新思路,為藥物研發和臨床應用提供理論依據。
1 材料與方法
1.1 主要試劑
葛根素(純度≥99%)購自美國Sigma公司;塞來昔布購自美國輝瑞制藥有限公司;異氟烷購自北京友誠盛達生物科技有限公司;MDA、SOD、GSH-Px和CAT測定試劑盒均購自武漢亞科因生物技術有限公司;大鼠IL-1β、IL-6、TNF-α、CTX-Ⅱ和COMP的ELISA試劑盒均購自上海酶聯生物科技有限公司。BCA試劑盒、RIPA裂解液和高敏型ECL化學發光檢測試劑盒均購自上海碧云天生物技術有限公司。GAPDH和ADAMTS4抗體購自武漢愛博泰克生物科技有限公司,Nrf2和HO-1抗體購自英國Abcam公司,MMP3和MMP13抗體購自江蘇親科生物研究中心有限公司。總RNA提取試劑盒購自北京天根生化科技有限公司。ChamQ Universal SYBR qPCR Master Mix試劑盒購自南京諾唯贊生物科技股份有限公司。
1.2 主要儀器
倒置光學顯微鏡(Leica,德國);Epoch多功能酶標儀(BioTek,美國);超微量分光光度計(Thermo,美國);電泳儀(Bio-Rad,美國);全自動化學發光/熒光圖像分析系統(Tannon,中國);羅氏480實時熒光定量PCR儀(Roche,德國)。
1.3 實驗動物及分組
雄性Sprague-Dawley大鼠40只(體重200~220 g),購自哈爾濱醫科大學第二附屬醫院動物實驗中心。所有動物均飼養在溫度適宜,通風良好的環境中。本研究所用實驗動物和試驗設計均遵循東北農業大學動物實驗倫理審查相關規定。
將40只Sprague-Dawley大鼠隨機分為4組:對照組(n=8)、模型組(n=8)、塞來昔布組(n=8)和葛根素組(n=16)。葛根素組隨機分為低劑量組(n=8)和高劑量組(n=8)。
1.4 大鼠PTOA模型建立和藥物干預
適應性飼養7 d后,采用ACLT方法建立大鼠PTOA模型。使用異氟烷吸入麻醉。大鼠右后肢剃毛,碘伏消毒,75%酒精脫碘。于大鼠右膝內側做2 cm切口,分離皮下組織,剪開關節囊后髕骨移位,屈曲膝關節,使用手術刀切斷前十字韌帶。進行抽屜試驗確保前十字韌帶完全切斷,生理鹽水沖洗關節腔,可吸收縫線閉合關節囊和皮膚,碘伏消毒后放回籠中不限制其活動。建立模型12 h后所有大鼠正常進食和飲水。對照組只切開關節囊后縫合進行假手術。
手術建模后,葛根素組的大鼠每日灌胃葛根素(低劑量組按50 mg·kg-1、高劑量組按100 mg·kg-1),葛根素的干預劑量參考先前的研究[14],每天同一時間灌胃,連續干預5周。對照組和模型組大鼠給予等量生理鹽水,塞來昔布組大鼠灌服2.86 mg·kg-1塞來昔布[15]。給藥結束后,所有大鼠實施安樂死。
1.5 大鼠關節腫脹和疼痛行為學檢測
在手術建模之前,各組大鼠進行右膝關節腫脹程度和疼痛行為學檢測,記錄為第0周。然后在建模后的第1、2、3、4和5周各檢測一次,共計6次。
1.5.1 關節腫脹程度檢測 根據Abo-Zalam等[16]的方法,使用電子游標卡尺測量每組大鼠的膝關節寬度(單位:cm),計算與第0周的差值代表大鼠膝關節的腫脹程度。
1.5.2 冷敏感反應檢測 根據Katri等[17]的方法,將大鼠放在金屬網地板安靜15 min后,從金屬網下方將丙酮涂抹在大鼠右后爪中部,觀察各組大鼠20 s內的行為變化并評分。評分標準:0=無反應;1=快速回縮右后爪或迅速拍打,反應時間<1 s;2=長時間回縮或重復拍打,反應時間1~3 s;3=重復回縮或舔右后爪,反應時間3~10 s;4=長時間舔右后爪,反應時間>10 s。每只大鼠重復操作3次,每次間隔10 min,記錄3次評分總和。
1.5.3 膝關節伸膝發聲檢測 根據前人的方法[18]。同一助手固定大鼠右側大腿,使膝關節處于靜息狀態(自然微屈),握住踝關節,使膝關節伸展(在膝關節運動的生理范圍內進行),關節伸展引起大鼠“吱吱聲”反應行為記1分,無反應記0分。連續5次,記錄伸展期間大鼠的發聲總分。
1.6 大鼠膝關節病理改變及Mankin評分
將各組大鼠脛骨和股骨樣本固定于4%多聚甲醛固定液中,對樣本進行脫鈣、包埋、制作石蠟切片,進行HE染色。HE染色結束后,通過顯微鏡捕獲圖像,并通過改良的Mankin分級系統[19]進行病理組織學評估。
1.7 微板法檢測大鼠氧化應激標志物
取大鼠右膝關節軟骨組織,加入RIPA后用超聲破碎儀進行裂解,4 ℃下13 000g離心10 min,過濾并取上清。嚴格按照試劑盒說明書,對軟骨組織中MDA含量進行檢測。采集大鼠血液,室溫1 000g離心20 min,取上清液。按照試劑盒說明書,對血清中氧化應激指標超氧化物岐化酶(superoxide dismutase,SOD)、谷胱甘肽過氧化物酶(glutathione peroxidase,GSH-Px)和過氧化氫酶(catalase,CAT)活性進行檢測,使用多功能酶標儀測定吸光值。
1.8 ELISA法檢測大鼠血清中軟骨代謝標志物和炎癥標志物
嚴格按照試劑盒說明書,使用ELISA法對軟骨代謝標志物II型膠原羧基末端肽(C-terminal type II collagen telopeptide,CTX-II)和軟骨寡聚基質蛋白(Cartilage oligomeric matrix protein,COMP)以及炎癥因子IL-1β、IL-6和TNF-α含量進行檢測,使用多功能酶標儀測定吸光值。
1.9 qRT-PCR檢測軟骨中Nrf2和HO-1 mRNA變化
使用Trizol試劑提取軟骨組織總RNA。使用Nanodrop 2000型超微量紫外分光光度計檢測各組RNA濃度及純度。按照反轉錄試劑盒說明書獲取樣品cDNA模板,以ChamQ Universal SYBR qPCR Master Mix試劑進行熒光定量PCR,檢測軟骨組織Nrf2和HO-1 mRNA的表達。引物序列如表1,其中,GAPDH為內參基因。20 μL反應體系:2×ChamQ Universal SYBR qPCR Master Mix 10 μL,上、下游引物各0.4 μL,cDNA 2 μL,補充無RNA酶水至20 μL。PCR反應條件:預變性95 ℃ 30 s;循環反應95 ℃ 10 s和60 ℃ 30 s,共40個循環。使用2-ΔΔCt法計算各基因相對表達水平。
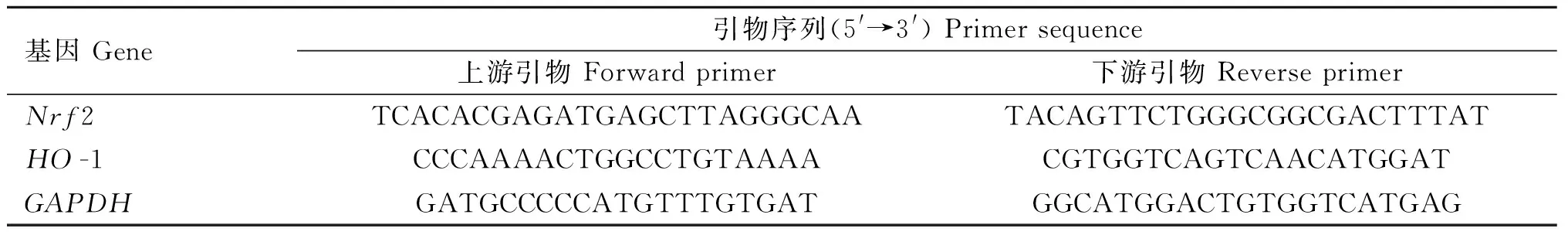
表1 qRT-PCR檢測的引物序列Table 1 The primer sequences used in qPCR assay
1.10 Western blot檢測軟骨中Nrf2/HO-1通路及ECM代謝標志物的表達
取大鼠右膝關節軟骨組織,加入1 mL PBS勻漿化。使用RIPA裂解液從軟骨組織中提取總蛋白。使用BCA試劑盒測定蛋白質濃度后,使用8%~12% SDS-PAGE凝膠分離相同數量的蛋白質。將蛋白質條帶轉移到PVDF膜上。用5%脫脂牛奶封閉1.5 h后,4 ℃下與一抗孵育過夜,比例如下:Nrf2(1∶1 500)、HO-1(1∶1 000)、MMP3(1∶1 000)、MMP13(1∶1 000)、ADAMTS4(1∶1 000)和GAPDH(1∶2 000)。二抗室溫孵育1 h后,使用高敏型ECL化學發光試劑在Tannon自動凝膠圖像分析系統獲得蛋白印跡條帶。使用ImageJ軟件分析蛋白質灰度值。
1.11 統計學分析
2 結 果
2.1 葛根素對PTOA大鼠關節腫脹和疼痛的影響
2.1.1 葛根素緩解PTOA大鼠關節腫脹 葛根素干預后,大鼠膝關節關節腫脹程度檢測結果如表2所示,術后的5周內,模型組大鼠關節寬度差逐漸增加,與對照組相比變化極顯著(P<0.01),關節腫脹嚴重。塞來昔布組和葛根素高劑量給藥組從給藥第3周至給藥結束,關節寬度差與模型組相比呈顯著下降趨勢(P<0.05);葛根素低劑量組給藥第5周關節寬度差與模型組相比出現極顯著減少(P<0.01)。
表2 葛根素干預后PTOA大鼠關節腫脹程度檢測結果Table 2 Detection results of joint swelling degree of PTOA rats after puerarin intervention cm
2.1.2 葛根素緩解PTOA大鼠疼痛癥狀 葛根素干預后,大鼠冷敏感反應結果如表3所示,術后的5周內,與對照組相比,模型組大鼠冷敏感反應評分極顯著增加(P<0.01)。塞來昔布組和葛根素高劑量給藥組從給藥第2周至給藥結束,冷敏感反應評分與模型組相比呈極顯著下降趨勢(P<0.01)。
表3 葛根素干預后PTOA大鼠冷敏感反應評分檢測結果Table 3 Detection results of cold sensitivity score of PTOA rats after puerarin intervention
葛根素干預對大鼠膝關節伸膝發聲檢測結果如表4結果所示,與對照組比較,術后的5周內,模型組發聲次數極顯著增加(P<0.01)。與模型組相比,塞來昔布組和葛根素高劑量給藥組從給藥第2周至給藥結束,發聲次數極顯著減少(P<0.01);葛根素低劑量組從給藥第3周至給藥結束,發聲次數極顯著減少(P<0.01)。以上結果說明,葛根素能夠有效減少ACLT誘導的大鼠關節腫脹,改善冷敏感和伸膝發聲行為,對緩解PTOA大鼠關節腫脹和疼痛癥狀具有積極作用。
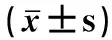
表4 葛根素干預后PTOA大鼠伸膝發聲(次數)檢測結果Table 4 Detection results of knee extension sound (number) in PTOA rats after puerarin intervention
2.2 葛根素對PTOA大鼠關節軟骨病理損傷的影響
各組大鼠脛骨和股骨的HE染色代表圖像如圖1所示。A1~E1為脛骨圖像,A2~E2為股骨圖像。對照組(圖1A1、A2)關節軟骨表面光滑,結構完整,層次清晰,軟骨細胞排列規則。模型組(圖1B1、B2)軟骨損傷嚴重,表面凹凸不平,軟骨細胞排列紊亂且丟失嚴重。塞來昔布組(圖1C1、C2)軟骨表面不光滑,表層軟骨細胞排列較規則。葛根素低劑量組(圖1D1、D2)軟骨表面較粗糙,炎性細胞浸潤較多,軟骨細胞空泡化較模型組少。葛根素高劑量組(圖1E1、E2)軟骨表面輕微粗糙,表層軟骨細胞排列較規則,軟骨細胞無肥大和丟失情況。如圖2所示,與對照組相比,模型組和葛根素低劑量組Mankin評分極顯著升高(P<0.01),葛根素高劑量組評分與對照組相比無差異顯著。以上結果說明,葛根素干預有效地減少了PTOA造模導致的大鼠軟骨細胞丟失,改善軟骨損傷,且高劑量葛根素組的效果更好。
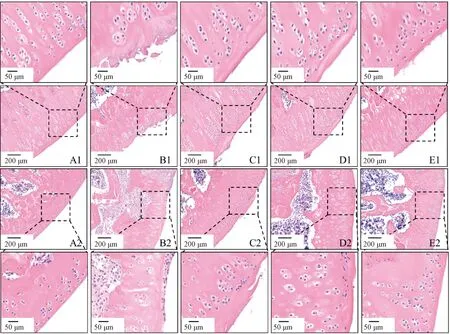
A1、A2.對照組; B1、B2.模型組; C1、C2.塞來昔布組; D1、D2.葛根素低劑量組; E1、E2.葛根素高劑量組A1, A2. Control group; B1, B2. Model group; C1, C2. Celecoxib group; D1, D2. Puerarin low-dose group; E1,E2. Puerarin high-dose group圖1 PTOA大鼠膝關節病理組織學觀察Fig.1 Histopathological observation of PTOA rats knee joint
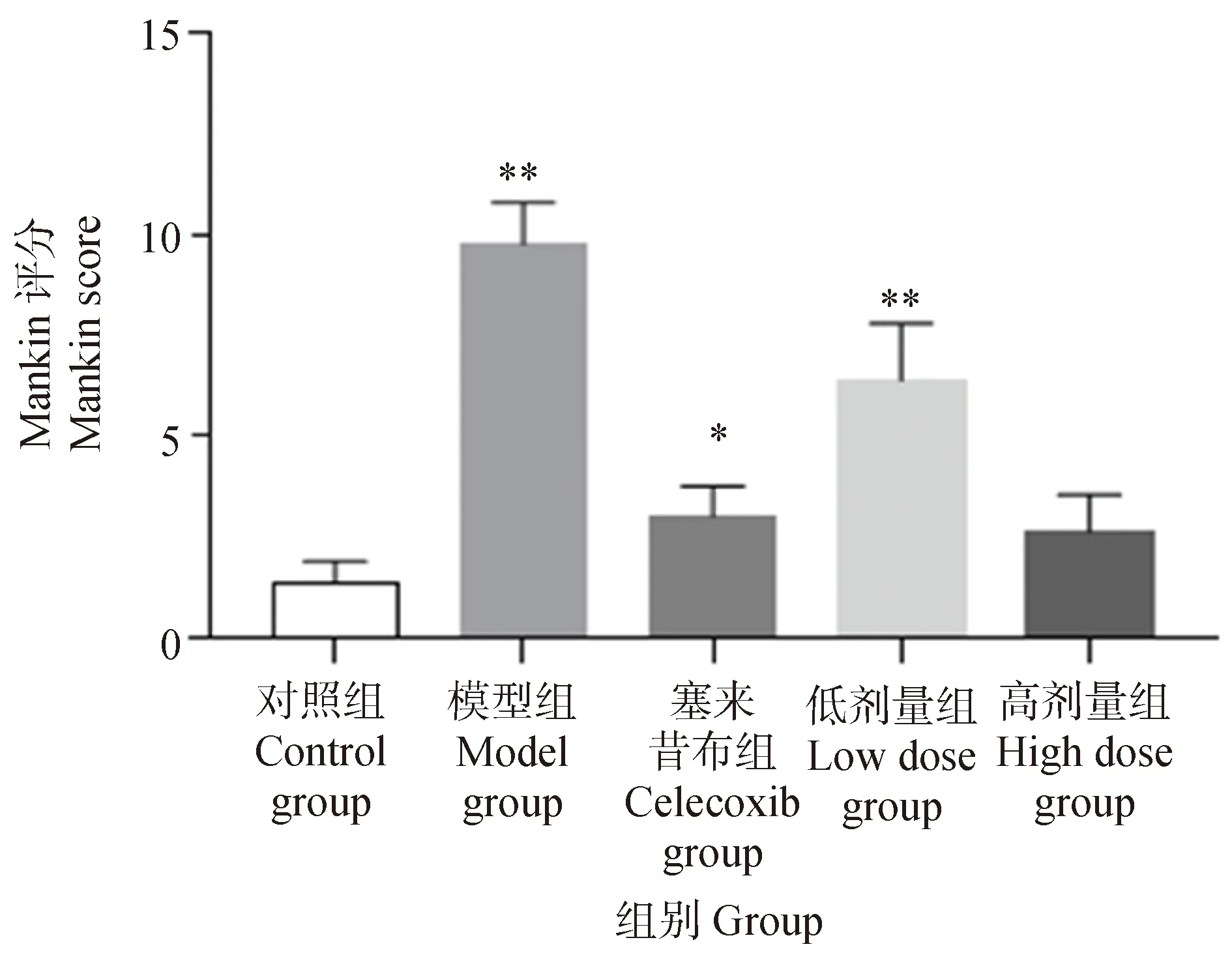
與對照組比較,*. P<0.05,**. P<0.01Compared with the control group, *.P<0.05,**.P<0.01圖2 PTOA大鼠膝關節Mankin評分Fig.2 Mankin score of PTOA rats knee joint
2.3 葛根素對PTOA大鼠軟骨中ECM代謝標志物的影響
如圖3所示,與對照組相比,模型組軟骨中MMP3、MMP13和ADAMTS4含量極顯著升高(P<0.01)。與模型組相比,塞來昔布組軟骨中MMP3和MMP13含量極顯著下降(P<0.01);葛根素低劑量組MMP3和ADAMTS4含量顯著下降(P<0.05);葛根素高劑量組軟骨中MMP3和ADAMTS4含量極顯著下降(P<0.01),MMP13含量顯著下降(P<0.05)。以上結果說明,葛根素干預能有效地降低軟骨ECM代謝標志物的含量,發揮抗PTOA軟骨基質降解的作用。
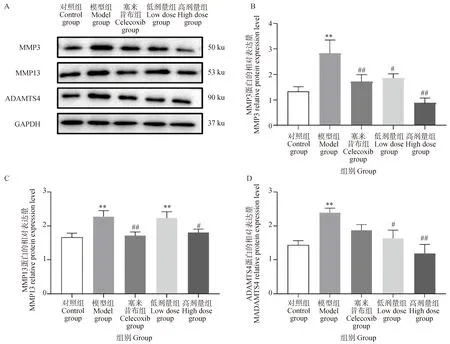
與對照組比較,*. P<0.05,**. P<0.01;與模型組比較,#. P<0.05,##. P<0.01;下圖同Compared with the control group, *. P<0.05,**. P<0.01. Compared with the moderl group, #. P<0.05,##. P<0.01. The same as below圖3 葛根素對PTOA大鼠軟骨中ECM代謝標志物含量的影響Fig.3 Effect of puerarin on the content of ECM metabolic markers in the cartilage of PTOA rats
2.4 葛根素對PTOA大鼠軟骨中MDA含量的影響
如圖4所示,與對照組相比,模型組軟骨中MDA含量極顯著升高(P<0.01)。與模型組相比,葛根素高劑量組和塞來昔布組軟骨中MDA含量極顯著下降(P<0.01),葛根素低劑量組顯著下降(P<0.05)。
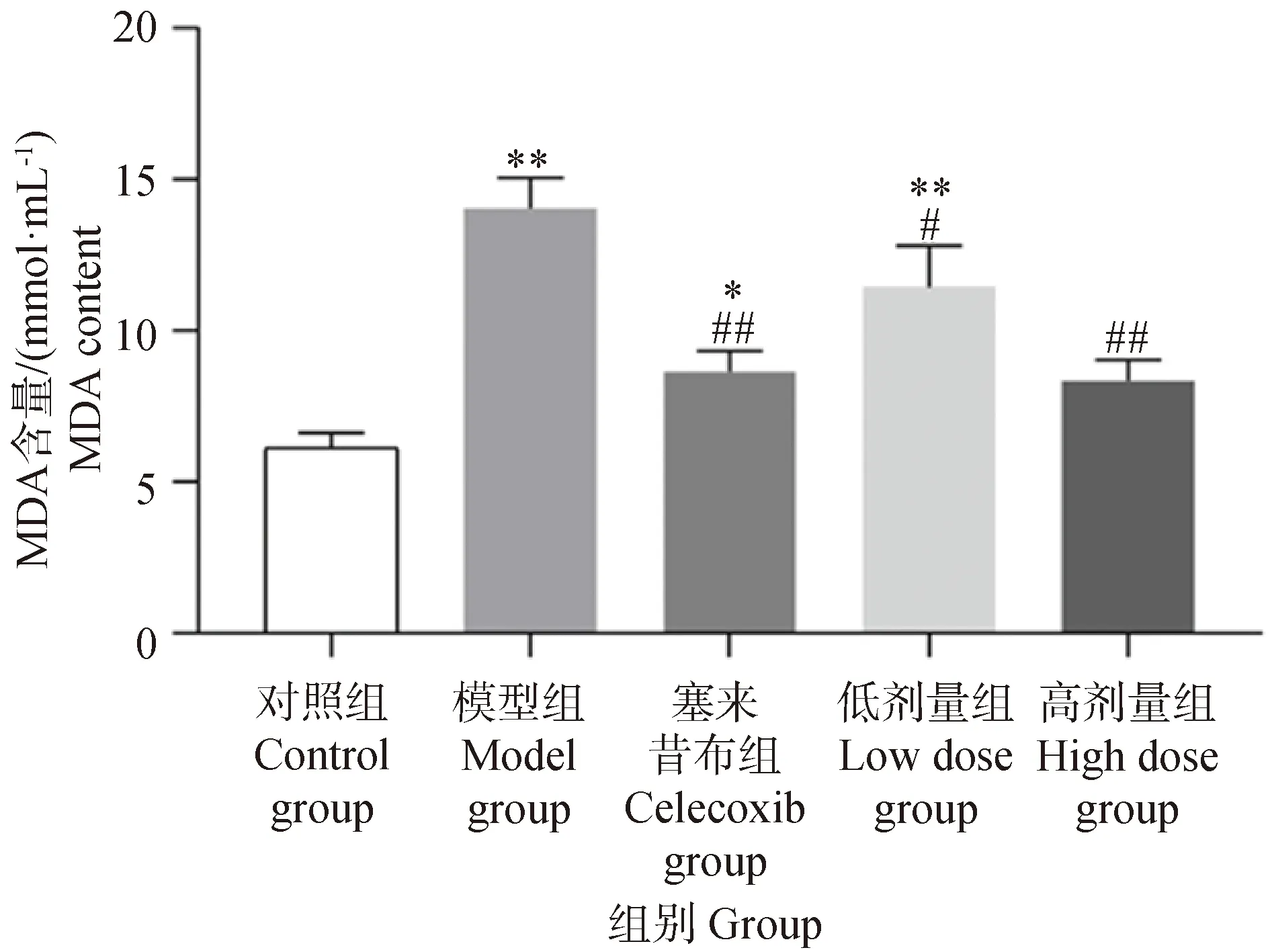
圖4 葛根素對PTOA大鼠軟骨中MDA含量的影響Fig.4 Effect of puerarin on the content of MDA in cartilage tissue of PTOA rats
2.5 葛根素對PTOA大鼠血清中抗氧化酶活力的影響
如圖5所示,與對照組相比,模型組SOD和GSH-Px活力極顯著下降(P<0.01),CAT活力顯著下降(P<0.05)。與模型組相比,葛根素高劑量組和塞來昔布組血清中SOD、GSH-Px和CAT活力極顯著升高(P<0.05)。以上結果說明,葛根素干預能有效地增強大鼠抗氧化酶活力,增強機體抗氧化應激的能力。
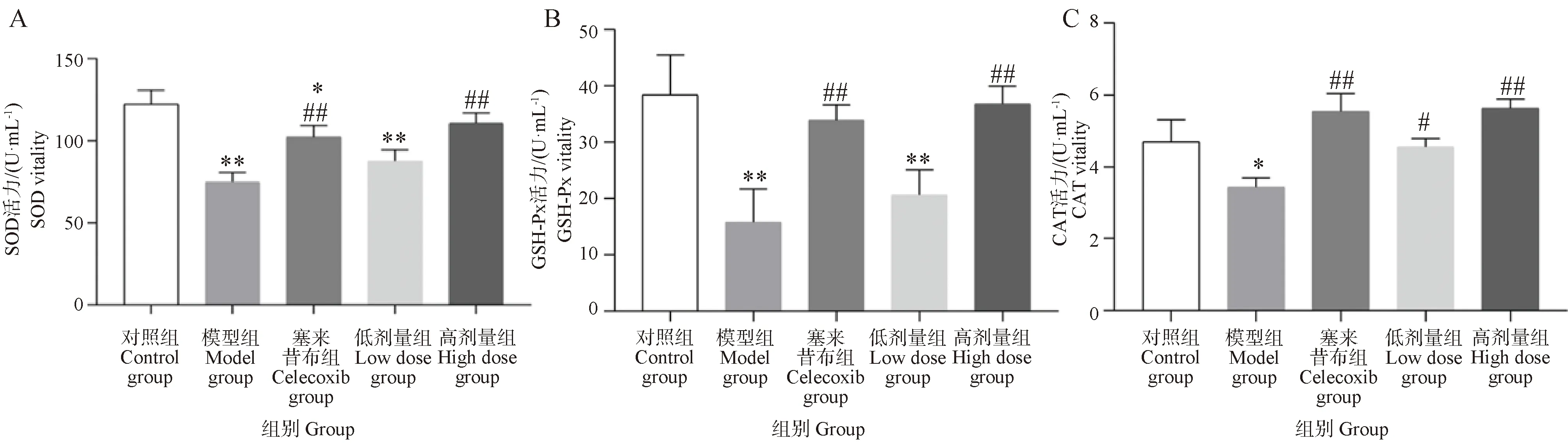
圖5 葛根素對PTOA大鼠血清中SOD、GAH-Px和CAT活力的影響Fig.5 Effect of puerarin on the activity of SOD, GAH-Px and CAT in serum of PTOA rats
2.6 葛根素通過Nrf2/HO-1通路改善PTOA大鼠軟骨氧化損傷
如圖6所示,與對照組比較,模型組大鼠膝關節軟骨中Nrf2和HO-1 mRNA水平無顯著性變化,塞來昔布組和葛根素高劑量組中Nrf2和HO-1 mRNA水平顯著極升高(P<0.01)。與模型組比較,塞來昔布組Nrf2 mRNA水平顯著極升高(P<0.01),HO-1 mRNA水平顯著升高(P<0.05),葛根素高劑量組中Nrf2和HO-1 mRNA水平極顯著升高(P<0.01)。如圖7所示,與對照組比較,模型組大鼠膝關節軟骨中Nrf2和HO-1蛋白表達無顯著性變化,塞來昔布組和葛根素高劑量組中Nrf2和HO-1蛋白表達極顯著升高(P<0.01)。與模型組比較,葛根素高劑量組中Nrf2和HO-1蛋白表達水平極顯著(P<0.01)升高。綜上所述,葛根素能夠激活大鼠軟骨的Nrf2/HO-1通路,通過調控Nrf2/HO-1通路改善骨關節炎大鼠氧化損傷。

圖6 葛根素對PTOA大鼠軟骨Nrf2/HO-1通路mRNA表達的影響Fig.6 Effect of puerarin on mRNA expression of Nrf2/HO-1 pathway in cartilage tissue of PTOA rats
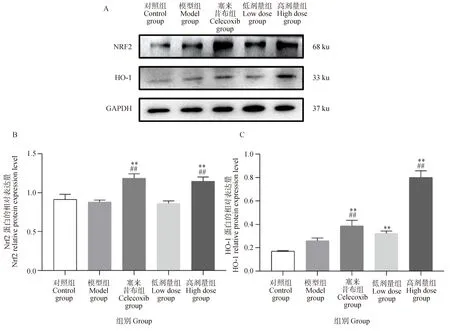
圖7 葛根素對PTOA大鼠軟骨Nrf2/HO-1通路蛋白質表達的影響Fig.7 Effect of puerarin on protein expression of Nrf2/HO-1 pathway in cartilage tissue of PTOA rats
2.7 葛根素對PTOA大鼠血清中炎癥因子IL-1β、IL-6和TNF-α的影響
由圖8所示,與對照組相比,模型組和葛根素低劑量組血清中的IL-1β、IL-6和TNF-α濃度極顯著升高(P<0.01),塞來昔布組血清IL-1β和IL-6濃度顯著升高(P<0.05)。葛根素高劑量組和塞來昔布組血清中的IL-1β、IL-6和TNF-α濃度與模型組相比顯著下降(P<0.01),葛根素高劑量組IL-1β、IL-6和TNF-α與對照組相比較無顯著差異。以上結果說明,葛根素干預能降低機體炎癥因子的水平。
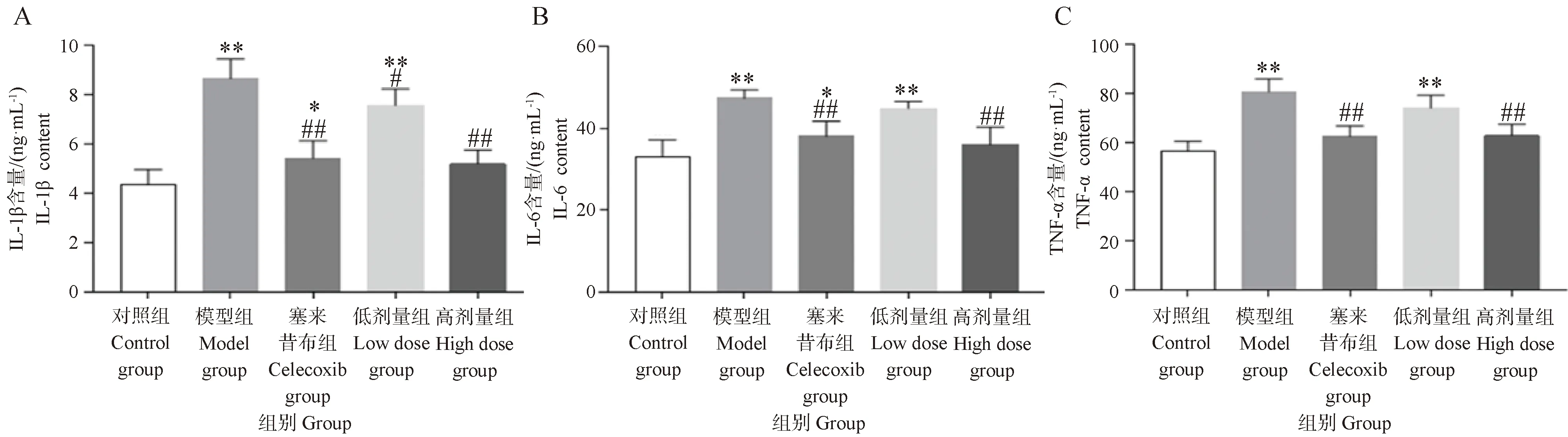
圖8 葛根素對PTOA大鼠血清中IL-1β、IL-6和TNF-α的影響Fig.8 Effects of puerarin on IL-1β, IL-6 and TNF-α in serum of PTOA rats
2.8 葛根素對PTOA大鼠血清中軟骨代謝標志物CTX-Ⅱ和COMP的影響
如圖9所示,與對照組相比,模型組和葛根素低劑量組血清中CTX-Ⅱ和COMP濃度極顯著升高(P<0.01),塞來昔布組血清中CTX-Ⅱ和COMP濃度與對照組相比有顯著差異(P<0.05)。與模型組相比,葛根素高劑量組血清中CTX-Ⅱ濃度極顯著下降(P<0.01),COMP濃度顯著下降(P<0.05),塞來昔布組CTX-Ⅱ和COMP濃度顯著下降(P<0.05);與對照組相比,葛根素高劑量組COMP濃度無顯著變化。以上結果說明,葛根素干預能有效地降低血清中軟骨代謝標志物CTX-Ⅱ和COMP的水平。
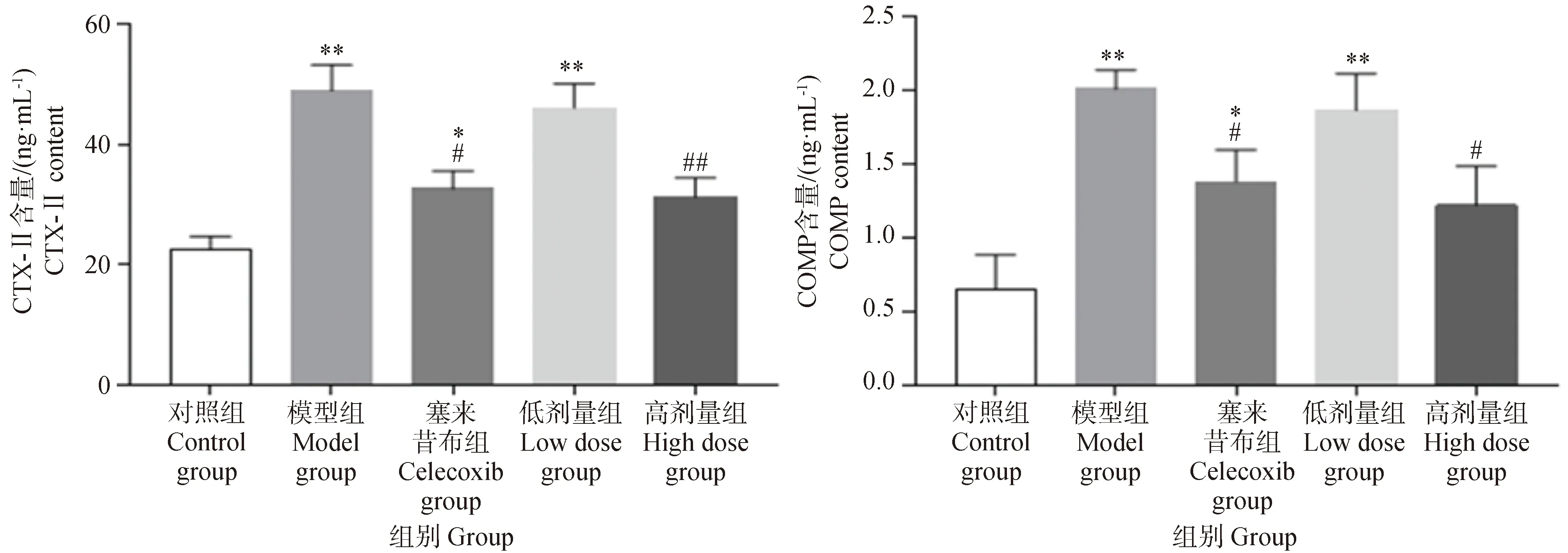
圖9 葛根素對PTOA大鼠血清中CTX-II和COMP的影響Fig.9 Effects of puerarin on CTX-II and COMP in serum of PTOA rats
3 討 論
骨關節炎是一種漸進性關節疾病,如不能及時發現和治療,將對動物骨關節造成不可逆性損傷,導致動物運動障礙,嚴重影響動物的健康和生活質量,同時也造成巨大的經濟損失。臨床常用的非甾體類抗炎藥副作用大,且治療效果欠佳,臨床獸醫師對許多頑固性骨關節炎依然束手無策。葛根素具有抗炎、抗氧化和緩解疼痛等藥理作用[11]。本研究通過檢測各組大鼠的膝關節腫脹和疼痛反應,并在給藥結束后關節軟骨病理切片進行觀察與評分,對血清中軟骨代謝標志物(CTX-II和COMP)、抗氧化酶(SOD、GSH-Px和CAT)活性、炎癥因子(IL-1β、TNF-α和IL-6)以及軟骨中MDA含量、ECM代謝標志物(MMP3、MMP13和ADAMTS4)含量和Nrf2/HO-1通路的蛋白和基因進行檢測。結果發現,葛根素能夠改善PTOA大鼠關節腫脹和疼痛程度,并通過調控Nrf2/HO-1通路改善軟骨氧化損傷和炎癥反應,抑制大鼠骨關節炎進展,為獸醫臨床防治骨關節炎提供更多的選擇。
在骨關節炎病理狀態下,軟骨細胞的線粒體功能障礙導致ROS過度產生[20]。機體內存在的天然ROS清除系統,主要包括SOD、CAT和GSH-Px。SOD常與MDA共同反映機體清除ROS的能力以及機體受ROS損傷的嚴重程度,CAT和GSH-Px反映清除過氧化氫和脂質過氧化物的水平,反映機體抗氧化損傷的能力。抗氧化酶的活性受到抑制會導致機體對ROS的清除率降低,引起氧化和抗氧化失衡,積累的ROS能夠通過調節NF-κB[21]、MAPK和Nrf2[22]等途徑誘導軟骨細胞凋亡和壞死,同時下調軟骨ECM的合成代謝標志物(Ⅱ型膠原和蛋白聚糖)的表達,上調分解代謝標志物(MMP3、MMP13和ADAMTS4)的表達,破壞ECM的代謝平衡,從而導致軟骨退變。氧化應激除直接導致軟骨損傷,還參與骨關節炎炎癥的發生。LPS刺激軟骨細胞產生的ROS能夠導致NLRP3炎癥小體的激活,而抑制Nrf2抗氧化途徑能夠導致NLRP3介導的骨關節炎炎癥反應上調[23]。IL-1β是骨關節炎發展的主要促炎因子,通過增強ECM代謝標志物MMP3、MMP13和ADAMTS4的表達促進軟骨ECM降解,同時刺激線粒體產生ROS導致軟骨細胞發生細胞凋亡和壞死,引起關節軟骨結構和功能的損傷[24]。TNF-α和IL-6除了與IL-1β相似的作用,還能促進軟骨細胞分泌纖維蛋白溶酶,直接或間接誘導炎癥反應[25]。此外,IL-1β、TNF-α和IL-6可以誘導前列腺素的產生,并抑制蛋白聚糖和II型膠原蛋白的合成[26]。II型膠原降解后CTX-II會釋放到血液循環系統中后隨尿液排出,COMP是軟骨中的非膠原蛋白成分,能夠反映軟骨退變程度。骨關節炎會引起血清中CTX-II和COMP水平升高,并隨著骨關節炎嚴重程度的增加,CTX-II和COMP水平也會相應增加[27],可以潛在地預測早期關節軟骨的破壞。在本研究中,ACLT方法誘導大鼠PTOA模型5周后,模型組軟骨中MDA以及ECM代謝標志物MMP3、MMP13和ADAMTS4的含量升高,血清中抗氧化酶SOD、GSH-Px和CAT活力顯著降低,炎癥因子IL-1β、IL-6和TNF-α的表達量顯著升高,軟骨代謝標志物CTX-II和COMP含量顯著升高。而使用高劑量葛根素干預后,與模型組相比,軟骨中MDA以及ECM代謝標志物MMP3、MMP13和ADAMTS4的含量顯著下降,血清中抗氧化酶SOD、GSH-Px和CAT活力顯著升高,炎癥因子IL-1β、IL-6和TNF-α的表達量顯著下降,軟骨代謝標志物CTX-II和COMP含量顯著下降。這說明葛根素干預能夠有效改善PTOA大鼠的氧化應激和炎癥水平,提高機體的抗氧化能力,降低軟骨ECM代謝標志物的表達,抑制炎癥因子導致的軟骨ECM降解。
ROS升高能夠使細胞質中的Keap1失活,導致軟骨細胞的Nrf2的清除受阻,積累的Nrf2易位到細胞核中,促進HO-1的產生,誘導細胞自噬,發揮抗氧化作用[7],并通過增加抗氧化蛋白的表達,減少炎癥和氧化應激[28]。有研究發現,敲除Nrf2可加速骨關節炎的發展[29]。目前已經發現許多天然產物可以通過Nrf2/HO-1通路平衡軟骨細胞的氧化還原狀態[30-32]。葛根素作為一種異黃酮,具有良好的抗氧化能力[33]。在本研究中,ACLT方法誘導大鼠PTOA模型5周后,模型組軟骨中Nrf2和HO-1的基因和蛋白與對照組無顯著性差異。而使用高劑量葛根素干預后,Nrf2和HO-1的基因和蛋白水平均上調,說明Nrf2/HO-1通路被激活。這表明,葛根素能夠激活PTOA大鼠中的Nrf2/HO-1通路并提高抗氧化能力。各組PTOA大鼠在葛根素干預后的關節腫脹和疼痛行為學檢測結果以及關節軟骨病理切片的評分的變化表明,葛根素能夠有效緩解PTOA引起的關節腫脹和疼痛癥狀,改善軟骨退變,抑制骨關節炎進展。
綜上所述,本試驗發現葛根素能夠激活PTOA大鼠軟骨中的Nrf2/HO-1通路,發揮抗氧化和抗炎作用,抑制大鼠軟骨退變。此外,發現葛根素能夠減輕PTOA疼痛程度,但具體作用機制需要進一步研究。本試驗為今后葛根素在獸醫臨床上的應用提供資料和研究基礎,為相關靶點藥物的研究提供理論依據。
4 結 論
葛根素能夠抑制創傷后骨關節炎大鼠的關節腫脹和疼痛反應,并通過激活Nrf2/HO-1通路發揮抗炎和抗氧化作用,從而改善大鼠軟骨退變。

