毒害艾美耳球蟲和產氣莢膜梭菌雙重PCR檢測方法的建立
陳 曦,王 一,王佳麗,楊 新,宋軍科,趙光輝
(西北農林科技大學動物醫學院,楊凌 712100)
毒害艾美耳球蟲(Eimerianecatrix)屬于孢子蟲綱、艾美耳科、艾美耳屬,是引起雞球蟲病的主要致病病原之一,可造成雞的營養吸收障礙、飼料轉化率降低、血痢等癥狀,感染嚴重的雛雞甚至會出現大批死亡[1-4]。產氣莢膜梭菌(Clostridiumperfringens)是一種革蘭陽性厭氧菌,在自然界廣泛分布,可引起雞的壞死性腸炎[5],表現采食量下降,產蛋量減少,嚴重時雞只消瘦、排黑色稀便并伴有惡臭味,有時會出現血痢[6],多見于2~6周齡的肉雞,發病率和病死率較高,病死率最高可達50%[7-8],經治療后的雛雞會出現發育遲緩、生產性能下降等,嚴重危害全球畜牧業的發展[9]。
納米PCR(nanoparticle-assisted PCR,nano-PCR)是納米技術結合分子生物學的一種新型PCR方法,通過向體系中加入納米顆粒,使PCR具有更好的靈敏性、特異性和反應速率[10]。納米粒子良好的導熱性使納米PCR 檢測在擴增過程中更快地達到目標溫度,同PCR 相比減少了反應在非目標溫度下的時間,可以有效減少非特異性擴增,增加反應的靈敏度。有研究表明,加入納米粒子的PCR的靈敏度提高了5倍~10倍,實時熒光PCR的靈敏度提高104倍[11-12]。同時,納米粒子有同單鏈結合蛋白(single strand binding protein,SSB)相似的作用,可有效降低引物和模板的錯配從而提高特異性[13]。此外,納米粒子還可通過在反應體系中吸附DNA聚合酶、Mg2+、寡核苷酸引物或DNA模板,使PCR反應物聚集,提高反應效率[14]。由于納米PCR優良的性能,近年來已經應用于犬巴貝斯蟲(Babesiacanis)、犬肝簇蟲(Hepatozooncanis)和食腦性阿米巴原蟲(Acanthamoebaspp.、Balamuthiamandrillaris、Naegleriafowleri)等病原的檢測[15-16]。
臨床上,雞球蟲和產氣莢膜梭菌常混合感染。為了實現同時對兩種病原的快速檢測,本研究初步建立了檢測毒害艾美耳球蟲和產氣莢膜梭菌的雙重PCR及雙重納米PCR檢測方法,以期為臨床雞毒害艾美耳球蟲病和壞死性腸炎的診斷提供技術支持。
1 材料與方法
1.1 病原及質粒
毒害艾美耳球蟲、產氣莢膜梭菌、柔嫩艾美耳球蟲、貝氏隱孢子蟲、藍氏賈第蟲、畢氏腸微孢子蟲、芽囊原蟲、禽毛滴蟲、沙門菌、金黃色葡萄球菌和大腸埃希氏菌等病原的基因組DNA樣品由西北農林科技大學動物寄生蟲學實驗室提取、鑒定并保存。
pMD19-T-ITS2和pMD19-T-cpa質粒均由西北農林科技大學動物寄生蟲學實驗室構建、保存。
1.2 主要試劑
E.Z.N.A. Stool DNA Kit購自美國Omega Bio-tek公司;納米PCR試劑盒購自上海戶實醫藥科技有限公司;ExTaqDNA聚合酶、10×ExTaqBuffer(Mg2+free)、MgCl2、dNTP、6×Loading buffer、DL2000 DNA Marker、pMD19-T Vector、大腸埃希菌感受態細胞JM109均購自中國寶生物工程(大連)有限公司;DNA純化回收試劑盒、質粒小提中量試劑盒購自天根生化科技(北京)有限公司。
1.3 引物設計與合成
參考GenBank數據庫收錄的毒害艾美耳球蟲ITS-2基因序列(GenBank登錄號:AM922243、AM922242、AM922241、JN022588、JN022587)應用軟件DNAMAN 7.0設計一對引物EnITS2 F/R。產氣莢膜梭菌的特異性引物cpa398 F/R參考前人文獻[17]。引物均由生工生物技術(上海)有限公司合成(表1)。

表1 毒害艾美耳球蟲和產氣莢膜梭菌雙重PCR和雙重納米PCR擴增引物Table 1 Primers for duplex PCR and duplex nano-PCR to detect E. necatrix and C. perfringens
1.4 毒害艾美耳球蟲和產氣莢膜梭菌雙重PCR檢測方法的建立
雙重PCR預設定反應體系:10×ExTaqBuffer(Mg2+free)1.25 μL、dNTP(2.5 mmol·L-1)1 μL、MgCl2(25 mmol·L-1) 1 μL、EnITS2 F/R(10 μmol·L-1)各0.5 μL、cpa398 F/R(10 μmol·L-1)各0.5 μL、ExTaqDNA聚合酶(5 U·μL-1)0.07 μL、模板DNA 1 μL,ddH2O補至12 μL;反應條件:94 ℃ 5 min;94 ℃ 45 s、54 ℃ 30 s、72 ℃ 1 min,35個循環;72 ℃ 10 min。
退火溫度、引物濃度和MgCl2濃度優化:在相同條件下,進行不同退火溫度(50、52、53、55、57、59、60、62 ℃)的優化;引物用量2~16 pmol進行優化,間隔2 pmol;MgCl2的使用體積為0.2~2.0 μL進行優化,間隔0.2 μL。
1.5 毒害艾美耳球蟲和產氣莢膜梭菌雙重納米PCR檢測方法的建立及優化
雙重納米PCR預設定反應體系:2×Nano-QPCR Buffer 6 μL、EnITS2 F/R各1 μL、cpa398 F/R各1 μL、Taqenzyme mix 0.2 μL、模板DNA 1 μL,ddH2O補至12 μL;反應條件同“1.4”方法。
雙重納米PCR反應體系及條件優化:退火溫度梯度設置同雙重PCR,引物用量梯度設置同“1.4”方法。
1.6 特異性試驗
分別用優化后的雙重PCR和雙重納米PCR對毒害艾美耳球蟲、產氣莢膜梭菌、藍氏賈第蟲、芽囊原蟲、畢氏腸微孢子蟲、禽毛滴蟲、貝氏隱孢子蟲、柔嫩艾美耳球蟲、沙門菌、金黃色葡萄球菌、大腸埃希菌的DNA樣品,以及毒害艾美耳球蟲和產氣莢膜梭菌混合DNA樣品進行擴增,檢驗所建立檢測方法的特異性。
1.7 敏感性試驗
重組質粒pMD19-T-ITS2和pMD19-T-cpa經10倍倍比稀釋得到不同濃度梯度的質粒模板,分別用優化后的雙重PCR和納米PCR進行擴增,檢測最低質粒檢出量。
1.8 臨床糞便樣品檢測
本研究的糞便樣品采集自規模化雞場雞的新鮮糞便,已用病原學(飽和鹽水漂浮法和形態學)方法明確了毒害艾美耳球蟲和產氣莢膜梭菌的感染情況;E.Z.N.A. Stool DNA Kit提取這些糞便的基因組DNA,用所建立的雙重PCR和雙重納米PCR對這些樣品進行檢測,分析其臨床適用性。
2 結 果
2.1 毒害艾美耳球蟲和產氣莢膜梭菌雙重PCR檢測方法的建立
優化后的雙重PCR反應體系為10×ExTaqBuffer(Mg2+free)1.25 μL、dNTP(2.5 mmol·L-1)1 μL、MgCl2(25 mmol·L-1)1.2 μL、EnITS2 F/R(10 μmol·L-1)各0.4 μL、cpa398 F/R(10 μmol·L-1)各0.4 μL、ExTaqDNA聚合酶(5 U·μL-1)0.07 μL、模板DNA 1 μL,ddH2O補至12 μL;反應條件:94 ℃ 5 min;94 ℃ 45 s、55 ℃ 30 s、72 ℃ 1 min,35個循環;72 ℃ 10 min。
在優化后的體系和條件下對毒害艾美耳球蟲和產氣莢膜梭菌的混合DNA樣品進行雙重PCR擴增,在約150 bp左右出現了毒害艾美耳球蟲的目的條帶,在約400 bp左右出現了產氣莢膜梭菌的目的條帶,擴增產物膠回收純化后送公司測序,經序列比對證實約150 bp的條帶為毒害艾美耳球蟲ITS-2基因的目的片段,約400 bp的條帶為產氣莢膜梭菌 α毒素基因的目的片段。
2.2 雙重PCR特異性試驗
雙重PCR分別擴增出E.necatrix和C.perfringens大小約為150和400 bp的目的條帶,其他寄生原蟲和細菌均無目的條帶擴增(圖1)。
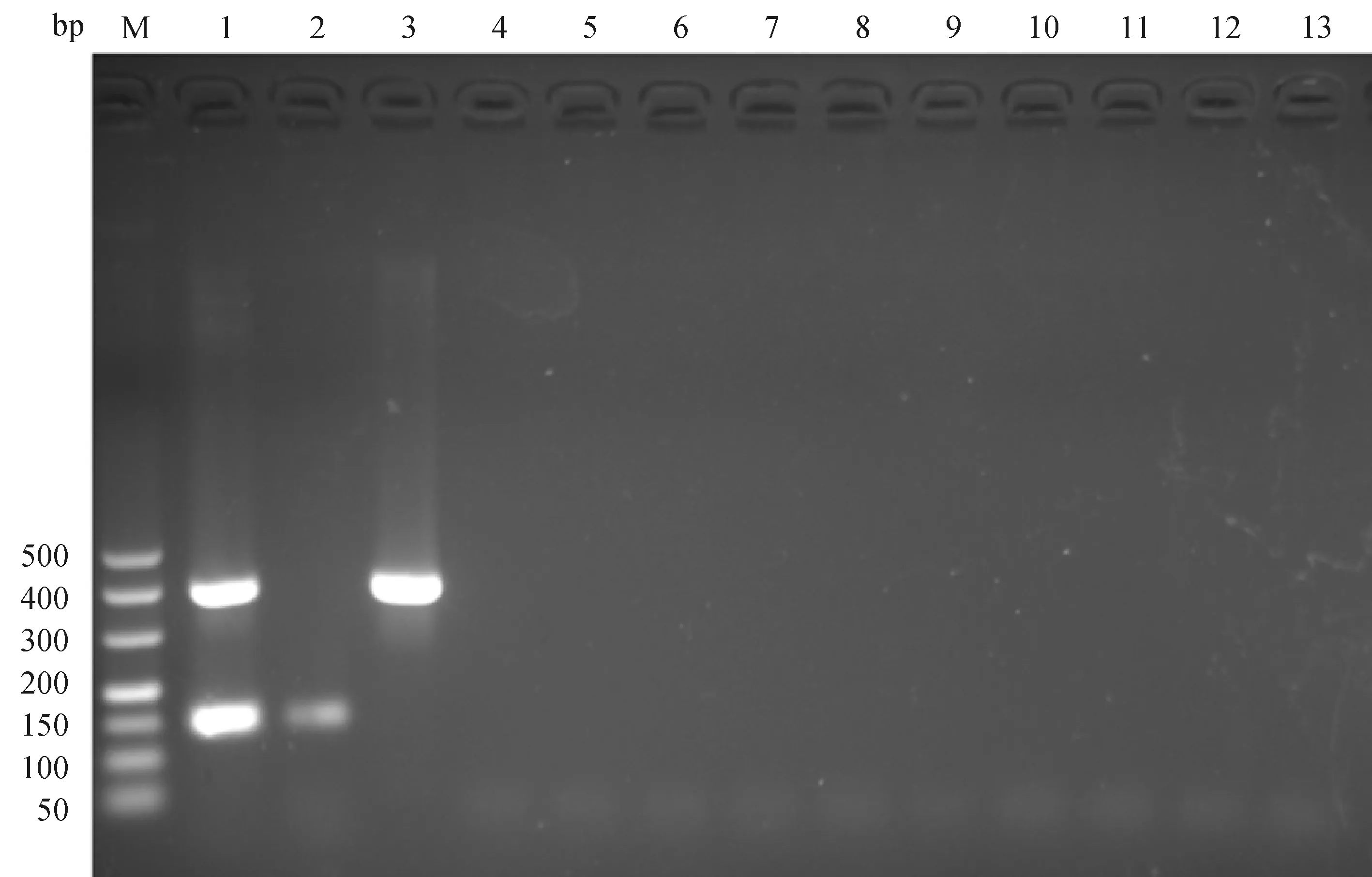
M. DNA相對分子質量標準 GL500;1. 毒害艾美耳球蟲+產氣莢膜梭菌;2. 毒害艾美耳球蟲;3. 產氣莢膜梭菌;4. 藍氏賈第蟲;5. 芽囊原蟲;6. 畢氏腸微孢子蟲;7. 禽毛滴蟲;8. 貝氏隱孢子蟲;9. 柔嫩艾美耳球蟲;10. 沙門菌;11. 金黃色葡萄球菌;12. 大腸埃希菌;13. 陰性對照M. GL500 DNA marker; 1. E. necatrix+C. perfringens; 2. E. necatrix; 3. C. perfringens; 4. G. lamblia; 5. Blastocystis sp.; 6. E. bieneusi; 7. T. gallinae; 8. C. baileyi; 9. E. tenella; 10. Salmonella spp.; 11. Staphylococcus aureus; 12. Escherichia coli; 13. Negative control圖1 毒害艾美耳球蟲和產氣莢膜梭菌雙重PCR特異性試驗Fig.1 Specificity test of the duplex PCR for E. necatrix and C. perfringens
2.3 雙重PCR敏感性試驗
所保存的質粒pMD19-T-ITS2和pMD19-T-cpa濃度分別為1.81×1011和1.05×1011copies·μL-1。將重組質粒pMD19-T-ITS2和pMD19-T-cpa 10倍倍比稀釋至濃度分別為1.81和1.05 copies·μL-1,對質粒濃度梯度進行雙重PCR擴增,最低檢出質粒量為pMD19-T-ITS2 181 copies和pMD19-T-cpa 1 050 copies。
2.4 毒害艾美耳球蟲和產氣莢膜梭菌體系雙重納米PCR檢測方法的建立
優化后的雙重納米PCR反應體系為2×Nano-qPCR Buffer 6 μL、EnITS2 F/R各0.6 μL、cpa398 F/R各0.6 μL、Taqenzyme mix 0.2 μL、模板DNA 1 μL、ddH2O補至12 μL;反應條件:94 ℃ 5 min;94 ℃ 45 s、55 ℃ 30 s、72 ℃ 1 min,35個循環;72 ℃ 10 min。
利用優化后的反應條件對毒害艾美耳球蟲和產氣莢膜梭菌的混合DNA樣品進行雙重納米PCR擴增,分別在約150和400 bp左右出現了毒害艾美耳球蟲和產氣莢膜梭菌的目的條帶。擴增產物膠回收純化后送測序,經序列比對證實約150 bp左右的條帶為毒害艾美耳球蟲ITS-2基因的目的片段,而約400 bp左右的條帶為產氣莢膜梭菌α毒素基因的目的片段。
2.5 雙重納米PCR特異性試驗
雙重納米PCR分別擴增出毒害艾美耳球蟲和產氣莢膜梭菌大小約為150和400 bp的目的條帶,其它病原均未出現擴增條帶(圖2)。
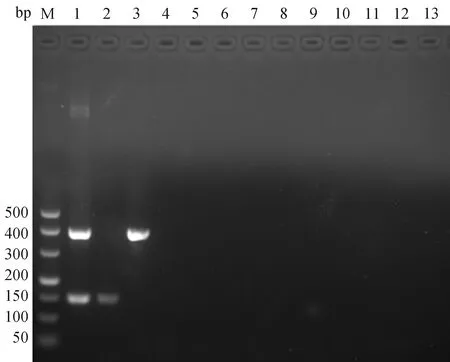
M. DNA相對分子質量標準 GL500;1. 毒害艾美耳球蟲+產氣莢膜梭菌;2. 毒害艾美耳球蟲;3. 產氣莢膜梭菌;4. 藍氏賈第蟲;5. 芽囊原蟲;6. 畢氏腸微孢子蟲;7. 禽毛滴蟲;8. 貝氏隱孢子蟲;9. 柔嫩艾美耳球蟲;10. 沙門菌;11. 金黃色葡萄球菌;12. 大腸埃希菌;13. 陰性對照M. GL500 DNA marker; 1. E. necatrix+C. perfringens; 2. E. necatrix; 3. C. perfringens; 4. G. lamblia; 5. Blastocystis sp.; 6. E. bieneusi; 7. T. gallinae; 8. C. baileyi; 9. E. tenella; 10. Salmonella spp.; 11. Staphylococcus aureus; 12. E. coli; 13. Negative control圖2 毒害艾美耳球蟲和產氣莢膜梭菌雙重納米PCR特異性試驗Fig.2 Specificity test of the duplex nano-PCR for E. necatrix and C. perfringens
2.6 雙重納米PCR敏感性試驗
利用優化好的雙重納米PCR擴增不同濃度的重組質粒pMD19-T-ITS2和pMD19-T-cpa,雙重納米PCR最低檢出質粒量為pMD19-T-ITS2 1.81 copies和pMD19-T-cpa 105 copies。
2.7 臨床樣品檢測
利用本研究所建立2種方法對19份已明確毒害艾美耳球蟲和產氣莢膜梭菌感染情況的雞的臨床糞便樣品檢測發現,毒害艾美耳球蟲和產氣莢膜梭菌的陽性率分別為52.6%和47.4%,雙重感染的陽性率為31.6%,與病原學的檢測結果一致。
3 討 論
臨床上,宿主感染毒害艾美耳球蟲后,腸道黏膜會發生出血性損傷。此時,產氣莢膜梭菌若趁機入侵大量繁殖則會繼發壞死性腸炎,加重腸道損傷,增加死亡率[18]。隨著我國對抗生素使用的限制以及2種病原不同的治療方式,當臨床上出現便血等癥狀時,對于球蟲和梭菌單一或混合感染的判定顯得尤為重要。本研究基于毒害艾美耳球蟲ITS-2序列和產氣莢膜梭菌α毒素基因設計特異性引物,經過反應體系和反應條件的優化,成功建立了能夠同時檢測毒害艾美耳球蟲和產氣莢膜梭菌的雙重PCR及雙重納米PCR方法。所建立的雙重納米PCR方法在檢測毒害艾美耳球蟲時最低模板檢出量為1.81 copies,敏感性是雙重PCR的100倍;而檢測產氣莢膜梭菌時最低模板檢出量為105 copies,敏感性是雙重PCR的10倍。同檢測其他病原的納米PCR相比,本研究建立的雙重納米PCR對于檢測毒害艾美耳球蟲的敏感性為1.81 copies,高于Luo等[19]建立檢測豬偽狂犬病毒(敏感性6 copies)和檢測豬博卡病毒(敏感性95 copies)的雙重納米PCR,而對于檢測產氣莢膜梭菌的敏感性為105 copies,略低于檢測豬博卡病毒的敏感性。目前國內外建立的多重納米PCR多用于樣品中病毒的特異性檢測,敏感性差異較大,多為2~1 000 copies,這可能與納米PCR體系、基因位點選取和引物設計的不同有關[20-23]。2種方法對已明確毒害艾美耳球蟲和產氣莢膜梭菌感染情況的雞的臨床糞便樣品檢測結果與病原學檢測結果一致,表明2種方法可用于雞的臨床糞便樣品檢測。
隨著我國禽養殖的規模逐漸擴大,毒害艾美耳球蟲和產氣莢膜梭菌感染的病例逐漸增加,迫切需要更加快速、簡便的檢測方法應用于臨床實踐。但目前國內尚未有關于毒害艾美耳球蟲和產氣莢膜梭菌雙重PCR檢測方法的商品化應用,限制了對臨床上常見的2種重要病原體的檢測和防控。本研究在前人研究的基礎上,建立了簡便快捷的雙重 PCR和雙重納米PCR方法,操作簡單,靈敏度高,特異性好,未來將對所建方法的臨床應用進行進一步的評估,以滿足臨床對于毒害艾美耳球蟲和產氣莢膜梭菌2種病原的檢測需求。
4 結 論
本研究成功建立了適用于臨床檢測E.necatrix和C.perfringens特異、敏感的雙重PCR和雙重納米PCR檢測方法。

