L-酪氨酸高密度流加發酵工藝研究
龔雨 馬零 趙春光 徐慶陽


摘要:為實現L-酪氨酸的大規模生產,提高L-酪氨酸的產量和糖酸轉化率,供試菌株為大腸桿菌TYR-05,通過單因素實驗、正交實驗、流加發酵優化實驗,以菌體密度、L-酪氨酸產量、糖酸轉化率及代謝副產物為指標,探究MgSO4·7H2O、磷酸二氫鉀、谷氨酰胺、甲硫氨酸、維生素B12、維生素H、磷酸吡哆醛對L-酪氨酸發酵的影響,最后確定適合L-酪氨酸發酵的培養基為MgSO4·7H2O 2.0 g/L、KH2PO4 2.5 g/L、維生素B12 2.0×10-3 g/L、PLP 1.0×10-3 g/L、維生素H 0.8×10-3 g/L,利用5 L發酵罐進行流加發酵生產,在初始發酵工藝的基礎上,采用從10 h持續流加發酵的優化策略。實驗結果表明,最高菌體密度達到65.0 g/L,L-酪氨酸產量為56.2 g/L,糖酸轉化率為23.1%,乙酸作為副產物積累量減少到1.0 g/L,驗證了L-酪氨酸高密度流加發酵策略的可行性,為L-酪氨酸及其他芳香族氨基酸的低成本、高效率工業化生產提供了一定的依據。
關鍵詞:L-酪氨酸;高密度發酵;大腸桿菌;發酵優化;連續流加發酵
中圖分類號:TS205.5文獻標志碼:A 文章編號:1000-9973(2023)10-0122-06
Study on High-Density Fed-Batch Fermentation Process of L-Tyrosine
GONG Yu1, MA Ling1, ZHAO Chun-guang2, XU Qing-yang1,3,4*
(1.College of Bioengineering, Tianjin University of Science and Technology, Tianjin 300457, China; 2.Ningxia Eppen Biotechnology Co., Ltd., Yinchuan 750100, China; 3.National and Local United Engineering Laboratory of Metabolic Control Fermentation Technology, Tianjin 300457, China; 4.Tianjin Engineering Laboratory of Efficient and Green Amino Acid Manufacture, Tianjin 300457, China)
Abstract: In order to realize the large-scale production of L-tyrosine and improve the yield of L-tyrosine and the conversion rate of glucose and acid, with Escherichia coli TYR-05 as the test strain, the effects of MgSO4·7H2O, potassium dihydrogen phosphate, glutamine, methionine, vitamin B12, vitamin H and pyridoxal phosphate on L-tyrosine fermentation are investigated by single factor experiment, orthogonal experiment and fed-batch fermentation optimization experiment with bacterial cell density, L-tyrosine yield, glucose-acid conversion rate and metabolic by-products as the indexes. Finally, the medium suitable for L-tyrosine fermentation is determined to be MgSO4·7H2O 2.0 g/L, KH2PO4 2.5 g/L, vitamin B12 2.0×10-3 g/L, PLP 1.0×10-3 g/L, vitamin H 0.8×10-3 g/L. Fed-batch fermentation production is carried out with a 5 L fermenter. On the basis of the initial fermentation process, the optimal fermentation strategy of continuous fed-batch fermentation from10 h is adopted. The experimental results show that the maximum cell density reaches 65.0 g/L, the L-tyrosine yield is 56.2 g/L, the glucose-acid conversion rate is 23.1%, and the accumulation amount of acetic acid as by-product is reduced to 1.0 g/L, which has verified the feasibility of L-tyrosine high-density fed-batch fermentation strategy, and provided a basis for low-cost and high-efficiency industrial production of L-tyrosine and other aromatic amino acids.
Key words: L-tyrosine; high-density fermentation; Escherichia coli; fermentation optimization; continuous fed-batch fermentation
L-酪氨酸(L-tyrosine,L-Tyr)是一種芳香族氨基酸[1],是人體必需氨基酸之一,對人體和動物的生長代謝都具有重要作用,有著廣泛的市場需求[2],在食品行業中,因其具有極高的營養價值,被用作氨基酸類營養補充劑添加到食品中[3],L-酪氨酸及其衍生物還是許多保健品的重要成分[4];在醫藥方面,L-酪氨酸的衍生物廣泛應用于醫藥載體,比如多巴胺是抗氧化藥物合成的前體物質,用于多種類型休克藥物的合成研究[5],L-酪氨酸亞硫酸鹽合成的藥物能治療無力綜合征、精神分裂癥等疾病;在化工方面,能夠降低黑色素的合成[6],是天然美白化妝品的合成原料。
當前L-酪氨酸生產主要以微生物發酵法為主,該方法具有成本低、無污染等生產優勢,但其大量生產仍面臨著巨大挑戰[7]。在微生物大規模發酵生產過程中,菌體密度在一定程度上決定了目標產物的生成量[8],因此高密度培養無疑是提高產量的重要途徑之一,其中培養基成分、發酵條件的控制等是至關重要的影響因素[9]。在大腸桿菌代謝途徑中L-酪氨酸合成的前體是磷酸烯醇式丙酮酸(PEP)和4-磷酸赤蘚糖[8],磷酸烯醇式丙酮酸還是芳香族氨基酸合成的前體物質[10-11],Mg2+是糖酵解途徑中的能量傳遞者NADH合成過程的輔因子,是其合成的激活劑[12]。維生素H可以促進菌體生長,但過量會造成菌體生長過快進入衰亡期,過少又會導致生長過慢的問題[13];磷酸二氫大腸桿菌合成細胞膜磷脂提供了主要成分磷,還參與了大腸桿菌的生長代謝,控制其生長速率[14-15],直接影響了大腸桿菌的生長密度和重組蛋白的表達量[12],磷酸吡哆醛(PLP)廣泛存在于細胞中,參與了脫羧反應、氨基轉移、消除反應[16];在代謝過程中,維生素B12是許多酶的輔酶,參與了甲基化和化合物異構作用,對DNA和蛋白質的合成及細胞的生長也有著重要作用[17];甲硫氨酸能增大蛋白的可溶性表達量,減少包涵體蛋白的形成,使后續純化工藝更簡便[18];谷氨酰胺在細胞中充當氮的載體,還作為蛋白質合成的調節物,對細胞的生長具有重要作用[19]。
為促進高密度發酵過程中微生物細胞更好地生長,避免營養不足或浪費等問題,本研究對L-酪氨酸發酵過程中的生長因子進行優化,并且設計了3種不同的底物添加方式進行上罐生產,大幅度提高了菌體最高密度及L-酪氨酸產量。
1 材料與方法
1.1 菌種
本實驗的供試菌株為大腸桿菌 TYR-05,保藏于天津科技大學代謝工程研究室。
1.2 培養基
1.2.1 活化培養基
葡萄糖25 g/L,酵母粉6 g/L,檸檬酸1 g/L,(NH4)2SO4·7H2O 2.4 mg/L,MgSO4·7H2O 0.4 g/L,谷氨酸 0.6 g/L,蛋氨酸0.5 g/L。
1.2.2 發酵培養基
葡萄糖25 g/L,酵母粉4.5 g/L,檸檬酸1.5 g/L,(NH4)2SO4·7H2O 2.8 mg/L,維生素H 0~2 mg/L;MgSO4·7H2O 0~3 g/L,KH2PO4 0~3 g/L;PLP 0~3 mg/L;維生素B12 0~3 mg/L。
1.3 儀器與設備
Biotech-15JS-3發酵罐 上海保興生物工程設備有限公司;Aglient 1290高效液相色譜儀 美國安捷倫科技公司;SBA-40D生物傳感分析儀 山東佰森泰克儀器有限公司;752PC紫外可見分光光度計 上海洪紀儀器設備有限公司。
1.4 培養方案
1.4.1 菌種活化
于-80 ℃冰箱中取出甘油管,使用接種環蘸取4環菌液涂抹于一代斜面上,37 ℃培養箱培養12 h,第2天再從一代斜面接種到二代斜面,繼續37 ℃培養10~12 h。
1.4.2 搖瓶培養
以培養基總體積的10%為接種量置于搖瓶中,調節pH為7.0~7.2,溫度37 ℃,220 r/min培養45 h(2%苯酚紅作為指示劑,補加氨水調節pH)。
1.4.3 5 L發酵罐培養
1.4.3.1 發酵菌種活化
于-80 ℃冰箱中取出甘油管,使用接種環蘸取4環菌液涂抹于一代斜面上,于37 ℃培養箱中培養12 h,第2天再從一代斜面接種到二代斜面,繼續于37 ℃培養10~12 h。
1.4.3.2 發酵罐種子培養
使用200 mL無菌水在超凈臺火焰旁洗脫茄形瓶中的菌體,在火焰旁從發酵罐進料口倒入種子培養基中。發酵過程中通過發酵罐參數將溫度控制在37 ℃,pH控制在7.0~7.2,溶氧控制在45%~55%,生物量>18時接入發酵培養基,進行發酵培養。
1.5 方法
1.5.1 生長因子添加量優化單因素實驗
在保證培養基等其他條件不變的前提下,按照表1中7種不同種類的生長因子,設計5組不同濃度梯度進行實驗,實驗結果取平均值。
1.5.2 正交實驗確定生長因子的最適添加量
在實驗2.1和2.2的基礎上,綜合菌體密度和產量考慮,各生長因子的影響順序為KH2PO4添加量>維生素H添加量>MgSO4·7H2O添加量>維生素B12添加量>PLP添加量,其中甲硫氨酸和谷氨酰胺的影響非常小。因此本實驗在單因素實驗的基礎上,以KH2PO4添加量(A)、PLP添加量(B)、維生素B12添加量(C)、維生素H添加量(D)和MgSO4·7H2O添加量(E)為研究對象,以菌體密度、L-酪氨酸產量為指標,進行正交實驗進一步分析,正交實驗因素水平表見表2。
1.5.3 生長因子添加方式的測定
由2.4可知,在優化添加量的基礎上,為了進一步達到實驗預期,實驗設計了3種生長因子添加方式,即一次性添加(a)、分時間段(10,15,20,25 h)添加(b)和10 h后持續流加(c)。3種添加方式添加總量一致 。
2 結果分析
2.1 生長因子添加種類及添加量對菌體密度的影響
由圖1可知,不同生長因子對菌體生長有較大影響,其中KH2PO4和維生素H對菌體密度的影響較大,當KH2PO4添加量為2.5 g/L時,菌體密度值達到34.1 g/L,當維生素H添加量為1.0 mg/L時,菌體密度最高,為30.2 g/L;二者差距較小,并且均高于其他5種生長因子對應的菌體密度。菌體的生長及基因的表達很大程度上取決于磷酸鹽的含量[20],細胞中磷酸鹽的含量對大腸桿菌中質粒表達及復制的速率有一定影響,因而決定了菌體的蛋白表達量[9];磷酸鹽是大腸桿菌合成細胞膜磷脂的主要成分,對菌體的生長有很大影響;它對代謝流分布有主要影響,控制著EMP途徑中L-酪氨酸合成的關鍵節點,PEP(磷酸烯醇式丙酮酸)和E4P(4-磷酸赤蘚糖)以及PRPP(磷酸核糖焦磷酸)是L-酪氨酸的合成原料[21],決定了EMP途徑的碳流量,因此磷元素是大腸桿菌生產L-酪氨酸不可或缺的成分之一,當過量添加時,會使代謝流中前體物的供給達到一種失衡的狀態,無法達到平衡點,進而使菌體密度降低[21];生物素參與了脂肪酸生物合成、氨基酸代謝和糖異生三大代謝過程[12],參與了脫羧、羧化、脫氫化等反應[12],是乙酰CoA羧化酶等的輔酶,還參與了CO2的固定作用,因此隨著添加量的增加,菌體密度逐漸變大,但當菌體密度達到最高值30.2 g/L后呈下降趨勢,分析得到添加量過高會導致菌體代謝過快而過早衰老,進而導致菌體密度下降。
2.2 生長因子添加種類及添加量對L-酪氨酸產量的影響
由圖2可知,7種生長因子對L-酪氨酸產量有顯著的影響。其中維生素B12、MgSO4·7H2O和PLP的影響較大,Mg2+是EMP途徑中關鍵酶的輔酶,還參與了甘油酸-3-磷酸和甘油酸-2-磷酸之間磷酸基團的轉移過程[22],為原料磷酸烯醇式丙酮酸的生成打下了基礎;磷酸吡哆醛促進了谷氨酸向谷氨酰胺的轉化[22],而L-酪氨酸是由前體物質HPP(對羥基苯丙酮酸)與谷氨酸的轉氨作用生成的,PLP為其生產提供了動力[23];維生素B12存在兩種活化形式,不僅參與了核苷酸與脫氧核苷酸的相互轉化,還參與了甲基的轉移[22];當谷氨酰胺的添加量≤2 g/L時,L-酪氨酸的產量與谷氨酰胺的添加量呈正相關,當谷氨酰胺添加量為2 g/L時,L-酪氨酸產量達到11.20 g/L,當谷氨酰胺添加量>2 g/L時,L-酪氨酸產量呈下降趨勢,維生素H的效果類似;隨著KH2PO4 添加量的增加,L-酪氨酸產量一直增大,并未像菌體密度呈先增后減的趨勢,分析出KH2PO4對產量只呈促進作用,甲硫氨酸的效果類似,分析原因為甲硫氨酸能減少包涵體的生成,提升質粒的表達效果[18]。
2.3 正交分析探究關鍵元素的最適用量
實驗得出KH2PO4、維生素H、MgSO4·7H2O、維生素B12、PLP對 L-酪氨酸發酵過程產生了較大影響,因此繼續優化5種物質的用量。
由表3中極差值的大小可以得出影響L-酪氨酸生物量的5個因素依次為A>D=E>C>B;通過比較5個因素的4個均值,即最大均值對應最適添加量,得到KH2PO4的最適添加量為2.5 g/L;維生素H的最適添加量為1.0 mg/L;MgSO4·7H2O的最適添加量為2.0 g/L;PLP的最適添加量為1.0 mg/L;維生素B12的最適添加量為2.0 mg/L。
由表4中極差值的大小可以得出影響L-酪氨酸產量的5個因素依次為B>C>A>D=E;通過比較5個因素的4個均值,即最大均值對應最適添加量,得到KH2PO4的最適添加量為2.4 g/L;維生素H的最適添加量為0.8 mg/L;MgSO4·7H2O的最適添加量為1.5 g/L;PLP的最適添加量為1.8 mg/L;維生素B12的最適添加量為2.0 mg/L。
綜合來看,維生素H和MgSO4·7H2O的添加量對產量的影響較大,其他3個因素對生物量的影響較大,因此確定維生素H的最適添加量為0.8 mg/L;MgSO4·7H2O的最適添加量為2.0 g/L;KH2PO4的最適添加量為2.5 g/L;PLP的最適添加量為1.0 mg/L;維生素B12的最適添加量為2.0 mg/L。
2.4 5 L發酵罐驗證
前期實驗以L-酪氨酸的菌體密度和產量為指標,探究了7個生長因子對L-酪氨酸發酵的影響,最后確定了效果較好的5個生長因子的添加量,并通過正交實驗進一步對添加量進行了篩選優化。但搖瓶實驗具有一定的局限性,導致菌體的生長潛力大大受限,因此在其他培養基成分及培養條件一致的條件下,進行5 L發酵罐對比驗證實驗,以不添加生長因子的培養基作為對照組,以KH2PO4、維生素H、MgSO4·7H2O、維生素B12、PLP分別添加2.5 g/L、0.8 mg/L、2.0 g/L、2.0 mg/L、1.0 mg/L為實驗組,進一步探究生長因子及添加量的優化效果。
由圖3可知,優化后實驗組的菌體密度和L-酪氨酸產量在發酵期間始終高于對照組,實驗組最大菌體密度為63.2 g/L,高于對照組的菌體密度56.7 g/L,發酵過程中菌體密度一直處于上升趨勢,但發酵后期菌體生長達到穩定期,所以增長較慢,趨于穩定。當不添加生長因子時,L-酪氨酸產量明顯偏低,增長趨勢較平穩,且最終產量為49.8 g/L。發酵中期(20~36 h)是L-酪氨酸積累速率最大的時期,且與菌體密度增長趨勢相近,當發酵時間達到36 h之后,L-酪氨酸積累較緩慢,最后44 h下罐時L-酪氨酸產量為53.1 g/L,較對照組提高了6.6%。
2.5 不同生長因子添加方式對L-酪氨酸發酵的影響
在發酵過程前期,菌體密度可通過發酵條件進行控制,進而縮短發酵周期,若生長因子添加時間過晚,會造成營養不足,導致菌體生長緩慢,發酵產酸水平較低,最后導致產量下降。因此,生長因子的添加方式對L-酪氨酸生物量及產量也具有一定影響。適合的添加方式對L-酪氨酸發酵至關重要。
2.5.1 不同添加方式對產量和糖酸轉化率的影響
由圖4可知,發酵過程中具體時間監測到的糖酸轉化率為實時糖酸轉化率,因此能夠通過數據呈現的轉化率的變化曲線得出發酵過程中轉化率最高的時期,如果設法延長這一時期,那么L-酪氨酸產量將會大大提高。a添加方式為一次性添加全部生長因子,因此發酵前期營養豐富,菌體能充分利用營養物質加速地進行菌體生長及L-酪氨酸的合成,糖酸轉化率也較高,菌體生長前期8 h時糖酸轉化率最高,8~20 h時菌體產酸速率逐漸降低,20~30 h產酸速率呈上升趨勢,30 h之后產酸速率較低,分析可能是生長因子前期利用充足但中后期供應不夠,不足以維持菌體正常的生長。添加方式b為分時間段(10,15,20,25 h)添加生長因子,可明顯看出前期0~10 h未添加生長因子時期L-酪氨酸產率較低,而添加生長因子的10~30 h內菌體大量生產L-酪氨酸,30 h后產酸率大大下降,最終L-酪氨酸產量為50.3 g/L,分析原因為前期菌體生長時期營養物質不足,導致菌體生長受到抑制,進而無法較好地進行L-酪氨酸生產,中期添加生長因子后這一問題有所緩解但最終產量低于a添加方式。添加方式c為發酵8 h后持續流加,能夠看出前期菌體生長速率較快,8 h時出現第一次轉化率高峰,分析原因是前期營養物質較充足,8~35 h生產較穩定,36 h后糖酸轉化率再次達到高峰,糖酸轉化率達到一個較平穩的水平,最終產量為56.1 g/L,糖酸轉化率達到23.2%,分析可得整個發酵過程中生長因子都處于一個相對穩定的水平,使菌體較好地吸收生長所需的各種營養物質,因此使L-酪氨酸發酵水平達到最高,較其他兩種添加方式有明顯優勢。
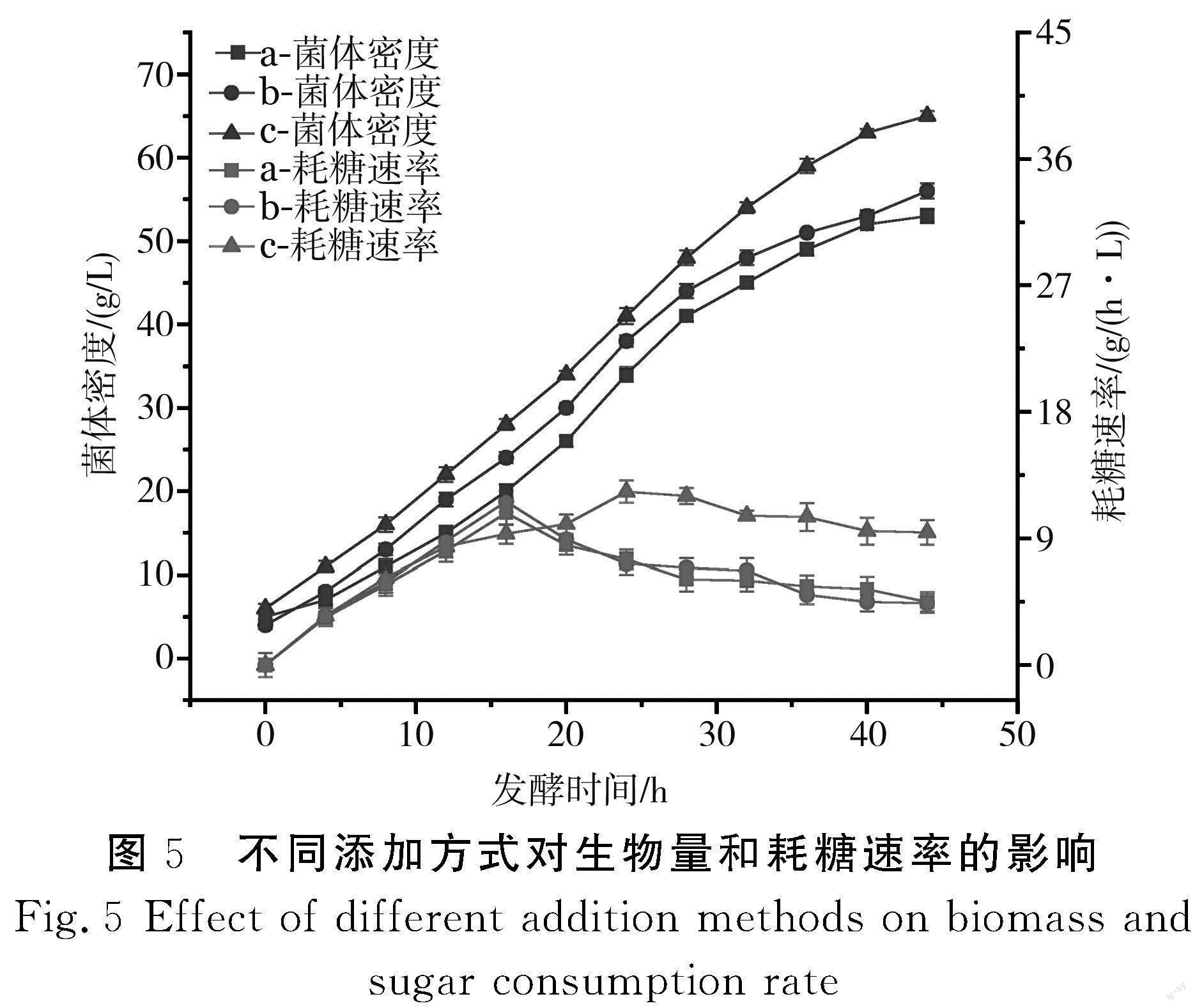
2.5.2 不同添加方式對生物量和耗糖速率的影響
由圖5可知,菌體密度和耗糖速率由大到小的順序都為c>b>a,c組最大菌體密度為65.0 g/L,c組在24 h時耗糖速率最大,為12.3 g/(h·L),而a組和b組最大耗糖速率出現在16 h,分別為10.1,11.2 g/(h·L),較c組早出現了4 h,并且可明顯看出c組在36 h之后菌體密度開始緩慢增長,而a組和b組在28 h之后菌體密度便開始出現緩慢增長的趨勢,菌體活性明顯下降,最終a組和b組的菌體密度分別為53.1,56.0 g/L,遠低于c組,因此添加方式c明顯優于另外兩種添加方式。
2.5.3 不同添加方式對副產物的影響
重組大腸桿菌高密度發酵過程中,很容易出現代謝副產物,其中乙酸最常見,它對蛋白的表達影響較大,研究表明,當菌體的生長速率達到一定值時,菌體密度達到最大值后攝氧能力不再繼續增強,進而導致乙酸的生成[24],方式b乙酸最終含量為1.9 g/L,分別比方式a和方式c增加了18.7%和60%,分析方式b會造成菌體過快衰老,菌體攝氧不足導致副產物乙酸含量較高,還會造成原料的浪費。限制比生長速率是減少乙酸生成的方法之一。綜合來看,方式c中副產物組氨酸(His)等均少于另外兩種添加方式,因此方式c有較大優勢。
3 結論
培養基的營養成分和發酵條件控制是大腸桿菌高密度發酵的兩個關鍵因素,實驗中選用5個生長因子并對其添加量及添加方式進行了探索,實驗表明5個生長因子的最優添加量為維生素H 0.8 mg/L,MgSO4·7H2O 2.0 g/L,KH2PO4 2.5 g/L,PLP 1.0 mg/L,維生素 B12 2.0 mg/L,最優添加策略為10 h開始持續流加。最終L-酪氨酸產量為56.2 g/L,最高菌體密度為65.0 g/L,糖酸轉化率為23.1%,副產物乙酸積累量減少到1.0 g/L,證明了生長因子的添加使菌體活性大大增強,強化了L-酪氨酸生產的通路代謝,L-酪氨酸產量明顯提高,使大腸桿菌生產L-酪氨酸的高密度培養達到一個較高的水平,也為L-酪氨酸發酵生產中各種生長因子的調控提供了依據[25]。
參考文獻:
[1]BONGAERTS J, KRMER M, MLLER U, et al. Metabolic engineering for microbial production of aromatic amino acids and derived compounds[J].Metabolic Engineering,2001,3(4):289-300.
[2]LI G H, CHEN Z C, CHEN N, et al. Enhancing the efficiency of L-tyrosine by repeated batch fermentation[J].Bioengineered,2020,11(1):852-861.
[3]TAN X, SONG W, CHEN X L, et al. Recent advances in biocatalytic derivatization of L-tyrosine[J].Applied Microbiology and Biotechnology,2020,104(23):9907-9920.
[4]劉堂浩.利用反向代謝工程調控釀酒酵母酪氨酸合成途徑[D].無錫:江南大學,2021.
[5]宋富強.代謝工程改造大腸桿菌生產多巴胺及羥基酪醇[D].天津:天津科技大學,2021.
[6]吳穎,王佳其,唐文,等.蒲公英黃酮對酪氨酸酶的抑制機理[J].食品工業,2021,42(6):283-287.
[7]BYOUNGJIN K, BINKLEY R, HYUN U K, et al. Metabolic engineering of Escherichia coli for the enhanced production of L-tyrosine[J].Biotechnology Bioengineering,2018,115(10):2554-2564.
[8]徐皓,李民,阮長庚,等.高密度發酵生產突變型重組人腫瘤壞死因子rhTNFα-DK2的研究[J].工業微生物,1998,28(2):20-25.
[9]王艷俠,楊珺,王飛.重組大腸桿菌高密度發酵工藝進展及研究[J].生物技術世界,2015(6):237.
[10]李國華.L-Tyr的發酵過程控制和提取工藝研究[D].天津:天津科技大學,2021.
[11]KIM S C, MIN B E, HWANG H G, et al. Pathway optimization by re-design of untranslated regions for L-tyrosine production in Escherichia coli[J].Scientific Reports,2015,5:13853.
[12]陳志超,王金多,徐慶陽.生長因子與生長因子對L-苯丙氨酸發酵的影響[J].食品與發酵工業,2022,48(8):82-89.
[13]徐達,梅漫莉,徐慶陽,等.生物素對L-纈氨酸發酵的影響[J].食品科學,2019,40(22):213-218.
[14]ANANDAN P, PARTHIPAN G, PAZHANIVEL K, et al. Growth and characterization of potassium halides mixed L-arginine phosphate monohydrate semi organic nonlinear optical single crystals[J].Optik-International Journal for Light and Electron Optics,2014,125(1):8-10.
[15]LAI S J, ZHANG Y, LIU S W, et al.Metabolic engineering and flux analysis of Corynebacterium glutamicum for L-serine production[J].Science China (Life Sciences),2012,55(4):283-290.
[16]TONEY M D. Reaction specificity in pyridoxal phosphate enzymes[J].Archives of Biochemistry and Biophysics,2005,433(1):279-287.
[17]羅祎,郝常明.維生素B12的研究及其進展[J].中國食品添加劑,2002(3):15-18,30.
[18]王肖彬,安登坤,劉洋.提高大腸桿菌高密度發酵可溶性表達量研究[J].山東工業技術,2018(17):36-37.
[19]果磊,黃崇本.谷氨酰胺在腸道的代謝及其作用[J].中國藥房,2005,16(4):305-307
[20]PFLEGER D.Hydrodynamic simulations of laboratory scale bubble columns fundamental studies of the Eulerian-Eulerian modelling approach[J].Chemical Engineering Science,1999,54(21):5091-5099.
[21]趙春光,謝希賢,徐慶陽,等.磷酸鹽對Escherichia coli TRJH L-色氨酸發酵代謝流分布的影響[J].天津科技大學學報,2009,24(5):10-13,26.
[22]王鏡巖.生物化學第三版[M].北京:高等教育出版社,2009:380-381.
[23]姚元鋒,趙廣榮.L-酪氨酸代謝工程研究進展[J].食品與發酵工業,2013,39(5):132-137.
[24]吳首標.重組大腸桿菌發酵過程中乙酸的控制方法研究[J].臨床醫藥文獻電子雜志,2019,6(31):197.
[25]張震,熊海波,徐慶陽.大腸桿菌高密度培養發酵L-色氨酸[J].食品與發酵工業,2019,45(23):15-20.

