少突膠質樣細胞條件培養液通過調節Sirt1/PGC-1α通路改善SH-SY5Y細胞氧化應激損傷
牛冬冬, 凌亞亭, 呂孝瑞, 王子瑜, 胡嘉波
(1. 江蘇大學醫學院, 江蘇 鎮江 212013; 2. 海爾施生物醫藥股份有限公司醫學檢驗所, 浙江 寧波 315042)
人胚胎干細胞源神經干細胞(human neural stem cells,hNSCs)是一種多能干細胞,具有自我更新、多向分化潛力[1]。少突膠質細胞是中樞神經系統的調節細胞,不僅可以在中樞神經系統中包裹軸突形成髓鞘,還可以通過旁分泌作用支持保護神經元,抑制神經元凋亡[2]。然而臨床上原代的少突膠質細胞來源受限,難以體外大量擴增[3]。基于移植細胞在體內遷移能力較差且存活率低[4],少突膠質細胞的旁分泌作用成為關注焦點。神經退行性疾病與氧化應激損傷密切相關[5],人神經干細胞源少突膠質樣細胞條件培養液(oligodendrocytes-like conditioned medium,OCM)成分豐富,可以很好地在體外模擬少突膠質樣細胞(oligodendrocytes-like,OLs)的旁分泌作用。hNSC-OLs可以在體外大量擴增,有望成為理想的種子細胞,為組織工程源源不斷地提供生物材料應用于神經退行性疾病的治療。本研究旨在探究OLs是否具備體外成髓鞘能力及OCM在人神經母細胞瘤細胞(SH-SY5Y)氧化應激損傷中的作用,為神經退行性疾病的治療提供新思路。
1 材料與方法
1.1 主要試劑與儀器
人神經母細胞瘤SH-SY5Y細胞(北京四正柏生物科技有限公司);NSCs由人胚胎干細胞誘導分化所得[6]。DMEM、DMEM/F12、FBS、Neurobasal培養基(美國Gibco公司),人表皮細胞生長因子(EGF)、堿性成纖維細胞生長因子(bFGF)、血小板衍生生長因子-AA(PDGF-AA)、神經營養因子-3(NT-3)、腦源性生長因子(BDNF,美國PeproTech公司),佛司可林(FSK,上海源葉生物科技有限公司),B27、NEAA(美國Thermo Fisher公司),基質膠(美國Corning公司),視黃酸(RA)、維生素C(vitamin C,Vc)、Accutase(美國Sigma公司),青霉素-鏈霉素雙抗(美國Invitrogen公司),CCK-8(美國APExBIO公司),DAPI、線粒體膜電位檢測試劑盒、還原型谷胱甘肽(GSH)含量檢測試劑盒(北京索萊寶科技有限公司),兔抗Olig2抗體、兔抗SOX10抗體、鼠抗Tuj抗體(英國Abcam公司),CyTM3-偶聯親和純化山羊抗兔IgG二抗(美國Jackson公司),山羊抗小鼠IgG-Alexa Fluor488二抗(美國Thermo Fisher公司),活性氧檢測試劑盒(大連美侖生物技術有限公司),乳酸脫氫酶(LDH)檢測試劑盒、丙二醛(MDA)檢測試劑盒、超氧化物歧化酶(SOD)檢測試劑盒(南京建成生物工程研究所),Annexin V-FITC/PI凋亡試劑盒(南京諾唯贊公司),單克隆兔抗β-肌動蛋白抗體(美國CST公司),兔抗Bax抗體(英國Abcam公司),兔抗Bcl-2抗體、兔抗Sirt1抗體、兔抗PGC-1α抗體(美國Affinity公司),山羊抗兔HRP標記二抗(蘇州睿瀛生物技術公司),Sirt1抑制劑EX527(美國Selleck公司)。激光共聚焦顯微鏡(德國Carl Zeiss公司),熒光顯微鏡(日本Olympus公司),多功能酶標儀(Cytation5,美國Biotek公司),超速離心機(美國Thermo Fisher公司),流式細胞儀(美國貝克曼公司)。
1.2 方法
1.2.1 細胞培養 SH-SY5Y細胞培養在含10% FBS的DMEM中,細胞匯合度達90%時進行傳代。NSCs由人胚胎干細胞分化得到,培養在含1% NEAA、20 ng/mL EGF、20 ng/mL bFGF、2% B27、100 U/mL青霉素-鏈霉素雙抗的無血清DMEM/F12中。NSCs匯合度達90%時進行傳代。在37 ℃、5% CO2飽和濕度條件下培養SH-SY5Y細胞和NSCs。
1.2.2 hNSC-OLs分化 使用P4~P18(第4代至第18代)NSCs進行OLs分化,在NSCs匯合度達60%左右時棄去原有的培養液,用無血清DMEM/F12清洗3遍,換成含10% FBS、10 ng/mL PDGF-AA、10 ng/mL NT-3、20 ng/mL bFGF、35 ng/mL RA、5 μmol/L FSK、100 U/mL雙抗的DMEM/F12。首次替換OLs分化培養基的細胞命名為第0代少突膠質樣細胞(P0-OLs),當P0-OLs匯合度達90%時進行細胞傳代。
1.2.3 免疫熒光鑒定OLs 6孔板中放置爬片,鋪置基質膠,將NSCs和P0-OLs用Accutase消化,終止消化后將NSCs和P0-OLs以5×104/mL的密度鋪置在6孔板中,分別使用NSCs培養液和OLs培養液繼續培養。48 h后棄去各自的培養液,PBS洗滌1遍,4%多聚甲醛固定5 min,PBS洗滌1遍,0.1% Triton X-100透化5 min,PBS洗滌1遍,1% BSA封閉1 h。1 ∶160稀釋兔抗Olig2抗體,1 ∶200稀釋兔抗SOX10抗體,4 ℃孵育過夜。棄去一抗工作液,PBS洗滌1遍,1 ∶200配制CyTM3-偶聯親和純化山羊抗兔IgG(H+L)二抗,二抗孵育1 h,PBS洗滌4次,每次30 min,加入DAPI染細胞核,覆蓋住細胞表面即可,室溫孵育4 min,PBS洗滌3次,每次20 min,封片,激光共聚焦顯微鏡觀察。
1.2.4 hNSCs神經元分化 使用P4~P18 NSCs進行神經元分化,在NSCs匯合度達40%左右時棄去原有的培養液,使用Neurobasal培養液清洗3遍,換成補充10 ng/mL BDNF、2% B27、20 ng/mL bFGF、100 U/mL雙抗的Neurobasal培養基,每2~3 d換1次液,2周之后拍照記錄。
1.2.5 OLs與神經元共培養及共聚焦顯微鏡檢測髓鞘形成 在神經元分化2周時,將OP1(P0-OLs傳代得到,即第一代少突膠質樣細胞)以5×104/mL密度消化后接種在神經元上,使用OLs培養液繼續培養,3 d后進行免疫熒光染色。1 ∶160稀釋兔抗Olig2抗體,1 ∶2 000稀釋鼠抗Tuj抗體,4 ℃孵育過夜。棄去一抗工作液,1 ∶200配制 CyTM3-偶聯親和純化山羊抗兔IgG(H+L)二抗,1 ∶500配制山羊抗小鼠IgG(H+L)-Alexa Fluor488二抗,孵育后,激光共聚焦觀察。
1.2.6 OLs條件培養液(OCM)的收集 收集P0-OLs傳代后的1~2代(P1~P2)OCM。當OLs細胞匯合度達90%左右時,棄去原來的培養液,用無血清DMEM輕輕洗滌細胞5次,再加入無血清DMEM繼續培養。12 h后收集上清液,以2 000 r/min離心20 min沉淀細胞碎片,隨后將收集的上清液用0.22 μm濾器進行過濾,得到OCM。分裝,置于-80 ℃保存備用。
1.2.7 CCK-8測定細胞活力 將SH-SY5Y細胞以1×104/孔接種于96孔板中,加入SH-SY5Y細胞完全培養基培養24 h后,正常對照組(NC組)使用無血清DMEM繼續培養24 h,加藥組設置50、100、200、400 μmol/L 4個濃度的H2O2處理細胞,24 h后吸去原有的培養液,加入100 μL CCK-8工作液,20 min后測定光密度,后續實驗均選用200 μmol/L H2O2處理細胞。設置含200 μmol/L H2O2的25%、50%、75%、100%的OCM處理SH-SY5Y細胞,24 h后同上述方法測定光密度。后續實驗均使用75% OCM處理SH-SY5Y細胞,即簡稱為H2O2+OCM組。H2O2+Vc組在含200 μmol/L H2O2的DMEM中補充100 μmol/L Vc,作為陽性對照。細胞處理24 h到達實驗終點,取上清液,應用LDH試劑盒測定細胞毒性。光學顯微鏡觀察SH-SY5Y細胞形態。
1.2.8 流式細胞術檢測活性氧 將SH-SY5Y細胞以1×105/mL密度接種于6孔板中,完全培養基培養24 h后,NC組細胞處理如“1.2.7”所述,H2O2組替換為含200 μmol/L H2O2的DMEM處理24 h,H2O2+OCM組替換為含200 μmol/L H2O2的75% OCM處理24 h,H2O2+Vc組在含200 μmol/L H2O2的DMEM中補充100 μmol/L Vc處理24 h。實驗終點,棄上清液,參照說明書將SH-SY5Y細胞和DCFH-DA(1 μmol/L)探針避光孵育30 min,陰性對照組不添加探針,PBS洗滌3次,流式細胞儀檢測。
1.2.9 化學發光法檢測SOD、GSH、MDA含量 將SH-SY5Y細胞以1×105/mL密度接種于大皿后使用完全培養基培養24 h,NC組、H2O2組、H2O2+OCM組、H2O2+Vc組細胞處理如“1.2.8”所述,棄上清液,PBS洗滌3遍,超聲破碎裂解細胞,收集離心后測定蛋白濃度。MDA含量及SOD、GSH活性根據試劑盒說明書進行測定。
1.2.10 熒光探針檢測線粒體膜電位 將SH-SY5Y細胞以1×105/mL密度接種于6孔板后使用完全培養基培養24 h,如“1.2.8”所述,NC組、H2O2組、H2O2+OCM組、H2O2+Vc組細胞處理12 h。參照說明書配制線粒體膜電位檢測探針,將不同處理組細胞與探針37 ℃孵育20 min,棄去探針工作液,加入2 mL完全培養基,熒光顯微鏡觀察。
1.2.11 流式細胞術測定SH-SY5Y細胞凋亡 SH-SY5Y細胞以1×105/mL的密度接種于6孔板中,完全培養基培養24 h,NC組、H2O2組、H2O2+OCM組細胞處理如“1.2.8”所述,棄去各處理組的培養液,PBS洗滌3次,用不含EDTA的胰酶消化細胞,60 s后加入培養液終止消化,收集細胞在EP管中,1 000 r/min、4 ℃離心5 min,棄上清液,PBS洗滌2次,加入100 μL緩沖液重懸細胞,加入5 μL Annexin V-FITC和5 μL PI熒光探針室溫避光孵育10 min后再加入400 μL緩沖液混勻,置于冰盒中,流式細胞儀檢測。
1.2.12 EX527處理SH-SY5Y細胞 NC組、H2O2組、H2O2+OCM組細胞處理如“1.2.7”所述,H2O2+OCM+EX527組,使用20 μmol/L Sirt1特異性抑制劑EX527預處理SH-SY5Y細胞2 h后,使用含200 μmol/L H2O2的OCM處理24 h;NC+EX527組,使用20 μmol/L Sirt1特異性抑制劑EX527預處理SH-SY5Y細胞2 h后,使用無血清DMEM繼續培養24 h。
1.2.13 蛋白質印跡法檢測細胞凋亡和Sirt1相關蛋白表達 NC組、H2O2組、H2O2+OCM組、H2O2+OCM+EX527組、NC+EX527組,細胞處理如“1.2.8”和“1.2.12”所述,實驗終點,棄上清液,用預冷的PBS洗滌細胞1遍,每孔加入100 μL含1% PMSF的RIPA裂解液,細胞刮刀刮取細胞后充分研磨并置于EP管中,冰上裂解1 h,裂解期間每隔15 min劇烈振蕩1次;12 000×g離心10 min,收取上清液測定蛋白濃度,按照4 ∶1的比例加入上樣緩沖液,混勻,100 ℃金屬浴10 min,-20 ℃保存。等量上樣,行SDS-PAGE,蛋白轉印至PVDF膜,TBST洗滌5 min,5% BSA封閉2 h,TBST清洗2次,每次5 min,將PVDF膜置于一抗工作液中,4 ℃冰箱搖床孵育過夜。使用的一抗包括:兔抗Bax抗體(1 ∶800)、兔抗Bcl-2抗體(1 ∶1 000)、兔抗Sirt1抗體(1 ∶1 000)、兔抗PGC-1α抗體(1 ∶1 000)、抗β-肌動蛋白抗體(1 ∶2 000)。第二天將膜取出,搖床上使用TBST清洗3次,每次10 min,1 ∶1 000稀釋二抗,將膜充分浸泡在對應的二抗中,室溫孵育1 h,TBST清洗3次,每次10 min。ECL顯色系統曝光,觀察條帶并保存圖像,使用Image J軟件分析條帶灰度值。
1.3 統計學分析
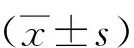
2 結果
2.1 NSCs分化為OLs
對比NSCs,OLs凸起明顯變長,細胞呈紡錘狀,多邊長梭形,與NSCs玫瑰花環樣結構有明顯不同(圖1A)。激光共聚焦結果顯示,OLs表達少突膠質細胞標志物Olig2和SOX10,而NSCs則幾乎不表達(圖1B、1C)。

A:NSCs與OLs形態學比較;B:少突膠質細胞標志物Olig2激光共聚焦圖;C:少突膠質細胞標志物SOX10激光共聚焦圖圖1 NSC-OLs的鑒定
2.2 NSC-OLs體外包裹軸突形成髓鞘結構
如圖2A、2B所示,由NSCs定向分化所得的神經元軸突細長,神經元標志物Tuj1免疫熒光染色陽性。激光共聚焦顯微鏡檢測到Olig2紅色標記的OLs包裹Tuj1綠色標記的神經元軸突、NSC-OLs與神經元之間的相互作用形成髓鞘樣結構,見圖2C箭頭。

A:人神經干細胞源神經元圖;B:神經元標志物Tuj1免疫熒光染色圖;C:激光共聚焦顯微鏡檢測體外OLs包裹神經元軸突(白色箭頭處形成髓鞘樣結構)圖2 體外觀察NSC-OLs包裹軸突形成髓鞘
2.3 OCM修復SH-SY5Y細胞損傷
與NC組比較,200 μmol/L H2O2組SH-SY5Y細胞存活率大約下降至50%(t=12.670,P<0.01),見圖3A。200 μmol/L H2O2刺激條件下,75% OCM表現出和100% OCM相似的保護效果,見圖3B。實驗選用Vc作為陽性對照,75% OCM表現出和Vc相似的保護效果,CCK-8結果顯示,OCM處理顯著提升了SH-SY5Y細胞存活率(t=6.923,P<0.01),降低了LDH的釋放(t=11.680,P<0.01),見圖3C、圖3D。
2.4 OCM改善SH-SY5Y細胞氧化應激
流式結果顯示,與NC組相比,H2O2組平均熒光強度顯著升高,而OCM處理顯著降低了熒光強度(t=8.109,P<0.01),提示OCM處理降低了活性氧水平,和Vc處理組效果相似(圖4A)。OCM處理提升了SH-SY5Y細胞中SOD(t=4.908,P<0.01)、GSH(t=9.679,P<0.01)的活性,降低了MDA含量(t=11.960,P<0.01),見圖4B~4D。此外還使用線粒體膜電位探針(JC-1)檢測了線粒體膜電位的高低,線粒體膜電位的下降是細胞凋亡早期的一個標志性事件,在線粒體膜電位較高時,JC-1聚集在線粒體基質中,形成聚合物,產生紅色熒光;當線粒體膜電位較低時,JC-1不能聚集在線粒體的基質中,此時JC-1為單體,產生綠色熒光。結果顯示,H2O2組線粒體膜電位最低,而OCM處理提升了線粒體膜電位,見圖4E。

A:DCFH-DA探針檢測SH-SY5Y細胞活性氧及定量分析;B~D:化學發光法檢測SH-SY5Y細胞SOD、GSH、MDA含量;E:線粒體膜電位檢測代表性熒光圖像;標尺=100 μm圖4 OCM在體外改善了H2O2誘導的SH-SY5Y細胞氧化應激損傷
2.5 OCM抑制SH-SY5Y細胞凋亡
結果顯示,與NC組相比,H2O2組SH-SY5Y細胞凋亡率明顯升高,而OCM處理降低了SH-SY5Y細胞凋亡(t=13.510,P<0.01),見圖5A。蛋白質印跡檢測結果顯示,與H2O2組相比,OCM處理降低了H2O2誘導的促凋亡蛋白Bax升高(t=3.226,P<0.05)、抑制了H2O2誘導的抗凋亡蛋白Bcl-2降低(t=3.056,P<0.05),見圖5B。

A:流式細胞儀檢測細胞凋亡及凋亡細胞百分比;B:蛋白質印跡檢測凋亡相關蛋白Bax、Bcl-2相對表達及灰度分析圖5 OCM降低了H2O2誘導的SH-SY5Y細胞凋亡
2.6 OCM通過激活Sirt1/PGC-1α通路修復SH-SY5Y細胞損傷
蛋白質印跡檢測結果顯示,OCM處理提高了SH-SY5Y細胞中Sirt1(t=3.394,P<0.05)、PGC-1α(t=13.920,P<0.01)蛋白表達水平(圖6A)。為了進一步驗證OCM是否通過Sirt1/PGC-1α通路改善H2O2誘導的SH-SY5Y細胞損傷,使用Sirt1特異性抑制劑EX527抑制Sirt1信號通路的表達。EX527預處理后,OCM對H2O2誘導的SH-SY5Y細胞損傷的保護作用消失,細胞皺縮,數量減少(圖6B)。蛋白質印跡檢測結果顯示,EX527預處理抑制了OCM處理所致的Sirt1(t=3.048,P<0.05)、PGC-1α(t=5.523,P<0.01)升高(圖6C)。結果提示OCM可以通過激活Sirt1/PGC-1α通路保護SH-SY5Y細胞。

A:蛋白質印跡檢測Sirt1、PGC-1α蛋白相對表達及灰度分析;B:SH-SY5Y細胞代表性圖像;C:蛋白質印跡法檢測EX527對SH-SY5Y細胞Sirt1、PGC-1α蛋白表達的影響及灰度分析圖6 OCM通過激活Sirt1/PGC-1α通路保護SH-SY5Y細胞
3 討論
神經退行性疾病病因多樣、機制尚未明確,常致記憶、認知功能障礙,神經元喪失是其主要的病理特征[7]。相關研究表明,神經退行性疾病發展過程中會產生過量的自由基,如羥自由基、超氧陰離子、一氧化氮等[8],過量的自由基未得到及時清除導致體內氧化/抗氧化失衡,過量的活性氧會對神經組織造成氧化損傷,最終導致神經元凋亡甚至壞死[9]。H2O2作為活性氧家族的一員,可以穿過細胞膜,產生羥自由基,進而對細胞造成損傷,最終導致細胞凋亡。SH-SY5Y細胞為人神經母細胞瘤細胞,具備一定的神經元特征,常被用作理想的體外細胞模型。因此,本研究使用H2O2刺激SH-SY5Y細胞來模擬氧化應激引起的神經退行性疾病的發生發展。
越來越多的研究表明,NSCs對神經系統具有積極的支持保護作用[10]。NSCs是一種具有多向分化潛力的細胞,葉開等[11]發現NSCs可以分化為外周神經系統的施萬樣細胞,本實驗探究NSCs能否分化為中樞神經系統的OLs且分化所得細胞是否對神經元氧化應激損傷具有積極的保護作用。基于少突膠質細胞的支持和營養作用,鐘欣等[12]將體外培養的少突膠質細胞移植到大鼠腦白質部分,發現少突膠質細胞可以存活和生長,但是移植細胞的存活率較低。盡管對少突膠質細胞移植已經做了一定的工作,但是移植細胞不能很好地生長、存活率低等問題仍不能得到很好地解決,因此近年來少突膠質細胞的旁分泌作用受到越來越多的關注。OCM容易獲得且生物安全性高,能夠很好地模擬細胞的旁分泌作用,有望成為理想的生物材料。
本研究在體外將NSCs分化為OLs和神經元,利用形態學結合免疫熒光對OLs進行鑒定并在體外觀察其髓鞘形成能力。OLs有望為組織工程提供源源不斷的生物活性材料用于髓鞘缺失類疾病的治療。本研究發現,OCM在體外提高了H2O2誘導的SH-SY5Y細胞活力,降低了SH-SY5Y細胞毒性。Vc為常用的抗氧化劑[13],參考鄭金平課題組的實驗方法[14],本研究設置100 μmol/L的Vc處理組作為陽性對照,結果顯示OCM處理可以改善SH-SY5Y細胞氧化應激,降低細胞凋亡,提示OCM可以通過降低氧化應激水平來保護SH-SY5Y細胞免于H2O2誘導的細胞凋亡。
Sirt1是一種組蛋白脫乙酰化酶[15],PGC-1α是Sirt1的去乙酰化底物,二者共同參與細胞內氧化應激的調節[16]。研究表明,在神經退行性疾病患者的血清和大腦中Sirt1含量降低,激活Sirt1有利于神經退行性疾病的治療[17]。在線粒體的生物發生過程中,PGC-1α被認為是核心調控因子[18],靶向Sirt1信號通路可以通過減少PGC-1α的乙酰化進行能量調節從而促進線粒體修復及生物合成,進而影響氧化應激相關進程[19]。本研究中,OCM處理提升了SH-SY5Y細胞內Sirt1、PGC-1α的蛋白表達,為了明確OCM對SH-SY5Y細胞的保護機制,使用Sirt1特異性抑制劑EX527預處理SH-SY5Y細胞,結果顯示OCM處理所致的Sirt1、PGC-1α蛋白表達升高被抑制,且OCM對SH-SY5Y細胞的保護作用減弱。然而活性氧介導的氧化應激損傷細胞途徑多樣,機制復雜,互有交叉,如內質網應激、鐵死亡等[20],有待進一步深入探討。
本研究證明了人神經干細胞源OCM對H2O2誘導的SH-SY5Y細胞的保護作用,為臨床治療神經退行性疾病提供了新的治療策略。但OCM的組分復雜,發揮保護作用的具體物質仍需進一步探索。

