酵母培養物和活性酵母對湖羊血清生化指標、瘤胃發酵及瘤胃細菌結構與組成的影響
武奧林, 蔡大亮,, 彭清潔, 周 迪,謝綠綠,, 張 彥,, 戴晉軍,
(1.農業微生物資源發掘與利用全國重點實驗室,湖北宜昌 443003;2.酵母功能湖北省重點實驗室,湖北宜昌 443003)
酵母源物質已被證實對反芻動物具有積極作用, 成為替代抗生素的優選添加劑(Mezzetti 等,2022;Brewer 等,2014)。 酵母源物質主要包括酵母菌、 酵母培養物、 酵母水解物和酵母微量元素等,隨著研究的深入,很多研究開始聚焦于酵母源物質對瘤胃的發酵特性、 菌群結構(Centeno 等,2023;Ferraretto 等,2012) 以及組學關聯性等(Wang 等,2023)。 研究表明, 酵母源物質可以對纖維分解菌 (Pinloche 等,2013)、 淀粉利用菌(Jiang 等,2017)和乳酸鹽利用菌(Rossi 等,2004)等瘤胃細菌產生影響(Rossi 等,2004),且不同的添加劑量會導致不同的菌群結構, 進而產生不同效果(Jiang 等,2017)。
反芻動物的生長依賴宿主與瘤胃微生物的共生作用, 微生物可以為宿主提供能量、 蛋白質、維生素等多種營養。 高達90%到達小腸的蛋白質和50%的宿主能量需求是由網狀瘤胃微生物細胞提供的(Boyd 等,1991)。 在日糧中,添加一些酵母菌或酵母培養物, 可以通過增加飼料攝入量和飼料消化率來提高動物的生產性能(何文娟等,2023;饒時庭等,2020)。 在某些條件下,它們還可能改變瘤胃發酵模式,降低乙酸/丙酸比例, 提高氨態氮和TVFA 含量 (Wang 等,2023; 任勝男等,2020), 提高血液抗氧化能力(王曉芳等,2022;Jia 等,2018), 增加纖維分解菌、淀粉利用菌和乳酸鹽利用菌的總活菌數,且不同的添加劑量會導致不同的菌群結構, 進而產生不同效果(Jiang 等,2017;Pinloche 等,2013;Rossi 等,2004)。 本試驗旨在研究酵母培養物和活性酵母對湖羊血清生化指標瘤胃發酵及瘤胃細菌結構與組成的影響。
1 材料與方法
1.1 試驗設計 試驗選取遺傳背景一致,體重相近[(25±2.5)kg]的湖羊公羔72 只,隨機分為3 組,每組4 個重復,每個重復6 只羊,每組分別飼喂3個不同配比的日糧,即對照組(基礎日糧,CON),酵母培養物A 組 (基礎日糧+1%酵母培養物A,YCA);酵母培養物B 組(基礎日糧+1%酵母培養物A+1.0×109CFU/g 活性酵母,YCB)。 預飼期10 d,正飼期60 d,正飼期后每組隨機選取6 只羊進行指標檢測。日糧配制根據肉羊營養需要量(NYT816-2021)配制,日糧組成及營養水平見表1。
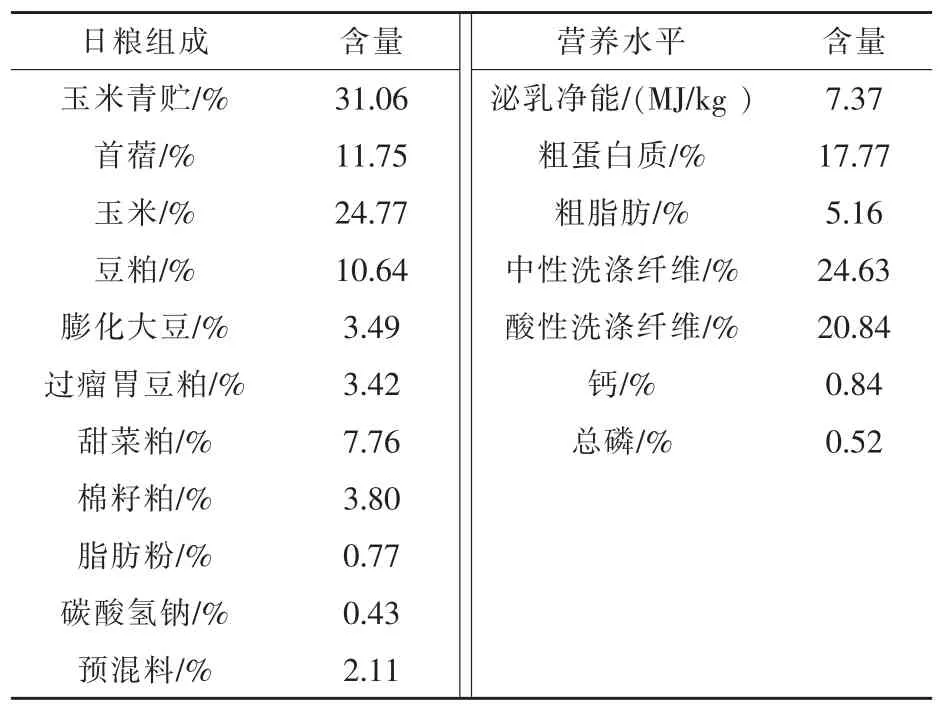
表1 日糧組成及營養水平(干物質基礎)
酵母培養物A 與活性酵母均購自湖北安琪酵母股份有限公司, 酵母培養物A: 粗蛋白質≥15%,甘露聚糖≥2%,粗灰分≤10%,水分≤10%;活性干酵母:活菌含量≥2×1010CFU/g。
1.2 試驗樣品采集與處理 晨飼后2 h, 通過湖羊口腔采集瘤胃液,4 層紗布過濾并分裝至5 mL離心管中,置于-80 ℃凍存備用。 通過比色法測定瘤胃液氨態氮含量(馮宗慈等,2013),采用氣相色譜法(Yue 等,2009)測定總揮發性脂肪酸和各揮發性脂肪酸含量。
1.3 測定指標與方法
1.3.1 血清生化指標和生殖激素 試驗結束后,湖羊頸靜脈采血,3500 r/min 離心10 min 取上清, 采用全自動血清生化分析儀測定血清中總蛋白(TP)、白蛋白(ALB)、谷丙轉氨酶(ALT)、谷草轉氨酶(AST)、尿素氮(BUN)、甘油三酯(TG)、總膽固醇(T-CHO)含量。
1.3.2 瘤胃細菌測序 提取樣品總DNA 后,根據保守區設計得到引物,在引物末端加上測序接頭,進行PCR 擴增并對其產物進行純化、定量和均一化形成測序文庫,建好的文庫先進行文庫質檢,質檢合格的文庫用Illumina NovaSeq 6000 進行測序。 高通量測序(如Illumina NovaSeq 測序平臺)得到原始圖像數據文件,經堿基識別(Base Calling)分析轉化為原始測序序列(SequencedReads),其中包含測序序列(Reads)的序列信息以及其對應的測序質量信息。 首先使用Trimmomatic v0.33軟件,對測序得到的Raw Reads 進行過濾;然后使用cutadapt 1.9.1 軟件進行引物序列的識別與去除,得到不包含引物序列的Clean Reads,其次使用QIIME2 中的dada2 方法進行去噪, 雙端序列拼接并去除嵌合體序列,97%聚類后獲得操作分類單元(OTUs)。
1.4 數據統計分析 用Excel 2010 對數據進行初步整理,采用Minitab 21.3.1.0 統計軟件中的單因素方差分析對所測指標進行統計分析。 利用百邁客云平臺和origin 對瘤胃微生物多樣性、 物種組成及豐富度、 物種差異以及主成分進行分析及作圖。用P ≤0.05 表示差異顯著,P ≤0.01 表示差異極顯著。
2 結果與分析
2.1 酵母培養物和活性酵母對湖羊瘤胃揮發酸指標的影響 由表2 可見, 與對照組相比,YCB組瘤胃戊酸比例極顯著升高(P <0.01),氨態氮濃度顯著升高(P <0.05),其余瘤胃揮發酸含量各組間差異不顯著(P >0.05)。
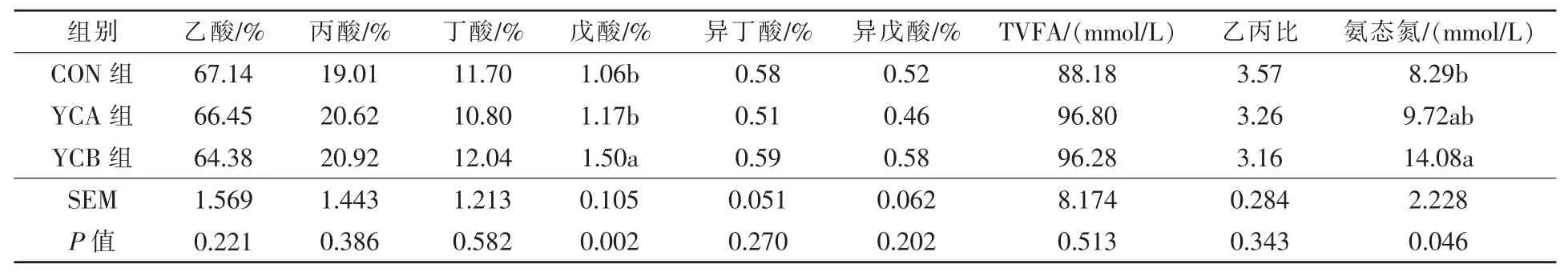
表2 酵母培養物和活性酵母對湖羊瘤胃揮發酸指標的影響
2.2 酵母培養物對湖羊血清生化指標的影響由表3 可見, 各組間血清生化指標差異均不顯著(P >0.05)。
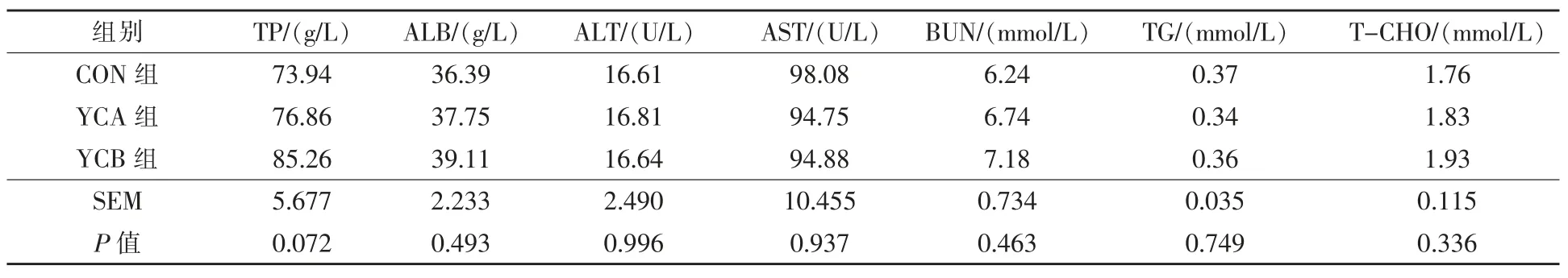
表3 酵母培養物和活性酵母對湖羊血清生化指標的影響
2.3 酵母培養物對湖羊瘤胃微生物區系的影響
2.3.1 測序結果及合理性 基于OTU 的Venn 圖可統計多組或多個樣本中所共有和獨有的物種數目。 如圖1 所示,以97%的一致性原則將序列聚類成OTU,共得到1996 個OTU,其中對照組OTU數為1471 個,YCA 組1350 個,YCB 組1467 個,共享823 個OTU,占總OTU 數的41.23%。
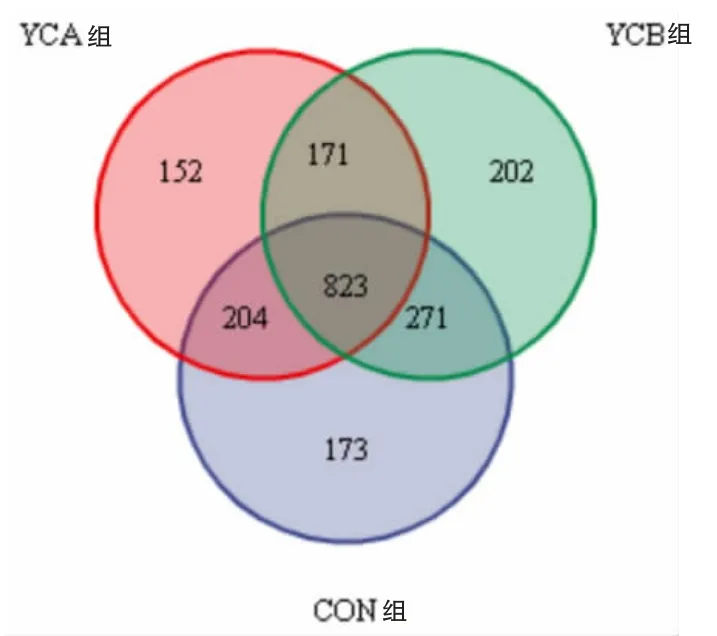
圖1 Veen 圖(基于OTU)
2.3.2 稀釋曲線 瘤胃細菌稀釋曲線如圖2,稀釋曲線呈現大幅度上升后趨于平緩, 說明深度覆蓋到樣本中的所有物種, 足以代表樣本中的物種豐富度。
2.3.3 α-多樣性 coverage 表示各樣品文庫的覆蓋率,各組樣品覆蓋率均為99%以上。 如表4 所示,Chao、Ace、Shannon 和Simpson 指數均無顯著的組間差異(P >0.05)。
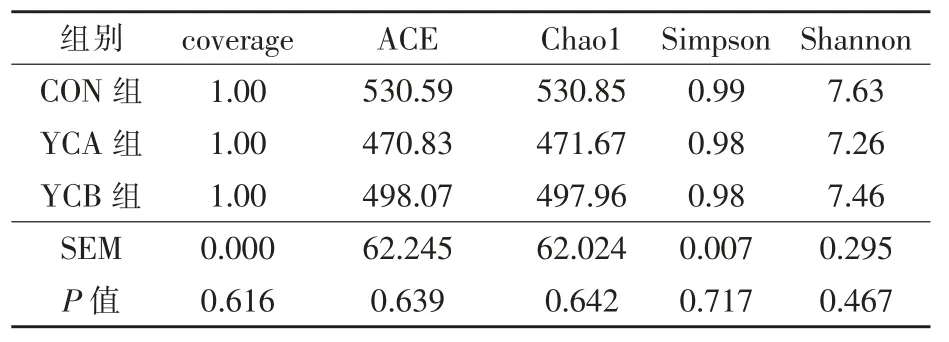
表4 酵母培養物對湖羊α-多樣性指數的影響(OTU 水平)
2.3.4 β-多樣性 分別在OTU 和屬水平進行PCA 分析。 如圖3 所示,在OTU 水平,PC1 和PC2對樣品差異的貢獻率分別為20.00%和16.92%。在屬水平,PC1 和PC2 對樣本差異的貢獻率分別為41.60%和19.25%。 對照組、YCA 組和YCB 組瘤胃細菌在OTU 和屬水平均聚類于不同的坐標位置,具有顯著的組間差異。
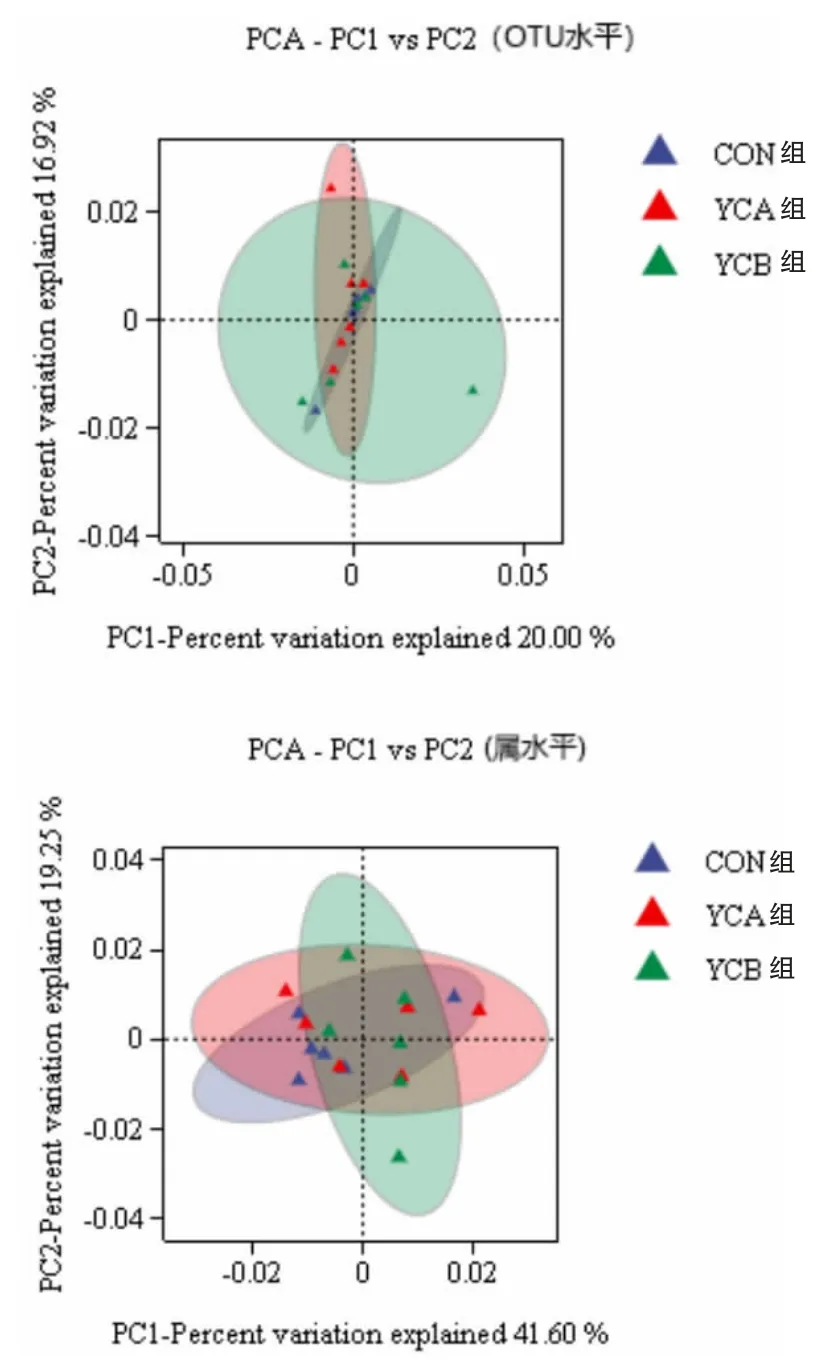
圖3 PCA 分析(OTU 和屬水平
2.3.5 物種組成及豐富度
2.3.5.1 門水平 分析三組瘤胃細菌菌群在門水平的區別,共檢測到相對豐度大于0.1%的細菌菌門11 個。由表5 可知,在門水平上,湖羊瘤胃優勢細菌菌門(豐度>1%)主要分布在擬桿菌門、厚壁菌門和變形菌門。
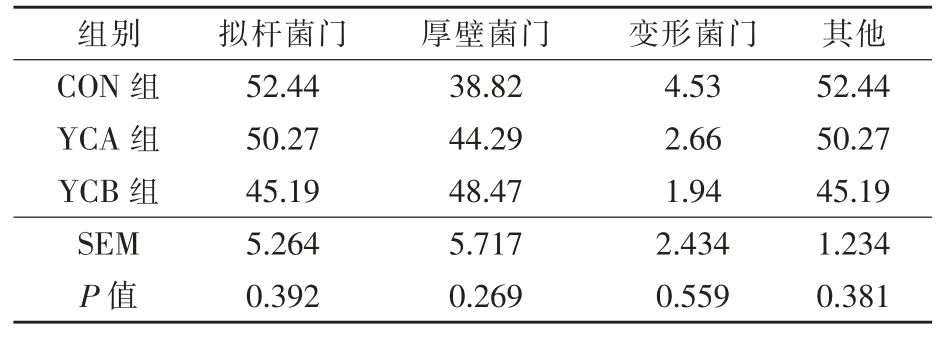
表5 酵母培養物對湖羊瘤胃細菌組成的影響(門水平>1%) %
2.3.5.2 屬水平 分析三組瘤胃細菌菌群在屬水平的區別, 共檢測到相對豐度大于0.1%的細菌菌屬66 個。 由表6 可知,在屬水平上,共有優勢菌屬為普雷沃氏菌屬,其余占比前10 的菌屬分別為未分類的普雷沃氏菌科、 未分類的月形單細胞菌科、瘤胃球菌屬、理研菌科RC9 群、未分類瘤胃細菌、解琥珀酸菌屬、未分類的擬桿菌科RF16 群和普雷沃氏菌科UGG_003 群。 與對照組相比,YCA 和YCB 組的解琥珀酸菌屬相對豐度顯著降低(P <0.05)。
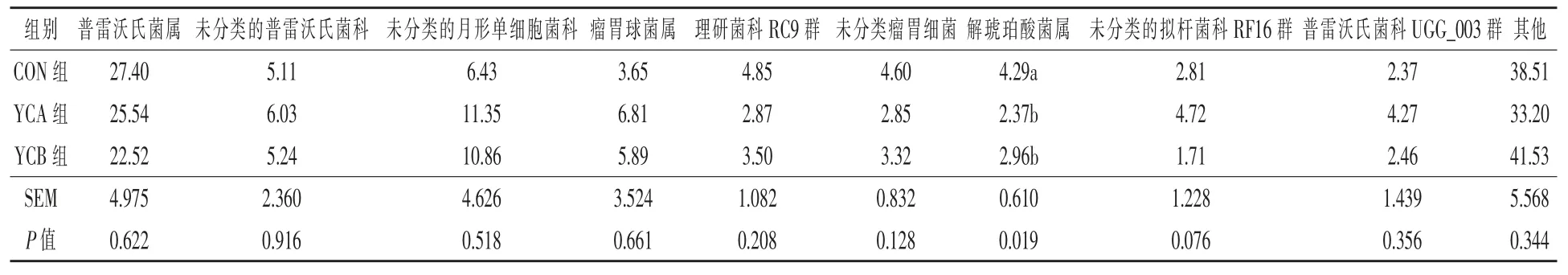
表6 酵母培養物對湖羊瘤胃細菌組成的影響(屬水平TOP10) %
2.3.6 瘤胃細菌組成與發酵參數及血清指標相關性分析 圖4 展示了湖羊瘤胃細菌屬水平相對豐度(排名前10 的菌屬)與瘤胃發酵參數及血清生化指標的相關關系。 其中普雷沃氏菌屬相對豐度與血清總蛋白 (R=-0.502,P ≤0.05)、 總膽固醇(R=-0.568,P ≤0.05)、戊酸(R=-0.519,P ≤0.05)濃度呈顯著負相關, 未分類的月形單細胞菌科與血清總蛋白(R=0.506,P ≤0.05)濃度呈顯著正相關,與血清谷丙轉氨酶(R=0.604,P ≤0.01)濃度呈極顯著正相關, 瘤胃球菌屬與血清谷丙轉氨酶(R=0.540,P ≤0.05)呈顯著正相關,未分類的擬桿菌科RF16 群與血清總蛋白 (R=-0.479,P ≤0.05)呈顯著負相關。
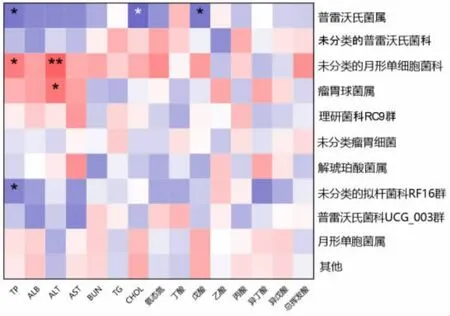
圖4 相關性分析
3 討論
3.1 飼喂酵母培養物和活性酵母對瘤胃發酵參數的影響 瘤胃發酵參數是影響瘤胃消化的重要因素, 其代表了瘤胃的微生物生長狀況及瘤胃消化能力。 研究表明,酵母源物質可以影響瘤胃發酵參數, 提高丙酸的表達量, 降低乙丙比(張雷雷等,2023; 任勝男等,2020;Chaucheyras等;1996;Mutsvangwa 等,1992),這是由于酵母菌和乳酸菌等可競爭性利用發酵液中的糖類,刺激埃氏巨型球菌的生長, 后者可將乳酸降解為丙酸和丁酸(Amin 等,2021)。 但Desnoyers 等(2009)研究發現,活性酵母可以提高瘤胃揮發性脂肪酸濃度(平均+2.17 mM)并降低瘤胃乳酸濃度(平均-0.9 mM),對乙丙比沒有影響。 在本研究中,1%酵母培養物與1.0×109CFU/g 活性酵母不會顯著影響丙酸比例, 但添加后丙酸比例有升高趨勢,乙丙比有降低趨勢。 只添加酵母培養物不會顯著影響戊酸比例, 同時添加酵母培養物和活性酵母,戊酸比例出現了顯著增加,這與Opsi(2012)等研究一致。 Liu 等(2022)研究發現,在育肥牛日糧中添加4 g/頭·d 活性酵母,可以顯著提高瘤胃中丙酸比例, 但對乙酸比例及乙丙比無顯著影響。 曾鈺等(2020)也發現,在舍飼牦牛日糧中添加1%和1.5%的酵母培養物,可以顯著提高瘤胃丙酸比例,降低乙丙比。 與活性酵母相比,酵母培養物中的活菌含量低,并不依賴活的酵母細胞起作用(Poppy 等,2012),酵母培養物中的有機酸、酶、小肽等均會對瘤胃發酵參數產生影響(姜奧宇等,2022;王小虎,2017;Vyas 等,2015; 馬寧等,2009;Castillo 等,2004),而活性酵母更依賴于酵母菌的呼吸作用(Newbold 等,1996)。說明酵母培養物和活性酵母均可在一定程度上提高瘤胃丙酸比例, 降低乙酸比例,但功能性物質不同,可能需要更多的酵母培養物有效成分或更多的有效酵母活菌數才能達到乙酸和丙酸比例的顯著改變。
瘤胃內氨態氮濃度通常與飼料蛋白的降解及微生物蛋白的合成有關, 還與瘤胃的尿素循環有關,6 ~30 g/dL 的氨態氮濃度不會產生不良的影響(Firkins 等,2007)。 在本研究中,瘤胃氨態氮濃度在此范圍內, 添加1%的酵母培養物和1.0×109CFU/g 的活性酵母會顯著提高瘤胃氨態氮濃度,只添加1%的酵母培養物氨態氮濃度有升高趨勢, 說明酵母培養物會在一定程度促進瘤胃氨態氮生成, 活性酵母會進一步增加瘤胃氨態氮的生成能力,這與蔡大亮等(2022)的研究結果一致。此外,當瘤胃中氨態氮濃度偏低時,會有大量在循環尿素進入瘤胃,進而降低血清BUN 濃度,但在本研究中,YCA 組與YCB 組的血清BUN 濃度均有升高趨勢, 說明酵母培養物和活性酵母可以改變瘤胃內環境, 促進微生物蛋白的合成與蛋白飼料的利用。
3.2 飼喂酵母培養物和活性酵母對血清生化指標的影響 血清生化指標不僅反映了營養物質的體內代謝情況, 還是衡量機體健康程度的重要標準。 血清TP 和ALB 可以反映日糧中蛋白質的消化吸收情況,而BUN 是蛋白質代謝的終產物,TP和BUN 的不足均會導致機體抵抗力降低,過多則會導致氮的浪費 (張學峰等,2016), 綿羊的TP、ALB 和BUN 參考范圍分別為53 ~89 g/L、21 ~46 g/L 和2.86 ~ 14.28 mmol/L (Uyanik,2001;Pernthaner 等,1993;Kaneko,1980)。 在本研究中,TP、ALB 和BUN 均在參考范圍內,且各組間無顯著差異,這與Hassan 等(2016)研究一致。 血清TG、T-CHO 與脂質代謝密切相關,T-CHO 是指血液中所有脂蛋白所含有的膽固醇含量, 包括游離膽固醇和膽固醇酯,AST 與ALT 代表了肝臟的代謝情況。 本研究表明, 添加1%的酵母培養物和1.0×109CFU/g 的活性酵母不會影響脂質代謝及肝臟代謝。
3.3 飼喂酵母培養物和活性酵母對湖羊瘤胃細菌菌群的影響 本研究結果顯示,CON 組的OTU數最多,其次為YCB 組和YCA 組,總體差別不大。 樣本覆蓋率高于99%,可以真實反映湖羊瘤胃細菌的結構和多樣性。 α-多樣性中Ace、Chao和Shannon 指數越大,多樣性越高,Simpson 指數越小,多樣性越高,在本研究中,各指數均無顯著差異, 說明添加1%的酵母培養物與1.0×109CFU/g 的活性酵母不會影響瘤胃菌群多樣性,這與Wang 等(2023)研究一致。 主成分分析結果表明,在OTU 水平,與對照組相比,YCA 組和YCB組的瘤胃細菌的菌群多樣性有逐漸升高趨勢,添加活性酵母后OTU 水平的瘤胃細菌菌群多樣性更高;在屬水平,第一主成分和第二主成分對樣品的貢獻值更高,CON 組與YCA 組的細菌菌群組成更接近,YCA 組與YCB 組的置信橢圓面積更大, 說明添加酵母培養物與活性酵母均可增加并改變屬水平瘤胃細菌菌群多樣性。 總而言之,添加1%的酵母培養物與1.0*10^9 的活性酵母均可增加并改變湖羊瘤胃細菌多樣性,且在添加酵母培養物的基礎上添加活性酵母,瘤胃細菌菌群的變異度更大。
瘤胃細菌的優勢菌門通常為擬桿菌門和厚壁菌門(Auffret 等,2017;Klevenhusen 等,2017),在本研究中,瘤胃的優勢菌門為擬桿菌門、厚壁菌門,這與前人研究結果一致。 Gao 等(2022)研究發現,在肉牛日糧中添加0.8 g/頭·d 的活性酵母顯著降低了瘤胃中變形菌門的相對豐度,但添加50 g/頭·d 的酵母培養物對變形菌門相對豐度沒有影響。 在本研究中,添加1%的酵母培養物和1.0×109CFU/g 的活性酵母不會對變形菌門相對豐度產生顯著影響, 但與對照組相比有降低趨勢, 這可能與酵母培養物和活性酵母的添加量較低有關。 郝凌魁等(2021)研究發現,在羯羊日糧中添加13.37%的酵母培養物后,擬桿菌門的相對豐度增加, 厚壁菌門的相對豐度降低,但與對照組無顯著差異,這與本研究趨勢正好相反,由于各組間擬桿菌門并無顯著差異,本文不做進一步討論。
普雷沃氏菌屬是瘤胃中最多的擬桿菌門菌屬,主要參與淀粉、木聚糖等能量物質的降解。本研究結果顯示,在屬水平上,各處理組的瘤胃優勢菌群均為普雷沃氏菌屬, 且各組間無顯著差異,這與前人研究結果一致(孫美杰等,2022;曾鈺等,2020)。 郭婷等(2022)研究發現,在圍產前期奶牛日糧中添加120 g/d 酵母培養物,瘤胃細菌中解琥珀酸菌屬及月形單胞菌屬的相對豐度極顯著降低。Jiang 等(2017)研究發現,在奶牛日糧中添加5.7×107CFU/頭·d 的活性酵母可以提高纖維分解菌瘤胃球菌、 瘤胃桿菌和反芻獸新月單胞菌的濃度, 而添加6.8×108 CFU/頭·d的活性酵母則可以提高瘤胃桿菌和反芻獸新月單胞菌的濃度, 可見不同的活性酵母添加劑量會對瘤胃屬水平細菌菌群產生不同影響。 在本研究中,添加1%的酵母培養物和1.0×109CFU/g的活性酵母會顯著降低接琥珀酸菌屬的濃度,解琥珀酸菌屬可將琥珀酸代謝生成丙酸鹽,進而分解為丙酸,由此可以解釋TVFA 中丙酸比例的上升原因。
瘤胃菌群通常與瘤胃揮發酸和血清生化指標密切相關, 微生物通過發酵產生揮發酸等小分子物質被瘤胃吸收, 并進入血液供機體生長代謝(郭延儉,2015)。 本研究發現,未分類的月形單胞菌科與血清AST 濃度呈極顯著正相關,而瘤胃球菌屬也與AST 濃度有顯著正相關性。AST 主要分布在肝臟等組織中, 當組織細胞受損,AST 就會釋放入血, 而肝臟還可以吸收氨合成尿素(馮仰廉,2004),進而參與瘤胃的尿素循環,因此,瘤胃球菌屬和未分類的月形單胞菌科與AST 的相關性,可能與瘤胃的尿素循環有關。金紅巖等(2020)在牦牛日糧中添加主成分為酵母菌的微生態制劑后, 也發現血清中AST 濃度有增加趨勢, 且月形單胞菌屬與瘤胃球菌屬也有增加趨勢,本研究與其一致。 普雷沃氏菌屬的發酵產物主要包括乙酸、琥珀酸和丙酸,而棲瘤胃普雷沃氏菌是瘤胃中主要的蛋白降解菌之一(馮仰廉,2004),在本研究中,普雷沃氏菌屬與血清TP 和CHOL 具有顯著負相關性,與戊酸具有顯著正相關,但與乙酸和丙酸無顯著相關性,這可能由于普雷沃氏菌參與了蛋白的降解,但酵母培養物和酵母菌的添加量不足, 導致普雷沃氏菌屬與乙酸和丙酸無相關性。
4 小結
本試驗結果表明,1%的酵母培養物可在一定程度上提高瘤胃細菌多樣性,改變瘤胃菌群組成,降低瘤胃解琥珀酸菌屬比例。1%的酵母培養物和1.0×109CFU/g 的活性酵母可以增強酵母培養物的效果,進一步改善瘤胃發酵,提高瘤胃戊酸比例和氨態氮濃度。

