桃葉珊瑚苷在煙曲霉菌角膜炎中抗炎作用及其機制
刁瑋琳 尹敏 李翠

[摘要] 目的 探討桃葉珊瑚苷(AU)對煙曲霉菌角膜炎的抗炎作用及其機制。方法 采用CCK-8實驗檢測AU對人角膜上皮細胞(HCECs)的細胞毒性,裂隙燈拍照和臨床評分評估AU對煙曲霉菌角膜炎的治療效果,髓過氧化物酶(MPO)實驗和免疫熒光染色檢查中性粒細胞浸潤和活性,RT-PCR、Western blot和ELISA方法檢測重組與合成蛋白(Nrf2)、血紅素氧合酶-1(HO-1)、白細胞介素-1β(IL-1β)以及白細胞介素-6(IL-6)的表達。結果AU降低了感染第3天的小鼠角膜臨床評分(F=35.714,P<0.001),抑制了中性粒細胞的募集和活性(t=9.882,P<0.001),同時也下調了IL-1β、IL-6的mRNA表達(F=59.356、110.224,P<0.001)。體外實驗顯示,AU明顯上調煙曲霉菌刺激的Nrf2、HO-1的mRNA和蛋白表達,下調IL-1β、IL-6的mRNA表達及IL-6的蛋白表達(F=17.569~146.436,P<0.001)。結論 AU能夠改善煙曲霉菌角膜炎嚴重程度,抑制中性粒細胞募集和活性,上調Nrf2和HO-1表達,抑制下游炎癥因子表達,在煙曲霉菌角膜炎中起抗炎作用。
[關鍵詞] 桃葉珊瑚苷;煙曲霉菌;炎癥;角膜炎
[中圖分類號] R772.22;R285.5
[文獻標志碼] A
[文章編號] 2096-5532(2023)04-0501-06
doi:10.11712/jms.2096-5532.2023.59.118
[網絡出版] https://link.cnki.net/urlid/37.1517.r.20230920.0937.006;2023-09-21 16:17:53
ANTI-INFLAMMATORY EFFECT OF AUCUBIN IN ASPERGILLUS FUMIGATUS KERATITIS AND ITS MECHANISM OF ACTION DIAO Weilin, YIN Min, LI Cui (Department of Ophthalmology, TheAffiliated Hospital of Qingdao University, Qingdao 266003, China)\; [ABSTRACT] Objective To investigate the anti-inflammatory effect of aucubin (AU) in Aspergillus fumigatus keratitis and its mechanism of action. Methods The cytotoxicity of AU to human corneal epithelial cells (HCECs) was determined using Cell Counting Kit-8. The therapeutic effect of AU for Aspergillus fumigatus keratitis was assessed by slit lamp photography and clinical scoring. Neutrophil infiltration and activity were examined by myeloperoxidase assay and immunofluorescence staining. The expression of nuclear factor erythroid 2-related factor 2 (Nrf2), heme oxygenase 1 (HO-1), interleukin-1β (IL-1β), and interleukin-6 (IL-6) was measured by RT-PCR, Western blot, and enzyme-linked immunosorbent assay. Results On the third day of infection, AU significantly decreased the clinical corneal score (F=35.714,P<0.001), significantly inhibited neutrophil recruitment and activity (t=9.882,P<0.001), and significantly downregulated the mRNA expression of IL-1β and IL-6 (F=59.356,110.224,P<0.001). In-vitro experiments showed that AU significantly upregulated the mRNA and protein expression of Nrf2 and HO-1, and significantly downregulated the mRNA expression of IL-1β and IL-6 and the protein expression of IL-6 (F=17.569-146.436,P<0.001) in the presence of Aspergillus fumigatus stimulation. Conclusion AU can reduce the severity of Aspergillus fumigatus keratitis through anti-inflammatory mechanisms that inhibit the recruitment and activity of neutrophils, upregulate the expression of Nrf2 and HO-1, and suppress the expression of downstream inflammatory factors.
[KEY WORDS] aucubin; Aspergillus fumigatus; inflammation; keratitis
真菌性角膜炎是最嚴重的感染性角膜病之一,其發病率持續上升[1]。煙曲霉菌(AF)是角膜感染的主要真菌病原體,角膜上皮損傷是角膜炎的關鍵誘發因素[2]。真菌侵入角膜基質層時誘發的免疫反應導致進一步的組織損傷[3]。桃葉珊瑚苷(AU)存在于許多天然植物中[4],具有廣泛的藥理學特性,如抗炎、抗菌、抗氧化、神經保護以及抗纖維化等作用[5-9]。研究顯示,AU能夠降低干眼癥小鼠白細胞介素-1β(IL-1β)和白細胞介素-8(IL-8)等炎癥因子表達預防角膜上皮損傷[10],AU通過TOLL樣受體4/髓樣分化因子88/人核因子κB抑制蛋白α/核因子κB信號通路抑制脊髓損傷模型中的炎癥,從而促進神經元功能恢復[11];AU通過抑制肌醇依賴酶1α/硫氧還蛋白互作蛋白信號通路緩解炎癥反應,從而延緩2型糖尿病誘導的肝纖維化發展[12]。因此,AU具有抗炎潛力并且可能成為治療真菌性角膜炎的藥物。本研究探討AU對AF誘導的真菌性角膜炎炎癥反應的作用。
1 材料和方法
1.1 真菌制備
AF標準菌株(菌株3.0772,中國微生物中心)于固體瓊脂培養基中培養,振蕩研磨后收集菌絲,以12 000 r/min離心15 min,用無菌PBS洗滌。將收集的活化菌絲用于動物實驗;用體積分數0.70乙醇處理滅活菌絲,并將濃度調整為3×1011CFU/L用于細胞實驗。
1.2 細胞培養與刺激
人角膜上皮細胞(HCECs)由中國福建廈門大學實驗室提供。將HCECs接種于6孔板或者12孔板之中,在含有胎牛血清的F12細胞培養液中37 ℃培養,至細胞生長密度達到80%,將細胞分為DMSO組、AU組、AF+DMSO組、AF+AU組,其中DMSO組與AU組分別加入含有體積分數0.005 DMSO和20 mg/L AU的細胞培養液培養;AF+DMSO組與AF+AU組分別加入體積分數0.005 DMSO和20 mg/L的AU預處理2 h后,加入滅活菌絲。收集菌絲刺激8 h后的細胞進行RT-PCR,收集刺激24 h的細胞進行Western blot和ELISA檢測。
1.3 檢測指標及方法
1.3.1 藥物細胞毒性評估 將HCECs接種于96孔板中,分別加入含有不同濃度AU(5、10、20、40、80、160、320 mg/L)細胞培養液,37 ℃下培養24 h后,每孔加入10 μL CCK-8試劑(Solarbio,中國北京)后培養2 h,用酶標儀測定450 nm波長處吸光度值,以其評估各組細胞存活率。
1.3.2 小鼠AF角膜炎模型的建立及AU對其作用健康8周齡雌性C57BL/6小鼠購自濟南朋悅實驗動物繁育有限公司,所有治療均符合視覺與眼科研究協會關于在眼科和視覺研究中使用動物的聲明要求。在正常小鼠右眼中分別滴入體積分數0.005的DMSO(DMSO組)以及20 mg/L的AU(AU組)5 μL,每天2次。選取小鼠的右眼作為實驗眼,80 g/L水合氯醛腹腔注射麻醉后刮取小鼠右眼中央2 mm角膜上皮,在眼表面涂抹AF(5 μL,3×1011CFU/L),放置軟接觸鏡后縫合眼瞼24 h以形成潰瘍。眼瞼縫線拆除后,分別將體積分數0.005的DMSO及20 mg/L AU 5 μL滴入小鼠結膜囊,每天2次,分別作為AF+DMSO組及AF+AU組。感染后第1天和第3天,裂隙燈下觀察小鼠角膜炎嚴重程度,參考相關文獻進行臨床評分評估角膜炎嚴重程度[13],根據潰瘍面積、混濁程度和潰瘍形態分為Ⅰ~Ⅳ級,分別對應1~4分。臨床評分總分為3項觀察指標分數相加,總分0~5為輕度感染,6~9為中度感染,10~12為嚴重感染。收集各組小鼠角膜用于實時熒光定量PCR(RT-PCR)、Western blot、ELISA和髓過氧化物酶(MPO)實驗,收集小鼠眼球用于免疫熒光染色。
1.3.3 RT-PCR檢測相關受體與炎癥因子mRNA表達 使用RNAiso Plus試劑盒(Takara,大連,中國)從滅活AF菌絲刺激8 h后的HCECs或小鼠角膜中提取總RNA,使用Prime Script RT試劑盒(Takara,大連,中國)將RNA逆轉錄獲得cDNA,用RT-PCR儀器(Eppendorf公司,德國)進行PCR擴增反應。PCR反應體系:目的基因上、下游引物各0.5 μL,SYBR 10.0 μL,樣本cDNA 2.0 μL,滅菌DEPC水7.0 μL。根據循環數計算基因的相對表達量,以β-actin作為內參照,分別檢測重組與合成蛋白(Nrf2)、血紅素氧合酶-1(HO-1)、IL-1β以及白細胞介素-6(IL-6)mRNA表達。PCR引物及其序列見表1。
1.3.4 Western blot檢測Nrf2和HO-1蛋白表達用比例為98∶1∶1的RIPA緩沖液、PMSF和磷酸酶抑制劑的混合液裂解細胞蛋白,BCA蛋白濃度測定試劑盒(Solarbio,中國北京)測定蛋白質的濃度后,應用體積分數0.10 SDS-PAGE分離總蛋白質,轉移到PVDF膜上。用封閉液(beyotime,中國北京)封閉膜,并將膜分別浸泡于一抗Nrf2(1∶1 000, CST)、HO-1(1∶20 000, Abcam)、β-actin(1∶1 000, Elabscience)和 β-tubulin(1∶1 000, Elabscience)中4 ℃孵育過夜,用PBST洗滌3次后,將膜與相應的二抗(1∶1 000, Elabscience)37 ℃下孵育1 h,于UVP(VILBER LOURM,美國)下顯像并拍照。應用Image J軟件分析各組蛋白條帶的灰度值,以其表示蛋白表達水平。
1.3.5 ELISA方法檢測IL-1β、IL-6蛋白表達 滅活AF菌絲刺激HCECs 24 h,離心并收集細胞上清液,應用ELISA試劑盒檢測IL-1β、IL-6蛋白表達水平,按試劑盒說明書進行操作。使用酶標儀檢測450 nm和570 nm波長處的吸光度值,根據標準蛋白曲線計算各組樣本蛋白表達濃度。
1.3.6 免疫熒光染色檢測AU對中性粒細胞募集的影響 收集小鼠感染第3天的眼球置于OCT包埋劑中液氮冷凍,-25 ℃下切成8 μm厚的連續切片,4 ℃下用丙酮固定5 min。加入山羊血清(1∶100,Solarbio)封閉30 min后,在4 ℃下用NIMP-R14(1∶100,Santa Cruz Biotechnology Company)孵育樣本過夜。加入相應的二抗(1∶200,Elabscience)避光孵育1 h,DAPI染色10 min。熒光顯微鏡(Zeiss Axio Vert,放大倍數400倍)觀察并拍照,觀察樣本中性粒細胞的定位。
1.3.7 MPO實驗檢測中性粒細胞MPO活性 收集小鼠感染第3天角膜,應用MPO試劑盒(南京建成生物工程研究所,中國江蘇)檢測各組樣本MPO活性,按試劑盒說明書步驟進行操作。在37 ℃下用酶標儀測量460 nm處吸光度值,以其作為MPO活性結果。
1.4 統計學方法
應用SPSS軟件對數據進行統計學處理。計量資料數據以±s表示,多組數據間比較采用單因素方差分析、雙因素析因方差分析或重復測量設計方差分析,兩兩比較采用Bonferroni檢驗;兩組間比較采用t檢驗。P<0.05表示差異有統計學意義。
2 結果
2.1 AU對細胞的毒性評估
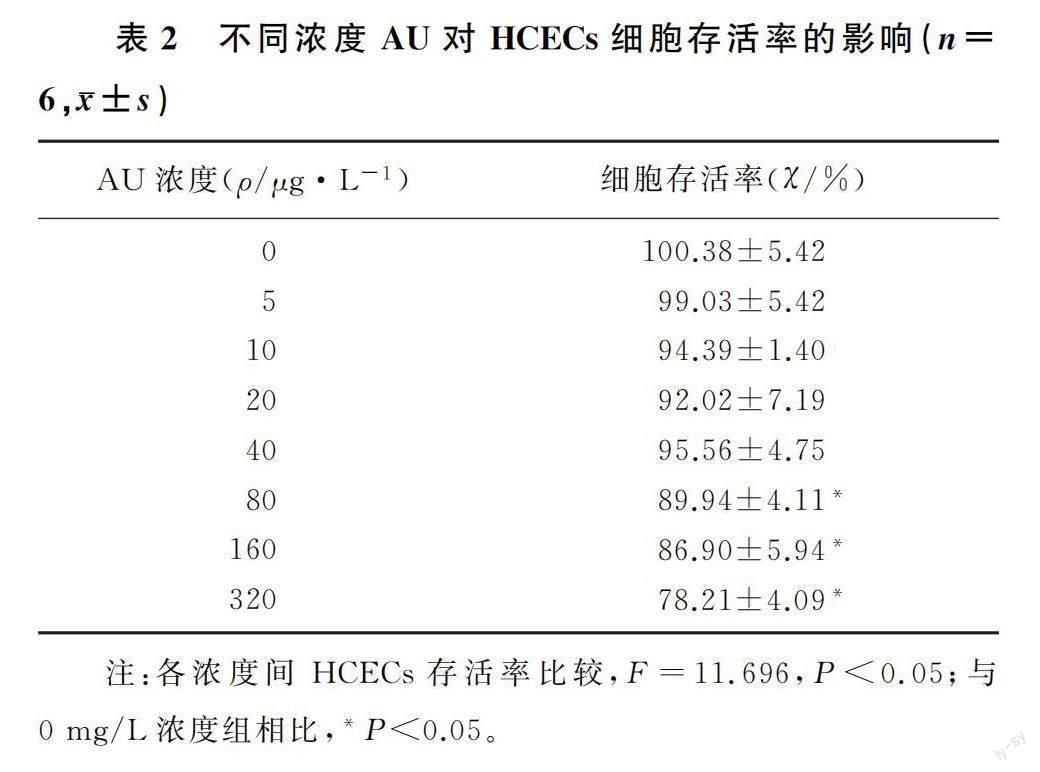
CCK-8實驗顯示,各處理組之間HCECs存活率差異有統計學意義(F=11.696,P<0.05)。濃度為80、160、320 mg/L的AU處理降低了HCECs存活率(P<0.05),濃度≤40 mg/L的AU處理對HCECs存活率無影響(P>0.05)。見表2。
2.2 AU對AF性角膜炎的嚴重程度和中性粒細胞的影響
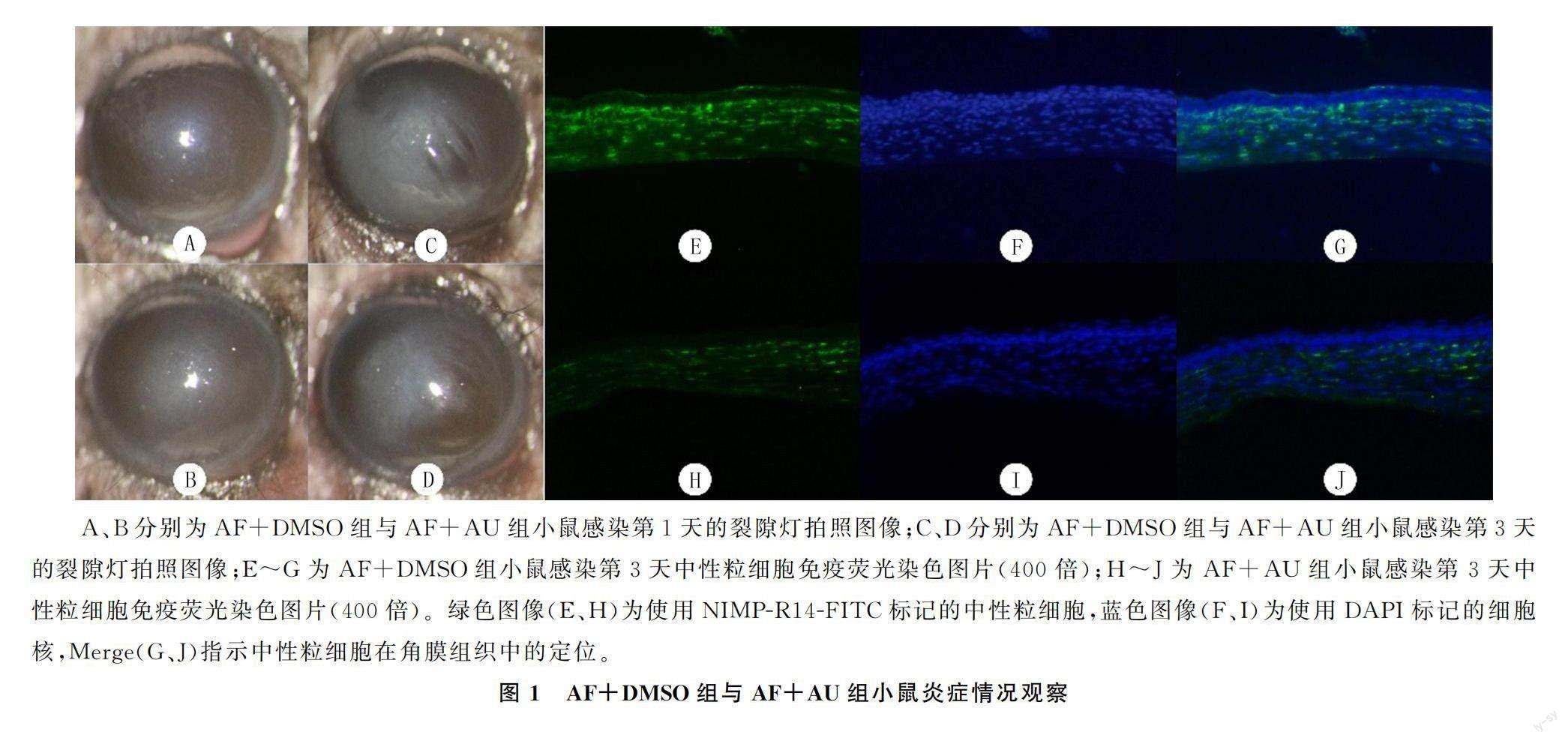
裂隙燈觀察顯示,與AF+DMSO組相比,感染第3天AF+AU組小鼠角膜潰瘍面積減少,混濁程度減輕(圖1A~D)。重復測量設計方差分析顯示,時間、組別、時間與組別的交互作用對臨床評分均有影響(F時間=91.207,F分組=16.200,F時間×分組=20.862,P<0.01)。單獨效應分析顯示,感染第1天AF+AU組與AF+DMSO組臨床評分差異無統計學意義(F=0.385,P>0.05);感染第3天AF+AU組臨床評分較AF+DMSO組降低,差異有統計學意義(F=35.714,P<0.001);感染第3天AF+DMSO組、AF+AU組小鼠臨床評分與第1天相比均明顯提高(F=99.655、12.414,P<0.01)。見表3。免疫熒光染色檢測顯示,AF+AU組小鼠角膜中性粒細胞浸潤少于AF+DMSO組(圖1E~J)。MPO實驗結果顯示,經過AU處理后小鼠角膜中性粒細胞活性小于AF+DMSO組,差異有統計學意義(t=9.882,P<0.001)。見表3。
2.3 AU對小鼠AF角膜炎中炎癥相關因子IL-1β、IL-6 mRNA表達的影響
析因設計方差分析顯示,AU處理、AF處理、AU與AF處理的交互作用對IL-1β和IL-6的mRNA表達均有影響(FAU=23.154、34.673,FAF=41.883、82.697,FAU×AF=23.173、34.942,P均<0.001)。單獨效應分析顯示,不用AF處理時,AU處理與不處理的小鼠炎癥因子IL-1β和IL-6的mRNA表達差異無統計學意義(P>0.05);不用AU處理時,AF處理與不處理相比IL-1β和IL-6mRNA表達上升,差異有統計學意義(F=57.595、128.336,P<0.001);用AF處理時,感染第3天時AU處理與不處理相比小鼠角膜IL-1β和IL-6的mRNA表達明顯下降,差異有顯著性(F=59.356、110.224,P<0.001);用AU處理時,AF處理與不處理相比小鼠IL-1β mRNA表達水平差異有統計學意義(F=4.511,P<0.05),IL-6 mRNA表達水平差異無統計學意義(P>0.05)。見表4。
2.4 AU對HCECs中AF誘導的炎癥的影響
析因設計方差分析顯示,AU處理、AF處理、AU與AF處理的交互作用對Nrf2、HO-1、IL-1β和IL-6的mRNA表達均有影響(FAU=9.111~60.965,FAF=84.676~673.934,FAU×AF=9.295~47.024,P<0.01)。單獨效應分析顯示,不用AF處理時,AU處理與不處理Nrf2、HO-1、IL-1β和IL-6 mRNA差異無統計學意義(P>0.05);不用AU處理時,AF處理與不處理相比上述受體和炎癥因子的mRNA表達明顯上升,差異有統計學意義(F=19.877~538.499,P<0.001);用AF處理時,AU處理與不處理相比Nrf2、HO-1 mRNA表達明顯上升,IL-1β和IL-6的mRNA表達水平明顯下降(F=17.569~103.117,P<0.001);用AU處理時,AF處理與不處理相比Nrf2、HO-1、IL-1β和IL-6的mRNA表達水平差異均有統計學意義(F=71.630~431.986,P<0.001)。見表5。
析因設計方差分析顯示,AU處理、AF處理、AU與AF處理的交互作用對Nrf2、HO-1和IL-6蛋白表達均有影響(FAU=61.030~95.257,FAF=106.921~663.812,FAU×AF=48.953~69.333,P<0.01)。單獨效應分析顯示,不用AF處理時,AU處理與不處理相比Nrf2、HO-1和IL-6蛋白表達差異無統計學意義(P>0.05);不用AU處理時, AF處理與不處理相比上述受體和炎癥因子蛋白表達上升,差異有統計學意義(F=69.637~169.483,P<0.001);用AF處理時,AU處理與不處理相比,AU處理上調了Nrf2、HO-1蛋白表達,下調了IL-6蛋白表達,差異有統計學意義(F=109.650~146.436,P<0.001);用AU處理時,AF處理與不處理相比Nrf2、HO-1、IL-6蛋白表達差異有統計學意義(F=5.590~548.402,P<0.05)。見表6。
3 討論
真菌性角膜炎是一種具有高致盲率的嚴重角膜感染性疾病[14]。宿主炎癥反應是角膜病變破壞的重要原因之一[15]。過度免疫反應會導致角膜混濁,甚至發生角膜穿孔威脅視力[3]。AU是一種來源于傳統草藥的環烯醚萜苷,是一種具有豐富潛在來源、良好安全性和眾多有益生物活性的化合物,具有很高的潛在應用價值。
本研究結果顯示,經過AU處理的感染第3天小鼠角膜潰瘍面積減小,角膜透明度提高,臨床評分降低,提示AU對真菌性角膜炎起到保護作用。炎癥細胞尤其是中性粒細胞浸潤角膜是角膜炎結局的主要決定因素[16]。MPO是一種含陽離子血紅素的酶,存在于中性粒細胞中,炎癥激活的中性粒細胞誘導炎癥因子和MPO的釋放,進一步引起炎癥部位組織損傷,從而導致嚴重的視力損害[17-18]。既往研究表明,中性粒細胞增多會導致銅綠假單胞菌角膜炎不可逆的角膜組織破壞[19]。本研究結果顯示,AU顯著減輕了AF角膜炎中性粒細胞浸潤程度,抑制了MPO的活性。既往研究顯示,AU能夠使LPS誘導的急性肺損傷的肺組織病理損傷評分和中性粒細胞數量顯著降低,從而減輕炎癥反應[20]。本文研究結果與其一致。推斷AU通過抑制中性粒細胞募集從而在AF角膜炎中發揮抗炎作用。
本文研究還探究了AU對AF誘導的小鼠角膜和HCECs炎癥中炎癥因子表達的影響。白細胞介素-1家族(IL-1家族)的細胞因子和受體在炎癥中的作用是眾所周知的。其中IL-1β的產生與疾病嚴重程度相關,其在自身免疫性和慢性炎癥中發揮作用[21]。IL-6是先天免疫的關鍵細胞因子,其具有與宿主防御、免疫細胞調節、增殖和分化相關的廣泛的生理功能[22]。本文研究結果顯示,AF刺激能夠使HCECs和小鼠角膜中的IL-1β、IL-6等炎癥因子的表達上升,而AU能夠下調這些炎癥因子表達。有研究結果顯示,AU能夠降低LPS誘導的牛子宮內膜上皮細胞炎癥中IL-1β、IL-6的表達[23]。本文研究結果與其相一致。真菌細胞壁的主要組成部分葡聚糖是宿主細胞識別的主要病原相關分子模式[24]。研究表明,真菌β-葡聚糖通過Nrf2途徑誘導口腔角質細胞中HO-1的表達,在宿主防御口腔上皮念珠菌感染引起的應激方面發揮重要作用[25]。另有研究結果表明,在高葡萄糖誘導的糖尿病視網膜病變的細胞模型中,Nrf2/HO-1通路的激活可以保護人視網膜上皮細胞免受高葡萄糖誘導的炎癥損傷[26]。Nrf2和HO-1的激活能夠下調炎癥因子水平,從而抑制真菌性角膜炎的炎癥反應。本文研究結果顯示,AU能夠顯著上調AF誘導的HCECs中Nrf2和HO-1的表達,提示AU可能通過Nrf2/HO-1通路下調炎癥因子的表達,從而在AF誘導的炎癥中發揮抗炎作用。
綜上所述,AU能夠抑制中性粒細胞募集,減輕AF角膜炎小鼠病情嚴重程度,下調體內外炎癥因子IL-1β、IL-6的表達水平,并且AU預處理能夠激活模式識別受體Nrf2和HO-1表達,提示AU可能通過Nrf2/HO-1通路在AF誘導的炎癥過程中發揮抗炎作用。
[參考文獻]
[1]KUO M T, CHEN J L, HSU S L, et al. An omics approach to diagnosing or investigating fungal keratitis[J]. International Journal of Molecular Sciences, 2019, 20(15):3631.
[2]LAKHUNDI S, SIDDIQUI R, KHAN N A. Pathogenesis of microbial keratitis[J]. Microbial Pathogenesis, 2017,104:97-109.
[3]ANSARI Z, MILLER D, GALOR A. Current thoughts in fungal keratitis: diagnosis and treatment[J]. Current Fungal Infection Reports, 2013,7(3):209-218.
[4]ZENG X C, GUO F, OUYANG D S. A review of the pharmacology and toxicology of aucubin[J]. Fitoterapia, 2020,140:104443.
[5]ZHANG S L, FENG Z J, GAO W D, et al. Aucubin atte-nuates liver ischemia-reperfusion injury by inhibiting the HMGB1/TLR-4/NF-κB signaling pathway, oxidative stress, and apoptosis[J]. Frontiers in Pharmacology, 2020,11:544124.
[6]SHIRLEY K P, WINDSOR L J, ECKERT G J, et al. In vitro effects of Plantago major extract, aucubin, and baicalein on Candida albicans biofilm formation, metabolic activity, and cell surface hydrophobicity[J]. Journal of Prosthodontics: Official Journal of the American College of Prosthodontists, 2017,26(6):508-515.
[7]鄭杰,劉端,趙肅清,等.杜仲葉桃葉珊瑚苷的酶法提取及其抑菌活性[J].中藥材, 2012,35(2):304-306.
[8]LI Y C, HAO J C, SHANG B, et al. Neuroprotective effects of aucubin on hydrogen peroxide-induced toxicity in human neuroblastoma SH-SY5Y cells via the Nrf2/HO-1 pathway[J]. Phytomedicine: International Journal of Phytotherapy and Phytopharmacology, 2021,87:153577.
[9]ZHOU Y, LI P, DUAN J X, et al. Aucubin alleviates bleomycin-induced pulmonary fibrosis in a mouse model[J]. Inflammation, 2017,40(6):2062-2073.
[10]KANG W S, JUNG E, KIM J. Aucuba japonica extract and aucubin prevent desiccating stress-induced corneal epithelial cell injury and improve tear secretion in a mouse model of dry eye disease[J]. Molecules, 2018,23(10):2599.
[11]XIAO S N, ZHONG N S, YANG Q M, et al. Aucubin promoted neuron functional recovery by suppressing inflammation and neuronal apoptosis in a spinal cord injury model[J]. International Immunopharmacology, 2022,111:109163.
[12]BAO X W, LI J Q, REN C X, et al. Aucubin ameliorates liver fibrosis and hepatic stellate cells activation in diabetic mice via inhibiting ER stress-mediated IRE1α/TXNIP/NLRP3 inflammasome through NOX4/ROS pathway[J]. Chemico-Biological Interactions, 2022,365:110074.
[13]WU T G, WILHELMUS K R, MITCHELL B M. Experimental keratomycosis in a mouse model[J]. Investigative Ophthalmology & Visual Science, 2003,44(1):210-216.
[14]BROWN L, LECK A K, GICHANGI M, et al. The global incidence and diagnosis of fungal keratitis[J]. The Lancet Infectious Diseases, 2021, 21(3):e49-e57.
[15]THOMAS P A. Current perspectives on ophthalmic mycoses[J]. Clinical Microbiology Reviews, 2003,16(4):730-797.
[16]CARLSON E C, DRAZBA J, YANG X P, et al. Visualization and characterization of inflammatory cell recruitment and migration through the corneal stroma in endotoxin-induced keratitis[J]. Investigative Ophthalmology & Visual Science, 2006,47(1):241-248.
[17]ARATANI Y, KOYAMA H, NYUI S, et al. Severe impairment in early host defense against Candida albicans in mice deficient in myeloperoxidase[J]. Infection and Immunity, 1999,67(4):1828-1836.
[18]MITTAL M, SIDDIQUI M R, TRAN K, et al. Reactive oxygen species in inflammation and tissue injury[J]. Antioxidants & Redox Signaling, 2014, 20(7):1126-1167.
[19]RUDNER X L, KERNACKI K A, BARRETT R P, et al. Prolonged elevation of IL-1 in Pseudomonas aeruginosa ocular infection regulates macrophage-inflammatory protein-2 production, polymorphonuclear neutrophil persistence, and corneal perforation[J]. Journal of Immunology, 2000,164(12):6576-6582.
[20]潘冰冰,周勇,孔高茵,等. 桃葉珊瑚苷減輕脂多糖誘導的小鼠急性肺損傷[J]. 中南大學學報(醫學版), 2019,44(2):128-133.
[21]MIGLIORINI P, ITALIANI P, PRATESI F, et al. The IL-1 family cytokines and receptors in autoimmune diseases[J]. AutoimmunityReviews, 2020,19(9):102617.
[22]RIDKER P M, RANE M. Interleukin-6 signaling and anti-interleukin-6 therapeutics in cardiovascular disease[J]. CirculationResearch, 2021,128(11):1728-1746.
[23]GAO F, LI H T, FENG Y N, et al. Aucubin ameliorates the LPS-induced inflammatory response in bovine endometrial epithelial cells by inhibiting NF-κB and activating the Keap1/Nrf2 signalling pathway[J]. Reproduction in Domestic Animals=Zuchthygiene, 2021,56(7):972-982.
[24]LI Z, LU G, MENG G X. Pathogenic fungal infection in the lung[J]. Frontiers in Immunology, 2019,10:1524.
[25]ISHIDA Y, OHTA K, NARUSE T, et al. Candida albicans β-glucan-containing particles increase HO-1 expression in oral keratinocytes via a reactive oxygen species/p38 mitogen-activated protein kinase/Nrf2 pathway[J]. Infection and Immunity, 2018,86(4):e00575-e00517.
[26]HAO Y, GAO X F. Diosgenin protects retinal pigment epithelial cells from inflammatory damage and oxidative stress induced by high glucose by activating AMPK/Nrf2/HO-1 pathway[J]. Immunity, Inflammation and Disease, 2022,10(12):e698.
(本文編輯 黃建鄉)

