蝴蝶蘭WRKY57基因的克隆、亞細胞定位及響應脫落酸功能分析
朱飛雪, 程玉江, 郭 麗
(1. 河南農業職業學院園藝園林學院,河南中牟 451450; 2. 河南東寶園林綠化工程有限公司,河南鄭州 451450)
脫落酸(ABA)是植物體內重要的天然激素,在植物細胞分化、休眠、組織發育等過程中發揮著至關重要的作用[1]。當植物受到外部環境脅迫時,ABA的合成、轉運及分布會受到顯著影響[2]。WRKY蛋白是植物中特異的轉錄因子家族,其特征為WRKY在蛋白質序列中存在高度保守的WRKY結構域,WRKY結構域由1個保守的核心序列WRKY-GQK和1個鋅指基序組成[3]。WRKY蛋白可根據WRKY保守結構域的數量和氨基酸序列分為3型:Ⅰ型WRKY蛋白包含2個WRKY結構域,而Ⅱ、Ⅲ型WRKY皆由1個WRKY結構域組成;但不同型WRKY的鋅指基序不同,在Ⅰ、Ⅱ型WRKY蛋白的C末端具有C2H2基序,而Ⅲ型的C末端則為C2HC[4]。此外,根據序列相似性,Ⅱ型分為a、b、c、d、e 5個亞型[5]。已有研究表明,WRKY轉錄因子在應對生物脅迫和調控植物生長發育方面發揮著重要作用,然而其對植物激素的串聯反應鮮有研究涉及。
自從WRKY轉錄因子首次在蘭科植物中被發現以來,關于WRKY基因的研究主要集中于生物學進展上,多項研究證實WRKY轉錄因子參與腺毛生長、種子萌發、果實成熟、葉片衰老等過程[6-8]。Raineri等研究表明,在水分脅迫下,HaWRKY76轉基因株系和野生型向日葵轉基因植株表現出更強的抗逆性和更高的產量[9]。王茹等發現,番茄SlWRKY6轉錄因子的過表達可誘導植株細胞壁螯合重金屬,從而對植株重金屬累積具有負調控作用[10]。低溫脅迫下,馬鈴薯StWRKY15基因的過表達可顯著提高脯氨酸、可溶性糖、總蛋白含量,降低丙二醛分泌,從而減輕寒冷脅迫對植株帶來的不利影響[11]。在水稻中,OsWRKY11可被熱應激和轉基因誘導上調表達,從而增強水稻幼苗對高溫脅迫的耐受性[12]。此外,WRKY轉錄因子在病害[13]、蟲害[7,14-15]等生物脅迫方面亦發揮著重要作用。
蘭科是最大的被子植物之一,約占被子植物總量的10%,在全世界約有750屬25 000余種。目前關于蘭科植物的研究主要集中在花朵發育、色素機制、菌根共生等方面[16]。隨著分子生物學技術特別是高通量測序技術的廣泛應用,已經探索了蘭科MADS-box、MYB家族的全基因組特征和響應環境變化的功能分析[17]。蝴蝶蘭(Phalaenopsisaphrodite)是我國栽培的重要蘭科植物,具有較高的觀賞價值和經濟價值。然而,該品種的過度挖取和生態環境惡化,使得蝴蝶蘭種質資源和生存環境維護日趨嚴峻[18]。WRKY家族是植物中最大的超家族之一,然而對蘭科植物WRKY轉錄因子的結構及功能卻知之甚少。基于此,本研究從蝴蝶蘭中克隆并分析了PaWRKY57基因,探索了該基因的理化特性、亞細胞定位、組織表達、響應脫落酸的功能分析,旨在為蝴蝶蘭的育種和遺傳改良提供理論依據。
1 材料與方法
1.1 植物材料處理
試驗于2021年6—10月在河南農業職業學院人工氣候室中進行。蝴蝶蘭品種為滿天紅,為河南東寶綠化工程園林有限公司培養的二年生組培苗。供試野生型擬南芥(Arabidopsisthaliana)種子為擬南芥Col-0生態型,過表達擬南芥種子為PaWRKY57轉化型,供試煙草品種為本氏煙草(Nicotianabenthamiana),購自福州愛若莎生物科技有限公司。供試脫落酸(ABA,C15H20O4)購自Sigma-Aldrich化工試劑公司。供試培養基質為泥炭、蛭石按體積比2 ∶ 1復配。
將二年生的蝴蝶蘭組培苗置于75%相對濕度的人工氣候室中培養,光—暗周期為16 h—8 h,光照度為150 μmol/(m2·s),晝、夜溫度分別為26、22 ℃;并在0、2、4、8、12、24、48 h取樣保存于 -80 ℃ 環境。用于瞬時轉化的本氏煙草培養環境同蝴蝶蘭組培苗。
將野生Col-0生態型擬南芥種子置于裝滿培養基質的缽體中,標記為WT,基質含水量為75%,轉移至人工氣候室中。相關過表達轉化品系培養方式同Col-0生態型。對于過表達擬南芥的外源脫落酸處理:采用10 mmol/L ABA噴灑擬南芥的葉子直至滴落,并在處理后0、12、24、48 h取樣。
1.2 WRKY基因克隆及序列分析
1.2.1WRKY基因的克隆 采用MiniBEST Plant RNA 提取試劑盒[TaKaRa,寶生物工程(大連)有限公司]對蝴蝶蘭進行總RNA提取,采用PrimeScript RT Master Mix試劑盒[TaKaRa,寶生物工程(大連)有限公司]逆轉錄合成第一鏈cDNA,將cDNA稀釋100倍以適合PCR反應,引物由Oligo5.0軟件根據PaWRKY57基因序列設計(表1),并通過RT-PCR克隆全長PaWRKY57基因。PCR反應程序如下:94 ℃ 3 min;98 ℃ 10 s,56 ℃ 15 s,72 ℃ 30 s,32個循環;72 ℃ 5 min。PCR產物采用2%瓊脂糖凝膠電泳檢測其質量和純度。將擴增的片段純化并連接到pEASYBlunt載體,然后將該載體轉化到Trans5α細胞中,并測試其克隆陽性反應。

表1 qRT-PCR引物序列信息
1.2.2WRKY基因的序列分析 通過Expasy系統(http://web.expasy.org/compute_pi/)在線預測氨基酸序列的物理和化學性質,包括分子量和等電點[19]。使用WOLF PSORT (http://www.genscript.com/psort/wolf_psort.html)對蛋白質亞細胞定位進行在線預測。使用SMART(http://smart.embl-heidelberg.de/)對保守域進行在線預測。多序列比對通過Clustal W (http://www.clustal.org/clustal2/)和DNAMAN5.0軟件(Lynnon Biosoft,https://www.lynnon.com/dnaman.html)進行。AtWRKY和OsWRKY轉錄因子的氨基酸序列從TAIR 9.0 (http://www.arabidopsis.org/index.jsp)和植物轉錄因子數據庫(http://planttfdb.cbi.pku.edu.cn/)下載。采用MEGA 7.0軟件的鄰接法(NJ)構架系統發育樹,bootstrap設置為1 000[20]。
1.3 亞細胞定位測定
利用在線軟件Plant-mPLoc 9.0(http://linux1.softberry.com/all.htm)和Cell-PLoc 2.0軟件[21](http://www.csbio.sjtu.edu.cn/bioinf/Cell-PLoc-2/)對蝴蝶蘭PaWRKY57蛋白進行亞細胞定位。根據PaWRKY57序列設計不含有終止密碼子(ORF)的XbaI/SmaI酶切位點特異性引物(表1),并以蝴蝶蘭cDNA為模板進行PCR擴增,利用雙酶切技術(NEB)將產物與pBI121-綠色熒光蛋白(GFP)載體用T3連接酶連接,最終構建pBI121-GFP ∶PaWRKY57融合表達載體。將新鮮的表達載體轉化到根癌農桿菌菌株GV3101中,5 000 r/min離心10 min,棄上清,在沉淀物中加入新鮮的煙草浸潤緩沖液(0.15 μmol/L乙酰丁香酮、10 mmol/L MgCl2、10 mmol/L MES(嗎啉乙磺酸),pH值為5.6),最終D600 nm調節為0.8。室溫靜置2 h后接種至5葉齡的健康本式煙葉表皮。采用共聚焦激光掃描顯微鏡(LSM710,Carl Zeiss,Jena,德國)觀察。
1.4 實時定量PCR分析
采用同基因克隆方式提取植物RNA,合成cDNA,使用ChamQ SYBR qPCR Master Mix(南京諾唯贊生物科技股份有限公司)在Step One Plus實時PCR系統(Thermo Fisher,Waltham,MA,美國)上進行RT-qPCR分析。反應程序如下:95 ℃ 5 min;95 ℃ 15 s,60 ℃ 60 s,40個循環。在分析PaWRKY57的表達水平時,使用蝴蝶蘭的18S-1300作為內參基因(表1)。qRT-PCR結果采用2-△△CT算法進行相對表達量分析。
1.5 PaWRKY57的擬南芥植株轉化
pBI121-35S ∶PaWRKY57通過根癌農桿菌介導的花朵浸泡法轉化擬南芥[13]。感染擬南芥花朵45~60 s后,在黑暗中培養20 h,在含有50 mg/L卡那霉素(C18H38N4O15S)的MS培養基上篩選轉基因種子,并將傳代植物用于進一步試驗。
1.6 轉化植株葉綠素含量及內源性技術含量測定
葉綠素含量(葉綠素a、葉綠素b)測定皆采用乙醇丙酮浸提法,采用紫外分光光度計(UV-1800,上海美譜達儀器有限公司)在663、646 nm處測定,具體步驟參照李合生的方法[22]。采用酶聯免疫吸附試驗(ELISA)測定擬南芥葉片中內源激素脫落酸(ABA)、油菜素內酯(BR)、赤霉素(GA)、吲哚乙酸(IAA)的含量,具體步驟參考Xu等所述[23]。
1.7 數據處理與統計分析
采用Microsoft Excel 2020對試驗數據進行整理,采用SPSS 23.0軟件進行單因素方差分析(ANOVA),采用鄧肯氏多重比較進行統計分析(α=0.05),采用Origin 2022進行圖形繪制。
2 結果與分析
2.1 蝴蝶蘭PaWRKY57基因克隆及蛋白質理化性質分析
以蝴蝶蘭cDNA為模板用PaWRKY57的特異性引物PaWRKY57-F/R進行PCR擴增,然后采用2%瓊脂糖凝膠電泳檢測,得到全長2 049 bp的特異性條帶(圖1-A)。PaWRKY57具有1個開放閱讀框(ORF),編碼682個氨基酸。利用Expasy在線工具預測結果表明,PaWRKY57蛋白的理論等電點為6.17,分子質量為76 416.43 ku,不穩定指數為45.24,脂肪系數為45.79,平均親水性系數為 -0.906,顯示PaWRKY57蛋白是一種不穩定的親水蛋白。二級結構由19.50%的α-螺旋、15.25%延伸鏈、4.84%β-轉角和60.41%的無規則卷曲結構組成(圖1-B)。
2.2 蝴蝶蘭PaWRKY57基因序列和系統發育樹分析
根據SMART在線工具分析,選取與PaWRKY57同源植物的WRKY保守結構域構建系統發育樹。結果表明,PaWRKY57與WRKY家族Ⅲ型的水稻OsWRKY45,擬南芥的AtWRKY30、AtWRKY41、AtWRKY53、AtWRKY70進行序列對比,發現其皆具有WRKY家族典型的“WRKYGQK”域,表明PaWRKY57屬于Ⅲ型家族(圖2-A)。為進一步確定PaWRKY57的分類地位,采用MEGA 7.0軟件對WRKY之間的進化關系進行系統發育樹分析,結果顯示13個蝴蝶蘭WRKY轉錄因子分別屬于Ⅲ型(PaWRKY70、PaWRKY57、PaWRKY53)、Ⅰ型(PaWRKY2、PaWRKY3、PaWRKY24、PaWRKY4)、Ⅱa型(PaWRKY40)、Ⅱb型(PaWRKY31)、Ⅱc型(PaWRKY49)、Ⅱd型(PaWRKY21、PaWRKY11)、Ⅱe型(PaWRKY65)。總而言之,確定PaWRKY57屬于Ⅲ型亞家族(圖2-B)。
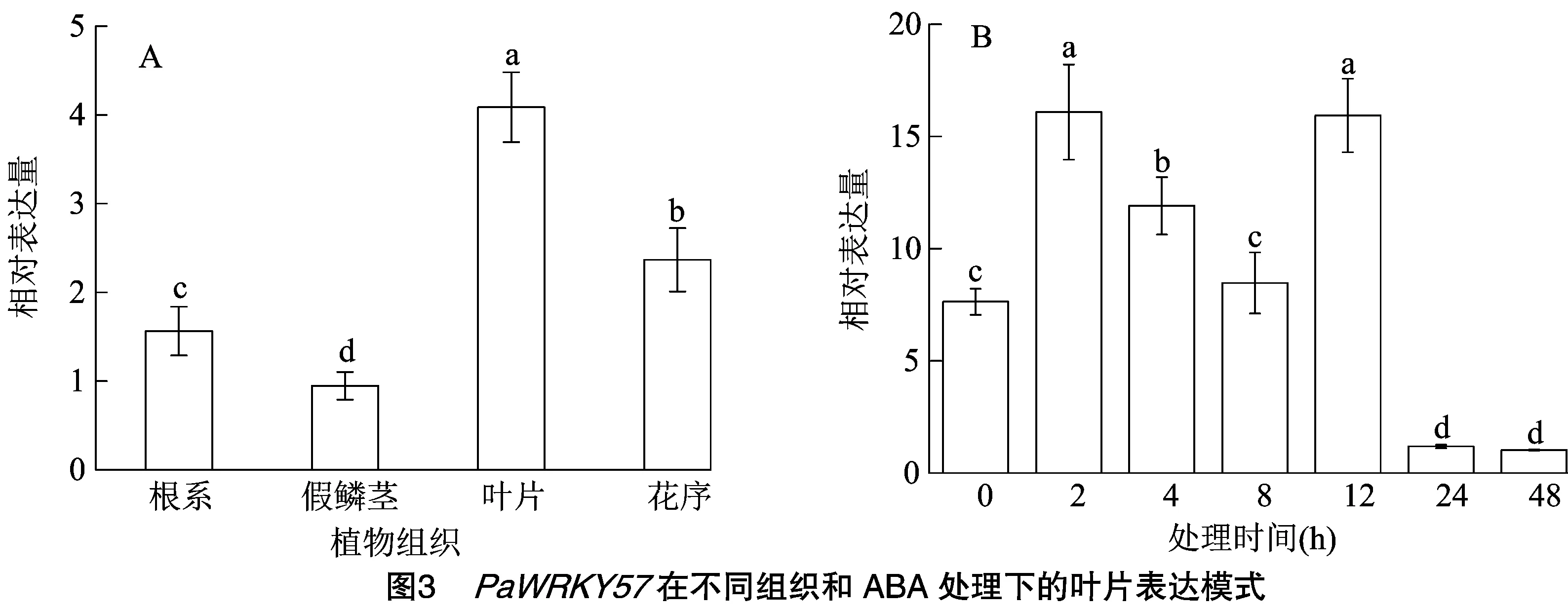
2.3 PaWRKY57在不同組織和ABA處理下的葉片表達模式
基因表達模式通常與基因功能密切相關。為了更好地了解PaWRKY57的功能,分析了其在蝴蝶蘭不同組織(根系、假鱗莖、葉片、花朵)中的表達水平。結果表明,PaWRKY57基因在所有組織中都有陽性表達,但在這4個器官中表現出不同的表達水平,其中在假鱗莖中表達水平最低,在葉片中相對表達量最高(圖3-A),表明PaWRKY57與葉片發育最為相關。作為一種植物激素反應因子,PaWRKY57對外源性脫落酸反應強烈,噴施ABA后PaWRKY57的表達水平顯著增加,并在處理后2 h達到峰值,而其在12 h的表達水平與2 h相當,此后急劇下降(圖3-B),這種“升—降—升—降”的表達模式表明PaWRKY57與外源脫落酸之間存在較為復雜的調控關系。
2.4 PaWRKY57的亞細胞定位
為了在蛋白質水平上探索PaWRKY57在細胞中的可能駐位點,借助在線分析工具WoLF PSORT預測了PaWRKY57蛋白的分布位置。如圖4所示,PaWRKY57可能存在于細胞核中;為了確定PaWRKY57的亞細胞準確位置,構建了一個PaWRKY57 ∶ GFP融合蛋白,通過農桿菌介導浸潤在本氏煙草中瞬時表達。結果表明,在激光共聚焦顯微鏡下,細胞核DNA被二脒基-2-苯基吲哚的藍色熒光(DAPI)染色,PaWRKY57 ∶ GFP綠色熒光與藍色熒光大部分重疊,表明PaWRKY57位于細胞核內。
2.5 過表達PaWRKY57及響應ABA處理的表型分析
選擇來自T2代的獨立轉基因系進行表型觀察。通過觀察擬南芥的整個生長周期,發現過表達PaWRKY57的轉基因植株比野生生態型(WT)植株開花更早(圖5-A),同時葉片衰老黃化更迅速(圖5-B、圖5-C),噴施ABA進一步加快了葉片的衰老;即相同培養周期內,過表達PaWRKY57或過表達噴施ABA其葉形無明顯變化,但葉黃化更明顯。為此測定了植株葉片葉綠素含量,結果表明,PaWRKY57過表達以及噴施ABA條件下均顯著降低了擬南芥葉片葉綠素a、葉綠素b含量(圖5-D~E)。在葉綠素a與葉綠素b含量比值中,轉基因與野生型擬南芥無明顯差異,且均顯著低于 ABA+PaWRKY57處理(圖5-G)。綜上,過表達PaWRKY57使植株生長史時間縮短,在此基礎上噴施ABA則加速葉片衰老。
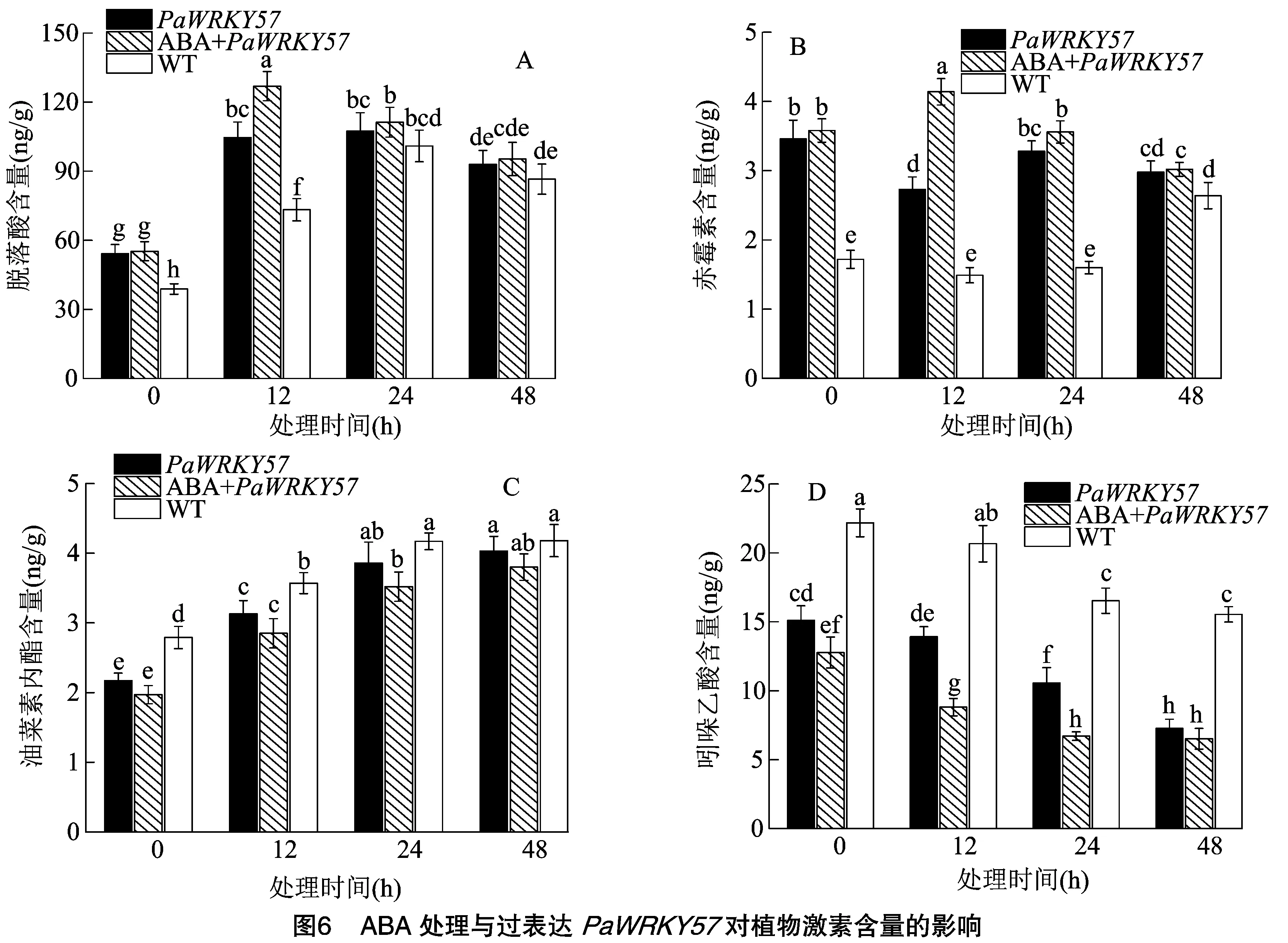
2.6 ABA處理下過表達擬南芥葉片激素變化分析
由圖6所示,在擬南芥的葉片中檢測到了內源激素,包括脫落酸、赤霉素、油菜素內酯、吲哚乙酸。結果顯示,脫落酸噴施處理下,轉化擬南芥中的ABA、GAs含量呈相同變化趨勢,即隨著脫落酸噴施處理時間的延長,ABA、GAs含量呈先升高后降低的趨勢,脫落酸處理后各處理ABA、GAs含量均表現為ABA+PaWRKY57>PaWRKY57>WT,且ABA+PaWRKY57均在處理后12 h出現峰值,此時PaWRKY57、ABA+PaWRKY57、WT間兩兩均差異顯著(圖6-A、圖6-B)。而在脫落酸噴施處理后,各處理BR含量均呈上升趨勢,且各處理BR含量均呈WT>PaWRKY57>ABA+PaWRKY57(圖6-C)。IAA含量與BR含量存在相反變化趨勢,即隨著處理時間延長,IAA含量均呈下降趨勢,但同時各處理IAA含量均呈WT>PaWRKY57>ABA+PaWRKY57(圖6-D)。
3 討論
蝴蝶蘭為蘭科(Orchidaceae)蝴蝶蘭屬(Phalaenopsis)多年生觀賞性草本植物,蝴蝶蘭以其花姿優美、葉色翠綠、香氣馥郁、葉藝優雅等特點深受園藝愛好者喜愛[24]。本研究從蝴蝶蘭中克隆得到PaWRKY57蛋白,生物學信息表明:PaWRKY57理論等電點為6.17,分子質量為76 416.43 ku,脂肪系數為45.79,且不穩定指數大于40(45.24)、平均親水性系數為負值(-0.906)。根據Expasy系統標準判別顯示,PaWRKY57蛋白是一種不穩定的親水蛋白[19]。
本研究序列對比分析表明,蝴蝶蘭WRKY蛋白存在完整的WRKYGQK序列。前人研究發現不同植物WRKY轉錄因子的基序保守序列不同,而被子植物進化而來的WRKY蛋白發生突變、存在大概率事件[25]。然而,本研究中PaWRKY57結構域的核心序列不包含突變序列(圖2-A),表明PaWRKY57結構域高度保守且其氨基酸序列在進化過程中沒有發生大量變化。系統發育分析顯示PaWRKY57、AtWRKY53等隸屬于WRKY轉錄因子家族的Ⅲ型家族;而PaWRKY57、OsWRKY47同屬一個小分支中,說明兩者在功能上可能與水稻OsWRKY47相似。基于雙酶切技術構建pBI121-GFP ∶ PaWRKY57融合表達載體,雙熒光染色分析顯示在本氏煙葉葉片中PaWRKY57存在于細胞核內。
基因表達模式是反映基因功能表達導向的重要指標,在植物組織中高表達的WRKY家族往往主導該組織的生長發育[26]。如編碼擬南芥WRKY轉錄因子的TESTA GLABRA2(TTG2)早期存在于種皮中,而進入生長期后則主要在葉片中表達[27]。擬南芥WRKY轉錄因子家族的37個成員中有32個存在于葉片表達域中,表明WRKY在葉細胞成熟中發揮特殊作用[28]。本研究中,組織表達分析表明,PaWRKY57在根系、假鱗莖、葉片、花序中均有表達,但在葉片中的表達水平顯著高于其他組織,表明其在葉片相關生理調控中扮演著重要角色。脫落酸噴施處理下葉片PaWRKY57表現出“升—降—升—降”的表達模式,同時在噴施ABA后PaWRKY57基因在2、12 h具有最高的表達水平;雙峰的表達模式意味著ABA在誘導PaWRKY57的過程中可能存在多激素潮汐式的波動影響[29]。
WRKY轉錄因子在植物生長發育中的作用已被眾多研究證實,最新的研究發現WRKY在植物葉片衰老、矮化等表型的形態建成方面起著關鍵作用[30]。一些研究表明,擬南芥AtWRKY53在葉片衰老早期顯著上調,其在轉基因擬南芥植物中的過表達加速了葉片衰老進程,而沉默AtWRKY53則延緩了葉片衰老[31]。Besseau等研究發現,敲除AtWRKY54、AtWRKY70的雙突變體植株衰老更快[32]。為進一步研究PaWRKY57轉錄因子的功能,通過花浸泡法獲得過表達PaWRKY57植株,與WT擬南芥相比,同一培養期內,過表達PaWRKY57的轉基因植物開花提前且葉片黃化明顯,表明該基因的過表達可能正調控植物的衰老過程。
ABA是WRKY調控網絡中的關鍵節點之一,在轉錄信號通路中充當催化劑或抑制劑[33]。茶樹的CsWRKY2基因在葉片中的表達量較高,ABA信號通路通過調控CsWRKY2基因在植物對寒冷和干旱脅迫的響應中發揮重要作用[34]。鐵皮石斛的DoWRKY5抑制ABI5基因響應ABA的表達,并與ABAR調節因子負調控ABA信號轉導通路[35]。本研究中,在轉基因植株上噴施ABA,轉基因植株葉片黃化加劇、葉綠素a/b含量比值更高;此外,液相色譜分析顯示,噴施ABA條件下過表達植株抑生型激素(ABA、GAs)含量更高,而促生長激素(BR、IAA)含量更低。表明PaWRKY57是一個衰老基因且對ABA反應敏感,ABA作為促進劑正向調控著PaWRKY57的功能表達。
4 結論
本研究表明,蝴蝶蘭PaWRKY57是一種不穩定的親水性蛋白,具有一個開放閱讀框(ORF),編碼682個氨基酸。亞細胞定位顯示,PaWRKY57蛋白位于細胞核中,根據其預測的亞細胞定位可能在細胞內發揮作用。結構域分析和同源性比較表明,PaWRKY57蛋白具有WRKYGQK結構域,屬于WRKY家族Ⅲ型家族,系統發育分析表明PaWRKY57與水稻OsWRKY47在生物學功能上密切相關。實時熒光PCR分析顯示,PaWRKY57在根系、假鱗莖、葉片、花序中表達,在葉片中表達量最高,且在ABA處理下波動較大。與野生型擬南芥品系(WT)相比,PaWRKY57過表達品系的生育周期縮短、葉片黃化嚴重、葉綠素含量降低、促生型植物激素含量降低、抑生型植物激素含量增加。綜上,PaWRKY57是一個響應ABA信號的轉錄因子,可能參與了ABA信號介導調控的蝴蝶蘭衰老過程。期待研究結果可為進一步研究PaWRKY57的功能和為未來蝴蝶蘭的遺傳改良與培育提供理論依據。

