不同豆角品種生長期及發(fā)芽處理對其皂苷含量的影響
管婷婷,寇 宇,張一婷,劉大軍,宋 永,孫慶申,
(1.黑龍江大學生命科學學院,農業(yè)微生物技術教育部工程研究中心,黑龍江省寒地生態(tài)修復與資源利用重點實驗室,黑龍江省普通高校微生物重點實驗室,黑龍江哈爾濱 150080;2.河北環(huán)境工程學院,河北省農業(yè)生態(tài)安全重點實驗室,河北秦皇島 066102;3.黑龍江大學現代農業(yè)與生態(tài)環(huán)境學院,黑龍江哈爾濱 150080)
油豆角是我國東北地區(qū)(黑龍江、吉林為主)特有的一種優(yōu)質菜豆品種[1],富含蛋白質、胡蘿卜素,營養(yǎng)價值高,口感好,具有促進胃腸蠕動、健脾補腎等功效。此外,油豆角中還含有皂苷類物質,主要為三萜類皂苷[2]。三萜皂苷主要通過乙酸/甲羥戊酸途徑合成,一般可劃分為3 個階段:合成異戊烯基焦磷酸(IPP)和二甲基烯丙基焦磷酸(DMAPP);由異戊烯基轉移酶和萜類環(huán)化酶催化IPP 和DMAPP 形成2,3-氧化鯊烯;2,3-氧化鯊烯依次經過環(huán)化、羥基化、糖基化修飾后最終形成三萜類皂苷[3-5]。
油豆角中皂苷主要由三萜皂苷元與糖組成,常見的糖有葡糖糖、半乳糖、鼠李糖等[6]。目前,采用超聲波輔助法[7]、正丁醇萃取[2]等方法來提取油豆角中皂苷,具有效率高、操作簡便、避免溶劑損失等特點。研究表明,品種、生長周期、生長部位等客觀條件會使油豆角等植物中皂苷含量發(fā)生改變[1]。這些皂苷具有多種重要的生物活性和廣泛的藥理作用,如降血脂、降血糖、抗癌、抗炎、抗過敏、抗氧化、治療白血病、抗病毒、防治心腦血管疾病等[6,8]。在生產生活中常被用于制作清潔劑、發(fā)泡劑和乳化劑等[9]。因此,對油豆角中皂苷類物質的開發(fā)具有重要的價值。
本文以東北油豆角為原料,分析不同時期豆莢及種子的皂苷含量,明確豆角皂苷含量與生長期的關系及存在的部位;對發(fā)芽聯(lián)合鹽脅迫后豆角種子皂苷含量的變化進行測定,探究豆角種子通過發(fā)芽聯(lián)合鹽脅迫處理后皂苷含量變化。利用UHPLC-Q-TOFMS 得到的精確相對分子質量,對照文獻數據庫,對豆角中的皂苷類成分進行鑒別,為開發(fā)油豆角深加工產品種類提供數據支持。
1 材料與方法
1.1 材料與儀器
豆角(金冠、綠冠、盛冠、紫冠、青冠、滿堂彩、哈15 號)均摘自黑龍江大學呼蘭校區(qū)園藝基地;人參皂苷Rg1 標準品 上海創(chuàng)賽科技有限公司;氯化鈉、冰醋酸、香草醛、高氯酸 均為分析純,天津科密歐試劑有限公司;AM-P996 型Parafilm 封口膜無錫德凡儀器有限公司。
A560 型雙光束紫外可見分光光度計 翱藝儀器上海有限公司;DZKW-D-2 型恒溫水浴鍋 天津天泰儀器有限公司;SB-5200DT 型超聲波清洗機信儀儀器有限公司;FW100 型高速萬能粉碎機 天津泰斯特有限公司;Agilent1290-G6470 型三重四極桿液質聯(lián)用儀 上海安捷倫科技有限公司。
1.2 實驗方法
1.2.1 樣品采集 在2022 年6~8 月于黑龍江大學呼蘭校區(qū)采摘金冠、綠冠、盛冠等7 個品種東北油豆角,在開花10~40 d 內每間隔五天采樣,每個品種各取樣100 g,平行取樣三份,在采摘過的植株上掛簽,實現對同株豆角在不同生長期進行采摘跟蹤。
1.2.2 豆角總皂苷的提取、含量測定
1.2.2.1 原料制備 開花后10、15 d 的豆角,因種子較小,難以分開,所以這兩個時期測定的是整個豆角中皂苷的含量;對開花后20 d 及以后的豆角,取不同生長期新鮮豆角的豆莢和種子剝離,置于60 ℃烘箱內烘干至恒重,用高速萬能粉碎機將其分別粉碎,過80 目篩備用。
1.2.2.2 豆角總皂苷的提取 參照劉寧等[7]的方法,采用超聲輔助提取法提取豆角總皂苷。準確稱取1 g 豆角粉末于燒杯中,加入15 mL70%乙醇溶液,用封口膜密封后放入超聲波清洗機中進行超聲輔助提取,提取時間為25、30、35、40、45 min,溫度為45 ℃,功率240 W,頻率40 kHz,得到皂苷粗提液,過濾至澄清備用。
1.2.2.3 標準曲線繪制 參照張慧穎等[10]的方法,利用人參皂苷Rg1 繪制標準曲線,取不同量的人參皂苷標準溶液(400 mg/L)于60 ℃水浴干燥。加入0.2 mL 5%香草醛冰醋酸溶液,轉動蒸發(fā)皿,使殘渣溶解,再加入0.8 mL 高氯酸,混勻后移入10 mL 比色管中,60 ℃水浴加熱15 min,取出。靜置冷卻40 min,使用冰醋酸定容,搖勻后。以1 cm 比色皿于545 nm 波長處測定其吸光度。以皂苷質量為橫坐標,吸光度為縱坐標,繪制人參皂苷Rg1 標準曲線方程如下:Y=2.3223X-0.0075(R2=0.9965)。
1.2.2.4 樣品中皂苷含量測定 準確吸取1 mL 皂苷粗提液于蒸發(fā)皿中,按照標準曲線的制備過程,在545 nm 波長處測定其吸光度,總皂苷含量計算公式如下:
式中:C 為由提取液吸光度值代入標準曲線回歸方程得出的總皂苷質量(mg);m 為豆角粉末質量(g);Vm為樣液定容后體積(mL);V0為測定所用樣液體積(mL)。
1.2.3 添加氯化鈉對豆角種子發(fā)芽過程中皂苷含量的影響 參照趙露等[11]的方法,對金冠、滿堂彩種子進行發(fā)芽處理。取一定量豆角種子,清洗后用蒸餾水浸泡過夜,將紗布平鋪于培養(yǎng)皿的底部,每皿擺放100 粒精選種,加入適量蒸餾水或不同濃度的氯化鈉(0.4%、0.8%、1.2%),在28 ℃恒溫培養(yǎng)箱中培養(yǎng)至漏出白芽,并選取發(fā)芽1~4 d 的種子,測定皂苷含量,每個樣本做三個平行。
1.2.4 UHPLC-Q-TOF-MS 分析金冠豆角粒中皂苷的種類
1.2.4.1 待測液制備 參照侯亞楠等[12]的方法,準確稱取1 g 豆角粉末置于100 mL 燒杯中,加入15 mL 70%甲醇,45 ℃、功率240 W、40 kHz 超聲提取35 min,提取液用0.22 μm 膜過濾后供檢測分析。
1.2.4.2 色譜與質譜條件 測定儀器為三重四極桿液質聯(lián)用儀,該系統(tǒng)配備Agilent ZORBAX RRHD Eclipse Plus C18柱(2.1 mm×50 mm,1.8 μm),流動相為0.1%甲酸/水(A)和乙腈(B)。簡化洗脫條件為10%乙腈至100%乙腈5 min線性梯度洗脫。柱溫25 ℃,流速0.4 mL/min,進樣量1 μL。電噴霧質譜(electrospray ionization-mass spectrometric,ESI-MS)分析,采用電離電壓3500 V,源溫度350 ℃電噴霧電離;氮氣35 psi,氣體流速10 L/min,負離子模式下對m/z 44 到m/z 1004 進行全掃描(MS2scan)在選擇離子監(jiān)測(selected lon monitoring,SIM)檢測方式下,檢測提取物的分子離子。在碎片離子掃描方式下,檢測提取物的碎片離子。
1.3 數據處理
使用Origin 8.0 軟件對試驗所得結果進行統(tǒng)計學分析,P<0.05 表示差異顯著,所有數據均以平均值±標準差表示。
2 結果與分析
2.1 不同生長期及品種豆角皂苷含量測定
由于開花后10~15 d 表現為豆粒不飽滿,豆莢太小,因此在這兩個生長期沒有進行莢皮及種子分別提取,只對整個豆角進行皂苷含量測定,不同豆角在開花后10、15 d 時皂苷含量的動態(tài)變化見表1。其中,綠冠、盛冠、紫冠、滿堂彩隨生長周期的增加皂苷含量逐漸升高,金冠、青冠、哈15 號皂苷含量下降。

表1 不同豆角在開花后10、15 d 時皂苷含量的動態(tài)變化Table 1 Changes of saponin contents in different beans at 10,15 d post blooming
圖1 是豆角開花后20~40 d 豆莢和豆角粒中皂苷含量的動態(tài)變化,金冠、綠冠豆角種子皂苷含量都在20 d 便達到最高值,但金冠和綠冠種子莢皮中皂苷含量分別在30 d 和20 d 時達到峰值,且豆粒中的皂苷含量顯著高于莢皮(圖1A,圖1B)。盛冠和青冠種子和莢皮皂苷含量在25 d 時顯著高于其它生長期,但盛冠和青冠種子莢皮中皂苷含量分別在25 d和35 d 時達到峰值(圖1C,圖1D)。紫冠、哈15 號種子皂苷含量在30 d 時含量顯著高于其它生長期,但紫冠和哈15 號種子莢皮中皂苷含量分別在25 d和20 d 時達到峰值(圖1E,圖1F),滿堂彩種子和豆莢中皂苷含量均在第35 d 達到最高值(圖1G)。
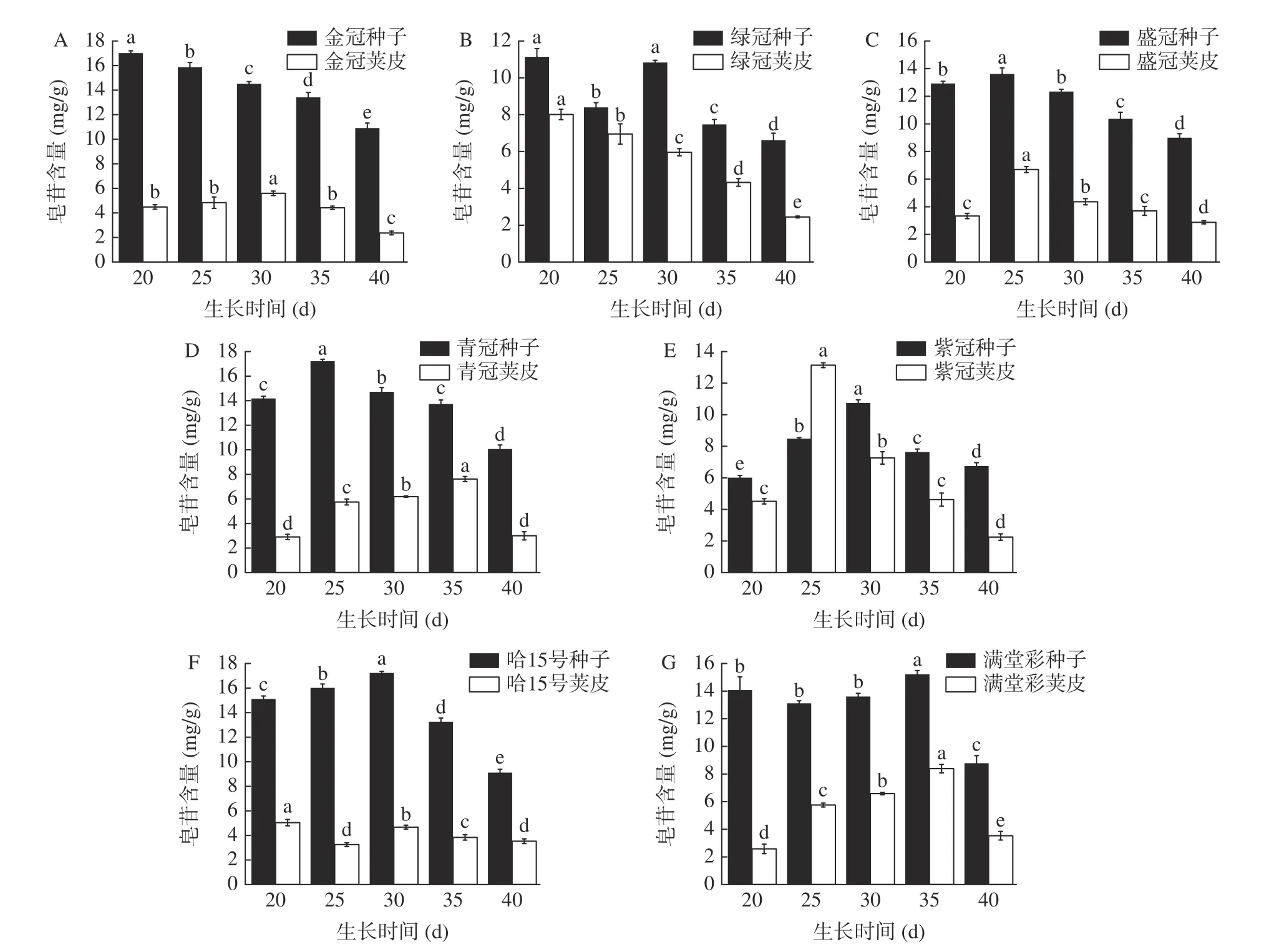
圖1 7 個品種豆角不同生長期種子及莢皮皂苷含量Fig.1 Contents of saponin in seeds and pods of seven varieties of Phaseolus vulgaris in different growth periods
本研究結果中,豆角總皂苷含量在不同部位不同生長期差別較大,種子中皂苷含量高于莢皮含量,皂苷含量都隨豆角生長先增加后降低,以20~35 d 采收質量較好。李啟照等[13]研究發(fā)現女貞不同藥用部位不同生長期薯蕷皂苷元含量有所不同。徐偉等[14]研究發(fā)現隨著生長時間的延長,美國皂莢殼皂苷的含量逐漸增加,在開花后25 d 皂苷含量達到最高后逐漸減少。均與本實驗所研究趨勢相近,其皂苷所存在位置對皂苷含量影響較大,隨生長時間的延長出現先升高后下降的趨勢。因此可以確定豆角皂苷主要存在部位為豆角種子中,且在不同生長期含量差別較大。因為隨著豆角生長周期的延長,經過甲酸戊醛代謝途徑等一系列反應最終形成三萜皂苷類化合物,使皂苷含量升高,達到峰值后,由于溫度升高,豆角內部水分大量流失,皂苷等活性物質損失,導致其含量下降。
2.2 發(fā)芽處理對豆角種子皂苷含量的影響
本文選取在海南種植的滿堂彩豆角及東北特色品種的金冠豆角做發(fā)芽處理,由于前期測定結果得到滿堂彩及金冠兩個品種豆角中總皂苷含量較高于其他品種,而滿堂彩豆角屬于海南品種,金冠豆角是東北地區(qū)特色油豆角品種,前期課題組已對金冠豆角種子中α-淀粉酶抑制劑進行研究,為進一步探究地域差異對豆角皂苷含量的影響,因此選擇滿堂彩和金冠豆角進行發(fā)芽處理。
由圖2 可知,對于不同氯化鈉濃度處理和空白組來說,在金冠種子發(fā)芽后1~4 d,其皂苷含量相比于發(fā)芽前(12.04±0.62)mg/g 均顯著下降(P<0.05)。Huang 等[15]研究發(fā)現發(fā)芽處理3 d 后,黑皮大豆中總皂苷含量較發(fā)芽前略有降低,與本實驗結果相似。本實驗四組氯化鈉濃度處理下均在發(fā)芽后1 d 皂苷含量最高,2~3 d 含量降低,第4 d 含量升高,可以得出皂苷含量與萌芽時間密切相關。可能是由于氯化鈉濃度的改變可以在一定程度上影響植物皂苷的合成途徑,抑制了皂苷合成所需的物質代謝和關鍵酶活性(圖3)[16-17]。
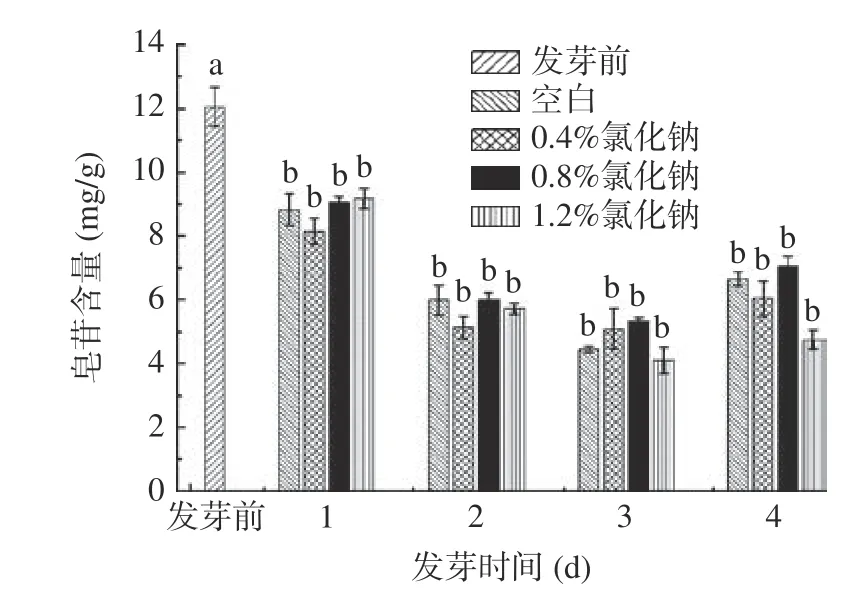
圖2 氯化鈉溶液發(fā)芽處理對金冠種子皂苷含量的影響Fig.2 Effects of sprouting treatment with sodium chloride solution on the content of saponins in Golden Crown seeds
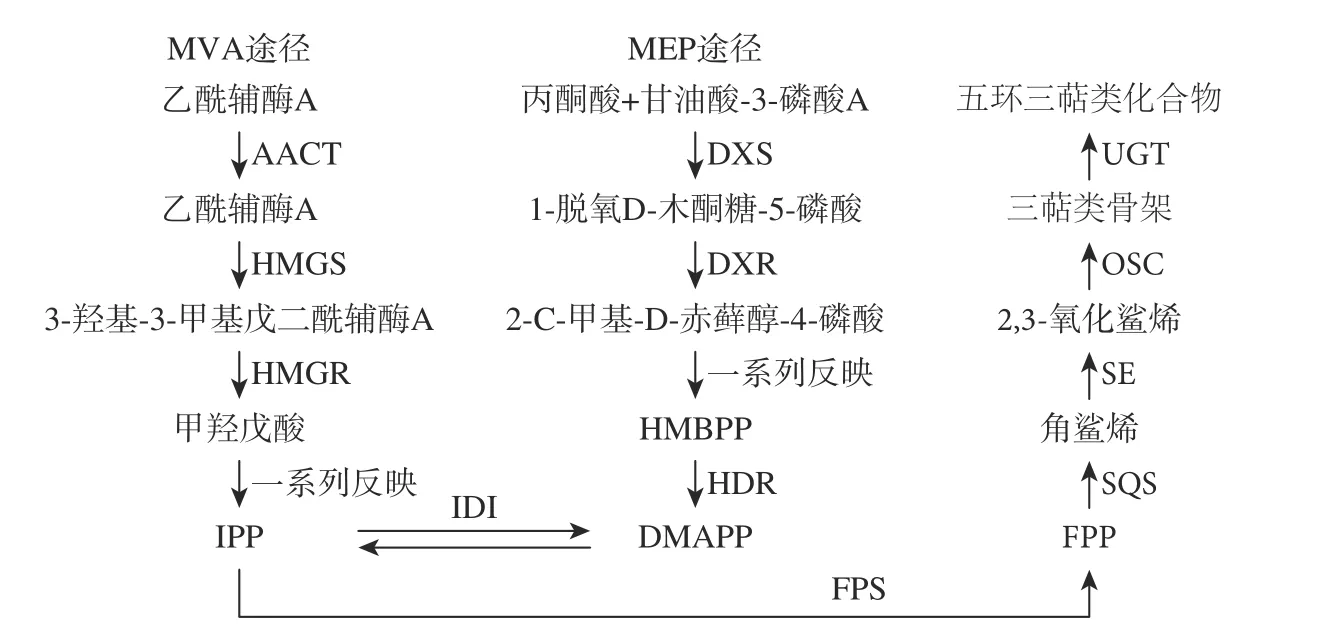
圖3 三萜皂苷類化合物合成途徑Fig.3 Synthetic pathway of triterpenoid saponins
高春霞等[18]也發(fā)現發(fā)芽4 d 后大豆中皂苷含量從2.8%增加到8.9%,與本實驗結果相似。如表2所示,本實驗四種濃度處理后,皂苷含量均在發(fā)芽第2 d 下降,3 d 含量升高,4 d 含量下降,且均在3 d 時皂苷含量最高。通過發(fā)芽處理可以顯著提高滿堂彩種子皂苷含量,且皂苷含量與萌芽時間和豆角品種密切相關。Alam 等[19]和Sarkar 等[20-20]采用氯化鈉等前處理方法對種子進行誘導,發(fā)現其活性物質含量增加,而本實驗隨氯化鈉濃度升高,呈先上升后下降的趨勢,可能是隨著氯化鈉濃度改變,通過調節(jié)皂苷合成酶來適應濃度改變,說明適度的鹽脅迫有利于種子生長以及豆角總皂苷的積累[21-22]。
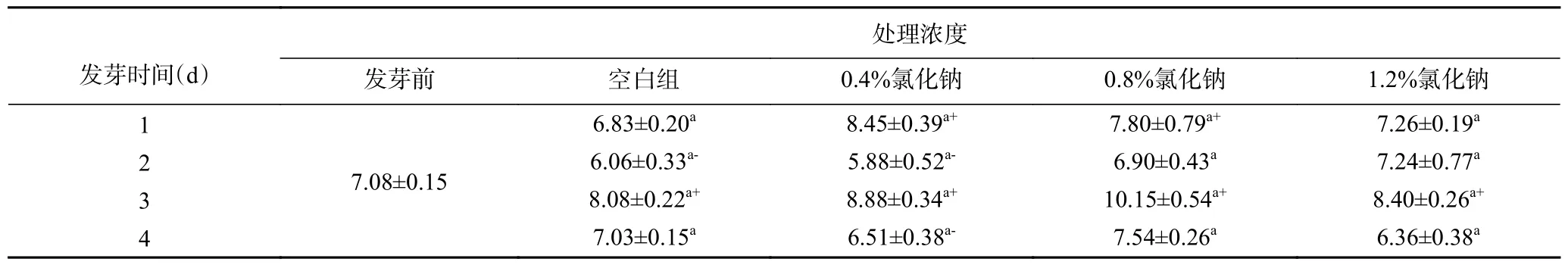
表2 氯化鈉發(fā)芽處理對滿堂彩種子皂苷含量的影響(mg/g)Table 2 Effect of sodium chloride germination treatment on saponin content of Mantangcai seeds (mg/g)
2.3 UHPLC-Q-TOF-MS 對金冠種子粗皂苷的化學成分分析
由于課題組前期對金冠豆角種子中α-淀粉酶抑制劑進行研究,為進一步挖掘金冠豆角種子的價值,因此對金冠種子粗皂苷進行液質聯(lián)用分析。
如圖4 為金冠粗皂苷在UHPLC-Q-TOF-MS 得到的質荷比與相對豐度的相關性圖。經過液質聯(lián)用對金冠種子粗皂苷進行鑒定,通過查出閱文獻建立譜庫共分析出柴胡皂苷F、赤豆皂苷II、黃芪皂苷IV等7 種皂苷,如表3 所示。
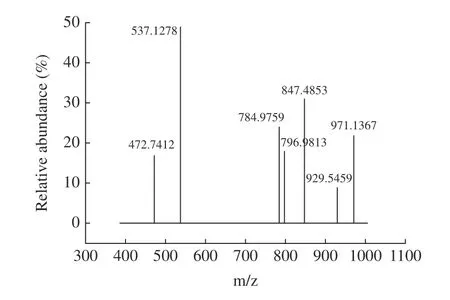
圖4 金冠種子粗皂苷在UHPLC-Q-TOF-MS 質譜圖Fig.4 Mass spectrum of crude saponin from golden crown seeds in UHPLC-Q-TOF-MS
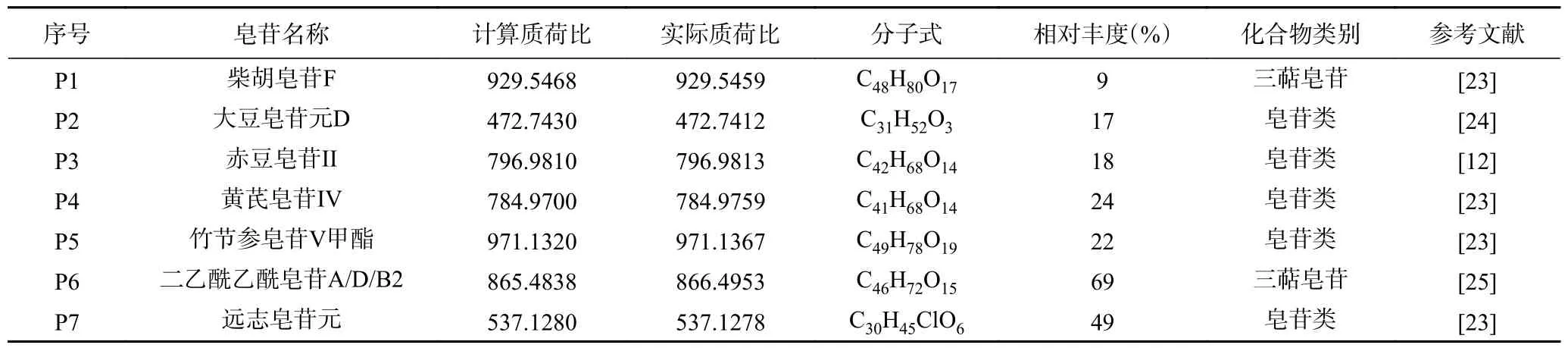
表3 金冠種子粗皂苷成分分析Table 3 Composition analysis of crude saponins in golden crown seeds
其中,柴胡皂苷F 具有抗病毒作用[26],赤豆皂苷II 具有利水消腫,解毒排膿等功效;黃芪皂苷IV 是中醫(yī)臨床上常用的中藥材,在食品、保健品、化妝品等行業(yè)具有廣泛的應用前景[27]。竹節(jié)參皂苷V 甲酯在抗炎,抗心肌缺血,保護肝損害和延緩衰老等方面具有重要的作用[28]。大豆皂苷元D 具有多種生物學活性,包括抗腫瘤,抗癌,預防肥胖和免疫調節(jié)等[29-30]。遠志皂苷元具有降低神經細胞炎癥反應的作用[31],可為緩解抗腫瘤藥物的毒副作用尋找新的突破口。
3 結論
豆角種子及莢皮中均含有皂苷類成分,且豆角種子中皂苷含量高于莢皮含量,隨著生長周期的增加豆角中總皂苷含量呈現先升高后下降的趨勢,且通過發(fā)芽處理可以顯著改變皂苷含量(P<0.05),且含量變化與萌芽時間、豆角品種密切相關。發(fā)芽時協(xié)同鹽脅迫處理可以顯著提高豆角種子中皂苷含量。通過液質聯(lián)用方法共鑒定出7 種皂苷類物質,在食品、保健品、醫(yī)療等領域具有廣泛應用前景。目前本實驗僅做了提取含量分析及活性成分鑒定,缺少應用、結構鑒定及功能評價,需要在未來進行進一步研究。

