豆血紅蛋白在釀酒酵母中的異源表達
薛常魯,張鵬飛,白麗君,肖功年,魏培蓮,
(1.浙江科技學院生物與化學工程學院,浙江杭州 310023;2.浙江省農產品化學與生物加工技術重點實驗室,浙江杭州 310023)
豆血紅蛋白(Leghemoglobin,LegH)是豆科植物 感染根瘤菌后共同產生的植物源血紅蛋白[1-2],由一條單鏈脫輔基蛋白和血紅素輔基構成,三維結構與動物血紅蛋白高度相似[3],在植物蛋白肉加工中可以作為風味催化劑和著色劑,大大增加植物蛋白肉的擬真性[4-5]。目前,LegH 主要從大豆根瘤中提取獲得,但由于工藝復雜、植物種植周期長、含量低等原因,生產成本較高,難以進行大規模生產。因此,利用微生物作為細胞工廠合成血紅蛋白是未來的發展方向[6],包括豆血紅蛋白[7-9]、人血紅蛋白[10]、豬肌紅蛋白[11]在內的多種血紅蛋白已實現異源表達[12]。以畢赤酵母作為表達宿主的LegH 已被美國食品藥品監督管理局(Food and Drug Administration,FDA)批準作為“人造肉”中的著色劑[13-15]。但目前豆血紅蛋白異源表達的相關研究主要集中于大腸桿菌和畢赤酵母[8-9]。大腸桿菌的表達量較低[16],存在形成包涵體、血紅素供應不足等問題,同時細菌內毒素會使豆血紅蛋白結合形成高鐵血紅蛋白致使蛋白純化變得更為復雜[17]。而畢赤酵母為甲醇營養型菌株,在表達過程中需要使用甲醇作為碳源和誘導表達,經超濾純化過程后并不能完全去除[15],這不僅增加了蛋白純化的難度,而且在食品中的應用帶來了潛在的安全風險。釀酒酵母被認為是GRAS(generally recognized as safe)生物,作為表達體系研究歷史悠久,已有多種血紅蛋白在釀酒酵母中實現了異源表達[18-20],而目前關于釀酒酵母表達豆血紅蛋白的研究鮮有報道。
本研究對釀酒酵母異源表達豆血紅蛋白進行了初步研究。將編碼豆血紅蛋白的LBC2的基因序列進行密碼子優化,并在N 端添加可以促進真核生物基因翻譯效率和提高基因表達水平的kozak 序列[21-22],將優化序列連接在表達載體pECS-TRP 上,通過對TEF1、ADH1、GAP、GAL1,10 不同啟動子的替換,確定啟動子與LBC2基因的適配性,成功實現了豆血紅蛋白在釀酒酵母中的表達,為釀酒酵母異源表達豆血紅蛋白提供了理論和技術參考。
1 材料與方法
1.1 材料與儀器
所涉及的菌株 見表1;表達克隆的基因 見表2;設計的引物信息 見表3;涉及的LegH 序列 經釀酒酵母密碼子優化[23](http://www.jcat.de/)后交北京擎科生物科技有限公司合成;PCR 引物(見表3)北京擎科生物技術公司合成;PrimeSTAR Max DNA Polymerase、Lysis Buffer for Microorganism to Direct PCR、DNA 限制性快切酶 北京寶日醫生物技術公司;Green Taq Mix 南京諾維贊生物科技公司;T4 DNA 連接酶、酵母基因組提取試劑盒、質粒抽提試劑盒、PCR 產物純化試劑盒、膠回收試劑盒、酵母蛋白提取試劑盒、脫脂奶粉、SDSPAGE 凝膠制備試劑盒、TBST、YNB、半乳糖、氨芐青霉素、咪唑及其他常用試劑 上海生工生物工程公司;DNA marker 北京全式金生物技術公司;Anti-His Antibody鼠單抗、超敏 ECL 化學發光液、快速轉膜液、穩定性抗體稀釋液、高效封閉液 上海七純生物科技公司;HRP-山羊抗小鼠IgG(H+I)二抗、GAPDH rabbit pAb、HRP-山羊抗兔IgG(H+I)二抗 蘇州博奧龍科技公司;Western 一抗二抗去除液 碧云天生物;HisSep Ni-NTA 6FF Chromatography Column 上海翌圣生物科技公司。

表1 本研究涉及的菌株信息Table 1 Strains used in this study

表2 本研究涉及的基因Table 2 Genes used in this study
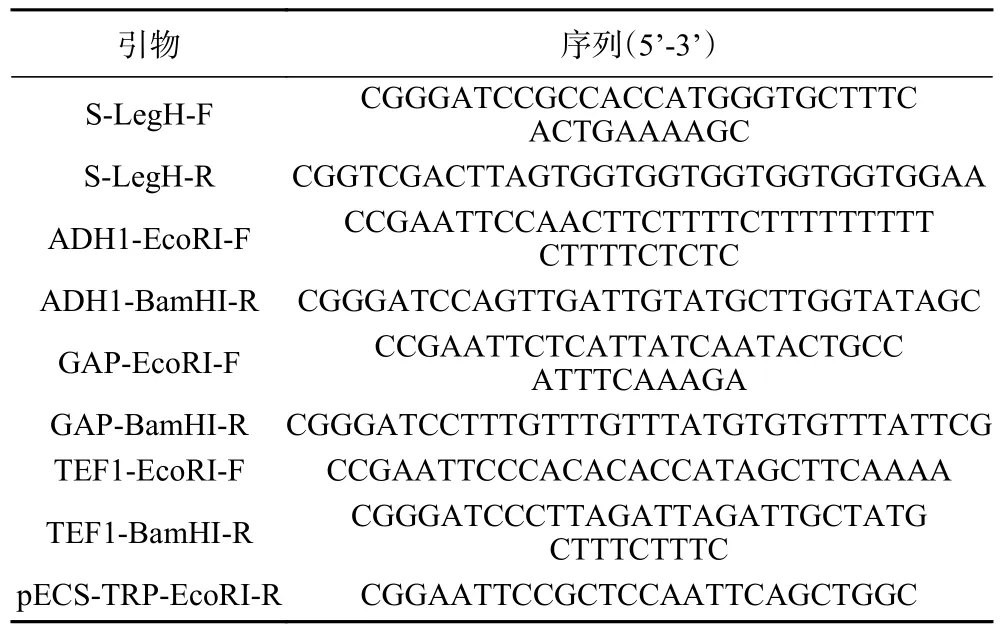
表3 本研究設計的引物Table 3 Primers designed in this study
ALLEGRA X-30R 型高速冷凍離心機 美國貝克曼庫爾特有限公司;HZQ-X300 型恒溫培養振蕩器 上海一恒科學儀器有限公司;DYY-6C 電泳儀 北京六一儀器廠;Omega Lum W 型化學發光多色熒光成像系統 環亞生物科技公司;AH100D 型高壓均質機 安拓思納米技術有限公司;SpectraMax iD3型多功能酶標儀 美谷分子儀器有限公司。
1.2 實驗方法
1.2.1 培養基的配制 LB 培養基(g/L):胰蛋白胨10,酵母提取物5,氯化鈉10;pH7.0~7.4。根據實驗需求添加2%(w/v)瓊脂粉。
YPD 液體培養基(g/L):蛋白胨20,酵母提取物10,葡萄糖20;根據實驗需求添加2%(w/v)瓊脂粉。
SC-Trp 篩選培養基(g/L):葡萄糖20,YNB5,硫酸銨1.7。添加過濾除菌的Leu、His、Ura 至終質量濃度為50 μg/mL。
1.2.2 LegH 重組表達載體構建 針對釀酒酵母對大豆血紅蛋白LBC2基因序列進行密碼子優化,并在N 端添加kozak 序列以增強基因的翻譯效率,在C端添加6×His 標簽用于后續蛋白分離純化。通過在LegH 序列上下游分別添加BamH Ⅰ和Sal Ⅰ酶切位點,將其插入pESC-TRP 質粒中,獲得誘導型pESCTRP-GAL1,10-LegH 重組表達載體。通過設計引物S-LegH-F、pECS-TRP-EcoRI-R 對質粒pESC-TRPGAL1,10-LegH 進行PCR 擴增獲得不含啟動子序列的質粒框架pESC-TRP-LegH。對S.cerevisiaeCEN.PK2-1C 進行基因組提取并擴增獲得組成型啟動子ADH1,GAP,TEF1 序列,并在其兩端分別添加EcoRⅠ和BamH Ⅰ酶切位點,通過EcoR Ⅰ和BamH Ⅰ酶切,將pESC-TRP-LegH 與三種組成型啟動子ADH1,GAP,TEF1 通過T4 連接酶酶連,連接產物轉化入E.coliDH5α感受態細胞中,涂布于含氨芐青霉素的LB 固體平板上,對陽性轉化子進行菌落PCR 篩選,提取質粒并送擎科測序驗證。獲得含有不同啟動子的重組表達載體pESC-TRP-GAL1,10-LegH、pESCTRP-TEF1-LegH、pESC-TRP-ADH1-LegH、pESCTRP-GAP-LegH,重組示意圖如圖1 所示。
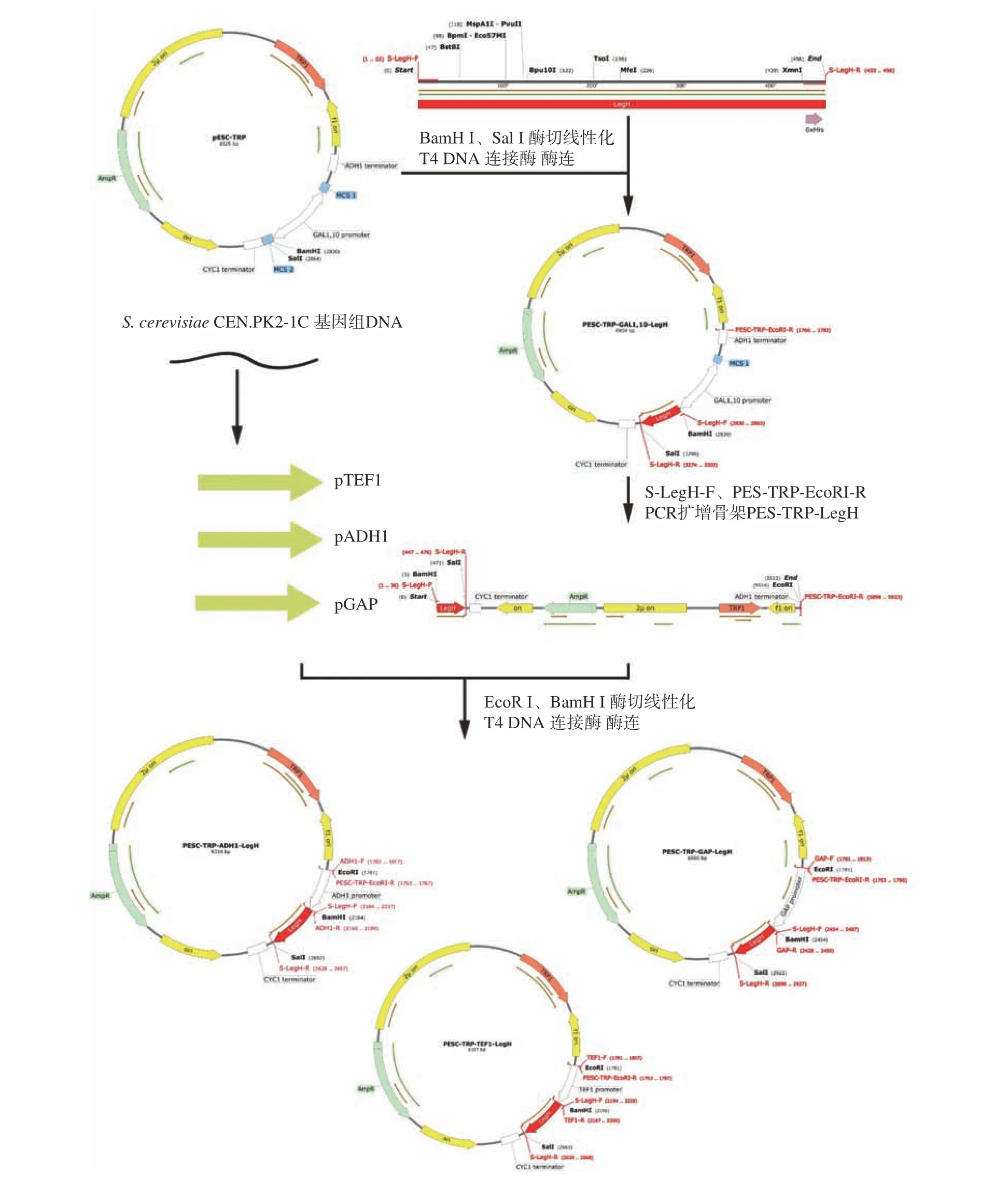
圖1 重組表達載體構建流程圖Fig.1 Schematic diagram of the recombinant expression vector construction process
1.2.3 釀酒酵母轉化及重組菌發酵 根據《釀酒酵母遺傳學方法實驗指南》[24]中酵母感受態細胞制備和高效轉化方法,將重組表達質粒轉化入S.cerevisiaeCEN.PK2-1C 中,涂布于SD-TRP 營養缺陷型篩選培養基,獲得轉化子。將轉化子通過Lysis Buffer for Microorganism to Direct PCR(Takara)裂解后進行菌落PCR 篩選檢驗。
將驗證后的陽性轉化子接種于SD-TRP 液體培養基,30 ℃,220 r/min 培養24 h。接種1×107CFU/mL 的菌體細胞于YPD 培養基中發酵并額外添加10 μg/mL的豆血紅蛋白輔基血紅素,誘導型表達菌株發酵20 h后補充誘導劑半乳糖至終濃度2%,30 ℃,220 r/min總共發酵48 h。發酵液于4 ℃,8000 r/min 下離心10 min 收集菌體,并用PBS 緩沖液清洗菌體2 遍去除培養基及血紅素殘留。通過高壓均質機對釀酒酵母進行細胞破碎,4 ℃,11000 r/min 離心20 min,取上清獲得胞內蛋白樣品,添加PMSF 至終濃度1 mmol/L,4 ℃保存備用。
1.2.4 Western blot 檢測LegH 表達水平 采用生工酵母蛋白提取試劑盒對發酵48 h 菌液進行總蛋白提取。取8 μL 抽提液進行SDS-PAGE 分析,分離膠按照15%進行配制將蛋白轉至PVDF 膜,快速封閉液封閉1 h,1:10000 稀釋Anti-His Antibody 鼠單抗4 ℃低溫搖床封閉過夜,TBST 漂洗三次后1:5000 稀釋HRP-山羊抗小鼠IgG(H+I)二抗室溫孵育1 h,超敏ECL 化學發光處理10 min,送化學發光成像檢測。Western 一抗二抗去除液處理10 min,去除his 抗體及其二抗。選擇酵母GAPDH 蛋白作為內參蛋白,采取與his 抗體相同方法孵育內參抗體,1:10000 稀釋GAPDH rabbit pAb(Yeast)一 抗,1:5000 稀 釋HRP-山羊抗兔IgG(H+I)二抗。對檢測結果進行ImageJ 數據處理。
1.2.5 LegH 蛋白純化濃縮 按照10%(w/v)對菌體進行重懸,130 MPa 高壓均質破碎細胞,11000 r/min 離心30 min 獲取上清液。通過AKTA pure 利用HisSep Ni-NTA 6FF 純化柱對蛋白進行純化。純化樣品通過15% SDS-PAGE 和全波段掃描進行蛋白定性分析。
1.2.6 蛋白濃度測定 純化樣品適當稀釋后通過Bradford 蛋白濃度測定法[25]測定總蛋白濃度,根據純化樣品SDS-PAGE 圖進行ImageJ 灰度分析,計算LegH 在總蛋白中所占百分比,從而算出豆血紅蛋白濃度。
2 結果與分析
2.1 不同啟動子PCR 擴增產物鑒定
通過對S.cerevisiaeCEN.PK2-1C 基因組進行擴增獲得三種不同啟動子片段TEF1(424 bp)、ADH1(413 bp)、GAP(683 bp),經1.5%瓊脂糖凝膠電泳驗證,如圖2 所示,片段大小符合目標條帶大小。
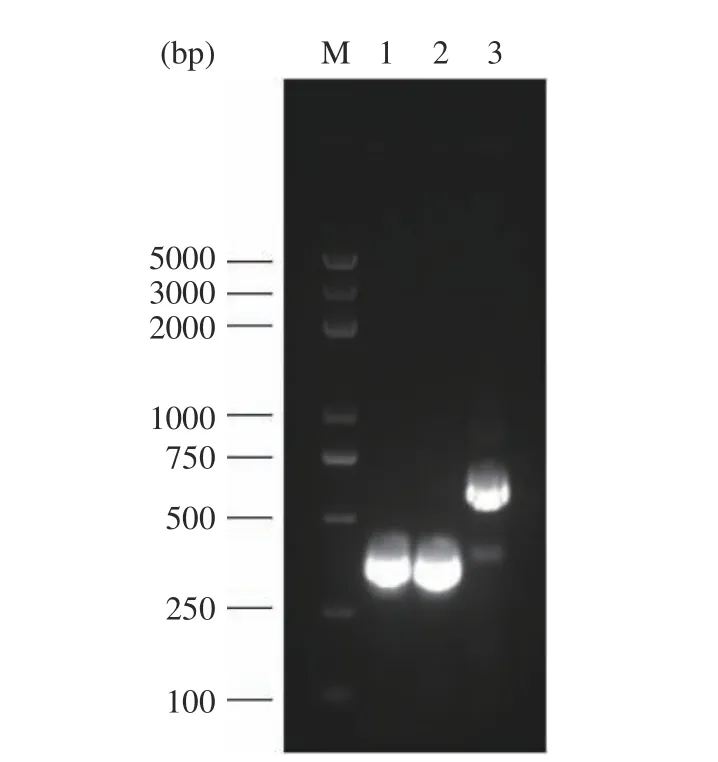
圖2 啟動子片段PCR 產物電泳圖Fig.2 Electrophoresis plot of the PCR products of the promoter fragments
2.2 重組表達載體鑒定及重組菌構建
通過對重組轉化大腸桿菌陽性克隆菌落PCR 驗證,提取陽性克隆重組質粒,EcoR Ⅰ和Sal Ⅰ酶切驗證表達框TEF1-LegH(882 bp)、ADH1-LegH(871 bp)、GAP-LegH(1141 bp)、GAL1,10-LegH(1146 bp),經1.5%瓊脂糖凝膠電泳,結果如圖3 所示。
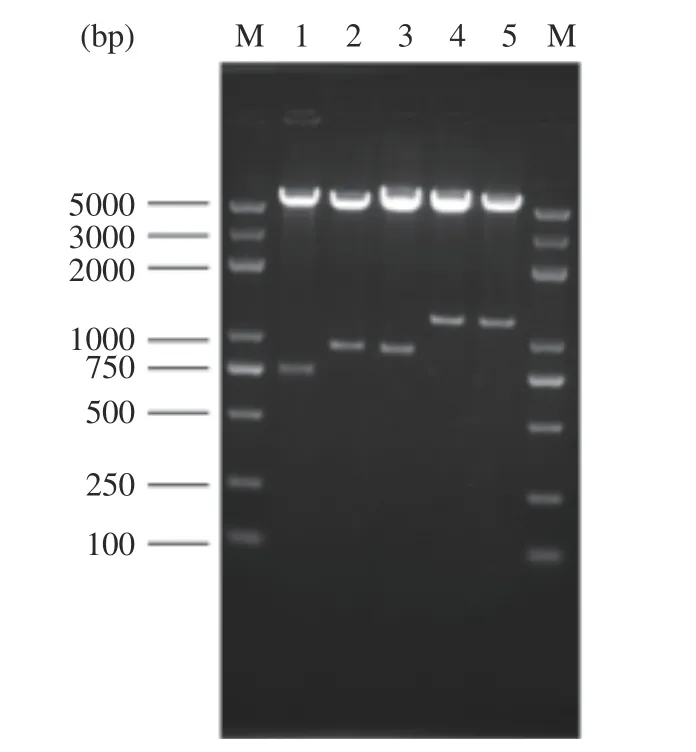
圖3 不同啟動子重組質粒酶切電泳圖Fig.3 Electrophoresis plot of recombinant plasmid digestion at different promoters
由圖3 可見,重組表達載體成功轉入大腸桿菌,片段大小符合目標條帶大小。重組質粒送北京擎科生物科技有限公司測序,測序結果與設計序列一致,表明含不同啟動子的LegH 表達質粒構建成功。
將鑒定正確的重組表達載體轉入釀酒酵母感受態細胞中,轉化子通過菌落PCR 驗證,成功獲得相應重組釀酒酵母表達菌株。
2.3 Western blot 檢測不同啟動子LegH 表達水平
啟動子的選擇在基因轉錄起始過程中起到重要的調控作用,選擇合適的啟動子與外源基因適配對基因的高效表達十分重要。釀酒酵母表達系統常用的啟動子主要分為誘導型啟動子和組成型啟動子兩種。組成型啟動子在啟動轉錄起始時無需轉錄因子的參與,可以維持一定的基因轉錄水平,而誘導型啟動子則受調控基因嚴格調控,基因表達需要添加特定誘導劑進行誘導表達[26]。根據表達需求選擇合適的啟動子對于外源基因的表達至關重要。本研究中選擇釀酒酵母中較為常見的三種組成型強啟動子(TEF1、ADH1、GAP)和誘導型強啟動子GAL1,10分別表達LegH 并進行比較,通過Western blot 驗證LegH 蛋白表達情況,結果見圖4 和圖5。
由圖4 可見,四種啟動子在16 kDa 處都存在明顯特異性條帶,且本底S.cerevisiaeCEN.PK2-1C 在目標位置無任何條帶,蛋白大小與預期一致,說明在釀酒酵母中采用TEF1、ADH1、GAP、GAL1,10 四種啟動子均成功表達目的蛋白LegH。通過Image J 灰度分析不同啟動子表達LegH 水平(見圖5),可以發現誘導型啟動子GAL1,10 較三種組成型啟動子TEF1、ADH1、GAP 在表達LegH 能力上具有顯著優勢,GAL1,10 啟動子較產量最低的ADH1 啟動子提升了3.93 倍。在組成型啟動子中,TEF1 較優,是ADH1 啟動子的2.91 倍,是GAP 啟動子的1.2 倍。分析其原因,可能是由于過早質粒表達LegH 對菌體生長具有一定負擔,不利于細胞的增長。而誘導型啟動子在葡萄糖存在的條件下,GAL1,10 表達受到抑制,菌株正常生長,當培養基中葡萄糖消耗殆盡時,GAL1,10 啟動子被激活,在半乳糖的誘導下開始正常表達,此時細胞已經具備一定密度,蛋白的表達對細胞生長的影響不再明顯,因此誘導型啟動子對LegH 表達具有一定優勢。組成性啟動子相對強度TEFp1>GAPp>ADH1p,這與Sun 等[27]的研究結果一致。誘導型啟動子在表達蛋白所展示出的優勢也與邱玲等[28]在釀酒酵母中表達乙肝抗原時相同,但其組成型啟動子相對強度結果顯示ADH1p>TEF1p。因此,需要根據表達蛋白的不同進行啟動子的優化選擇,以調整轉錄強度進而提升目標物質的產量。
2.4 LegH 表達結果
對重組酵母菌株在發酵培養基中進行發酵,在不同發酵時間測定菌體密度,以SDS-PAGE 蛋白電泳檢測目標蛋白表達情況,結果如圖6 和圖7 所示。由圖6 中可以看出,菌體在12~36 h 菌體大量擴增,處于指數增長期,48 h 后細胞增長速率緩慢,菌體密度趨于穩定。圖7 中發酵液SDS-PAGE 蛋白電泳結果顯示,隨著發酵時間的增加,LegH 的表達量呈上升趨勢,在發酵48 h 時表達量達到最高,隨著發酵時間延長,LegH 表達量沒有明顯提升,甚至有所降解,因此確定最佳發酵時間為48 h。
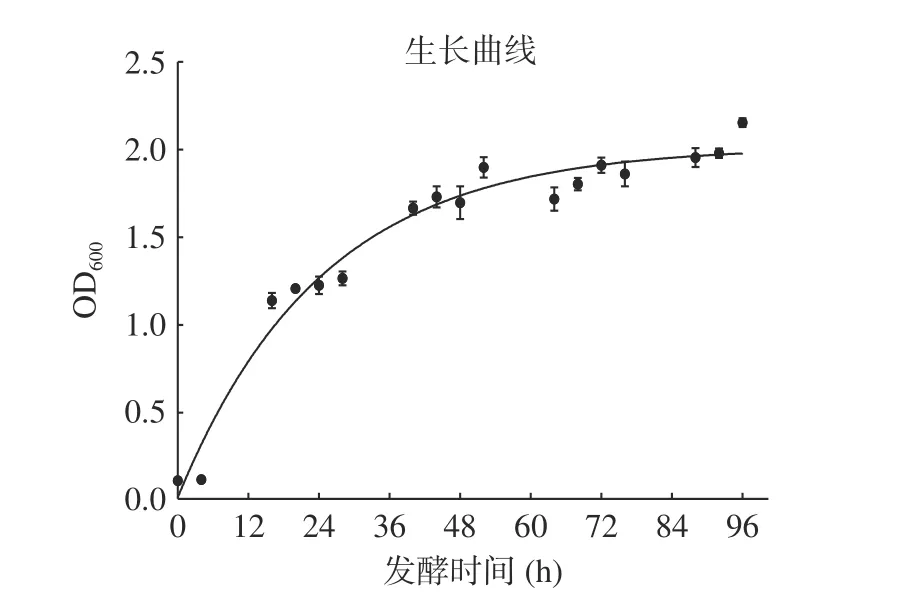
圖6 重組酵母生長曲線Fig.6 Recombinant yeast growth curve
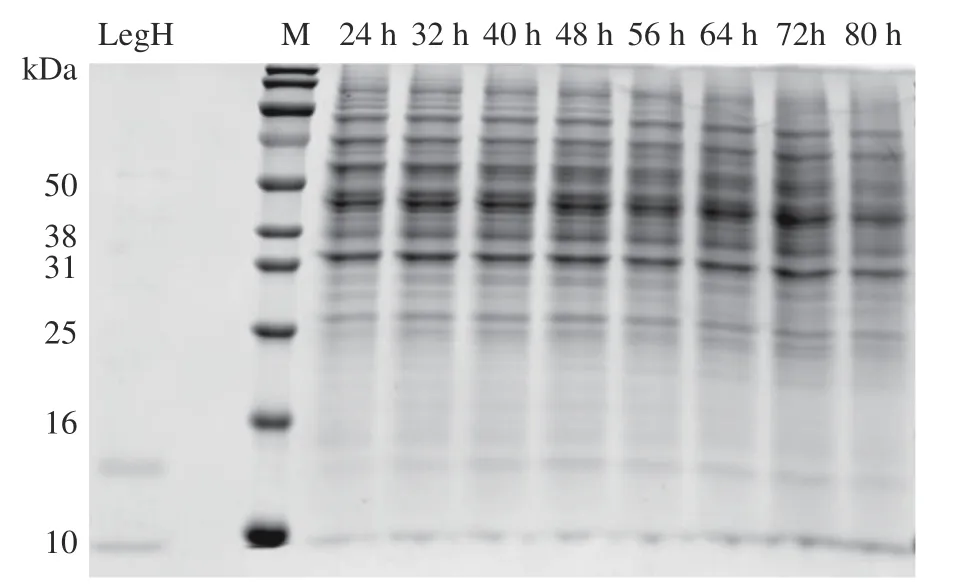
圖7 SDS-PAGE 電泳檢測不同發酵時間 LegH 表達量Fig.7 LegH expression at different fermentation time determined by SDS-PAGE electrophoresis
因蛋白表達量較低,SDS-PAGE 電泳顯示雜蛋白條帶較多,直接對蛋白定量不準確,因此對發酵48 h的蛋白進行了濃縮純化以更好地定量。
在進行重組質粒設計時LegH 碳末端加有His純化標簽,因此可以通過鎳柱對LegH 進行親和層析。在咪唑洗脫濃度為250 mmol/L 的條件下獲得了目標蛋白,蛋白經15% SDS-PAGE 電泳驗證,在目標區域出現明顯條帶,如圖8 所示。蛋白經全波段光譜掃描顯示,在420 nm 波長下有特征吸收峰,如圖9 所示,符合血紅素輔基卟啉化合物的特征吸收[29-30]。蛋白分子量與通過氨基酸序列預測的一致,表明豆血紅蛋白在釀酒酵母中成功表達。通過Bradford 法測定蛋白濃度結合灰度分析,測得蛋白濃度達到698.33 mg/L,折算成發酵濃度為2.79 mg/L。該表達水平與現有報道的畢赤酵母菌株相比[8],尚有一定差距。但該水平僅是目前的初步研究結果,尚未進行發酵工藝優化,后續通過發酵優化以及相關代謝途徑的強化(添加信號肽進行分泌型表達、構建血紅素合成途徑等),有望進一步提升菌株的表達水平。

圖8 純化蛋白SDS-PAGE 電泳圖Fig.8 SDS-PAGE electrophoresis plot of purified legH
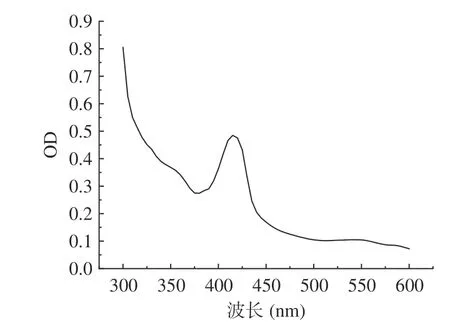
圖9 LegH 蛋白光譜分析Fig.9 Spectrophotometry analysis of LegH
3 結論
本研究成功構建了豆血紅蛋白釀酒酵母異源表達菌株,在不同啟動子下實現了LegH 的表達,其中誘導型啟動子GAL1,10 獲得了較高表達水平,蛋白經鎳柱濃縮純化后,測得LegH 濃度達到698.33 mg/L,折算成發酵濃度為2.79 mg/L。釀酒酵母作為一種GRAS 生物,其在食品工業中應用的安全性是無法比擬的,經過深入研究,釀酒酵母有可能成為豆血紅蛋白異源表達的又一途徑。

