牛骨髓蛋白的酶解工藝優化及其理化性質和抗氧化特性
古麗米熱·阿巴拜克日,帕爾哈提·柔孜,則拉萊·司瑪依,阿力木·阿布都艾尼,曹 博,楊曉君
(新疆農業大學食品科學與藥學學院,新疆烏魯木齊 830052)
動物骨骼是一種營養豐富的天然資源,含有蛋白、脂肪、軟骨素以及礦物質等成分,且骨蛋白水解物中包括了人體所需的必需氨基酸,是一種優質蛋白來源[1]。近年來,從海洋動物和陸生動物副產物骨骼中制取膠原蛋白和制備活性多肽,并將其用于保健品和化妝品領域的研究逐漸深入,這對全產業鏈的增值帶來便利。同時,骨骼提取物在降血壓、免疫調節、骨病治療、抗菌、抗氧化等活性[2-4]方面的發現促進了相關功能產品的研發和上市。隨著保健食品加工技術的進步,越來越多的學者關注著動物骨類蛋白肽與相關產品的生物活性及應用方面的研究。因此,建立骨骼蛋白高值化利用技術評價體系,優化有效成分制備工藝,提高目標產物的含量在畜牧副產物循環利用、健康產品開發及產業鏈的升級等領域具有重要的意義。
較多研究表明動物骨骼含有豐富的活性膠原蛋白,且不同的畜禽骨骼含有的膠原蛋白含量有一定的差異。劉泓等[5]研究發現牦牛腿骨、黃牛腿骨、豬腿骨及雞腿骨富含活性蛋白,蛋白含量在79.18%~90.43%范圍內。張巖[6]研究得出,經過胰蛋白酶和堿性蛋白酶水解得到的魷魚多肽分子量小于經過氨肽酶水解得到的魷魚多肽,且抗氧化能力較強。由于膠原蛋白的分子量較大,結構較為復雜,導致其攝入人體后難以發揮本有的營養價值和功能[7]。因此需要對其進行適當的酶解,從而降低分子量。酶解法制備肽被譽為21 世紀營養革命的潛在觸發器[8]。酶解法具有溫和、可控、周期短等特點,能滿足食品經濟發展和環保的工藝要求,對膠原蛋白的破壞作用相對較少,而且可維持所得膠原蛋白肽的活性。通過酸溶酶法及超聲輔助酶法制備的牛骨膠原肽均顯出較強的抗氧化活性[9]。同時,多項研究已證實動物來源骨膠原蛋白及肽具有較好的理化性質和抗氧化活性,在食品工業加工中具有較好的應用潛力。然而多數食藥加工業通常使用全骨,未能將骨質和骨髓有效地分離,并且動物骨髓有效成分的針對性研究尚處于初步階段。本課題組前期比較了牛骨質及骨髓的營養成分,得出牛骨髓蛋白含量顯著高于其骨質蛋白,牛骨髓蛋白中的氨基酸含量高達466.24 mg/g[10],且含有豐富的Na、K、Ca、P、Mg 等常量元素及Fe、Zn 等微量元素[11]。目前,較多的研究集中于牛骨膠原蛋白肽的制備及生物活性研究,而對牛骨髓膠原蛋白肽的針對性研究仍然較少。
為了進一步提高牛骨的綜合利用率及附加值,本文以牛骨髓為原料,以水解度、蛋白含量、DPPH·清除率為評價指標,結合結構表征篩選出酶解牛骨髓蛋白的最佳酶種,通過響應面法優化酶解工藝,并對其酶解物的理化性質和抗氧化活性進行研究,為后期分離純化、肽序列鑒定及其食藥功能的開發等方面提供理論依據。
1 材料與方法
1.1 材料與儀器
冷凍牛骨 購買于新疆阿勒泰地區,經新疆農業大學食品科學與藥學學院巴吐爾·阿不力克木教授鑒定為新疆褐牛腿骨;牛血清蛋白E-BC-K318-M Elabscience 公司;考馬斯亮藍G-250 上海藍季科技發展有限公司;2,2-聯苯基-1-苦基肼基自由 上海麥克林生化科技公司;堿性蛋白酶(400 U/mg)、胃蛋白酶(300 U/mg)、木瓜蛋白酶(800 U/mg)、中性蛋白酶(100 U/mg)華邁科公司;花生油 益海嘉里金龍魚糧油食品股份有限公司;所有有機溶劑 均為國產分析純。
FA1004 電子天平 常州市幸運電子設備有限公司;DF-101S 集熱式恒溫加熱磁力攪拌器 上海興創科學儀器設備有限公司;PHS-3CB pH 計 上海越平科學儀器有限公司;BCD-208JDE 冷藏冷凍箱 浙江星星冷鏈集成股份有限公司;T6 新世紀紫外可見分光光度計 北京普析通用儀器有限責任公司;RE-52 旋轉蒸發儀 上海亞榮生化儀器有限公司;SF-TDL-40D 離心機 上海菲恰爾分析儀器股份有限公司;XHF-DY 高速分散器 寧波新芝生物有限公司;TGL-16M 高度冷凍離心機 湖南湘鑫儀器儀表有限公司。
1.2 實驗方法
1.2.1 樣品預處理 取出冷凍的牛骨,用鋸骨器將牛骨切開,初步洗凈,除去骨髓中的殘留碎片和多余的肉渣并洗去多余的血跡,將所得的牛骨髓冷凍至-20 ℃下硬化,再放置于搗藥罐中按照1:6(g/mL)的固液比加入液氮進行冷凍粉碎,粉末保存在-40 ℃冰箱,備用。
1.2.2 牛骨髓蛋白(Bovine bone marrow protein,BBMP)的提取 參照文獻[12]并略作修改,取100 g牛骨髓粉末,以蒸餾水作為溶劑提取BBMP,用磁力攪拌器在45 ℃回流提取3 次,三次提取料液比及提取時間分別為1:10、1:7、1:5 g/mL 及2、1、0.5 h,合并提取液。用分液漏斗分離油水層,收集水層,用石油醚脫脂3 次,水溶液經適當濃縮,透析(3500 Da,48 h),真空冷凍干燥得到牛骨髓蛋白粉末。
1.2.3 酶的篩選 參照文獻[9]并略作修改,稱取200 mg 牛骨髓蛋白粉末,加蒸餾水100 mL,再分別加入四種蛋白酶,酶加量均為2%,于各自最適水解條件水解2 h,各蛋白酶的水解條件見表1。待酶解結束,沸水滅酶15 min,冷卻,pH 調到7,4000 r/min離心15 min,取上清液測定其各酶解液的水解度、蛋白含量及DPPH·清除率,通過綜合評分選擇適宜的酶。

表1 不同蛋白酶水解實驗條件Table 1 Experimental conditions for different proteases
1.2.4 結構表征
1.2.4.1 紫外光譜(Ultraviolet Spectroscopy,UV)分析 將1 mg/mL 的牛骨髓蛋白酶解物溶液在室溫條件下用紫外分光光度計于200~400 nm 波長范圍內進行掃描,以蒸餾水為空白對照[13]。
1.2.4.2 紅外光譜(Fourier Transform Infrared Spectroscopy,FTIR)分析 取少量牛骨髓蛋白酶解物,與適量溴化鉀混合,用壓片法測定其4000~400 cm-1范圍內的紅外吸收光譜[13]。
1.2.4.3 SDS-PAGE 分析 將20 mg/mL 的牛骨髓蛋白酶解物溶液與4×蛋白質上樣緩沖液3:1 比例混合后煮沸5 min,冷卻后將15 μL 上樣。分離膠15%,濃縮膠5%,采用直壓恒流電源,75 V 開始,在分離0.5 h 后,將電壓調節到120 V。結束后,用考馬斯亮藍染色2 h,脫色至透明后,拍照并進行觀察分析[13]。
1.2.5 單因素實驗 按照酶種篩選結果得出胃蛋白酶為最佳酶種,固定因素水平為酶解時間2 h,加酶量2%,pH2,酶解溫37 ℃,在上述工藝條件下,通過測定酶解液的水解度、蛋白含量及DPPH·清除率來研究酶解時間(1、2、3、4、5 h)、加酶量(1%、2%、3%、4%、5%)、pH(1、2、3、4、5)、酶解溫度(27、32、37、42、47 ℃)等因素對牛骨髓蛋白酶解效果的影響,重復試驗3 次。
1.2.6 響應面優化試驗 根據單因素實驗結果,運用Box-Behnken 設計原理,以酶解時間(A)、加酶量(B)、pH(C)、酶解溫度(D)為變量,進行四因素三水平的響應面試驗,因素與水平設計見表2。

表2 響應面試驗因素與水平Table 2 Response surface test factors and levels
1.2.7.1 水解度的測定 采用甲醛電位滴定法[14]測定水解度。吸取10 mL 滅酶后的水解液于燒杯中,加5 滴30%過氧化氫。將燒杯置于磁力攪拌器上,將pH 計的電極插入燒杯內試樣中適當位置。先用0.1 mol/L 氫氧化鈉緩慢調節pH 至7.5 左右,再用0.05 mol/L 氫氧化鈉溶液調節至pH=8.10,并且保持1 min 不變。再緩慢加入15 mL 甲醛溶液,反應1 min,用0.05 mol/L 氫氧化鈉標準溶液滴定至pH=8.10。記錄消耗氫氧化鈉標準溶液滴定的體積(V1)。按下式(1)計算水解度:
式中:V1為1 mL 水解液消耗的氫氧化鈉溶液體積,mL;V0為1 mL 空白液消耗的氫氧化鈉溶液體積,mL;V 為配料用水體積,mL;C 為滴定用氫氧化鈉溶液濃度,mol/L;14.01 為氮的摩爾質量,g/mol;6.25 為氮換算為蛋白質的系數;M 為牛骨髓蛋白水解產物的質量,g;pro 為牛骨髓蛋白水解產物的蛋白含量,%。
1.2.7 指標測定
1.2.7.2 蛋白含量的測定 1 mL 不同濃度的(0.1、0.2、0.4、0.6、0.8、1 mg/mL)牛血清蛋白質溶液中分別加入3 mL 考馬斯亮藍溶液,避光靜置反應5 min,在595 nm 處測吸光度。以蛋白濃度為橫坐標,吸光度為縱坐標繪制標準曲線[15],得到回歸方程:Y=1.0139X+0.692(R2=0.9996)。取濃度為1 mg/mL的樣品溶液,按照上述蛋白標準曲線的試驗步驟測定其蛋白含量。
式中:C1是樣品起始濃度,mg/mL;C2是供試品溶液中蛋白濃度,mg/mL。
1.2.7.3 抗氧化活性的測定 BBMP-PH 對1,1-二苯基-2-三硝基苯肼自由基(DPPH·)、羥自由基、超氧陰離子自由基、ABTS+自由基清除率及總還原能力的測定采用文獻[16-17]的方法,以維生素C 為對照品。
1.2.7.4 綜合評分的計算 基于綜合評分選擇適宜的酶,由于貢獻值大小未知,因此綜合評分設定總值為100%,水解度為主要考察指標占50%,蛋白含量占25%,DPPH·清除率占25%。按下式(3)~(6)計算綜合評分:
1.2.7.5 等電點的測定 準確稱取牛骨髓蛋白酶解物10 mg 于離心管中,溶解于10 mL 蒸餾水,加入鹽酸(0.5 mol/L)或氫氧化鈉(0.5 mol/L)分別調pH(2、4、6、8、10、12),測定不同pH 條件下BBMPPH 在660 nm 處的透光率,繪制pH 與透光率的對應關系圖[18]。
1.2.7.6 溶解性的測定 準確稱取牛骨髓蛋白酶解物10 mg 于離心管中,溶解于10 mL 蒸餾水,加入鹽酸(0.5 mol/L)或氫氧化鈉(0.5 mol/L)分別調pH(2、4、6、8、10、12),混合6 min,離心(3500 r/min)25 min,測定上清液蛋白含量,按下式(7)計算溶解性[18]。
式中:M1:懸浮液中加入的蛋白含量;M2:離心后上清液蛋白含量。
1.2.7.7 蛋白乳化性和乳化穩定性的測定 參照文獻[16]測定其BBMP-PH 的乳化性(EAI)與乳化穩定性(ESI)。準確稱取牛骨髓蛋白酶解物10 mg 于燒杯中,加入10 mL 蒸餾水,分別將溶液pH 調至2、4、6、8、10、12,再加5 mL 花生油,10000 r/min的條件下高速均質2 min。分別在0 min(A0)和靜置10 min(A10)時從燒杯底部取50 μL 乳濁液與5 mL SDS(1%)溶液混合均勻,在500 nm 處測定吸光度。用式(8)、式(9)計算EAI 和ESI[18]:
式中:DF為樣品稀釋倍數;C 為蛋白質濃度,mg/mL;Φ為光程,設定為0.01;θ為乳狀液的油體積分數,0.25。
1.2.7.8 持水性的測定 準確稱取10 mg 牛骨髓蛋白酶解物記錄為m0,將樣品稱入離心管中記錄重量為m1,加10 mL 蒸餾水溶解,將溶液pH 分別調至2、4、6、8、10、12,漩渦混合6 min 并于30 ℃恒溫箱恒溫30 min,離心(4000 r/min、30 min),除去上層清液,稱重記為m2,按下式(10)計算持水性[19]。
1.2.7.9 持油性的測定 準確稱取10 mg 牛骨髓蛋白酶解物記錄為m0,將樣品稱入離心管中記錄重量為m1,加入10 mL 花生油,再漩渦混合5 min,直到樣品持油量達到飽和,靜置30 min,離心(4000 r/min、20 min),將上清液的油去掉,稱離心管重量記為m2,按下式(11)計算持油性[18]。
1.3 數據處理
每個樣品重復測定3 次,取平均值,采用SPSS 26.0、Origin 9.0、Design-Expert 8.0.6 進行數據處理和分析。
2 結果與分析
2.1 蛋白酶的篩選結果
2.1.1 不同酶對牛骨髓蛋白酶解效果的影響 由表3可知,牛骨髓蛋白通過四種蛋白酶進行酶解,結果表明胃蛋白酶水解物的水解度達到31.68%,顯著高于木瓜蛋白酶水解物和中性蛋白酶水解物(P<0.05),可能是由于不同蛋白酶對肽鍵的作用部位不同,所以酶解產物的水解度有所不同[9];堿性蛋白酶水解物的蛋白含量達到38.91%,顯著高于胃蛋白酶水解物和中性蛋白酶水解物(P<0.05);胃蛋白酶水解物的DPPH·清除率達到29.85%,顯著高于其它三種蛋白酶(P<0.05)。代亞民[20]采用胃蛋白酶酶解牛骨蛋白,水解度僅為14.4%。因此,根據綜合評分初步確定胃蛋白酶為最適用酶。
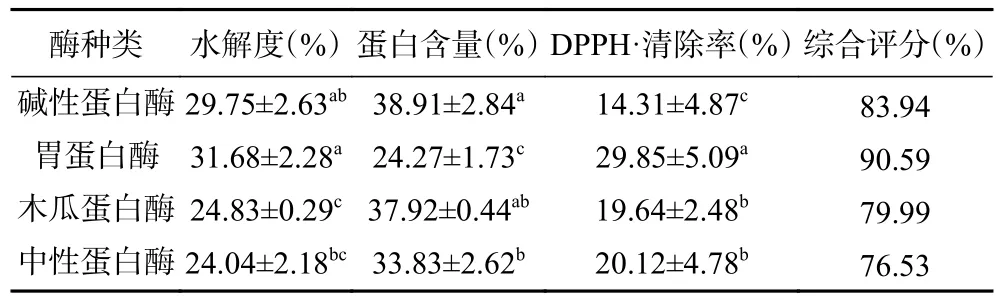
表3 不同蛋白酶對牛骨髓蛋白酶解效果的影響Table 3 Effect of protease type on hydrolysis efficiency
2.1.2 紫外光譜分析 四種蛋白酶水解物的紫外掃描圖譜如圖1 所示。四種蛋白酶水解物分別在229、230、223、237 nm 處有最大的吸收峰,均符合膠原蛋白肽的特征吸收峰,280 nm 附近也有微弱的吸收峰,說明牛骨髓膠原肽含有一定的酪氨酸[18]。綜上,四種蛋白酶能夠有效酶解牛骨髓蛋白。
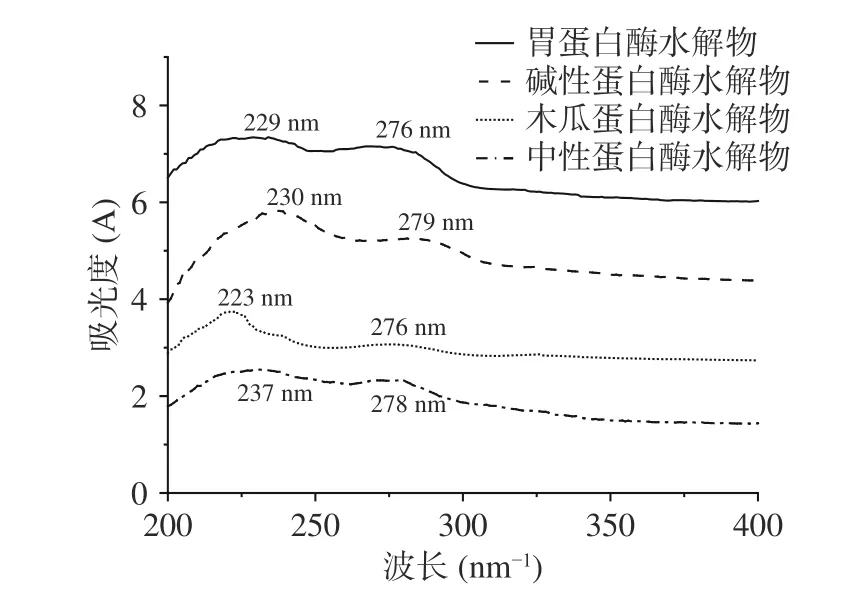
圖1 牛骨髓蛋白酶解物的紫外光譜圖Fig.1 Ultraviolet spectra of BBMP hydrolysates
2.1.3 傅里葉紅外光譜分析 FT-IR 是一種常用于闡明蛋白質二級結構官能團的定性分析技術[17],四種蛋白酶水解物的FT-IR 光譜圖如圖2 所示。
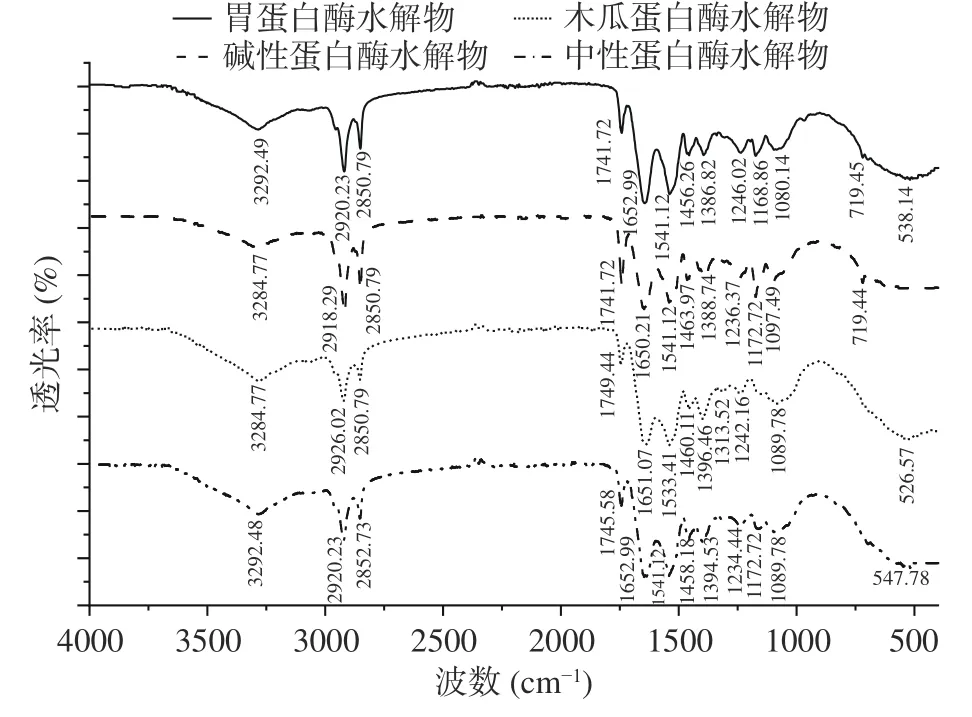
圖2 牛骨髓蛋白酶解物的紅外光譜圖Fig.2 FT-IR spectra of BBMP hydrolysates
圖2 可知,四種蛋白酶水解物均在4000~400 cm-1呈現出蛋白類化合物的特征吸收峰,在3200~3300 cm-1處附近均出現強吸收峰,是典型的因N-H 伸縮振動形成的酰胺A 帶的特征峰;出現在2900~2950 cm-1處的吸收峰是因C-N 伸縮振動產生的酰胺B 帶的特征峰,分別在2924.21、2918.29 cm-1處有吸收峰;1600~1700 cm-1處歸屬于蛋白酰胺Ⅰ帶的吸收峰,由C=O 的伸縮振動引起,四種蛋白酶水解物的酰胺Ⅰ帶分別在1655.79 和1650.21 cm-1;1540 和1450 cm-1左右出現的振動是酰胺II 帶,是由N-H 鍵的面內彎曲振動和C-N 鍵的伸縮振動引起的;在1380.86 和1388.74 cm-1處出現的吸收峰是因C-N 伸縮振動引起的酰胺Ⅲ帶,1239.74 和1236.37 cm-1處出現的吸收峰是因N-H 面內彎曲振動引起的酰胺Ⅲ帶。同時,1646~1664 cm-1處的吸收峰為α螺旋結構的特征峰。綜上,牛骨髓蛋白四種蛋白酶水解物均顯出了典型的蛋白吸收峰。
2.1.4 SDS-PAGE 凝膠電泳分析結果 牛骨髓蛋白及其四種蛋白酶水解物的SDS-PAGE 結果如圖3所示。如圖所示,BBMP 及其水解物的相對分子質量主要分布在4.1~66.0 kDa。其中,水提蛋白的分子量較大,集中在66.0 kDa 左右,也有10 kDa 左右的亞基。經酶解處理后,胃蛋白酶水解物分子量降低較明顯,肽段亞基降低到4.1~14.4 kDa 處,主要在10 kDa 以下較為集中。尹玉文等[21]對骨膠蛋白酶處理的牛骨制備酶解液,電泳顯示其分子量為7.8~20.1 kDa,本實驗得出經胃蛋白酶處理后能夠得到分子量更小的牛骨髓膠原多肽。

圖3 牛骨髓蛋白及其酶解物的SDS-PAGE 凝膠電泳圖Fig.3 SDS-PAGE profile of BBMP and its hydrolysates
因此,經結合不同酶種對水解度、蛋白含量、DPPH·清除能力的影響及UV、FT-IR、SDS-PAGE結果,得出胃蛋白酶能夠更有效的制備分子量較低的牛骨髓膠原肽。綜上,進一步選用響應面法優化BBMP 的胃蛋白酶酶解工藝,為其生產應用能提供依據。
2.2 單因素實驗結果
2.2.1 酶解時間對BBMP 酶解效果的影響 由圖4A所示,隨著酶解時間的延長,在1~2 h 范圍內蛋白含量、DPPH·清除率和水解度不斷增加,當酶解時間為2 h 時,蛋白含量、DPPH·清除率及水解度分別為34.11%、27.47%、32.83%達到最高值(P<0.05)。此后,各指標緩慢下降,可能由于酶解時間過長,導致酶失活。因此,選擇1~3 h 作為響應面分析的最佳時間范圍。
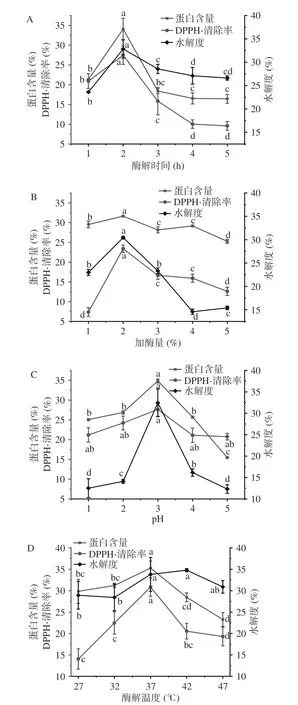
圖4 酶解時間、加酶量、pH、酶解溫度對BBMP酶解效果的影響Fig.4 Effects of time,enzyme concentration,pH and enzymatic hydrolysis temperature on the hydrolysis efficiency of BBMP
2.2.2 加酶量對BBMP 酶解效果的影響 由圖4B所示,隨著加酶量的增加,蛋白含量、DPPH·清除率和水解度呈現先升高后降低的趨勢,加酶量達到2%時蛋白含量、DPPH·清除率及水解度分別為31.64%、23.40%、30.44% 達到最高值(P<0.05)。酶加量過高時可能導致酶解物的進一步降解。因此,選擇1%~3%作為響應面分析的最佳酶用量范圍。
2.2.3 pH 對BBMP 酶解效果的影響 由圖4C 所示,酶解物的蛋白含量、DPPH·清除率和水解度隨著pH 的增加呈現先升高后降低的趨勢,pH 為3 時蛋白含量、DPPH·清除率及水解度分別為34.86%、27.64%、32.45% 達到最高值(P<0.05)。此后隨著pH 增加各指標逐漸降低。因此,選擇pH2~4 作為響應面分析的最佳pH 范圍。
2.2.4 酶解溫度對BBMP 酶解效果的影響 由圖4D所示,隨著酶解溫度的升高,酶解物蛋白含量及DPPH·清除率呈現先升高后降低的趨勢,水解度呈現平穩的趨勢,當溫度達到37 ℃時蛋白含量、DPPH·清除率及水解度分別為35.28%、30.83%、33.81% 達到最高值(P<0.05)。考慮到溫度的升高導致蛋白質變性及酶失活,選擇溫度為32~42 ℃作為響應面分析的最佳溫度范圍。
2.3 Box-Behnken 響應面試驗結果
2.3.1 響應面試驗結果 響應面優化酶法制備牛骨髓膠原蛋白工藝試驗結果見表4。水解度、蛋白含量和抗氧化活性是蛋白酶解的重要屬性,對上述3 個指標進行綜合考慮,分別以水解度、蛋白含量及DPPH·清除率的權重系數設為0.5、0.25、0.25 得出綜合評分。

表4 Box-Behnken 試驗設計及結果Table 4 Box-Behnken design with experimental results
2.3.2 方差分析 運用Design-Expert 8.0.6 軟件對表4 中綜合評分的數據進行統計分析后進行多元回歸擬合,得到二次回歸方程Y=91.55+2.81A–4.79B-0.096C+0.68D+0.42AB+0.13AC+1.60AD+0.86BC-0.18BD-3.44CD-19.88A2-18.19B2-21.06C2-18.71D2。
綜合評分回歸方程方差分析結果見表5,方程因變量與自變量之間的線性關系明顯,回歸模型極顯著(P<0.01),失擬項不顯著,回歸系數R2=0.9203,說明該模型與試驗擬合良好,以綜合評分為響應值所建立的酶法制備牛骨髓膠原肽工藝模型是合理的。通過方差分析結果可以發現,B、A2、B2、C2、D2均對Y 影響顯著(P<0.05),表明酶解時間、酶添加量、pH、酶解溫度對酶法制備牛骨髓膠原蛋白的水解度、蛋白含量及DPPH·清除率均有一定的影響。F值的大小反映因素對試驗指標(因變量)的重要程度為,FB>FA>FD>FC。
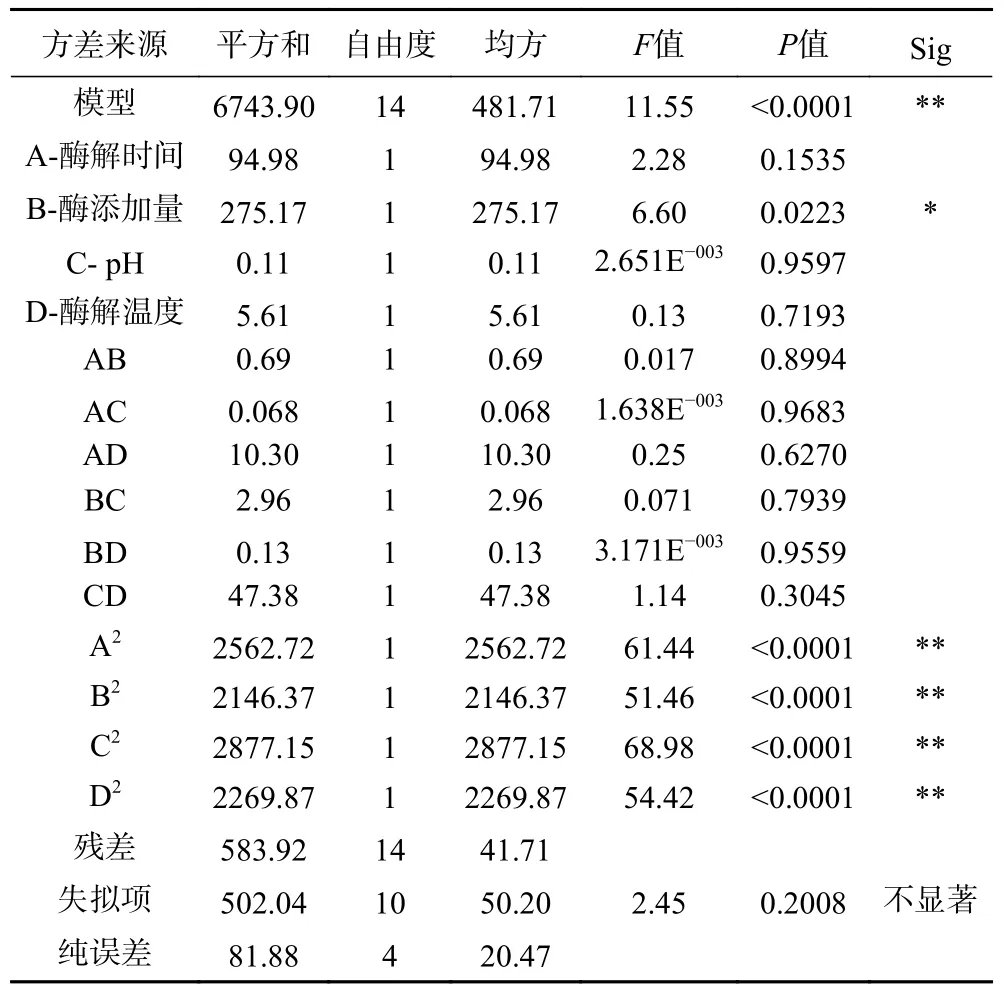
表5 回歸模型方差分析Table 5 Analysis of variance of regression equation
各因素影響綜合評分的交互作用見圖5。圖5中酶解時間、酶添加量、pH、酶解溫度兩兩交互作用的等高線接近橢圓,說明交互作用明顯。
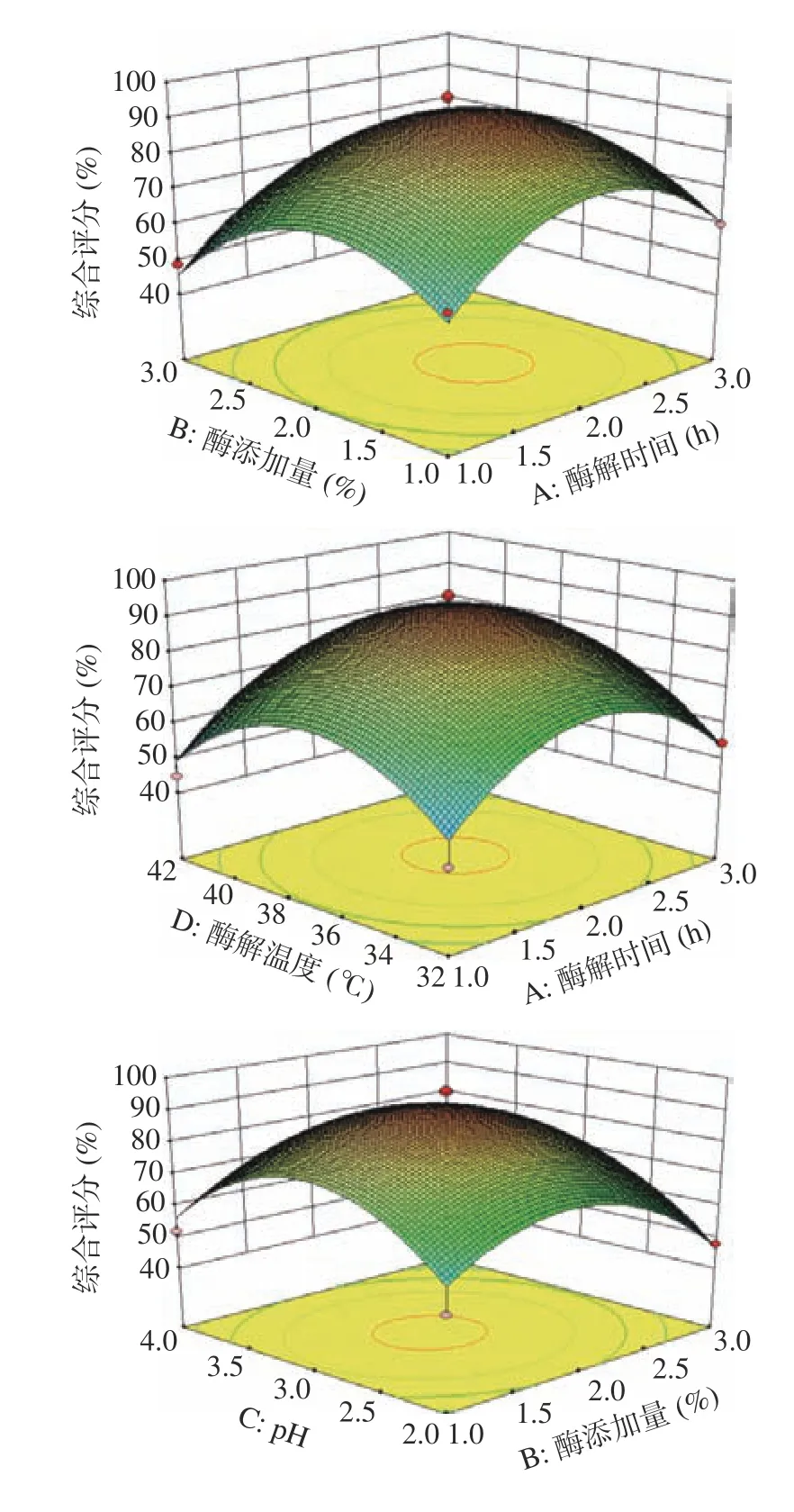

圖5 各因素交互作用對綜合評分的影響Fig.5 Response surface plots for the interactive effects of different variables on comprehensive score of BBMP-PH
2.3.3 最優工藝確定及驗證試驗 經Design-Expert 8.0.6 軟件分析,最終得到最優酶解工藝為酶解時間2.04 h、酶添加量1.92%、pH2.95、酶解溫度37.23 ℃,此時預測的水解度、蛋白含量及DPPH·清除率分別為35.47%、37.68%及37.13%。考慮到實際運用時的可操作性,將酶解工藝參數修正為酶解時間2 h、酶添加量2%、pH3、酶解溫度37 ℃,做3 次平行試驗進行驗證,得到的水解度為36.07%±1.17%、蛋白含量為37.05%±1.29%、DPPH·清除率為39.57%±1.69%,此結果與預測值接近,說明水解度、蛋白含量及DPPH·清除率為指標,采用響應面法對胃蛋白酶酶解牛骨髓蛋白工藝條件進行優化是行之有效的。
2.4 牛骨髓蛋白酶解物的理化特性
2.4.1 等電點分析 膠原蛋白是一種兩性電解質,等電點與其結構有著密切的關系,尤其是與其側鏈上的酸性和堿性氨基酸數量有關[22]。膠原蛋白在等電點時,分子之間沒有靜電排斥,導致溶液的渾濁程度增加,透光率降低[16]。如圖6A 所示,BBMP-PH 在不同的pH 條件下透光率呈現先降低后升高的趨勢,當pH 為6 時最低為19.57%。因此,可初步推斷BBMPPH 的等電點在pH6 左右。馮建慧等[23]研究報道采用酸法和酶法提取的鰱魚魚皮和魚骨膠原蛋白的等電點在pH6.7 左右,與本實驗結果相似。

圖6 BBMP-PH 的理化特性研究Fig.6 Functional properties of BBMP-PH
2.4.2 溶解性分析 如圖6B 所示,BBMP-PH 的pH 偏酸或偏堿時,溶解性較好。當pH 為6 時溶解性最低為79.02%,這是由于等電點附近的蛋白分子表面電荷幾乎為零,極易導致蛋白顆粒聚集,溶解性降低并形成沉淀[24],這與楊恒[25]報道的雞肺膠原蛋白在等電點附近溶解度最小,偏離等電點溶解度增大的結果一致。當pH 為2 時,BBMP-PH 溶解性達到94.72%,表明在酸性環境中的溶解性高于堿性環境,可能是因為酸性環境有利于蛋白質與水的相互作用,結果與張鑫[26]研究的牛鼻膠原蛋白在酸性環境中的溶解度較高一致。
2.4.3 乳化性及乳化穩定性的分析 蛋白質在界面上的吸附能力對食品加工中乳劑的形成和穩定起著重要的作用[26]。如圖6C,BBMP-PH 的乳化性及乳化穩定性均隨pH 的增加先降后升再降,當pH 在等電點6 時最低為0.27 m2/g 和69.23%,和溶解性表現出相似的曲線圖,在等電點附近乳化性及乳化穩定性較差。當pH 為8 時乳化性和乳化穩定性最高1.11 m2/g 和101.37%,與烏日古莫樂[27]報道吉爾利閣蒙古牛骨膠原蛋白在pH 為8 時乳化性及乳化穩定性最好的結果相似。
2.4.4 持水性的分析 如圖6D 所示,BBMP-PH 的持水性呈現出先降后升的變化,強堿性環境下持水性下降。當pH 達到等電點時持水性最低為3.81 g/g,這是由于蛋白質在等電點的總電荷值為零,分子之間的交互作用最強,結合和收縮蛋白的水化和膨脹率最低[28]。在pH8 時,BBMP-PH 的持水性最高為4.59 g/g,是因為遠離等電點后蛋白間的相互作用變小,結合水的能力增大,表現為持水性增強[29]。
2.4.5 持油性的分析 BBMP-PH 的持油性為13.65 g/g,大于駝掌膠原蛋白(6.22 g/g),可作為優良的蛋白質補充劑。
2.5 牛骨髓蛋白酶解物的抗氧化活性
2.5.1 DPPH·清除能力 DPPH 為測定物質體外抗氧化活性的重要指標[30],不同濃度的BBMP-PH 與維生素C 對DPPH·清除能力如圖7A 所示。在0.1~1.0 mg/mL 范圍內,清除能力與濃度均呈正比關系。當濃度1 mg/mL 時清除率達到69.93%,其半抑制濃度IC50值為0.65 mg/mL。郭佳俊等[31]利用堿性蛋白酶提取牛骨膠原蛋白肽的DPPH·清除率為37.33%,其清除能力顯著小于BBMP-PH。
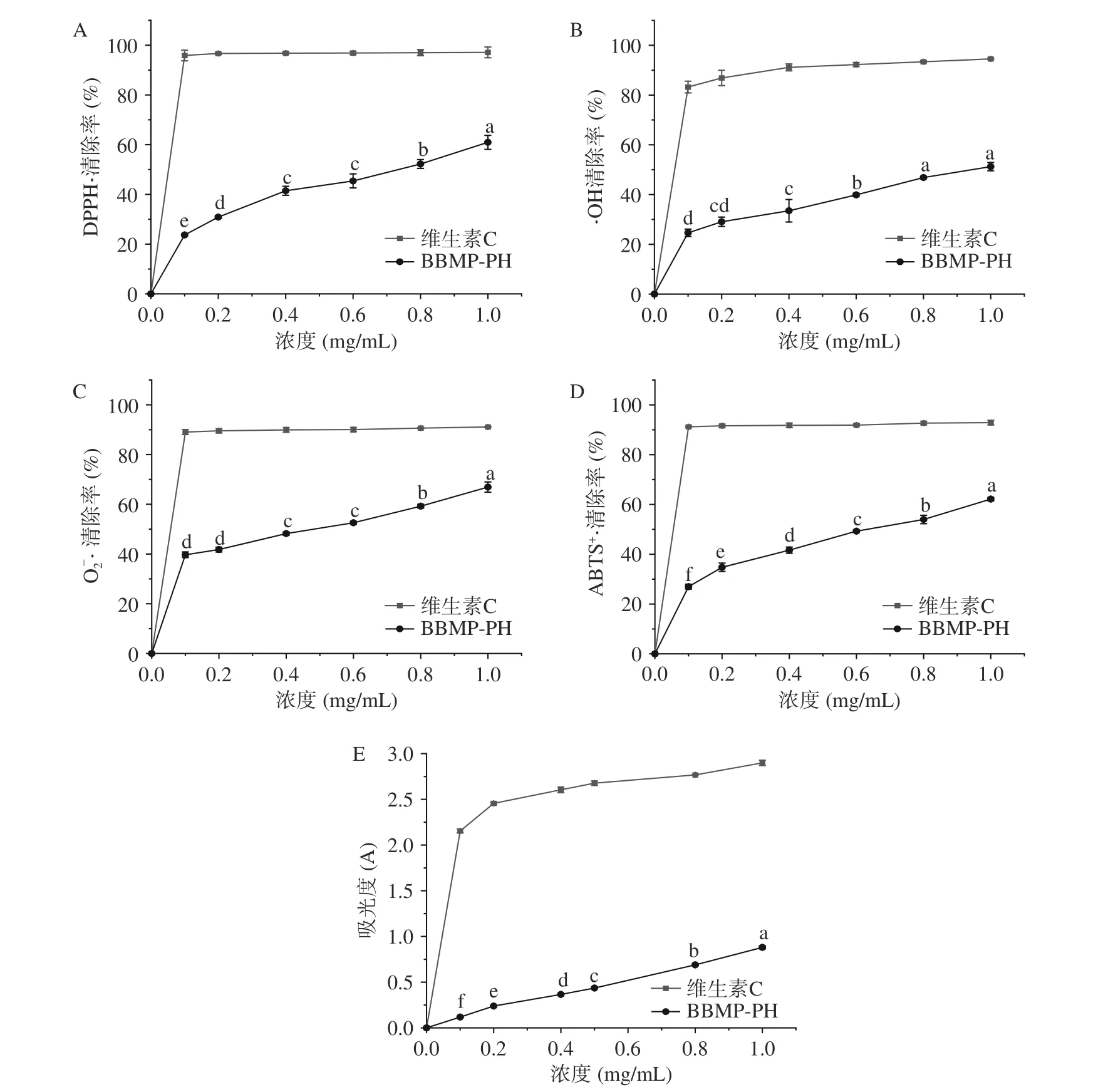
圖7 BBMP-PH 的抗氧化活性Fig.7 Antioxidant activity of BBMP-PH
2.5.2 羥自由基(·OH)清除能力 ·OH 是體內產生的活性氧,能帶給細胞很大的傷害,因此清除·OH 是很有必要的[32]。如圖7B 所示,BBMP-PH 在0.1~1.0 mg/mL 濃度范圍內的·OH 清除能力隨著濃度的升高逐漸增強,其半抑制濃度IC50值為1.16 mg/mL。魏潔瓊等[9]比較了不同蛋白酶對牛骨膠原蛋白肽酶解效果的影響,得出濃度為5 mg/mL 時堿性蛋白酶處理后的牛骨蛋白酶解物對·OH 清除率達到70.86%。本研究中,經胃蛋白酶水解所得的BBMP-PH 在濃度為1 mg/mL 時,對·OH 的清除能力達到51.23%,表明其具有較強的清除·OH 的能力。
2.5.3 超氧陰離子自由基(O2-·)清除能力 如圖7C所示,BBMP-PH 在0.1~1.0 mg/mL 濃度范圍內隨著濃度的增高,O2-·清除率也增高,當濃度為1.0 mg/mL時,BBMP-PH 的O2-·清除率達到最高值為66.92%,其半抑制濃度IC50值為0.35 mg/mL。郭佳俊等[31]研究表明,酶解法提取的牛骨膠原蛋白肽濃度為5 mg/mL 對O2-·的清除率為64.74%,由此可知,BBMPPH 的O2-·清除率高于牛骨蛋白酶解產物。
2.5.4 ABTS+·清除能力 如圖7D 所示,BBMP-PH在0.1~1.0 mg/mL 濃度范圍內隨著濃度的增高,ABTS+·清除率也增高。當濃度為1 mg/mL 時,清除率達到62.16%。徐紅萍等[33]經超聲波輔助酶解制備東海海參膠原蛋白低聚肽,當低聚肽濃度為8 mg/mL,其對ABTS+·的清除率達87.20%。本研究結果得出BBMPPH 清除ABTS+·的IC50值為0.57 mg/mL,說明具有較強的抗氧化活性。
2.5.5 總還原能力 生物大分子化合物的總還原能力與抗氧化活性之間具有顯著的相關性[34]。如圖7E 所示,0.1~1.0 mg/mL 濃度范圍內BBMP-PH 總還原能力明顯低于陽性對照維生素C。當濃度1.0 mg/mL 時BBMP-PH 總還原能力最高為0.88,表明被測蛋白的總還原能力較弱。隨著濃度的升高BBMP-PH 總還原能力有所提高。
3 結論
胃蛋白酶較適合于牛骨髓蛋白的酶解,酶解后理化性質及抗氧化活性進一步增強。最優條件為:酶解時間2 h、酶添加量2%、pH3、酶解溫度37 ℃,此時膠原肽的水解度為36.07%、蛋白含量為37.05%、DPPH·清除率為39.57%。pH 對牛骨髓膠原蛋白溶解性、乳化性、乳化穩定性及持水性的影響較為顯著。當pH 接近其等電點時,BBMP-PH 的溶解性、乳化性及乳化穩定性、持水性最低。BBMP-PH 在非等電點的酸性和堿性條件下的理化特性相應得到提升,隨pH 的增大其乳化性及乳化穩定性、持水性提高,當pH 為8 時乳化性及乳化穩定性達到1.11 m2/g 和101.37%,持水性最高為4.59 g/g,持油性為13.65 g/g。抗氧化實驗結果顯示,BBMP-PH 對DPPH·、·OH、O2-·、ABTS+·均具有清除能力和還原能力,且呈劑量效應關系。酶解處理可有效提高牛骨髓蛋白的理化特性及抗氧化能力,進一步擴大其在食品、醫藥等領域的開發應用范圍。

