空間代謝組學在中藥研究中的應用
趙 杰,馮素香
·專 論·
空間代謝組學在中藥研究中的應用
趙 杰1, 2,馮素香1*
1. 河南中醫藥大學中醫藥科學院,河南 鄭州 450000 2. 河南中醫藥大學,呼吸疾病中醫藥防治省部共建協同創新中心,河南 鄭州 450000
空間代謝組學是基于質譜成像和代謝組學技術發展而來的一門新興組學技術,通過原位檢測生物體系中內源性小分子和外源性藥物代謝物的分子結構、空間分布及含量變化,精準地反映代謝物在組織整體或微區的代謝網絡變化特征,深度揭示中藥的藥效物質基礎及作用機制。通過對近年來空間代謝組學技術在中藥質量控制、中藥在生物體內代謝及分布、中藥藥效機制和中藥毒性機制中的研究成果進行綜述,為探索基于空間代謝組學技術的中藥研究提供理論依據。
空間代謝組學;中藥;質量控制;體內代謝及分布;藥效機制;毒性機制
中藥在我國的應用已有數千年歷史積淀,在治療眾多復雜疾病方面具有豐富的臨床經驗和獨特于西醫的特色優勢。中藥是在中醫理論基礎指導下的遣方用藥,具有多成分、多靶點、多途徑和整體性等特點。雖然中藥臨床療效顯著,但一定程度上因藥效物質不明、作用機制不清,制約了其現代化發展。近年來,以生物體內小分子代謝物為研究主體的代謝組學技術飛速發展,其基于檢測整體代謝物動態變化的研究策略與中醫藥理論相切合,為解決中醫藥發展的瓶頸問題帶來了新機遇。目前已廣泛應用于揭示中藥物質基礎與藥效作用機制等方面的研究,并初步取得了諸多令人鼓舞的成果[1-2]。但是,由于中藥成分在生物體內的代謝和分布往往具有精準的空間定位,使得藥效作用與其在生物組織整體或微區的空間分布密不可分。然而,傳統代謝組學由于樣本前處理方法的限制,導致代謝物在組織中的空間分布信息缺失,使中藥的效應部位和藥效機制難以得到全面、客觀地詮釋。
空間代謝組學是將質譜成像與代謝組學技術相結合的一種新興組學技術,一方面通過質譜成像技術提供代謝物在組織整體或微區的精確分布,另一方面利用代謝組學技術對區域內的差異性成分進行深度挖掘與生物信息學分析,從而將代謝物及其生物學功能與生物組織解剖特征相關聯,更為精準、科學地解析中藥的藥效成分及在生物體內對疾病的調控機制。因此,通過空間代謝組學技術構建“分子結構-空間分布-含量變化-代謝通路”相互關系,為尋找中藥藥效成分、治療靶點和作用機制提供新思路。本文通過總結空間代謝組學技術在中藥質量控制、中藥在生物體內代謝及分布、中藥藥效機制和中藥毒性機制中的研究進展,并對空間代謝組學在中藥研究中存在的不足和未來的發展方向進行了思考和展望,為探索基于空間代謝組學技術的中藥研究提供理論依據,促進中藥的現代化、國際化進程。
1 空間代謝組學概述
1.1 空間代謝組學技術
代謝組學由英國Nicholson教授提出,最初用于測定由遺傳或病理生理變化導致的生物體內小分子代謝物動態變化情況,目前已廣泛用于尋找疾病生物標志物、揭示疾病發病及中藥藥效作用機制等研究[3-5]。代謝組學分析的樣本檢測前通常需要進行萃取、研磨或勻漿等前處理。但是,對待分析樣本的均質化處理將使得代謝產物在原有組織中的空間分布信息喪失。由于生物組織器官因由多種類型細胞構成并具有異質性和復雜性,代謝物的空間分布與其病理生理功能改變緊密相關,有必要將代謝物動態變化與空間位置分布聯系起來[6]。傳統色譜-質譜聯用技術的代謝組學方法已無法滿足此類需求,同時隨著分子原位成像技術的不斷發展,促進了空間代謝組學的誕生。
空間代謝組學是組學研究的一個新技術,能夠在樣本復雜的空間結構背景下檢測內源性小分子物質及藥物及其代謝物,并揭示各類物質含量變化的潛在機制[7]。與傳統代謝組學相比,空間代謝組學的特點主要表現在樣本預處理操作簡化,不破壞待測樣本結構,保留代謝物在組織中的空間分布信息[8]。空間代謝組學的發展,在很大程度上是由質譜成像技術的快速發展所推動的。質譜成像是一種新興的分子成像技術,其能夠利用質譜儀直接采集待測樣本切片的離子信息,并通過專業數據處理軟件將質譜數據可視化,獲得內源性分子與外源性藥物及其代謝物分子的結構、在組織切片中的空間分布和含量信息[9]。與其他可視化分析技術相比,質譜成像技術具有免標記、高覆蓋、高靈敏度和檢測范圍廣等特點[10]。目前,空間代謝組學中應用的質譜成像技術主要包括:二次離子質譜成像(secondary ion mass spectrometry mass spectrometry imaging,SIMS-MSI)、基質輔助激光解吸電離質譜成像(matrix-assisted laser desorption ionization mass spectrometry imaging,MALDI-MSI)和解吸電噴霧電離質譜成像(desorption electrospray ionization mass spectrometry imaging,DESI-MSI)等[11]。其中,現階段以MALDI-MSI技術在空間代謝組學中的應用最為廣泛。近年來,研究者針對MALDI-MSI質譜技術需要真空操作、樣本處理復雜等問題,后續研發出了多種常壓敞開式質譜成像技術并建立了相應的空間代謝組學方法,如激光消融電噴霧電離質譜成像技術和空氣動力輔助解吸電噴霧離子化質譜成像技術(air-flow-assisted desorption electrospray ionization mass spectrometry imaging,AFADESI-MSI)等[12-13]。常壓敞開式質譜成像技術降低了對質譜采集環境的要求,簡化了樣本預處理操作,為空間代謝組學的發展提供了新的契機。
1.2 空間代謝組學的流程
空間代謝組學的研究流程主要包括組織樣本獲取、切片制備、質譜數據采集和成像數據分析(圖1)。其中,樣本獲取和切片制備是影響質譜成像結果真實性和準確性的關鍵環節,此過程中樣本的完整性和分子密度的細微差別都會對檢測的分子類型、質譜響應強度或空間定位產生影響[14]。在切片制備過程中,樣本通常快速冷凍于液氮后切片;而對于整體動物和不易于切片的組織樣本則需要在切片之前進行包埋處理[15-16]。對于中藥材樣本,質地較為堅硬的根莖類藥材一般需要利用適宜的介質進行包埋處理后冷凍切片;而花、葉類中藥鮮品在質譜數據采集過程中容易變形或移位,則需要采用轉印法間接分析[17-18]。冷凍或包埋處理的樣本通常采用冷凍切片機制備厚度均一的組織切片,厚度一般控制在5~20 μm[19],隨后采用融裱法、膠帶法等方式將冷凍切片轉移至質譜靶上。在質譜成像儀掃描采集質譜數據之前,需要根據采用的質譜成像技術對切片進行相應的預處理。在MALDI-MSI技術中,為了提高檢測離子響應強度需要對樣本切片涂覆基質,通常分析氨基酸、核苷酸類低相對分子質量化合物選用2,5-二羥基苯甲酸;分析蛋白質、低聚糖類化合物選用芥子酸;對于相對分子質量500以下的小分子化合物選用3,4-二甲氧基肉桂酸和納米材料等新型基質[20]。采用SIMS-MSI、DESI-MSI和其他敞開式離子化質譜成像技術則無需預處理即可上機。
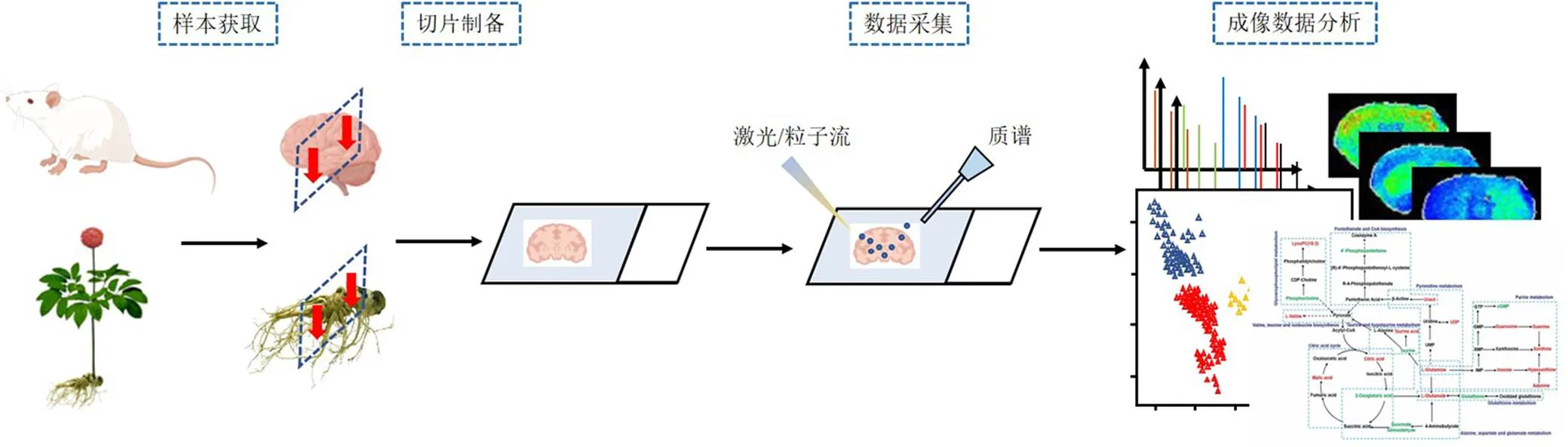
圖1 空間代謝組學研究流程圖
樣本數據經質譜掃描儀采集后,需要對數據進行批量讀取、背景扣除、數據篩選及生成圖像等,常用的軟件包有MassImager、MSiReader和ImageQuest等[21-22]。利用成像軟件將成像離子圖譜與組織切片的光學圖像或連續切片的病理染色圖像相結合,提取不同微區的質譜數據,進行多元統計分析,隨后根據變量投影重要性指標、獨立樣本檢驗和倍率變化篩選差異代謝物。差異代謝物通過HMDB和METLIN等在線數據庫進行二級碎片離子匹配后,經在線網站MetaboAnalyst進行代謝通路分析。
2 空間代謝組學在中藥質量控制中的應用
中藥質量控制是確保中藥臨床療效的重要保障。中藥藥用部位的成分組成、含量和分布情況能夠直觀地反映中藥質量,但傳統分析方法難以實現。空間代謝組學利用質譜成像技術對成分進行原位表征,從而對中藥品種、產地、生長年限、采摘時期和炮制加工等環節進行評價,在中藥質量控制中具有廣闊的應用前景。近年來,空間代謝組學在中藥質量控制中的研究見表1。
Li等[23]基于MALDI-MSI技術對芍藥和牡丹根進行鑒別,對單萜類、丹皮酚苷類和鞣質酸等成分進行空間分布表征,其中芍藥苷及其衍生物主要聚集在2種藥材根的木質部和韌皮部,而牡丹皮苷和牡丹皮苷A等成分主要見于芍藥根皮層和木質部及牡丹根的皮層和韌皮部。該研究首次可視化了沒食子鞣質生物合成途徑主要中間體的空間分布,發現沒食子酸、沒食子酰葡萄糖等13個主要中間體在2種藥材根部的空間分布存在明顯差異,為藥用成分在不同藥材中的空間分布及生物合成途徑的研究具有指導意義。Nie等[24]首次采用DESI-MSI技術鑒定了板藍根中包括生物堿、核苷和氨基酸類等在內的102個代謝物,并對其中19個代謝物在藥材中的空間分布進行研究,其中優質板藍根藥材橫截面皮部占比多于木部,且皮部中代謝物離子強度較高。該研究隨后對不同品質板藍根藥材進行了正交偏最小二乘判別分析,發現精氨酸、3-甲酰基吲哚和紫丁香苷等11個代謝物可以作為區分優質和劣質板藍根的質量控制標志物。與傳統的板藍根質量評價方法相比,該研究將板藍根的形態特征與化學成分特征直接聯系起來,進一步完善了板藍根藥材的質量控制方法。Liu等[25]建立了雙層介質嵌入樣品制備方法,并采用SIMS-MSI首次對天然和人工冬蟲夏草的蟲體進行原位化學成分分析和成像,鑒定并成像的成分超過200個,其中大多數成分在蟲體中分布均勻,而三酰甘油、甘油二酯、髓鞘相關糖蛋白和脂肪酸類成分只在蟲體的消化室外分布。該研究發現,除脂肪酸、甘油和甘油磷脂類成分外,2種冬蟲夏草的氨基酸、核苷、單糖、鞘脂和甾醇類成分比例相當。相較于傳統的冬蟲夏草質量控制方法,僅能分析特定溶劑在特定條件下提取的一類或幾類成分,該研究提供了一種無需溶劑萃取即可同時測定和評估各類成分的方法,為冬蟲夏草的鑒別提供了新方案。此外,研究者對丹參[26]、姜黃素[27]、三七[28]、黃連[29]、石斛[30]和銀杏[31]等藥材成分的空間分布均進行了表征,為該類藥材的質量控制和成分特征部位的分離提取提供參考。
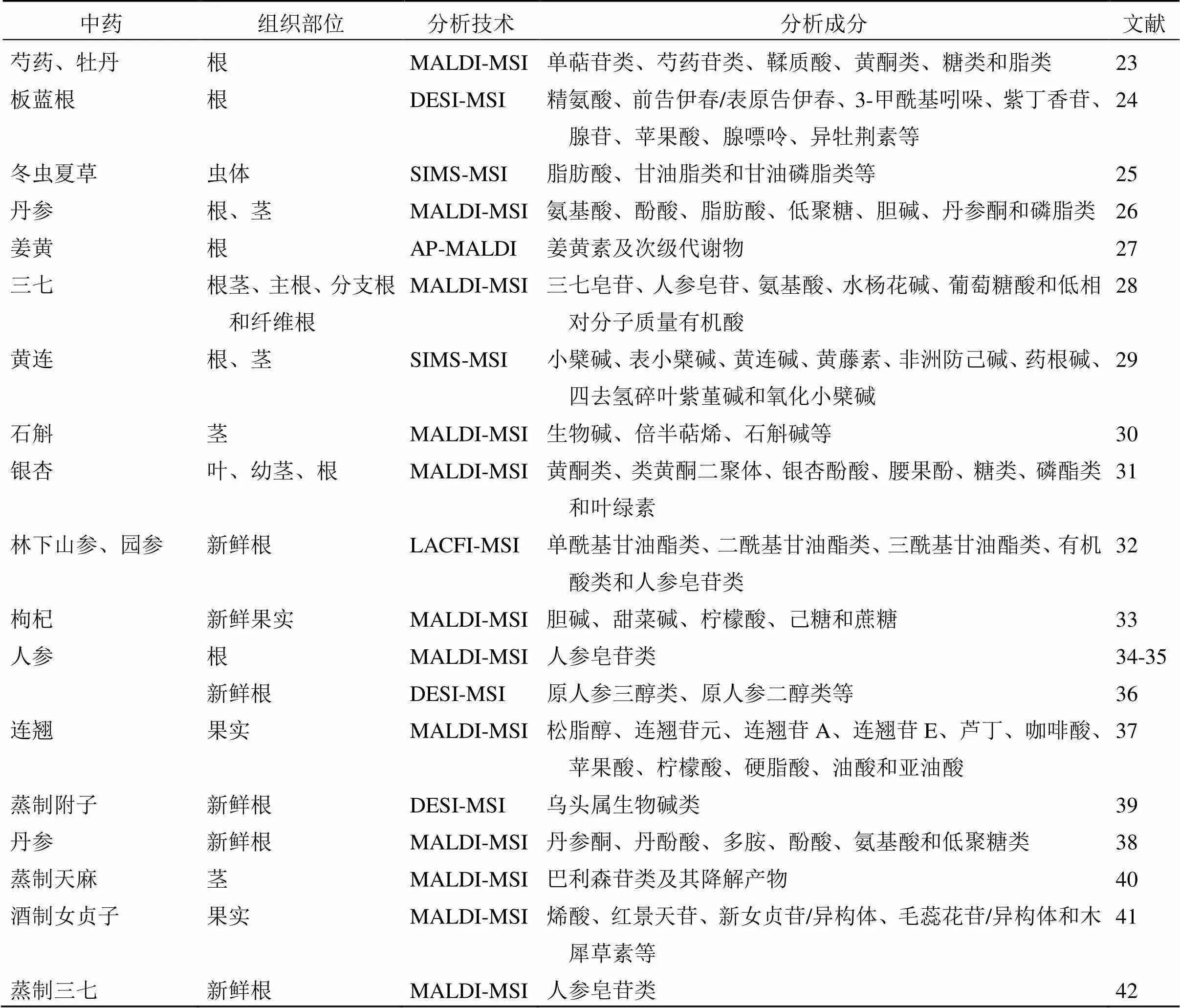
表1 空間代謝組學在中藥質量控制中的應用
生長環境和年限能夠對中藥成分組成及含量產生直接影響,是中藥材質量控制的主要考察指標。Lu等[32]建立了高靈敏度的激光燒蝕碳纖維離子化質譜成像(laser ablation carbon fiber ionization mass spectrometry imaging,LACFI-MSI)分析方法,對不同年限林下山參和園參新鮮根中活性代謝物的空間分布進行了表征。該研究利用碳碳雙鍵廣泛存在于人參皂苷類、聚乙烯類和萜烯類等活性成分中,采用[d]/[d]-雙(吡啶)四氟硼化碘作為碳碳雙鍵衍生化試劑增強代謝物響應度,同時可視化了52種代謝物的空間分布,并通過相關性分析發現林下山參中代謝物的相關性高于園參。該研究避免了利用單一生物活性成分作為區分林下山參和園林參的不足。Zhao等[33]基于MALDI-MSI技術對枸杞果實發育過程中內源性分子的空間分布進行了可視化,結果顯示在此過程中內源性分子空間分布差異較大。其中,膽堿、甜菜堿和檸檬酸均呈均勻分布,己糖主要分布在內果皮和果肉組織中,蔗糖主要分布在種子組織中。隨著果實的發育,檸檬酸的信號強度降低,而膽堿、甜菜堿、己糖和蔗糖的信號強度增加。該研究填補了傳統技術無法呈現的內源性分子空間分布信息,為深入了解內源性分子生物合成和積累過程提供了新思路。此外,研究者對不同生長年限的人參[34-36]、不同收獲階段的連翹[37]和連作丹參[38]的成分空間分布進行分析,結果顯示生長年限和收獲階段及種植方式不同中藥所含成分會發生較大變化,為提高種植中藥質量及中藥材質量控制提供重要依據。
中藥炮制是我國特有的藥材加工環節,對中藥藥性轉變、減毒增效等方面具有獨特作用,運用空間代謝組學技術能夠直觀反映出炮制前后中藥所含成分的變化,可為炮制的工藝優化提供科學指導。Liu等[39]通過結合DESI-MSI和代謝組學技術,對不同時間蒸制的附子中烏頭屬生物堿類化合物進行質譜成像和分析,發現生附子和制附子內烏頭堿類成分明顯不同,且蒸制4 h對毒性成分的減弱及藥效成分的保留效果最佳。同時,篩選了42個代謝標志物用于區分蒸制4、8 h的附子,并揭示了蒸制中的減毒過程主要是二酯二萜生物堿水解為單酯二萜生物堿再水解為非酯化二萜生物堿。該研究簡化了傳統分析方法中復雜的樣本制備過程,從原始藥材樣本中直接分析和識別毒性成分變化,為確定附子的最佳炮制時間提供了理論依據。Ma等[40]利用MALDI-MSI技術對天麻在蒸制過程中13個酚類內源性分子的“空間-時間-含量”進行表征,并通過整合巴利森苷類成分與相應水解酶的空間分布信息,揭示了蒸制能夠導致水解酶失活進而保護巴利森苷類成分,為天麻炮制工藝的改進和標準化奠定了基礎。另外,通過分析女貞子[41]和三七[42]藥材炮制過程中成分的空間分布情況發現,炮制過程中藥成分發現明顯變化,為從宏觀角度闡明中藥炮制機制提供理論支撐。
3 空間代謝組學在中藥的生物體內代謝及分布研究中的應用
中藥活性成分在動物各組織中的分布和代謝情況對明確中藥的靶器官、藥效物質基礎、作用機制和評估潛在不良反應具有重要作用。然而,傳統分析技術在樣本制備過程中會破壞組織結構,難以清晰表征中藥活性成分及代謝物在區域內分布情況。空間代謝組學依托質譜成像技術,結合多變量統計分析手段,能夠同時表征中藥活性成分及其代謝物在不同組織器官整體或微區的空間代謝分布,呈現更為完整的代謝過程。近年來,空間代謝組學在中藥的生物體內代謝分布中的研究見表2。
Gao等[43]采用DESI-MSI技術對7種鉤藤生物堿在大鼠大腦的分布情況進行定量成像,發現7種生物堿在大鼠大腦存在相似的分布特征且呈彌漫分布,分布趨勢分別為單萜吲哚生物堿>單萜氧化吲哚生物堿,型異構體>型異構體。該研究首次在松果體中檢測到鉤藤生物堿,對今后該類成分的藥效學研究具有指導意義。Wang等[44]結合MALDI-MSI技術成功建立了針對野黃芩苷和其代謝物在小鼠腎臟的成像方法,優化了氧化石墨烯和咖啡酸的二元基質檢測條件,提高野黃芩苷及3個代謝物在小鼠腎組織切片中的檢測效率。此外,相較于傳統代謝組學技術無法提供活性成分在組織內的空間分布信息,該研究在小鼠ip野黃芩苷后,發現野黃芩苷及其代謝物野黃芩素2種成分主要分布在腎皮質和髓質區且豐度較高,提示其可能具有預防和治療腎臟疾病的潛能。Zhu等[45]通過超高效液相色譜-高分辨質譜和DESI-MSI技術,結合內部非目標精確和徹底背景扣除數據處理技術,用于消渴丸在斑馬魚體內的藥動學分析。該研究在斑馬魚體內共檢測出消渴丸相關的13種原型成分和36種代謝物。隨后對芒柄花黃素在斑馬魚體內代謝分布的研究發現,其能夠進入斑馬魚體循環,并與體內葡萄糖醛酸結合形成芒柄花黃素葡萄糖醛酸結合物,在體內廣泛分布,尤以頭部和胃腸道居多。該研究為快速分析中藥復方在生物體內的藥動學特征及有效活性成分的高通量篩選提供了參考。Wei等[46]建立了基于液相色譜串聯質譜聯合DESI技術,用于分析大鼠iv人參皂苷Rg1后不同時間點在各組織切片內的空間分布情況,其中人參皂苷Rg1在腎臟濃度最高,隨后依次為肝臟、肺、胰腺、心臟和大腦,并在1 h內迅速清除。同時,該研究亦發現人參皂苷Rg1在腎臟主要集中在腎盂段,而在大腦則分布于腦橋和延髓區。此項研究真實地反映了人參皂苷Rg1在各組織中的空間分布信息,為進一步探究其療效及藥物開發提供了參考。Meng等[47]使用MALDI-MSI技術對紅景天苷在小鼠腎臟、肝臟和脾臟等多個組織器官切片中的分布情況進行成像表征,該研究發現小鼠iv紅景天苷后,主要分布于肝臟、腎臟和肺中,且在肝臟和肺中呈均勻分布,而在腎臟中則呈不均勻分布,推測可能與不同組織區域的血流灌注差異及葡萄糖共同轉運體的不均勻表達有關。同時該研究證實MALDI-MSI技術與傳統技術分析結果一致,但能夠將紅景天苷在組織中的分布情況可視化,促進其對各器官的生物活性及潛在毒性的研究。Zhang等[48]利用虛擬校準定量質譜成像(virtual calibration quantitative mass spectrometry imaging,VC-QMSI)和AFADESI-MSI方法對紫杉醇和其前體藥物在整體裸小鼠和其皮下移植腫瘤組織切片中的分布情況進行定量分析,發現在注射紫杉醇或其脂質體后,藥物分布在裸小鼠的多個器官內,并且在胃腸道部位積累明顯,而腎臟幾乎無分布,提示紫杉醇主要通過膽汁排泄到糞便中。而注射紫杉醇前體藥物后,其與代謝后產生的紫杉醇則主要分布在腫瘤組織部位,并且在腫瘤內低分化區和壞死區存在明顯特異性聚集。該研究為尋找中藥靶器官、預測中藥藥效及安全性具有指導意義。
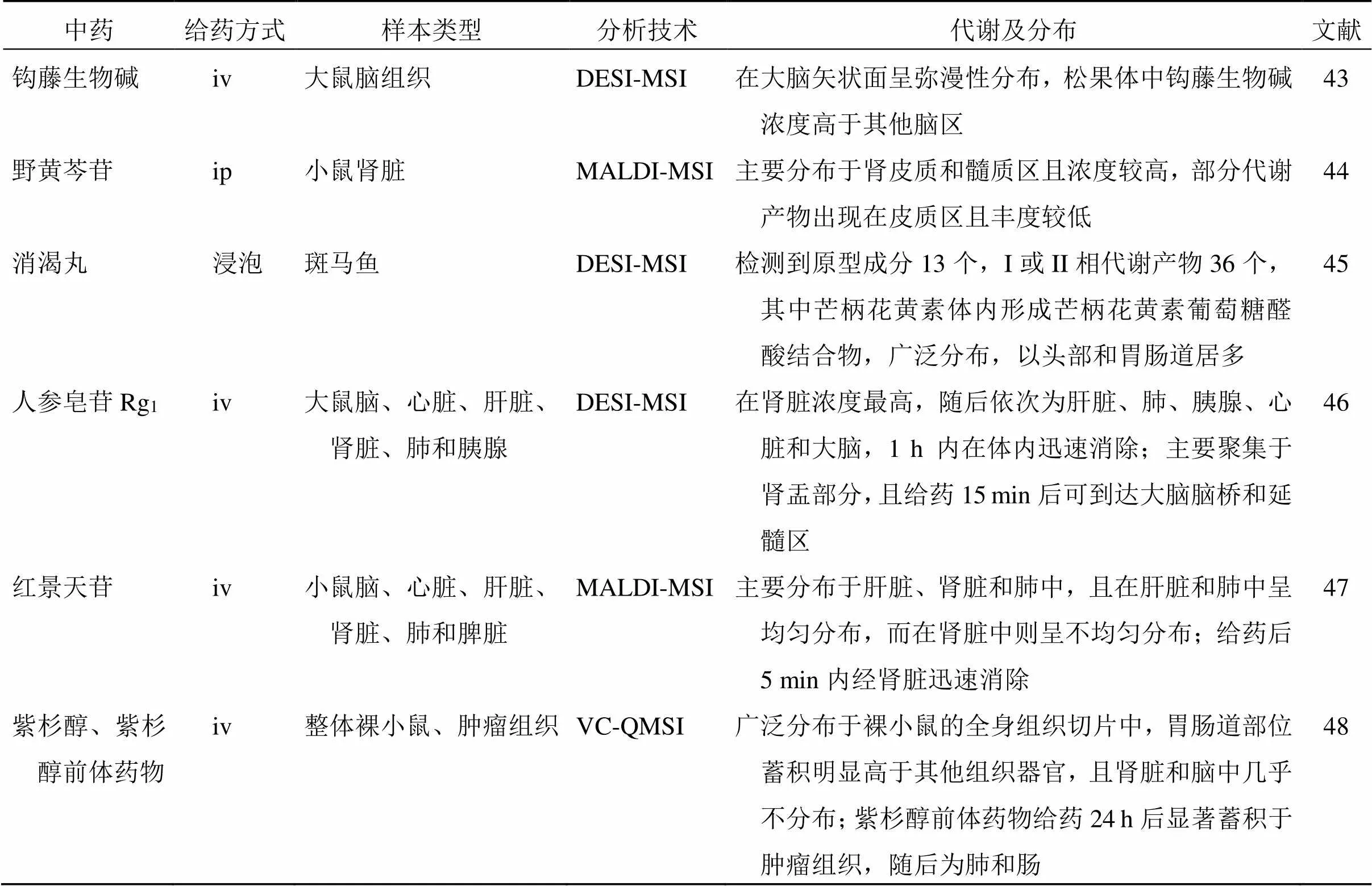
表2 空間代謝組學在中藥的生物體內代謝及分布研究中的應用
4 空間代謝組學在中藥藥效機制研究中的應用
中藥及中藥復方因其多成分、多靶點特性在治療復雜疾病方面具有突出優勢,但也為闡明藥效機制帶來了挑戰。空間代謝組學技術能夠對代謝物在組織整體或微區的分布進行原位表征,并且與組織病理學結果相關聯,更為深入地揭示藥效與代謝物之間的相互作用,為中藥藥效機制賦予科學內涵。近年來基于空間代謝組學的中藥藥效及作用機制研究見表3。
Huang等[49]基于DESI-MSI的空間代謝組學方法,研究人參和西洋參對大鼠腦內神經化學物質分布的影響。采用DESI-MSI技術對大鼠腦組織切片進行數據采集,隨后通過偏最小二乘判別分析對溫性和寒性相關的神經化學物質進行區分,篩選并鑒定出與人參和西洋參不同特性相關的神經化學標志物。該研究共鑒定了25個神經化學物質,并對其進行了質譜成像分析,均主要分布于大腦矢狀面和冠狀面,其中17個歸類為溫性標志物,8個歸類為涼性標志物。該研究根據神經化學物質的貢獻度證明人參具有溫性,而西洋參具有涼性。同時發現溫性和涼性神經化學物質在大腦不同區域的分布及含量變化均會影響機體功能和代謝的變化,為揭示大鼠腦內小分子神經化學物質的空間分布和代謝提供了一種快速有效地可視化方案。Li等[50]利用基于液體萃取表面采樣方法和納米噴霧DESI-MSI(nano-spray DESI-MSI,nanoDESI-MSI)的空間代謝組學技術對外傷性腦損傷(traumatic brain injury,TBI)發病機制及血府逐瘀湯治療作用機制進行了研究。采用脂質代謝組學分析空白組、TBI組和血府逐瘀湯治療組大鼠不同腦區組織的差異脂質物質,隨后利用微液節點采樣質譜成像技術分析大鼠腦組織切片,獲取目標脂質物質在不同組大鼠各腦區的定量空間分布情況,進而揭示疾病進程及治療響應機制。該研究發現TBI后損傷區域外彌漫性變化最大的是中腦區,并且在中腦和丘腦中多種磷脂酰膽堿、磷脂酰乙醇胺、磷脂酰酸和二酰甘油類代謝物含量在血府逐瘀湯治療后顯著升高,這與神經炎癥在TBI慢性期激活的“自我修復”機制有關。另外,腦損傷后大部分腦區內的糖鞘脂類含量顯著升高,并且包括脂肪酸、氨基酸和嘌呤等在內的小分子代謝物在TBI后均發生明顯變化,涉及10條代謝通路,其中6個血府逐瘀湯的靶蛋白與上述通路相關。Zhang等[51]利用脂質組學和MALDI-MSI技術對蟾毒靈、華蟾蜍精及聯合治療作用后的裸鼠腫瘤組織及切片進行分析,闡明蟾毒靈聯合華蟾蜍精抗癌的藥效作用機制。研究發現蟾毒靈聯合華蟾蜍精使用主要引起腫瘤細胞中鞘脂和甘油磷脂類脂質代謝物的改變,進一步證實其影響了相關代謝酶的表達,從而導致腫瘤細胞線粒體驅動的細胞凋亡和生物膜的系統性破壞。同時,該研究通過對抗癌脂質標志物進行空間分布可視化,發現卵磷脂(20∶1/18∶2)和磷脂酰甘油(16∶0/18∶2)等4個顯著變化的脂質代謝物主要分布在腫瘤的實質區和間質區。該研究為揭示脂質重編程在蟾毒靈聯合華蟾蜍精抗癌中的作用及臨床應用提供了理論依據。Tian等[52]首次利用MALDI-MSI技術對百里醌治療大鼠腦缺血再灌注損傷的作用機制進行了研究,發現百里醌夠改善模型大鼠神經行為評分,減少腦梗死面積及腦水腫,增加損傷后正常神經元數量。進一步對大鼠腦組織切片的質譜成像研究發現,大鼠腦缺血區主要位于受損傷側的皮層和紋狀體區域,并且百里醌能夠升高損傷區能量代謝、抗氧化和磷酯類等分子代謝物的含量,揭示了百里醌藥效機制可能與調節能量代謝和小分子基底物質代謝有關。Liu等[53]基于代謝組學和DESI-MSI技術研究了聚果榕果治療糖尿病大鼠的潛在藥效機制。發現聚果榕果提取物能夠抑制血糖水平并改善組織損傷程度,通過血清和肝臟代謝學組及肝臟組織切片質譜成像分析結果相互印證,明確聚果榕果的藥效作用機制與調節氨基酸代謝和能量代謝有關。該研究為闡明中藥藥效作用機制提供了新思路。

表3 空間代謝組學在中藥藥效及作用機制研究中的應用
5 空間代謝組學在中藥毒性機制研究中的應用
由于中藥中部分藥材存在嚴重的多器官毒性,使含毒性藥材的中藥復方安全性備受質疑。然而,中藥毒性成分往往是其藥效成分,并具有其他中藥無法替代的獨特療效。因此,明確中藥毒性物質基礎及作用機制對有毒中藥的減毒增效、臨床合理應用及低毒新藥研發意義重大。空間代謝組學能夠研究毒性中藥成分及其代謝物在組織器官內的分布及生物代謝過程情況,為確定毒性靶器官并揭示毒性分子機制提供科學依據。
Wang等[54]采用基于AFADESI-MSI技術的空間代謝組學方法,研究了馬兜鈴酸I給藥后大鼠腎臟切片的空間代謝譜變化情況并揭示了其腎毒性作用機制,篩選出了包括肌酸酐、肌酸和精氨酸等在內的38個差異代謝物,涉及通路包括精氨酸-肌酸酐代謝通路、尿素循環、絲氨酸合成通路、脂類、膽堿、組胺、賴氨酸和三磷酸腺苷的代謝通路。通過質譜成像與相鄰組織的病理切片對比發現,涉及代謝物主要分布在腎組織形態改變的病理病變區域。此外,發現給予馬兜鈴酸I后大鼠腎皮質的代謝變化比腎外髓質和腎內髓質的代謝變化更顯著,提示腎皮質對馬兜鈴酸I毒性更為易感。與傳統代謝組學技術分析結果相比,該研究可視化了差異代謝物在組織內的空間分布情況,更有利于篩選與藥物毒性密切相關的原位生物標志物,揭示潛在的毒性分子機制。Li等[55]通過空間代謝組學和脂質組學方法對魚藤酮致小菜蟲毒性作用機制進行了研究。通過對小菜蟲整體切片的質譜成像分析發現,單磷酸腺苷和肌苷在小菜蛾全身分布且在魚藤酮暴露后水平顯著升高,而鳥苷-5′-單磷酸和色氨酸則顯著下調,提示魚藤酮能夠影響小菜蛾體內嘌呤和氨基酸代謝。空間脂質組學結果表明,魚藤酮可顯著破壞小菜蛾細胞膜中的甘油磷脂,抑制脂肪酸生物合成,消耗甘油二酯,促進脂肪氧化。該研究表明空間代謝組學不僅能夠發現代謝變化,而且亦可揭示代謝變化涉及的特定組織區域及關鍵代謝途徑,為中藥的毒性作用機制研究提供了新方案。Jiang等[56]采用空間代謝組學與網絡毒理學整合分析方法,對何首烏導致肝毒性作用機制進行研究。利用網絡毒理學篩選出何首烏的30個潛在肝毒性作用靶點,涉及的通路包括磷脂酰肌醇3-激酶(phosphatidylinositol-3-kinase,PI3K)-蛋白激酶B(protein kinase B,Akt)、絲裂原活化蛋白激酶、哺乳動物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)、Ras和缺氧誘導因子-1通路,并且分子對接結果證實8個關鍵毒性成分與mTOR、PIK3CA和Akt1等10個核心靶點具有高結合活性。對小鼠肝臟切片的空間代謝組學分析發現,何首烏提取物給予小鼠后肝臟代謝分布顯著改變,篩選出牛磺酸、牛磺膽酸、腺苷和乙酰肉毒堿類等小分子代謝物與何首烏肝毒性有關,涉及通路包括亞麻酸和亞油酸代謝、肉毒堿合成和支鏈脂肪酸氧化等6條代謝通路。隨后,整合分析發現何首烏導致肝毒性機制與膽汁淤積、線粒體損傷、氧化應激和能量、脂質代謝紊亂密切相關,為何首烏的肝毒性機制及安全臨床應用提供了理論基礎。
6 結語與展望
空間代謝組學是近年來基于質譜成像技術逐漸發展起來的組學研究新方法,其填補了傳統代謝組學對原位可視化分析的不足,在尋找潛在生物標志物和闡明疾病的發病機制等方面取得了諸多研究成果,已成為生命科學及醫學等領域的研究熱點。將空間代謝組學技術引入到中藥領域研究中,能夠為中藥質量控制、體內代謝分布、藥效機制和毒性機制的研究提供新的視角。然而,目前空間代謝組學在中藥領域的研究仍處于起步發展階段,在實際應用過程中,仍然存在諸多不足,可以從以下方面開展深入研究:(1)空間代謝組學在樣本制備、數據采集和處理等其他關鍵性操作過程中尚未形成統一規范的操作準則,導致實驗結果重現性較差,因此有必要建立規范的空間代謝組學操作流程和定量分析方法;(2)空間代謝組學利用質譜成像儀捕獲組織切片中代謝物的精確質譜信息,儀器的靈敏度和分辨率對后續分析至關重要,而提高檢測分辨率將大大延長成像時間,因此迫切需要能夠兼顧高分辨率和成像速度的新型高靈敏度質譜成像設備;(3)深入開展中藥活性/毒性成分及其代謝產物與體內差異代謝物的空間分布關聯性研究,進而明確中藥活性/毒性成分及其作用靶區,更精確地闡明中藥的藥效或毒性作用機制;(4)將空間代謝組學與空間蛋白質組學和空間轉錄組學等空間組學技術相結合,實現在細胞或亞細胞水平對中藥質量控制、代謝分布及藥效或毒性機制等的深層次研究。綜上所述,空間代謝組學技術在中藥領域的研究仍存在巨大的發展空間,經過不斷地完善與創新,必然會進一步推動中藥的現代化發展。
利益沖突 所有作者均聲明不存在利益沖突
[1] Wang M, Chen L, Liu D,. Metabolomics highlights pharmacological bioactivity and biochemical mechanism of traditional Chinese medicine [J]., 2017, 273: 133-141.
[2] 崔芙巖, 楊佳穎, 王志剛, 等. 代謝組學在中醫藥領域的應用與展望 [J]. 中草藥, 2022, 53(14): 4512-4526.
[3] Nicholson J K, Lindon J C, Holmes E. ‘Metabonomics’: Understanding the metabolic responses of living systems to pathophysiological stimuli via multivariate statistical analysis of biological NMR spectroscopic data [J]., 1999, 29(11): 1181-1189.
[4] Du X H, Yang L, Kong L,. Metabolomics of various samples advancing biomarker discovery and pathogenesis elucidation for diabetic retinopathy [J]., 2022, 13: 1037164.
[5] Wu G S, Li H K, Zhang W D. Metabolomics and its application in the treatment of coronary heart disease with traditional Chinese medicine [J]., 2019, 17(5): 321-330.
[6] Dyar K A, Eckel-Mahan K L. Circadian metabolomics in time and space [J]., 2017, 11: 369.
[7] Petras D, Jarmusch A K, Dorrestein P C. From single cells to our planet-recent advances in using mass spectrometry for spatially resolved metabolomics [J]., 2017, 36: 24-31.
[8] Fox B W, Schroeder F C. Toward spatially resolved metabolomics [J]., 2020, 16(10): 1039-1040.
[9] Ma X, Fernández F M. Advances in mass spectrometry imaging for spatial cancer metabolomics [J]., 2022, e21804.
[10] 再帕爾·阿不力孜. 質譜分子成像技術與應用進展 [J]. 分析測試學報, 2022, 41(9): 1335-1344.
[11] Chughtai K, Heeren R M A. Mass spectrometric imaging for biomedical tissue analysis [J]., 2010, 110(5): 3237-3277.
[12] Hieta J P, Kopra J, R?ikk?nen H,. Sub-100 μm spatial resolution ambient mass spectrometry imaging of rodent brain with laser ablation atmospheric pressure photoionization (LAAPPI) and laser ablation electrospray ionization (LAESI) [J]., 2020, 92(20): 13734-13741.
[13] He J J, Luo Z G, Huang L,. Ambient mass spectrometry imaging metabolomics method provides novel insights into the action mechanism of drug candidates [J]., 2015, 87(10): 5372-5379.
[14] Buchberger A R, DeLaney K, Johnson J,. Mass spectrometry imaging: A review of emerging advancements and future insights [J]., 2018, 90(1): 240-265.
[15] Goodwin R J A, Nilsson A, Borg D,. Conductive carbon tape used for support and mounting of both whole animal and fragile heat-treated tissue sections for MALDI MS imaging and quantitation [J]., 2012, 75(16): 4912-4920.
[16] Huber K, Khamehgir-Silz P, Schramm T,. Approaching cellular resolution and reliable identification in mass spectrometry imaging of tryptic peptides [J]., 2018, 410(23): 5825-5837.
[17] Li S L, Zhu N L, Tang C P,. Differential distribution of characteristic constituents in root, stem and leaf tissues ofusing MALDI mass spectrometry imaging [J]., 2020, 146: 104679.
[18] Mohana Kumara P, Uma Shaanker R, Pradeep T. UPLC and ESI-MS analysis of metabolites ofL. and their spatial localization using desorption electrospray ionization (DESI) mass spectrometric imaging [J]., 2019, 159: 20-29.
[19] He M J, Pu W J, Wang X,. Comparing DESI-MSI and MALDI-MSI mediated spatial metabolomics and their applications in cancer studies [J]., 2022, 12: 891018.
[20] Zhu X P, Xu T Y, Peng C,. Advances in MALDI mass spectrometry imaging single cell and tissues [J]., 2021, 9: 782432.
[21] Sun C L, Li T G, Song X W,. Spatially resolved metabolomics to discover tumor-associated metabolic alterations [J]., 2019, 116(1): 52-57.
[22] Holm N B, Deryabina M, Knudsen C B,. Tissue distribution and metabolic profiling of cyclosporine (CsA) in mouse and rat investigated by DESI and MALDI mass spectrometry imaging (MSI) of whole-body and single organ cryo-sections [J]., 2022, 414(24): 7167-7177.
[23] Li B, Ge J Y, Liu W,. Unveiling spatial metabolome ofandroots using MALDI MS imaging [J]., 2021, 231(2): 892-902.
[24] Nie L X, Huang L Y, Wang X P,. Desorption electrospray ionization mass spectrometry imaging illustrates the quality characters of[J]., 2022, 13: 897528.
[25] Liu Q B, Lu J G, Jiang Z H,.chemical profiling and imaging of cultured and naturalby TOF-SIMS [J]., 2022, 10: 862007.
[26] Sun C L, Liu W, Ma S S,. Development of a high-coverage matrix-assisted laser desorption/ionization mass spectrometry imaging method for visualizing the spatial dynamics of functional metabolites inBge [J]., 2020, 1614: 460704.
[27] Shimma S, Sagawa T. Microscopy and mass spectrometry imaging reveals the distributions of curcumin species in dried turmeric root [J]., 2019, 67(34): 9652-9657.
[28] Sun C L, Ma S S, Li L L,. Visualizing the distributions and spatiotemporal changes of metabolites inby MALDI mass spectrometry imaging [J]., 2021, 45(6): 726-733.
[29] He F, Huang Y F, Dai W,. The localization of the alkaloids inrhizome by time-of-flight secondary ion mass spectrometry [J]., 2022, 13: 1092643.
[30] Liu Q L, Huang Y, Linghu C,. Metabolic profiling, in-situ spatial distribution, and biosynthetic pathway of functional metabolites instem revealed by combining UPLC-QTOF-MS with MALDI-TOF-MSI [J]., 2022, 13: 1125872.
[31] Li B, Neumann E K, Ge J Y,. Interrogation of spatial metabolome ofwith high-resolution matrix-assisted laser desorption/ionization and laser desorption/ ionization mass spectrometry imaging [J]., 2018, 41(11): 2693-2703.
[32] Lu Y J, Cao Y Q, Chen D Q,. An online derivatization strategy targeting carbon-carbon double bonds by laser-ablation carbon fiber ionization mass spectrometry imaging: Unraveling the spatial characteristic in mountain-cultivated ginseng and garden-cultivated ginseng with different ages [J]., 2023, 410: 135365.
[33] Zhao W H, Zhang Y D, Shi Y P. Visualizing the spatial distribution of endogenous molecules in wolfberry fruit at different development stages by matrix-assisted laser desorption/ionization mass spectrometry imaging [J]., 2021, 234: 122687.
[34] Bai H R, Wang S J, Liu J J,. Localization of ginsenosides inwith different age by matrix-assisted laser-desorption/ionization time-of-flight mass spectrometry imaging [J]., 2016, 1026: 263-271.
[35] Lee J W, Ji S H, Lee Y S,. Mass spectrometry based profiling and imaging of various ginsenosides fromroots at different ages [J]., 2017, 18(6): 1114.
[36] Yang Y G, Yang Y B, Qiu H,. Localization of constituents for determining the age and parts of ginseng through ultraperfomance liquid chromatography quadrupole/time of flight-mass spectrometry combined with desorption electrospray ionization mass spectrometry imaging [J]., 2021, 193: 113722.
[37] Jing F T, Wang L, Yang M,. Visualizing the spatial distribution of functional metabolites inat different harvest stages by MALDI mass spectrometry imaging [J]., 2022, 162: 105285.
[38] Sun C L, Cui L, Zhou B Q,. Visualizing the spatial distribution and alteration of metabolites in continuously croppedBge using MALDI-MSI [J]., 2022, 12(5): 719-724.
[39] Liu Y, Yang X X, Zhou C,. Unveiling dynamic changes of chemical constituents in raw and processed Fuzi with different steaming time points using desorption electrospray ionization mass spectrometry imaging combined with metabolomics [J]., 2022, 13: 842890.
[40] Ma T Y, Sun C L, Han Y H,. Matrix-assisted laser desorption/ionization mass spectrometry imaging reveals “spatial-temporal-content” changes of parishins induring the steaming process [J]., 2022, 162(Pt B): 112092.
[41] Li M R, Wang X Y, Han L F,. Integration of multicomponent characterization, untargeted metabolomics and mass spectrometry imaging to unveil the holistic chemical transformations and key markers associated with wine steaming of[J]., 2020, 1624: 461228.
[42] Fan W X, Yang Y G, Li L N,. Mass spectrometry-based profiling and imaging strategy, a fit-for-purpose tool for unveiling the transformations of ginsenosides induring processing [J]., 2022, 103: 154223.
[43] Gao L, Zhang Z J, Wu W Y,. Quantitative imaging of natural products in fine brain regions using desorption electrospray ionization mass spectrometry imaging (DESI-MSI):alkaloids as a case study [J]., 2022, 414(17): 4999-5007.
[44] Wang T, Lee H K, Yue G G L,. A novel binary matrix consisting of graphene oxide and caffeic acid for the analysis of scutellarin and its metabolites in mouse kidney by MALDI imaging [J]., 2021, 146(1): 289-295.
[45] Zhu C Y, Jiang X J, Tian J J,. Integrated approach toward absorption, distribution, metabolism, and excretion of Xiaoke Pills in zebrafish based on UPLC-HRMS and DESI-MS techniques [J]., 2022, 1200: 123276.
[46] Wei W L, Li Z W, Li H,. Exploration of tissue distribution of ginsenoside Rg1by LC-MS/MS and nanospray desorption electrospray ionization mass spectrometry [J]., 2021, 198: 113999.
[47] Meng X Y, Fu W Q, Huo M L,.label-free visualization of tissue distributions of salidroside in multiple mouse organs by MALDI-MS imaging [J]., 2020, 453: 116347.
[48] Zhang J, Du Q Q, Song X W,. Evaluation of the tumor-targeting efficiency and intratumor heterogeneity of anticancer drugs using quantitative mass spectrometry imaging [J]., 2020, 10(6): 2621-2630.
[49] Huang X, Wang R, Wang Y K,. Investigation on property differences of ginseng and American ginseng by spatial metabolomics of neurochemicals with desorption electrospray ionization mass spectrometry imaging [J]., 2023, 303: 116006.
[50] Li Y M, Wu Q, Hu E,. Quantitative mass spectrometry imaging of metabolomes and lipidomes for tracking changes and therapeutic response in traumatic brain injury surrounding injured area at chronic phase [J]., 2021, 12(8): 1363-1375.
[51] Zhang J H, Hong Y J, Xie P S,. Spatial lipidomics reveals anticancer mechanisms of bufalin in combination with cinobufagin in tumor-bearing mice [J]., 2020, 11: 593815.
[52] Tian F, Liu R Z, Fan C X,. Effects of thymoquinone on small-molecule metabolites in a rat model of cerebral ischemia reperfusion injury assessed using MALDI-MSI [J]., 2020, 10(1): 27.
[53] Liu Y Q, Zheng W, Zhang L,. Metabolomics-based evidence of the hypoglycemic effect and alleviation of diabetic complications byfruit in diabetic mice [J]., 2022, 13(14): 7871-7884.
[54] Wang Z H, He B S, Liu Y Q,.metabolomics in nephrotoxicity of aristolochic acids based on air flow-assisted desorption electrospray ionization mass spectrometry imaging [J]., 2020, 10(6): 1083-1093.
[55] Li P, Tian Y Q, Du M Y,. Mechanism of rotenone toxicity against: New perspective from a spatial metabolomics and lipidomics study [J]., 2023, 71(1): 211-222.
[56] Jiang H Y, Gao H Y, Li J,. Integrated spatially resolved metabolomics and network toxicology to investigate the hepatotoxicity mechanisms of component D ofThunb [J]., 2022, 298: 115630.
Application of spatial metabolomics in traditional Chinese medicine research
ZHAO Jie1, 2, FENG Su-xiang1
1. Academy of Chinese Medical Sciences, Henan University of Chinese Medicine, Zhengzhou 450000, China 2. Collaborative Innovation Center for Chinese Medicine and Respiratory Diseases Co-constructed by Henan province & Education Ministry of P. R., Henan University of Chinese Medicine, Zhengzhou 450000, China
Spatial metabolomics is an emerging technology based on the development of mass spectrometry imaging and metabolomics technology, which accurately reflects the metabolic network changes of metabolites in the whole or micro regions of the tissue by detecting the molecular structure, spatial distribution, and content changes of endogenous small molecules and exogenous drug metabolites in biological systems, and reveals the efficacy material basis and mechanism of traditional Chinese medicine (TCM) in depth. This study aims to review the research achievements of spatial metabolomics technology in the quality control, metabolism and distribution in organism, pharmacodynamic mechanism, and the toxicity mechanism of TCM in recent years, providing a theoretical basis for exploring the research of TCM based on spatial metabolomics technology.
spatial metabolomics; traditional Chinese medicine; quality control; metabolism and distribution; pharmacodynamic mechanism; toxicity mechanism
R285
A
0253 - 2670(2023)20 - 6569 - 11
10.7501/j.issn.0253-2670.2023.20.001
2023-05-10
河南省中醫藥科學研究專項課題(2023ZY1029);河南省科技攻關項目(232102311215);中國博士后科學基金(2020M672244)
趙 杰,博士,講師,從事中藥藥效物質基礎與作用機制研究。E-mail: jiezhao1702@163.com
通信作者:馮素香,博士生導師,教授,從事中藥質量分析與新藥研究。E-mail: fengsx221@163.com
[責任編輯 趙慧亮]

