高低溫催青溫度敏感期家蠶卵的差異蛋白篩查
白 旭,馮嘉偉,白新宇,李慶榮,鐘仰進,楊婉瑩*
(1. 華南農業大學動物科學學院, 廣東省農業動物基因組學與分子育種重點實驗室, 廣州 510642; 2. 廣東省農業科學院蠶業與農產品加工研究所, 廣州 510610)
滯育(Diapause)是昆蟲對外界環境變化做出的對策,在漫長的進化過程中,該機制保護昆蟲渡過不利環境并保證了種族繁衍(柴華等,2019;Zhangetal., 2019)。根據昆蟲滯育發生階段的不同,可分為卵滯育、幼蟲滯育、蛹滯育以及成蟲滯育(徐衛華,2008)。家蠶Bombyxmori是卵滯育昆蟲的典型代表,也是最早開展滯育研究的模式昆蟲。滯育誘導和滯育解除機理的應用對蠶業生產有非常重要的推動作用。
家蠶滯育由滯育激素(Diapause hormone, DH)調控,DH由咽下神經節(Suboesophageal ganglion, SG)的12個神經細胞合成,再由心側體至咽側體釋放到血淋巴中(Kunioetal., 1991;Xuetal., 1995;Hayakawaetal., 1998)。DH被卵巢上的滯育激素受體(Diapause hormone receptor, DHR)識別后,作為G蛋白偶聯受體的DHR促使卵巢細胞內第二信使鳥苷酸環化酶(cAMP)活性下降(Hommaetal., 2006),導致血液中的海藻糖被分解為葡萄糖。葡萄糖就如卵母細胞中的糖原,最后在滯育卵中被轉化為山梨醇和甘油。這些物質幫助蠶卵抵御低溫等不良環境(Chino, 1958;Yasuhiroetal., 2000)。
二化性家蠶滯育的發生主要受基因和外界環境的影響。蠶卵在25℃長光照下催青時,其產下的子代卵是滯育卵;當蠶卵在15℃短光照下催青時,產下的子代為非滯育卵,可以正常發育(Noguchietal., 2001)。Sato等(2014)研究發現家蠶瞬時受體電位通道蛋白BmTrpA在高于21℃時被激活表達,繼而通過未知的方式激活γ-氨基丁酸(γ-aminobutyric acid, GABA)信號系統和黑化誘導神經肽(corazonin)級聯系統,通過調節滯育激素釋放誘導子代滯育(Tsuchiyaetal., 2020)。也有研究發現激素控制、生物節律和瞬時電位通道等途徑也參與了家蠶滯育調控(Clapham, 2003;Huang, 2004)。說明家蠶滯育發生是一個非常復雜的過程,其具體機制還在不斷探索研究中。
隨著家蠶全基因組測序的完成和蛋白表達圖譜的建立,家蠶組學研究發展迅速。Lanfen等(2018)通過液相色譜-串聯質譜(LC-MS/MS)對家蠶產下的滯育卵和非滯育卵進行數據分析,從滯育卵和非滯育卵中鑒定出309個共有蛋白質。陳艷榮(2019)分別對產滯育卵和產非滯育卵的雌蛹進行轉錄組測序,鑒定出滯育相關基因akr2e-like,將其敲除后,25℃催青的雌蠶產下部分非滯育卵,證明該基因參與滯育調控。為了研究高低溫誘導家蠶滯育發生的分子機制,本研究用25℃和15℃分別催青蠶卵,按照Xu等(1995)建立的催青方法,在蠶卵發育到溫度敏感期時取樣,抽提蠶卵蛋白通過LC-MS/MS技術進行蛋白質測序,篩選出差異表達的蛋白質,并結合數據庫對差異蛋白進行功能分類和功能富集,為進一步解析溫度誘導家蠶滯育發生的分子機理提供參考依據。
1 材料與方法
1.1 家蠶
供試家蠶二化性品種P50由中國科學院蠶業研究所徐安英研究員提供,幼蟲在溫度26±2℃,相對濕度60%±5%,12 h日夜交替的環境下用新鮮桑葉飼養。
1.2 試劑
SDS、BSA、Tris、二乙醇胺、尿素等購自廣州翔博生物科技有限公司;BCA法蛋白定量試劑盒購自上海碧云天生物技術有限公司。蛋白酶抑制劑、TCA、Triton X-100、TSA、NAM、TEAB、二硫蘇糖醇DTT、碘乙酰胺(IAA)購自上海藍木化工有限公司。RNAex Pro RNA提取試劑、Evo M-MLV反轉錄試劑盒購自湖南艾科瑞生物工程有限公司。qPCR SYBR Green Master Mix購自上海翌圣生物科技股份有限公司。
1.3 蠶卵催青處理
按照宋宇航等(2022)的方法,將二化性家蠶品種P50的蠶卵放在25℃催青,飼喂1代后產下滯育卵。將產下的滯育卵放置20 h后進行浸酸處理,在比重1.075(115℉)的鹽酸溶液中浸泡270 s,隨即放在流動的水中浸泡30 min,沖洗干凈后放置在25℃晾干。將解除滯育的蠶卵分成兩組,1組放置于25℃氣候箱中催青(高溫滯育誘導組),另一組放置于15℃氣候箱中催青(低溫非滯育誘導組)。分別在蠶卵發育至反轉終了期即23期時取樣,將蠶卵在液氮中速凍后放入-80℃冰箱。
1.4 蠶卵蛋白質的抽提
從-80℃取出蠶卵,加液氮充分研磨至粉末。各組樣品分別加入粉末4倍體積裂解緩沖液(1% Triton X-100,1%蛋白酶抑制劑,3 μmol/L TSA,50 mmol/L NAM),超聲裂解。4℃,12 000 g離心10 min,去除細胞碎片,上清液轉移至新的離心管,利用BCA試劑盒進行蛋白濃度測定。
1.5 蛋白質電泳檢測
制樣:根據蛋白濃度測定結果,每個樣品取等量蛋白到離心管中,加入5 μL的4×Loading buffer,再加入2% SDS使總體積為20 μL;上樣:依次上樣1 μL預染蛋白marker和20 μL蛋白樣品;電泳:按照15 mA/gel的電流跑濃縮膠,約15 min后蛋白濃縮為一條線;用35 mA跑分離膠直至電泳到膠底部;染色和脫色:將凝膠取出后于考馬斯亮藍R-250染液中室溫染色2 h,然后加入脫色液,脫色至背景無色、條帶清晰。
1.6 胰酶酶解
取等量蛋白樣品,用裂解液將體積調整濃度體積一致。緩慢加入終濃度20%TCA,渦旋混勻,4℃沉淀2 h。4 500 g離心5 min,棄上清,用預冷的丙酮洗滌沉淀2~3次。晾干沉淀后加入終濃度200 mmol/L TEAB,超聲波打散沉淀,以蛋白酶∶蛋白=1∶50的比例(m/m)加入胰蛋白酶,酶解過夜。加入DTT使其終濃度為5 mmol/L,56℃還原30 min,然后加入IAA使其終濃度為11 mmol/L,室溫避光孵育15 min。
1.7 液相色譜-質譜聯用分析
肽段用液相色譜流動相A相溶解后使用NanoElute超高效液相系統進行分離。流動相A為含0.1%甲酸和2%乙腈的水溶液;流動相B為含0.1%甲酸和100%乙腈溶液。液相梯度設置:0~70 min,6%~24%B;70~84 min,24%~35%B;84~87 min,35%~80%B;87~90 min,80%B,流速維持在450 nL/min。肽段經由超高效液相系統分離后被注入Capillary離子源中進行電離然后進timsTOF Pro質譜進行分析。離子源電壓設置為1.65 kV,肽段母離子及其二級碎片都使用高分辨的TOF進行檢測和分析。二級質譜掃描范圍設置為100~1 700。數據采集模式使用平行累積串行碎裂(PASEF)模式。一張一級質譜采集后進行10次 PASEF模式采集母離子電荷數在0~5范圍內的二級譜圖,串聯質譜掃描的動態排除時間設置為30 s避免母離子的重復掃描。
1.8 差異蛋白轉錄水平驗證
將蠶卵樣品置于液氮預冷的研缽中研磨為粉末,使用Trizol沉淀法提取樣本RNA,經過去基因組DNA反應和反轉錄得到cDNA。使用Primer-BLAS網站設計目的基因的qRT-PCR引物(引物序列如表1所示),由生工生物公司合成。熒光定量PCR方法參照試劑SsoFast EvaGreen Supermix(Bio-Rad)操作說明進行。
2 結果與分析
2.1 家蠶胚胎發育進度觀察
家蠶的胚胎期被劃分為30個發育階段,Xu等(1995)通過溫度交換催青實驗發現,在蠶卵胚胎發育的第20~23階段,即器官形成期的頭胸分節期、反轉期、反轉終了期、毛瘤發生期時對溫度誘導最為敏感。只要在蠶卵發育的20~23階段保持25℃催青,94%的子代卵為滯育卵,第20~25階段保持25℃催青,則子代97%為滯育卵。說明家蠶胚胎發育的第20~25階段是感受溫度變化誘導子代進入滯育的窗口期,20~23階段是關鍵期,因此本實驗取23階段即反轉終了期的蠶卵進行蛋白質質譜分析。為確保兩組蠶卵樣本處在同一發育階段,通過觀察胚胎形態來監控蠶卵的發育進程。圖1為15℃催青組和25℃催青組蠶卵胚胎,可以看出取樣時兩組蠶卵都發育到了第23階段。

圖1 反轉期家蠶胚胎Fig.1 Embryo in reversal period of Bombyx mori
2.2 蠶卵蛋白濃度測定及電泳檢測
蠶卵蛋白抽提完成后,使用BCA蛋白濃度測定試劑盒測定蛋白濃度,根據標準曲線和使用的樣品體積計算出樣品的蛋白濃度(表2)。
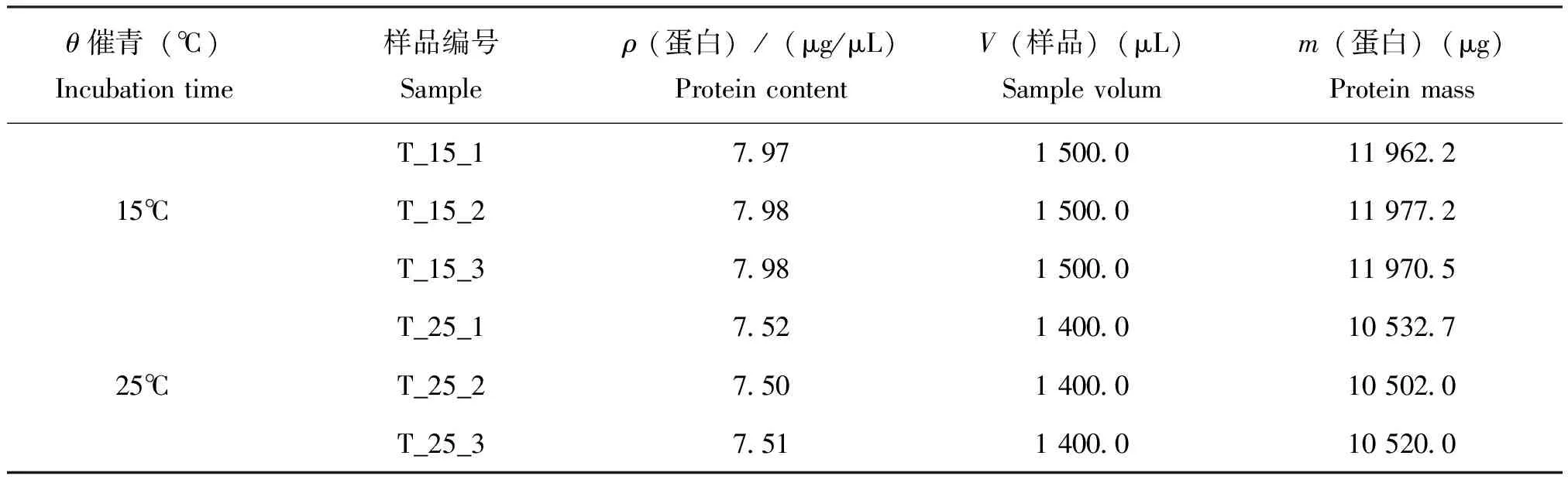
表2 蠶卵蛋白濃度測定結果
通過SDS-PAGE電泳檢測抽提蛋白質量,每個樣品取15 μg進行電泳。結果如圖2所示,25℃和15℃催青組的蠶卵蛋白條帶清晰,分布正常均一,蛋白無降解,組內各泳道平行性好,組間電泳行為差異不明顯。存在明顯的高豐度蛋白,蛋白總量滿足接下來的質譜要求。

圖2 高低溫催青溫度敏感期家蠶卵蛋白的SDS-PAGE 電泳檢測Fig.2 SDS-PAGE electrophoresis detection of silkworm egg protein in temperature-sensitive period of high and low temperature注:泳道M為蛋白Maker,15-1、15-2、15-3為15℃催青組的三個重復樣本,25-1、25-2、25-3為25℃催青組的三個重復樣本。Note: Lane M was the protein maker, 15-1, 15-2, and 15-3 were three replicates of the 15℃ group, and 25-1, 25-2, and 25-3 were three replicates of the 25℃ group.
2.3 質譜數據庫篩選
質譜測序完成后,為了得到高質量的數據分析結果,首先做數據過濾。將譜圖、肽段、蛋白3個層面鑒定的準確性FDR設定為1%;鑒定蛋白至少需要包含一個特異性(Unique)肽段。圖3-A是經過數據過濾后鑒定的肽段和蛋白總數。從圖中可以看出質譜檢測產生的二級譜圖數,即總譜圖數(Total spectrums)為719 520條,其中有效譜圖數(Matched spectrums)為164 030條,鑒定肽段數(Peptides)為28 334條,根據匹配結果解析出的特異性肽段(Unique peptides)有27 570個。這些肽段對應的鑒定蛋白數(Identified proteins)有3 817個,可量化的蛋白(Quantifiable proteins)數有3 076個。圖3-B是各組生物重復樣本的相對標準差(RSD),RSD值越小,表明重復試驗定量的波動程度越小。從圖中看出25℃催青蠶卵與15℃催青蠶卵組間的RSD數據均小于0.6,說明樣本重復性較好,具有統計學一致性。

圖3 差異蛋白質組學基礎數據統計Fig.3 Basic data statistics of differentially expressed proteomics注:A,蛋白質鑒定質譜結果統計圖;B,樣品重復性的RSD檢驗。Note: A, Statistical chart of protein identification mass spectrometry results; B, RSD test of sample repeatability.
2.4 差異蛋白質的分析
將15℃催青組與25℃催青組的質譜數據進行分析,首先通過樣本定量值的P-value篩選差異表達蛋白,當P-value <0.05時,以差異表達量變化超過1.5作為顯著上調的變化閾值,小于1/1.5作為顯著下調的變化閾值。比較發現兩個處理組中差異表達的蛋白有104個,其中56個蛋白上調,48個蛋白下調(圖4)。表3是部分顯著差異蛋白。

圖4 25℃和15℃催青的蠶卵差異蛋白的火山圖Fig.4 Volcano plots of differential protein expression in silkworm eggs incubated at 25℃ and 15℃

表3 25℃/15℃下催青家蠶溫度敏感期卵的差異表達蛋白
2.5 差異蛋白的聚類分析
對25℃和15℃催青的蠶卵差異蛋白分別進行了GO分類、KEGG通路和蛋白結構域3個層面的富集分析。圖5-A是差異蛋白的本體聚類分析(Gene Ontology,GO),從圖中可以看出差異蛋白主要參與的生物過程有細胞過程(Cellular process)、代謝過程(Metabolic process)、生物調節(Biological regulation)、生長發育過程(Developmental process)、多細胞生物過程(Multicellular organismal process)和脅迫應答(Response to stimulus)。差異蛋白的分子功能主要為催化活性(Catalytic activity)和結合(Binding)。

圖5 差異蛋白的聚類分析Fig.5 Cluster analysis of differentially expressed proteins注:A,差異蛋白的GO分類;B,差異蛋白的COG分類。Note: A, GO classification of differential protein expression; B, COG classification of differential protein expression .
圖5-B是COG功能分類的結果,從圖中可以看出差異蛋白的功能主要為翻譯后修飾(Posttranslational modification)、蛋白質周轉(Protein turnover)、分子伴侶(Chaperones)和物質代謝。對差異蛋白的亞細胞定位顯示差異蛋白主要分布于細胞質、細胞質基質和細胞核中。
2.6 差異蛋白的KEGG功能富集分析
接下來對差異蛋白進行KEGG功能富集分析,通過氣泡圖的方式展現差異表達蛋白顯著富集(P-value <0.05)到的功能分類和通路。結果顯示(圖6),差異蛋白主要參與了乙醛酸和二羧酸代謝途徑(Glyoxylate and dicarboxylate metabolism)、丙酮酸代謝途徑(Pyruvate metabolism)和半乳糖代謝途徑(Galactose metabolism)。其中,差異蛋白在乙醛酸和二羧酸代謝途徑富集最為顯著,所含5個顯著差異蛋白全部上調。此外,在丙酮酸代謝途徑中,蘋果酸合酶顯著上調,而蘋果酸酶顯著下調。這些差異蛋白的主要分子功能有:鐵反應元件結合(Iron-responsive element binding)、催化活性(Catalytic activity)、裂解酶活性(Lyase activity)、烏頭酸水合酶活性(Aconitate hydratase activity)、水解酶活性(Hydro-lyase activity)、外肽酶活性(Exopeptidase activity)、葡萄糖醛酸轉移酶活性(Glucuronosyltransferase activity)以及碳-碳裂解酶活性(Carbon-carbon lyase activity)。
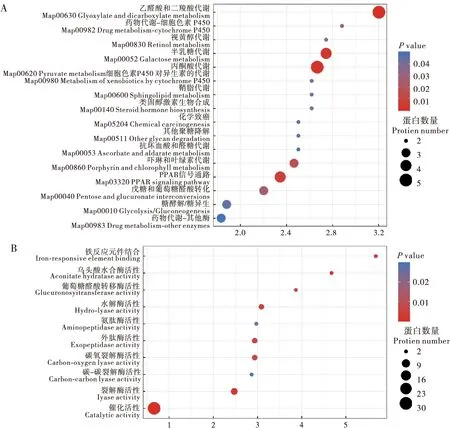
圖6 差異蛋白的KEGG分析Fig.6 KEGG analysis of differentially expressed proteins注:A,差異蛋白的KEGG通路分析;B,差異蛋白的KEGG分子功能分析。縱軸為通路或功能分類,橫軸為差異表達蛋白在該功能類型中所占比例相比于鑒定蛋白所占比例的變化倍數(Fold enrichment)的Log2轉換后的數值。圓圈顏色表示富集顯著性P-value,圓圈大小表示功能類或通路中的差異蛋白個數。Note: A, KEGG pathway analysis of differential protein expression; B, KEGG molecular function analysis of differential protein expression. Vertical axis was the pathway or functional classification, and horizontal axis was the Log2-transformed value of the fold enrichment (Fold enrichment) of the proportion of differential protein expression in this functional type compared to the proportion of identified proteins. The color of the circle indicated the significant P-value of enrichment, and the size of the circle indicated the number of differential protein expression in the functional class or pathway.
2.7 差異蛋白轉錄水平驗證
為了驗證上述差異蛋白定量結果,選取了參與代謝過程的L-乳酸脫氫酶、地芬甲酸酯合酶、尿酸酶、脫氧海絲氨酸合酶、UDP-葡萄糖4-差向異構體、泛素硫酯酶和氨肽酶;參與脅迫應答的蛋白絲光蛋白、血管緊張素轉化酶和觸角特異性蛋白;保幼激素信號通路中的保幼激素結合蛋白進行實時熒光定量qRT-PCR驗證。圖7分別是qRT-PCR檢測結果,15℃和25℃催青組中,目的蛋白轉錄水平的變化趨勢與蛋白組學結果一致,說明差異蛋白定量結果準確。

圖7 25℃和15℃催青的蠶卵差異蛋白的轉錄水平定量結果Fig.7 Quantitative results of transcriptional levels of differential protein expression in silkworm eggs treated at 25℃ and 15℃注:qRT-PCR檢測差異基因表達情況。用內參基因Eif-4A使基因表達標準化。*表示P<0.05,**表示P<0.01,***表示P<0.001。Note: Differential gene expression was detected by qRT-PCR. Gene expression was normalized with the internal reference gene Eif-4A. * means P<0.05, ** means P<0.01, *** means P<0.001.
3 結論與討論
家蠶滯育卵胚胎發育被劃分為30個階段,Xu等(1995)以二化性家蠶品種大造為研究材料,對蠶卵進行高低溫(25℃/15℃)交替催青,發現在第20~23階段進行25℃催青對誘導滯育至關重要,22~25期對滯育卵的誘導也很重要,完整經歷20~25階段25℃催青的蠶卵,其子代滯育率升至100%。這說明第20~25階段是家蠶胚胎感受溫度變化誘導子代進入滯育的敏感期。
本研究通過液相色譜-質譜串聯技術對高、低溫催青下家蠶敏感期卵的差異蛋白進行研究,結果發現,與15℃催青的蠶卵相比,25℃催青的蠶卵在敏感期蛋白表達顯著上調的有56個,顯著下調的有48個,這些蛋白可能參與了溫度誘導家蠶子代滯育發生的調控過程。對差異表達蛋白的GO功能注釋顯示,差異蛋白主要參與的生物過程有細胞過程、代謝過程、生物調節、生長發育過程、多細胞生物過程和脅迫應答。差異蛋白的分子功能主要為催化活性和結合。KOG功能分類的結果顯示,差異蛋白的功能主要為翻譯后修飾、蛋白質周轉、分子伴侶和物質代謝。KEGG富集結果顯示,差異蛋白主要參與了乙醛酸和二羧酸代謝途徑、丙酮酸代謝途徑和半乳糖代謝途徑。
特定昆蟲通過調節發育過程中的某一步驟,在特定發育階段進入滯育(Mikietal., 2020)。如,煙草天蛾Manducasexta蛹期滯育的原因被認為是大腦分泌促前胸腺激素(Prothoracicotropic hormone, PTTH)的釋放量減少(Tomiokaetal., 1995);家蠶通過滯育激素誘導胚胎進入滯育(Okitsugu, 1996);黑腹果蠅Drosophilamelanogaster和庫蚊Culexpipiens主要通過胰島素(insulin)信號途徑誘導成蟲進入滯育(Simetal., 2013)。保幼激素(Juvenile hormone,JH)被認為是調節昆蟲變態、繁殖和滯育的重要激素之一(Royetal., 2018)。胰島素信號通過JH通路誘導滯育發生,用外源性JH可以回補胰島素受體敲除后引起的滯育改變(Simetal., 2013)。大部分昆蟲滯育的誘導和發生往往伴隨著體內JH水平的顯著降低,但在少數昆蟲中,滯育也會隨著體內JH增加而發生。短光照可誘導異色瓢蟲Harmoniaaxyridis發生滯育,其體內的JH滴度在短光照下飼養比在長光照下飼養更低(Gaoetal., 2022)。Jiang等(2011)的研究也表明,在家蠶中提高保幼激素水平的同時,降低蛻皮激素的水平可誘導滯育卵的產生。在篩選到的差異表達蛋白中發現,保幼激素結合蛋白(Juvenile hormone binding protein, JHBP)在25℃催青蠶卵中的表達比15℃催青蠶卵顯著上調。在鱗翅目昆蟲中,JH信號主要由血淋巴中的物種特異性JHBP介導(Lietal., 2016)。在與其受體相互作用之前,JH作為與JHBP的復合物被轉運至靶組織,在此期間,JHBP是JH信號轉運中的第一個關鍵元件(Krameretal., 1974)。JHBP將JH從血淋巴輸送到靶器官的細胞,并保護JH免受非特異性酯酶的降解(Debskietal., 2004)。來自不同物種的JHBP的序列分析表明,JHBP蛋白與兩個保守的N末端半胱氨酸殘基具有高度相似性,并且可以結合親脂性小分子如JH的結構域(Kolodziejczyketal., 2008)。保幼激素合成過程中JHBP基因的表達受JH負控制。JHBP在高低溫催青卵中的差異表達,也為研究家蠶滯育誘導的機制提供了新的靶標。
溫度是影響家蠶卵滯育發生的最主要環境因素(Baleetal., 2010),越來越多的研究表明溫度應激反應與滯育之間關系密切。在家蠶的滯育過程中,啟動了一套應激反應機制來保證越冬存活,如合成甘油和山梨醇(Han, 1998;Kostaletal., 2000)、熱休克蛋白(Hsps)等分子伴侶的合成(Rinehartetal., 2007)。本研究發現的差異表達蛋白,如L-乳酸脫氫酶、磷酸烯醇丙酮酸羧激酶、蘋果酸酶和保幼激素結合蛋白等,可能參與到這些物質的代謝和轉化。
綜上所述,家蠶滯育誘導的分子機制較為復雜,涉及多種信號通路和調控因子,本研究利用蛋白組學技術初步發現多種信號通路和差異蛋白可能在家蠶受環境溫度影響下誘導子代滯育的分子機制中起到重要作用,為進一步研究滯育發生的分子機制研究提供候選蛋白。

