紫丁香苷對LPS/D-GalN誘導的急性肝損傷的保護作用研究
胡閃閃,胡紅杰,徐艷萍,何靈芝,盧玉潔,黃伊芹,程明,李恭賀,司紅彬
(廣西大學動物科技學院/亞熱帶農業生物資源保護與利用國家重點實驗室,廣西 南寧 530004)
肝臟對生命至關重要,是許多生理過程關鍵的樞紐,具有血容量調節、營養素代謝、免疫系統支持、脂質和膽固醇穩態、外源性化合物的分解等重要功能[1-2]。急性肝損傷是與高死亡率相關的一種嚴重綜合征,多是由于脂多糖(LPS)和醋氨酚(APAP)等藥物過量引起的[2]。過量藥物在肝臟的代謝過程中會產生大量的活性氧自由基(ROS),從而使谷胱甘肽還原酶(GSH)含量降低[3-4],使肝臟產生大量的白細胞介素-6(IL-6)、白細胞介素-1β(IL-1β)、腫瘤壞死因子α(TNF-α)等促炎因子,這些促炎因子又可與炎性信號通路上的相關蛋白進行特異性結合,如與核轉錄因子p65(NF-κBp65)的特異性位點進行結合,促使NF-κBp65磷酸化發生核轉移與DNA相應結構區域進行結合,進一步調節下游促炎因子轉錄,使炎性反應不斷加強,炎性細胞因子不斷釋放導致細胞因子失衡和免疫功能障礙,進而損害肝功能[5-9],危及生命健康。
紫丁香苷從刺五加中提取,現有研究表明紫丁香苷具有抗癌、抗氧化、免疫調節、保護肝臟、腎以及肺等藥理功能[10-12]。作用機制均與消除氧化自由基、提高抗氧化物酶的活性、抑制機體炎性信號通路的激活、炎性因子的產生有關[13-15],但有關紫丁香苷保肝作用的機制研究目前較少。本研究旨在通過建立藥物性急性肝損傷模型,來探究紫丁香苷對于肝損傷小鼠的保護作用,并探究其發揮作用的潛在機制,為紫丁香苷的應用提供研究基礎。
1 材料與方法
1.1 試劑
紫丁香苷(純度98%,成都埃法生物科技有限公司);LPS、D-半乳糖胺鹽酸鹽(D-GalN)購于阿拉丁;丙氨酸氨基轉移酶(ALT)、天冬氨酸氨基轉移酶(AST)、GSH、超氧化物歧化酶(SOD)、過氧化氫酶(CAT)均購于南京建成生物科技有限公司;鼠源IL-1β、IL-6、TNF-α、ELISA試劑盒購于南京博研生物科技有限公司;蘇木素伊紅(HE)染色試劑盒購于索萊寶;一抗(兔抗NF-κBp65)、二抗(山羊抗兔),DAB顯色液均購于賽維爾生物科技有限公司。
1.2 實驗動物
40只SPF級昆明雄性小鼠,體重(22±2)g,由長沙市天勤生物技術有限公司提供,在清潔級實驗鼠房適應性飼養1周,12 h晝夜循環,飲水清潔充足,每天給予新鮮鼠糧,平均4 g/只,室溫維持為(25±2)℃。
1.3 方法
1.3.1 分組與處理
隨機將40只小鼠分為4組,每組10只:對照組(NC)、模型組(LD)、紫丁香苷低劑量(LSY+LD)組、紫丁香苷高劑量(HSY+LD)組。低、高劑量紫丁香苷組每天以25 mg/kg、50 mg/kg劑量通過腹腔注射給藥,NC、LD組以同樣的方式注射等量的生理鹽水。在第3天腹腔給藥1 h后,LD組、LSY+LD組、HSY+LD組腹腔給予LPS/D-GalN(30 μg/kg+250 mg/kg),NC組給予生理鹽水。LPS/D-GalN給藥6 h后,小鼠眼球靜脈采血,全血室溫靜置2 h后移置-4 ℃冰箱放置12 h,-4 ℃、3 000g離心機分離血清,分裝并保存于-80 ℃;采取組織肝臟,稱重,并在無菌生理鹽水中快速沖洗,采取肝臟左側小葉放入4%甲醛中固定,剩余肝臟分割放入EP管中,置于-80 ℃保存,以備后用。
1.3.2 血清及肝臟生化指標檢測
根據試劑盒說明書檢測血清中AST、ALT活性;肝臟組織中GSH水平,SOD、CAT活性。
1.3.3 ELISA法檢測肝臟組織炎癥因子水平
將相同質量的肝組織進行勻漿處理,并按照試劑盒說明書將勻漿進行相同倍數的稀釋,然后檢測肝組織中IL-6、IL-1β、TNF-α的水平。
1.3.4 肝臟組織病理切片
從固定液中取出肝組織,分割成小組織塊,置于燒杯中流水過夜,并在梯度酒精中進行脫水,包埋,切片機連續切割5 μm厚的切片,60 ℃烘箱中烤片2 h,二甲苯中脫蠟,在梯度酒精中進行復水,采用蘇木精伊紅(HE)染色,分別在95%,100%的酒精中脫色1 min,二甲苯Ⅰ,二甲苯Ⅱ中分別透明兩分鐘,將切片放于通風箱中風干30 min,封片。
1.3.5 免疫組織化學分析
將組織切片進行上述的脫蠟操作后,在梯度酒精中進行復水;使用檸檬酸抗原修復緩沖溶液(pH = 7.4)加熱進行抗原修復,3%雙氧水溶液避光孵育25 min以阻斷內源性過氧化物酶;BSA封閉、一抗4 ℃孵育過夜,并用PBS洗滌3次(每次5 min),二抗孵育50 min(HRP標記);DAB顯色、蘇木素復染胞核3 min、自來水反藍,封片。
1.3.6 數據分析
試驗數據采用IBM SPSS Statistics 26進行單因素ANOVA檢驗;P<0.05表示差異顯著;通過GraphPad Prism 8軟件、ImageJ軟件進行數據處理。
2 結果
2.1 紫丁香苷對小鼠血清AST、ALT活性的影響
由圖1A可見,LD組小鼠與NC相比AST活性升高,且差異極顯著(P<0.01),LSY+LD、HSY+LD組與LD組相比AST活性顯著降低(P<0.01)。由圖1B可見,LD組與NC相比ALT極顯著升高(P<0.01),LSY+LD、HSY+LD組與LD組相比ALT降低,差異極顯著(P<0.01);HSY+LD組與LSY+LD組相比ALT差異極顯著(P<0.01),AST無明顯差異。
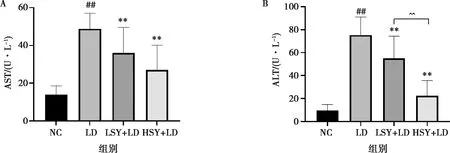
LD組與NC組相比,#表示P<0.05,##表示P<0.01;LSY+LD組或HSY+LD組與模型組相比,*表示P<0.05,**表示P<0.01;
2.2 小鼠肝臟生化指標
SOD、GSH、CAT水平如圖2所示。LD組與NC組相比小鼠肝組織中SOD和CAT活性、GSH含量降低,差異顯著(P<0.05);LSY+LD、HSY+LD組與LD組相比,SOD和CAT活性、GSH含量顯著升高(P<0.05,P<0.01);HSY+LD組與LSY+LD組相比SOD、GSH活性差異極顯著或顯著(P<0.05,P<0.01),CAT活性無明顯差異。
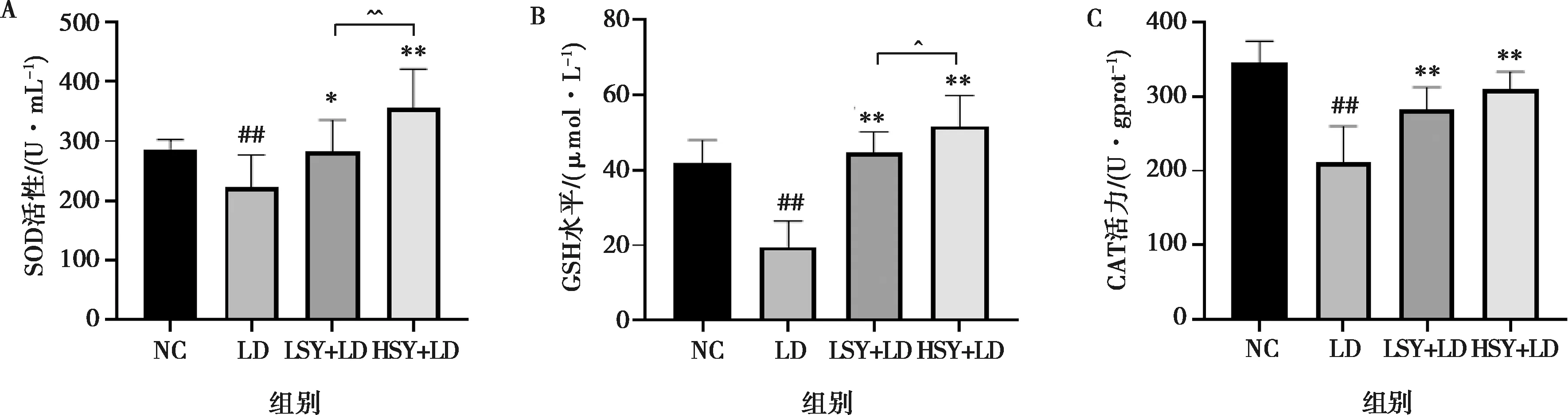
圖2 SOD(A)、GSH(B)、CAT(C)在肝組織中的活性
2.3 小鼠肝臟組織中IL-1β、IL-6、TNF-α炎癥因子的水平
小鼠肝臟組織中IL-1β、IL-6、TNF-α炎癥因子的水平如圖3所示。LD組與NC組相比小鼠肝組織中IL-1β、IL-6、TNF-α水平升高,差異極顯著(P<0.01);LSY+LD、HSY+LD組與LD組相比,IL-1β、IL-6、TNF-α水平降低,差異顯著或極顯著(P<0.05,P<0.01);HSY+LD組與LSY+LD組相比IL-1β差異極顯著(P<0.01),IL-6、TNF-α無顯著差異。
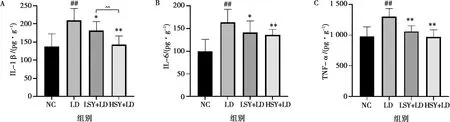
圖3 IL-1β(A)、 IL-6(B)、TNF-α(C)在肝組織中的表達水平
2.4 小鼠肝臟病理組織切片
小鼠肝臟病理組織切片觀察結果如圖4所示。NC組小鼠肝臟,肝細胞在肝竇,肝靜脈周圍呈放射狀,且排列整齊;LD組小鼠肝臟細胞間出現嚴重瘀血,肝索紊亂,在肝管周圍有大量的淋巴細胞;LSY+LD、HSY+LD組小鼠肝細胞形態隨SY濃度增加逐漸趨于正常,淤血以及炎性浸潤減少。
2.5 小鼠肝臟NF-κBp65免疫組化切片
小鼠肝臟NF-κBp65免疫組化檢測結果如圖5所示。與正常組相比,LD組核內NF-κBp65核表達量增加(P<0.01),在LSY+LD組、HSY+LD組中核內NF-κBp65表達量降低(P<0.01);HSY+LD組與LSY+LD組相比差異極顯著(P<0.01)。
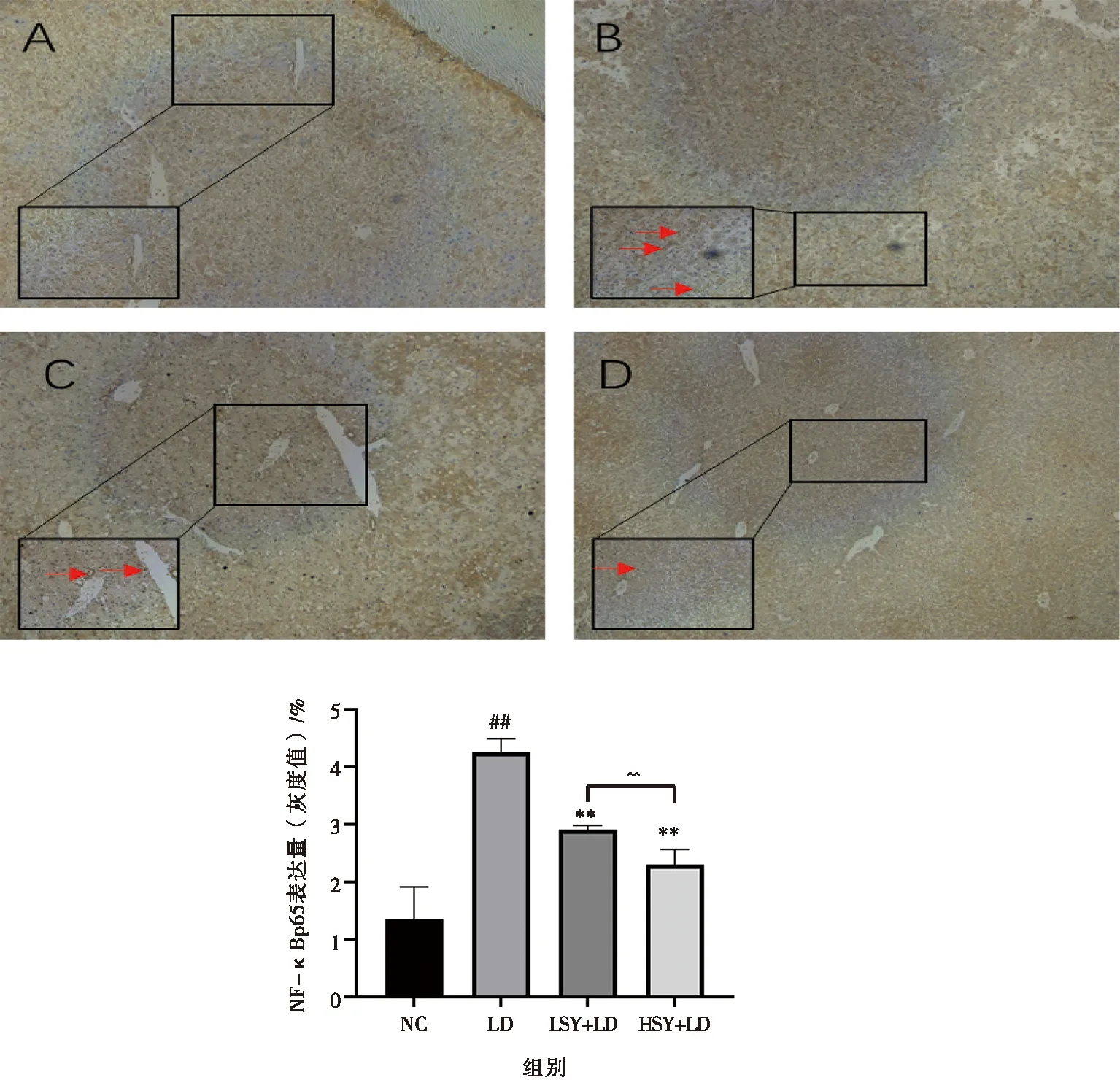
A.NC組;B.LD組;C.LSY+LD組;D.HSY+LD組
3 討論
藥物性肝損傷(drug-induced liver injury,DILI)是由一些傳統的化學藥物、草藥、膳食補充劑以及其他的外源性物質,通過不同途徑進入體內;或藥物代謝產物及由于特殊體質對藥物的超敏感性或耐受性降低而導致的肝臟損傷、慢性肝炎、急性肝衰竭等肝功能異常的總稱[18-21]。LPS/D-GalN聯合給藥可在短時間內引起嚴重的肝細胞炎癥反應和過氧化應激反應,其病理特征與臨床上病毒性肝炎所造成的損傷相似,因此,由LPS/D-GalN聯合給藥建造小鼠肝損傷模型,被廣泛應用于保肝藥物的研究。根據已有的文獻,在LPS/D-GalN(30~100 μg/kg LPS+600~700 mg/kgD-GalN)聯合給藥劑量的基礎上進行給藥劑量的摸索[22-25]。研究結果表明,600~700 mg/kg的D-GalN藥物劑量造成的肝損傷無法逆轉,因此本試驗降低D-GalN的給藥劑量進行建模摸索。根據《藥物性肝損傷基層診療指南》中肝細胞損傷型、混合型以及肝血管損傷型的模型評判標準,血清生化學特征ALT≥3倍正常上限(ULN)即證明肝損傷模型建立成功,最終確定以LPS/D-GalN(30 μg/kg+250 mg/kg)給藥[26-29]。在本試驗中,與NC組相比,LD組血清中AST、ALT的活性顯著升高,且ALT≥3 ULN,LSY+LD組與HSY+LD組的AST、ALT的活性得到逆轉,趨于正常水平;與LD組相比,紫丁香苷預防給藥組隨著給藥劑量的增加,肝細胞在中央靜脈周圍的排列、形態逐漸恢復正常的放射狀,炎性細胞數目減少,淤血減輕。正常生理情況下機體的抗氧化防御系統如SOD、CAT與GSH等可以消除過量ROS,避免肝臟的氧化應激反應,維持肝功能正常;但當肝功能受損時,抗氧化防御系統的激活受到抑制,過多的ROS無法被完全清除,從而在肝臟位置發生劇烈得脂質過氧化,進一步損害肝功能[30-32]。在本研究中,給予LPS/D-GalN后SOD、CAT活性降低,GSH含量降低,與現有研究結果相符合;與LD組相比,LSY+LD組、HSY+LD組的SOD、CAT活性升高,GSH含量上調,且具有劑量依賴性,證明SY可以通過激活機體的抗氧化防御系統,從而刺激抗氧化酶的產生,減輕機體的脂質過氧化。此外,LPS/D-GalN造成肝損傷另一主要原因是LPS與巨噬細胞表面的Toll-4(TLR4)受體相結合,通過TLR4/MYD88途徑使得NF-κBp65亞單位S536發生磷酸化反應被激活,從而發生核轉位與靶向的DNA結構域結合,調節下游炎性細胞因子的轉錄,從而造成炎性因子不可控的增加,如IL-6,IL-1β、TNF-α等炎性因子的劇增[33-37]。本文研究中利用總NF-κBp65抗體進行免疫組化,結果表明與NC組相比LD組NF-κBp65的核轉移率增高,且與藍染的細胞核顏色發生重疊呈現烏黑色,IL-6、IL-1β、TNF-α因子的表達顯著升高;在SY的干預下NF-κBp65核轉移率下降,IL-6、IL-1β、TNF-α表達顯著降低,證明SY可以通過抑制NF-κBp65的激活,抑制其發生核轉移,從而抑制了下游的炎性因子的表達,降低肝臟的炎性反應。
綜上,本試驗結果顯示紫丁香苷對LPS/D-GalN誘導的小鼠急性肝損傷具有保護作用,其作用機制可能與抑制NF-κBp65蛋白在肝臟的激活,抑制炎性因子IL-6、IL-1β、TNF-α的產生,促進肝臟抗氧化酶的產生有關。

