CD30、c-Myc及P53蛋白在彌漫大B細胞淋巴瘤中的表達及臨床意義*
王小玲 何禮想 王研 呂國慶 吳隼,
(新鄉醫學院第一附屬醫院 1.血液科;2.病理科,河南 衛輝 453100)
彌漫大B細胞淋巴瘤(Diffuse large B-cell lymphoma,DLBCL)是最常見的侵襲性大B淋巴細胞淋巴瘤類型,發病年齡峰值為60~70歲,占非霍奇金淋巴瘤的25%~30%。該病可發生在有淋巴組織存在的任何部位,異質性較強,臨床、病理學特征不同,對免疫化療的反應亦不相同。其病情進展較為迅速,若不及時治療,中位生存時間一般不超過12個月[1-2]。
淋巴造血系統病變,無疑也是病理診斷中的一個難點。一方面是因為病種繁多,另一方面也是因為不同病種間的形態學、免疫表型存在顯著重疊。也正是因為這一點,近年來CD30逐漸成為體液免疫及細胞免疫中一個頗有潛力的靶點[3-4]。因此,本研究就CD30及c-Myc、P53蛋白在DLBCL中的表達情況及臨床病理學特征進行分析,評估其預后價值,并確定其可能的相關因素。
1 資料與方法
1.1 一般資料 回顧性分析2019年3月—2023年1月新鄉醫學院第一附屬醫院血液科收治并確診的160例DLBCL患者的臨床信息,收集納入患者資料:性別、年齡、體重指數(BMI)、B組癥狀、初診時乳酸脫氫酶(LDH)水平、結外累及、霍奇金淋巴瘤(Staging of Hodgkin′s lymphoma,Ann Arbor)分期、國際預后指數(International prognostic index,IPI)評分、東部腫瘤協作組體能狀態(Eastern Cooperative Oncology Group performance status,ECOG PS)評分、Hans分型、骨髓浸潤、治療方案;病理學資料:CD30、c-Myc、P53、Ki-67、CD5及BCL-2等。160例患者按照Hans免疫分型進行分組,生發中心B細胞樣亞型(Germinal center B cell,GCB)分型(GCB組)17例,非生發中心B細胞樣亞型(non-Germinal center B cell,non GCB)分型(non-GCB組)143例。納入標準:①符合WHO(2016)關于淋巴組織腫瘤修訂版相關分類標準,淋巴結活檢確診為DLBCL的成年患者。②確診后生存期>6個月。③檢查完善且資料齊全。排除標準:排除了原發性免疫缺陷、HIV感染、淋巴惡性腫瘤史、實體器官移植、同種異體干細胞移植或免疫抑制藥物導致的免疫系統損害患者。該研究經本院倫理委員會審核批準。
1.2 實驗方法 利用免疫組化(Immunohistochemistry,IHC)中抗原能夠與抗體特異性結合的原理,通過一些化學反應使被熒光素酶、金屬離子、同位素等顯色劑標記的抗體顯色,并對其進行定位、定性及定量研究,間接確定組織細胞內CD30、c-Myc、P53、CD5等的表達情況。步驟:取4~5 μm厚的連續石蠟切片,放在67 ℃烘箱中烤片2 h,二甲苯脫蠟和常規梯度酒精水化,用pH=6.0的檸檬酸鹽緩沖液微波加熱至沸騰修復抗原。PBS緩沖液沖洗,然后3%過氧化氫沖洗阻斷內源性過氧化物酶活性。向每張切片滴加稀釋后的一抗,恒溫箱中4 ℃過夜,PBS緩沖液沖洗,滴加1滴酶標抗鼠/兔聚合物(即二抗),37 ℃恒溫箱中孵育15 min,PBS沖洗,二氨基聯苯胺試劑染色、蘇木素復染,PBS緩沖液沖洗,藍化,梯度酒精脫水干燥,二甲苯透明,最后用中性樹膠封片。陰性對照采用PBS代替一抗。熒光原位雜交(Fluorescence in situ hybridization,FISH)是原位雜交的方法之一,可以用于定位固定組織和細胞中特定核酸靶標的強大技術,能夠獲得與基因表達和遺傳位點相關的時間和空間信息。本研究收集的病例中有23例患者使用了FISH檢測技術,使用的c-Myc、BCL-2基因探針為雙色斷裂探針,-20 ℃保存備用。步驟:首先將探針85 ℃溫浴5 min,立即0 ℃放置5~10 min,使雙鏈DNA探針變性。將制作好的染色體玻片標本50 ℃培養箱烤片2~3 h,再將其置于70~75 ℃ 70%甲酰胺/2×SSC的變性液中2~3 min,使其變性,70%、90%、100%乙醇梯度脫水,各5 min,然后空氣干燥。加10 μL已變性的DNA探針在玻片標本上雜交區域,蓋蓋玻片,橡膠封片,放在37 ℃濕盒中雜交過夜,洗脫,暗處晾干。取10 μL雜交藍染染色液至干燥的載玻片上,熒光顯微鏡下觀察結果。
最后由2名以上病理學專家確定IHC及FISH的檢測結果。關于IHC評估CD30陽性的閾值目前尚缺乏共識,本研究使用>0%和20%的閾值分別評估了DLBCL患者中CD30的表達情況。
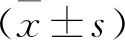
2 結果
2.1 納入患者一般資料 納入患者中男79例,女81例;平均年齡(63.03±12.46)歲,≥60歲 103例,<60歲57例;結外累及79例;Ann Arbor分期為Ⅲ+Ⅳ分期患者75例,而Ⅰ+Ⅱ分期患者85例;IPI評分≥2分95例,而<2分65例;ECOG PS評分≥2分37例,而<2分123例。骨髓浸潤15例,R-CHOP/ R-X-CHOP(R-mini-CHOP、DA-EPOCH-R、R-Hyper-CVAD、DA-EPOCH-R等)方案治療123例,手術、放療、BR、MA-Rix、COP、VP等單個或多個不含利妥昔單抗的方案治療37例。
2.2 臨床病理特征 DLBCL光鏡表現,腫瘤細胞彌漫浸潤生長,瘤細胞體積大,核直徑>2個小淋巴細胞,高倍鏡下易見核分裂象(見圖1)。CD30研究結果如下:閾值為>0%時,50例(31%)患者的CD30結果判讀陽性;使用>20%的閾值,27例(17%)患者CD30結果判讀陽性(見圖2)。c-Myc陽性表達率及P53表達率分別為46%(74/160)、52%(83/160),其它臨床和病理學特征(見表1)。根據免疫組化結果對160例患者進行了細胞起源分型評估:17例(11%)為GCB,143例(89%)為non GCB。在所有患者中,BCL-2和c-Myc的表達率分別為81.25%和46.25%(見圖2),其中有3例(1.9%)原位雜交發現EB病毒陽性,并且這3例患者均表達CD30(無論陽性閾值>0%,還是>20%),相較CD30陰性組, CD30陽性組患者可能有較高的EB病毒陽性率,差異有統計學意義(P<0.05)(見表1);另外,23例患者使用FISH檢測c-Myc、BCL-2基因是否存在斷裂,其中7例僅c-Myc斷裂,2例僅BCL-2斷裂,2例檢測到c-Myc及BCL-2同時斷裂,診斷為高級別B細胞淋巴瘤伴雙打擊,見圖3。

表1 160例DLBCL患者的臨床病理特征與CD30、c-Myc、P53蛋白表達情況的比較[n(×10-2)]

圖1 DLBCL形態特點

圖2 DLBCL組織CD30、c-Myc、P53、BCL-2及CD5蛋白表達免疫組化檢測結果

圖3 DLBCL FISH基因檢測結果
2.3 CD30、c-Myc、P53及CD5表達情況及其與患者的臨床病理和預后參數之間的相關性 盡管CD30判讀陽性的閾值(>0%和>20%)不同,但分析所得出的結果卻是相似的。當CD30陽性閾值>0%時,CD30陽性組與CD30陰性組數據分析顯示:ECOG PS評分、EBER兩組參數比較,差異有統計學意義(P<0.05);當CD30陽性閾值>20%時,IPI評分和EB病毒陽性相比差異有統計學意義(P<0.05),其余比較差異均無統計學意義(P>0.05)。c-Myc陽性和陰性表達組患者與初診時LDH水平、骨髓浸潤發生率之間對比差異有統計學意義(P<0.05),并且c-Myc陽性組有較高的Ki-67(>70%,58例,78%)增殖指數(P=0.001)。CD5陽性組與陰性組高BMI及結外累及的發生對比差異有統計學意義(P<0.05),其余參數包括B組癥狀、診斷時的LDH水平、Ann Arbor 分期、IPI評分、骨髓浸潤及ECOG PS評分等差異均無統計學意義(P>0.05)。此外,P53陽性與陰性之間臨床、預后參數數據分析差異均無統計學意義(P>0.05)。見表1。
2.4 不同亞組CD30、P53表達與BCL-2、c-Myc蛋白與基因變化的相關性分析 GCB組與non-GCB組143例,不同亞組CD30、P53表達患者與BCL-2、c-Myc基因重排或蛋白表達之間的關系。發現僅non GCB組中,CD30陽性(>20%)患者相較于CD30陰性患者有較高的c-Myc陽性表達率(P<0.05),其余比較差異均無統計學意義(P>0.05)。同樣,P53表達組對比差異均無統計學意義(P>0.05)。見表2、表3。

表2 CD30、P53蛋白表達情況與c-Myc蛋白和基因變化的相關性

表3 CD30、P53蛋白表達情況與BCL-2蛋白和基因變化的相關性
3 討論
DLBCL是一類由中等至大B淋巴樣細胞構成的腫瘤,腫瘤細胞的核相當于或超過正常巨噬細胞的胞核,或者是大于正常淋巴細胞胞核的2倍,呈彌漫性生長。形態學上包括中心母細胞變型、免疫母細胞變型、間變變型以及其它少見的變型(如梭形細胞變型、印戒細胞樣變型)[1];DLBLC是非霍奇金淋巴瘤中最常見的類型,是一種高侵襲性腫瘤,在細胞起源、形態學、免疫組織化學表型、分子遺傳學、累及部位、化療反應及生存率等方面都表現出明顯的異質性[5-6]。
根據Hans分型,DLBLC細胞起源可以通過聯合使用CD10、BCL-6、IRF4/MUM1抗體,從免疫表型上將其分為具有對預后良好的GCB亞型和不良的non GCB亞型。然而,環磷酰胺、多柔比星、長春新堿和潑尼松(CHOP)傳統方案聯合利妥昔單抗作為最基礎的治療方案,可以改善non GCB亞型患者的預后,減少兩個亞組之間的預后差異,但這兩種亞型之間仍然是異質的[7]。R-CHOP僅可以治愈60%的患者,仍然有高達40%的患者對一線標準治療原發難治,或者在一線治療緩解后或早或晚出現復發[8],其中涉及多種機制和相關基因蛋白的異常表達。因此精確的病理診斷及分子學分類,早期確定腫瘤病情惡化及不良預后風險,是優化DLBLC治療方案,進一步提升療效的關鍵所在。
CD30是腫瘤壞死因子超家族的成員之一,主要在活化的T細胞、B細胞和NK細胞表面表達[9],生理狀態下表達水平較低;而在疾病狀態下,例如病毒感染、自身免疫性疾病及多種淋巴瘤中,CD30則會呈現較高水平表達[10]。既往的研究[11]表明,相當數量的彌漫大B細胞淋巴瘤中會有比例不等的瘤細胞表達CD30。有研究認為不管細胞來源如何(GCB、non GCB),CD30陽性DLBCL的總體預后、無進展預后都優于CD30陰性DLBCL,但其在預后方面的預測價值仍不十分明確,尚不能將CD30作為DLBCL患者的獨立預后因素[12-14]。并且隨著CD30靶向藥物Brentuximab vedotin(BV,維布妥昔單抗)在我國的上市及多項單/多中心臨床試驗的開展,一致認為BV與傳統療法相結合治療CD30陽性B細胞淋巴瘤是一種可行且積極的一線治療方法[15]。本研究中31%(閾值>0%)的DLBCL患者表達CD30,閾值為20%時,17%的患者表達CD30,這些結果與之前其他研究[12,16]中的數據是一致的,相對于CD30陽性患者,CD30陰性組患者中存在B組癥狀、IPI評分≥2分、ECOG PS評分≥2分患者比例更高。此外有研究發現兩種不同閾值可以得出類似的陽性表達結果,提出低水平的CD30表達似乎足以對CD30靶向治療做出反應,閾值>0%可能成為識別新發CD30陽性DBLCL患者的最佳方法[3]。并且有研究[11]提出絕大部分EBV陽性DLBCL患者也表達CD30,它們之間的這種關聯可能是由于特定的病毒機制引起的,而本研究中3例EBV陽性患者也同樣是如此,不管CD30陽性閾值>0%還是>20%,差異均具有統計學意義。另外,因為大部分EBV陽性DLBCL病例表達PD-L1或PD-L2[17],有研究指出這類患者可能會從CD30靶向治療中獲益,尤其是聯合免疫檢查點抑制劑治療。
癌蛋白c-Myc和腫瘤抑制因子P53在調控正常細胞存活和增殖中密不可分,它們的功能也維持組織的穩態:c-Myc能夠誘導ARF腫瘤抑制因子的表達,隨后結合并抑制MDM2的表達,最終引起P53的激活;而P53能夠通過包括轉錄失活和micro-RNA介導的抑制作用在內的多種機制來對c-Myc起抑制作用[18-19]。本研究同時也納入了c-Myc、P53與臨床及病理相關參數的觀察,發現c-Myc陽性患者有更高的LDH水平(初診時)、骨髓浸潤發生率及Ki-67(>70%)增殖指數,而P53蛋白表達與否在本研究中沒有指標有顯著統計學差異,可能是樣本量較少的原因。除此之外,CD5在DLBLC患者中有11%的陽性表達率,CD5陽性患者結外累及發生率較高,雖然統計學提示其與BMI之間存在相關性,但臨床意義并不大。
2017年WHO第四版[20]造血與淋巴組織腫瘤分類中提出BCL-2和c-Myc雙表達的DLBLC患者,其預后比沒有雙表達的DLBLC患者差。而后,2022年第五版[21]再次指出BCL-2和c-Myc雙表達的DLBLC患者不一定有BCL-2和c-Myc基因的重排,而非雙表達的DLBLC患者也有個別的病例可以出現BCL-2和c-Myc基因的重排,所以不能根據BCL-2和c-Myc表達情況來準確推測是否有BCL-2和c-Myc基因重排。因此,本研究還進一步探討了CD30、P53與c-Myc、BCL-2蛋白表達及基因重排之間的相關性。結果顯示僅在non GCB組,CD30陽性與c-Myc表達相關,但考慮本研究總樣本量較少,且使用FISH檢測基因重排的患者數量有限,并未得到更多有明顯統計學差異的陽性結果,但是確有其他研究認為CD30陽性表達與“雙打擊”之間存在某種聯系[22],Campuzano-Zuluaga、Hao等[23-24]甚至認為CD30與BCL-2表達和不良預后之間呈正相關。
4 結論
CD30蛋白陽性與c-Myc蛋白陰性提示DLBLC患者的臨床病理分級更低,可能具有更好的預后,因此其在判斷DLBCL患者的臨床病理及預后中具有重要作用;同時,可能是受樣本量大小的影響,在本研究中P53蛋白的意義暫不明確,這需要更深層次的研究及干預實驗明確其在DLBCL中的意義。

