CT影像組學列線圖模型預測胃腸道間質瘤危險度分級
賈濟波,張萬軍,劉原慶,馮飛文,胡粟,胡春洪
胃腸道間質瘤(gastrointestinal stromal tumor,GIST)是消化系統的一種常見間葉組織來源腫瘤,組織學上有梭形細胞和上皮細胞,生物學行為上具有惡性潛能[1]。研究表明[2]對于局部進展期或晚期GIST,術前治療可提高手術切除率,保護臟器功能,降低復發率,甚至帶來生存獲益。Tirumani等[3]研究發現中高危GIST易發生復發及轉移。因此,術前預測GIST的危險度分級可為是否需要術前行輔助化療提供參考依據。目前主要通過術前穿刺活檢或手術切除病理來評價GIST危險度分級。但是,由于病理取材有限,可能導致病理結果并不能準確反映腫瘤整體危險度分級,此外穿刺活檢還存在并發癥風險[4]。因此,尋找一種能可靠、準確、全面評估GIST患者術前危險度分級的無創方法具有重要的臨床意義。本研究建立基于CT圖像的影像組學列線圖模型,用于術前預測GIST危險度分級,以指導臨床診療及判斷預后。
材料與方法
1.臨床資料
搜集本院和二院2016年1月-2022年4月經病理證實為GIST患者266例的臨床及CT圖像資料進行回顧性分析。納入標準:病理診斷為GIST且進行危險度分級;術前或活檢前2周內行腹部增強檢查。排除標準:①檢查前接受過治療(包括手術及新輔助化療);②手術合并其他腫瘤;③影像檢查與手術或活檢間隔時間超過2周;④圖像質量不佳或影像資料不全者;⑤術中腫瘤破裂,病理無法評估危險度者。
2.檢查方法
檢查設備包括GE revolution CT、Philips Brilliance iCT、SIEMENS Somatom Definition Flash螺旋CT以及SIEMENS Somatom Sensation 64層螺旋 CT 。掃描范圍包括全部病灶區域。掃描期相包括平掃期、動脈期以及靜脈期。增強掃描使用高壓注射器系統。對比劑劑量1.5~2.0 mL/kg,注射流率3~4 mL/s。注射對比劑后25~30 s進行動脈期掃描,55~60 s行門靜脈期掃描(表1)。
3.CT特征分析
兩名放射科醫生對所有CT圖像進行獨立閱片,記錄CT特征,主要包括腫瘤部位、大小、邊界、形態、有無囊變壞死、潰瘍、鈣化、強化方式等(圖1)。意見分歧時進行協商取得一致。
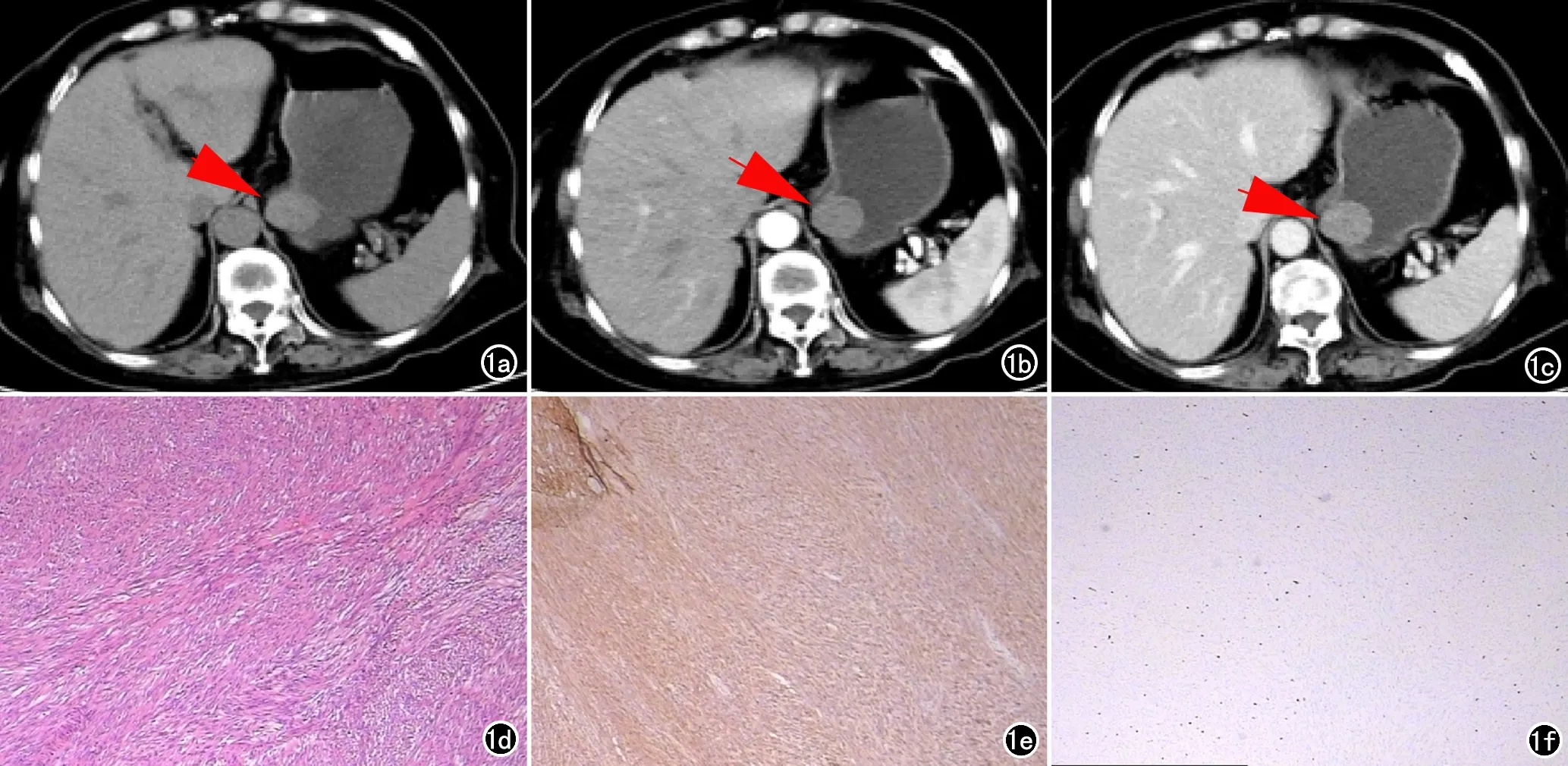
圖1 (賁門下、大彎側)胃間質瘤,危險度分級:低危險度。a)CT平掃賁門下、胃大彎側類圓形軟組織腫塊(箭);b)動脈期病灶輕度均勻強化(箭);c)靜脈期病灶進一步均勻強化(箭);d)鏡下見梭形細胞(×100,HE);e)CD117(+);f)Ki67(+,約1%)。
4.CT圖像分割與放射組學特征提取
首先由1名放射科醫師使用ITK-SNAP(v3.8.0;www.itksnap.org)軟件對腫瘤平掃期、動脈期及靜脈期圖像逐層進行勾畫和分割,生成體積感興趣區(VOI)。VOI包括全部腫瘤,避開內部壞死區,邊緣氣體、腸腔內容物、脂肪以及周圍血管(圖2)。兩周后該醫生和另一名放射科醫生分別對50例(隨機選取)腫瘤各期圖像再次進行分割,以行觀察者間和觀察者內的一致性評估。基于上述VOI,使用FAE軟件對CT圖像進行腫瘤特征提取。
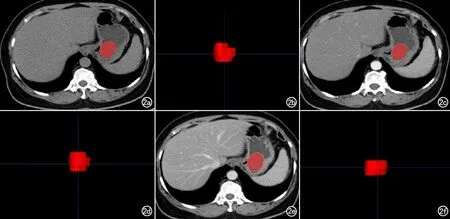
圖2 a) 平掃期橫斷面腫瘤ROI分割圖; b) 平掃期腫瘤VOI; c) 動脈期橫斷面腫瘤ROI; d) 動脈期腫瘤VOI; e) 靜脈期橫斷面腫瘤ROI分割圖; f) 靜脈期腫瘤VOI。
5.危險度分級
據美國國立衛生研究院(NIH)2008改良版[5],將極低危和低危合并為低惡性風險組,中危和高危合并為高惡性風險組。
6.建立臨床模型、影像組學模型及聯合模型
將臨床資料及CT圖像特征、平掃期(N)、動脈期(A)、靜脈期(V)、影像3期(N+A+V)提取的組學特征導入數坤科研平臺(https://science.shukun.net)通過Select Percentile和最小絕對收縮與選擇算子(least absolute shrinkage and selection operator,LASSO)算法降維,使用5個分類器(Random Forest、Logistic Regression、SVM、SGD、XGBoost)建立臨床模型、各期組學模型以及臨床-組學聯合模型。
7.統計分析
使用IBM SPSS 22.0統計軟件進行統計分析。采用組內相關系數(intraclass correlation coefficients,ICC)評估觀察者間和觀察者內在影像組學特征上的一致性(ICC>0.75時認為重復性較好)。采用受試者工作特征(receiver operating characteristic,ROC)曲線下面積(area under curve,AUC)對各模型訓練組與測試組進行量化。采用靈敏度、特異度、準確度、陽性預測值和陰性預測值來評價模型的診斷效能。使用Delong檢驗比較各模型間AUC值差異。
結 果
1.臨床資料及CT圖像特征比較(表2)
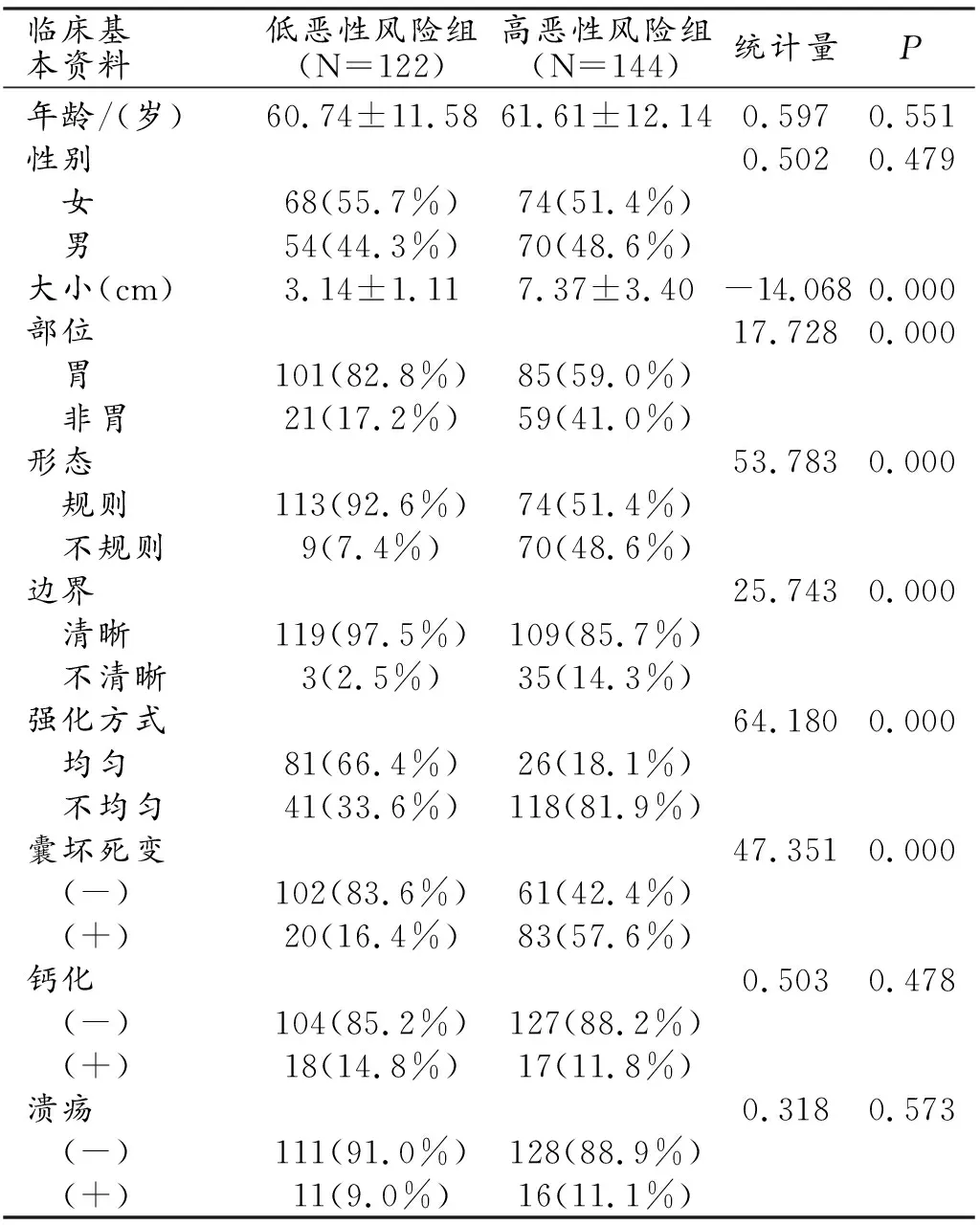
表2 2組患者臨床資料及CT圖像特征比較
266例患者中低惡性風險組122例,女68例,男54例,平均年齡(60.74±11.58)歲,腫瘤生長于胃腔者101例,非胃腔者21例(十二指腸8例,小腸11例,空腸1例,腹腔1例);高惡性風險組144例,女74例,男70例,平均年齡(61.61±12.14)歲,腫瘤生長于胃腔者85例,非胃腔者59例(食管2例,十二指腸7例,小腸36例,直腸2例,腸系膜2例,肝臟1例,后腹膜2例,腹腔7例)。腫瘤大小、部位、形態、邊界、強化方式及有無囊變壞死在兩組中均有統計學差異(P<0.05),而年齡、性別、有無鈣化及潰瘍在兩組中均無統計學差異(P>0.05)。
2.臨床特征篩選及模型建立
按照7:3的比例隨機分組,訓練組186例,測試組80例。臨床資料及CT圖像特征經select percentile和LASSO算法篩選出2個特征(大小、強化方式)建立臨床模型,LASSO特征權重系數分別為0.08、0.20(圖3)。
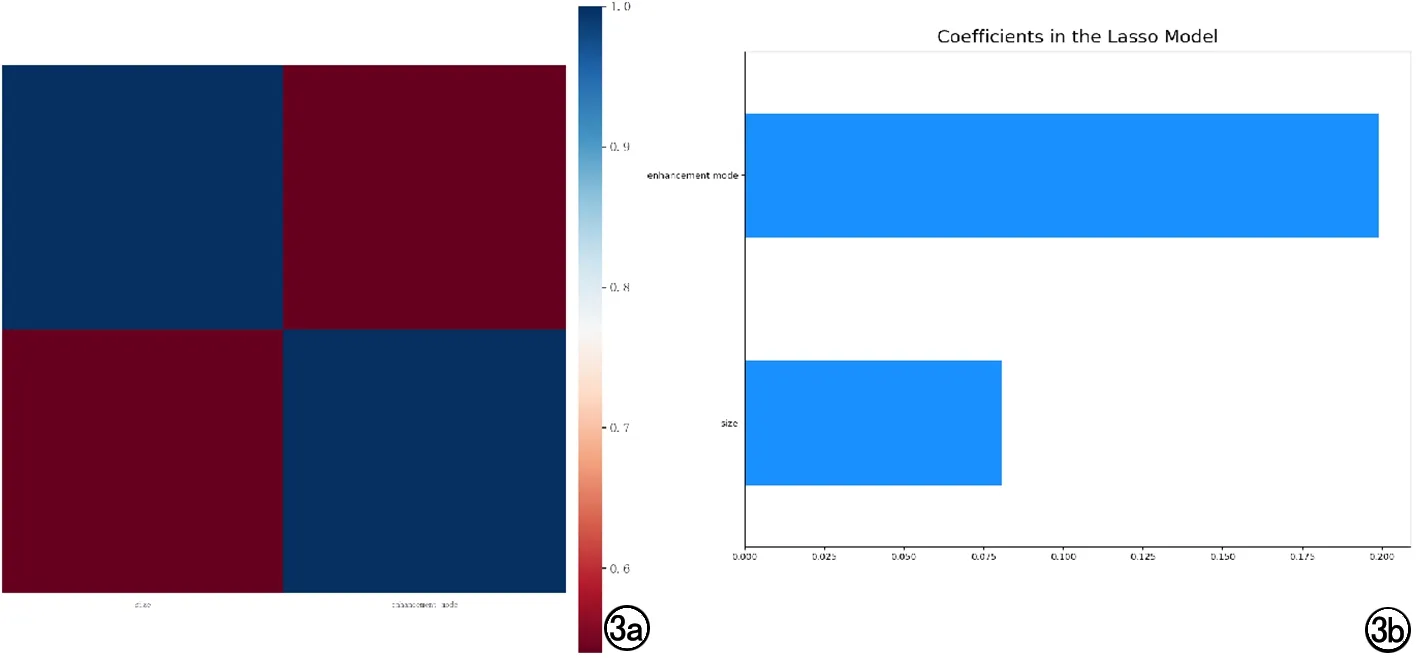
圖3 a)LASSO算法篩選臨床特征;b) 臨床特征權重系數。
3.組學特征篩選和模型建立
對腫瘤提取特征進行一致性檢驗,各期像有1781個組學特征具有較好一致性(ICC>0.75)。按照7:3的比例隨機分組,訓練組186例,測試組80例。首先,將各期像提取的組學特征,經select percentile和LASSO算法降維后,平掃期(圖4a)、動脈期(圖4b)、靜脈期(圖4c)獲得的組學特征分別為5個、24個、24個,而影像3期(N+A+V)共得到8個組學特征(圖4d)。平掃期1個、動脈期2個、靜脈期5個。應用上述篩選后組學特征,使用5個分類器建立各期組學模型。然后,據AUC值進行各期模型組內比較,選出組內最優模型。最后,共建立6個預測模型(表3),包括1個臨床模型、 4個影像組學模型(平掃期、動脈期、靜脈期、平掃期+動脈期+靜脈期)及1個組合模型(臨床-影像-期組學模型)。
4.模型的比較與驗證
6個模型的ROC曲線如圖5所示。通過Delong檢驗進行比較(圖6),臨床模型聯合影像3期 (N+A+V) 組學模型與平掃期模型及影像3期模型有統計學差異,其余各模型間無統計學差異。基于XGBoost分類器構建的臨床模型聯合影像3期 (N+A+V) 組學模型為最佳模型,具有最高的預測效能(訓練組AUC=0.98(95%CI:0.97~0.99);測試組AUC=0.95(95%CI:0.89~0.98))。據該最佳模型生成臨床-CT影像組學列線圖實現模型可視化(圖7)。
討 論
GIST起源于胃腸道Cajal間質細胞或其前體細胞[6],全球發病率約10~15例/100萬[7]。腫瘤較小時常無明顯臨床癥狀。隨著腫瘤體積增大,常出現腹痛、腹部腫塊、消化道出血等癥狀[8]。手術治療是GIST首選治療方法[9],但GIST危險度分級為中高危的患者,存在復發和轉移的風險,需輔以輔助治療。術前行靶向藥物治療縮小腫瘤體積,不僅可避免不必要的聯合臟器切除,降低手術風險,還可增加腫瘤根治性切除機會;對于特殊部位的腫瘤,還可保護其結構和功能[1]。
本研究篩選臨床特征的方法與既往研究不同,既往研究[10-13]臨床特征先行單因素分析,有統計學差異的特征再進一步行多因素邏輯回歸分析。本研究采用數坤科研平臺select percentile和LASSO算法進行特征篩選,最終篩選出腫瘤大小和強化方式2個特征建立臨床模型,LASSO特征權重系數分別為0.08、0.20。基于XGBoost分類器臨床模型具有較高的診斷效能,訓練組和測試組AUC值分別為0.95和0.91。據美國國立衛生研究院(NIH)2008改良版,腫瘤大小、核分裂象計數和腫瘤原發部位是GIST危險度分級的主要參數。但在本研究中腫瘤原發部位特征權重系數較低,不能用于構建臨床模型。張麗靜等[14]研究也表明腫瘤原發部位不是GIST危險度分級的獨立危險因素。但陳媛慧等[15]研究發現胃底間質瘤比小腸間質瘤高危概率大,董婷宇等[16]基于增強CT影像組學術前預測GIST危險度分級的研究也發現腫瘤部位在兩組間存在統計學差異。她們將性別、年齡、腫瘤部位及Ki-67表達情況僅采用卡方檢驗比較兩組間的差異,未進一步進行多因素回歸分析,單因素分析診斷效能價值有限。本研究中腫瘤強化方式也具有較高的特征權重系數。高惡性風險組(中危、高危)腫瘤一般體積較大,密度欠均勻,內部血供不均勻,易出現囊變壞死,故強化不均勻,而低惡性風險組(極低危、低危)腫瘤體積相對較小,內部密度均勻,強化也均勻,與母青林等[17]報道一致。本研究中其他臨床及CT圖像特征權重系數均較低,不能用于構建臨床模型。
目前已有利用放射組學預測GIST危險度分級的報道。Chu等[10]利用增強CT靜脈期圖像構建放射組學術前預測GIST危險度分級模型,該模型在訓練組、驗證組的AUC分別為0.793、0.791。同時,他們的研究還建立了基于患者年齡、腫瘤直徑和形態的臨床模型,AUC值為0.718。本研究構建了4個組學模型,包括平掃期(N)、動脈期(A)、靜脈期(V)以及3期聯合(N+A+V)模型以充分提取各期組學特征;另外,還使用5個分類器對各期特征進行訓練建模,對比了不同模型間的診斷效能。研究結果發現平掃期、動脈期、靜脈期組學模型在測試組對GIST危險度分級預測能力相當,AUC分別為0.84、0.87、0.84,影像3期模型AUC略提高為0.88,較他們僅利用靜脈期圖像建立組學模型預測效能明顯提高。同時,本研究基于腫瘤大小和強化方式建立的臨床模型,AUC值為0.91,較他們的臨床模型預測效能亦明顯提高。WANG等[18]基于動脈期和靜脈期圖像構建放射組學模型預測GIST危險度分級。研究發現使用隨機森林模型在訓練組、外部驗證組具有最高AUC分別為0.88±0.06、0.90,具有較高的預測效能,與本研究影像3期組學模型預測效能差別不明顯,但未建立臨床模型。本研究臨床模型與影像3期(N+A+V)建立的聯合模型在訓練組和測試組的AUC分別為0.98、0.95,預測效能較他們僅構建組學模型有明顯提高。本研究通過勾畫全瘤體、多期像、多算法聯合臨床及CT圖像特征的模型,可使組學特征信息與臨床信息相互補充,從而提高了診斷效能及準確性。
本研究雖為雙中心,但是非前瞻性,結果可能存在選擇偏倚,需要更多前瞻性數據,以便進一步驗證模型效能;此外,本研究包括多種機器類型,對結果也可能存在影響。
綜上所述,本研究基于XGBoost分類器建立了臨床-CT影像組學列線圖,其在術前預測GIST危險度分級上具有較高臨床價值。

