外周血微核試驗檢測可降解生物材料補片的遺傳毒性
王國偉,孫曉霞,車國喜,蓋瀟瀟,屈秋錦,王 焱,汪曉飛,杜曉丹*,劉成虎,*
(1.山東省醫療器械和藥品包裝檢驗研究院/國家藥品監督管理局生物材料器械安全性評價重點實驗室,山東 濟南 250101;2.中國食品藥品檢定研究院,北京 102629)
在疝修補術的發展過程中,隨著無張力疝修補概念的提出及現代材料學的發展,以聚丙烯材料為代表的人工合成補片在臨床上得到了廣泛的應用。人工合成補片具有恢復快、并發癥少、復發率低的特點,基本達到疝修補手術的要求。但在術后出現的感染、黏連、侵襲性腸瘺、局部硬結、異物感等并發癥一直不能得到很好的解決[1-2]。在這種背景下,可降解生物材料補片應運而生了。可降解生物材料補片主要由膠原蛋白、彈性纖維等成分組成,其中膠原蛋白的含量最多,使其具有一定的強度與剛度[3]。在臨床應用中,可降解生物材料補片以“三維立體支架”的形式植入到機體缺損或薄弱部位,通過多種機制吸引宿主細胞向支架移位并生長,為細胞提供生長的場所和空間,宿主細胞分泌新的細胞外基質成分,形成自身組織,完成對缺損組織的修復和重建[4]。隨著可降解生物材料補片在臨床應用中逐漸推廣,其作為一種長久植入體內的醫療器械,評價其在長期植入過程中潛在的遺傳毒性風險是生物相容性研究中的重要部分。
流式體內微核技術借助流式細胞儀高通量檢測的技術優勢,在化合物的遺傳毒性風險評價中有廣泛的應用前景[5]。目前應用流式體內微核技術的研究中,主要以急性暴露后的小鼠或大鼠模型外周血中網織紅細胞微核(micronucleus of reticulocytes,MN-RET)作為關注重點,對于外周血中成熟紅細胞微核(micronucleus of mature erythrocytes,MN-NCE)與 遺傳毒性風險的研究相對較少。本研究從小鼠外周血中MN-RET 和MN-NCE 兩個方面探索可降解生物材料補片體內潛在遺傳毒性風險的方法。
1 材料與方法
1.1 試驗動物
ICR小鼠48只(雌雄各半),體質量18~22 g,購自北京維通利華實驗動物技術有限公司,實驗動物生產許可證號:SCXK(京)2021-0006。
1.2 樣品與主要試劑、設備
外科生物補片(腹壁修補專用),主要成分為纖維蛋白原與己內酯共聚物,規格為140 mm×60 mm,由上海松力生物技術有限公司提供。PBS、甲醇、環磷酰胺(cyclophosphamide,CP)、碘化丙啶、異硫氰酸熒光素標記的磷脂結合蛋白(Annexin V-FITC)、3-16P離心機、3-18KS離心機(Sigma公司),蘇木素染液、伊紅染液(北京索萊寶科技有限公司),甲醛、二甲苯、無水乙醇(國藥集團化學試劑有限公司);小鼠的微核流式加強型檢測試劑盒(BD公司);0.9%氯化鈉注射液(辰欣藥業股份有限公司)。Cytoflex 流式細胞儀(Beckman Coulter 公司),CLASS II 生物安全柜(NuAire 公司),MS3BS25 電動渦旋儀(IKA 公司),振蕩培養箱(上海知楚儀器有限公司),石蠟、超低溫冰箱、組織脫水機、自動組織包埋機、全自動切片機(美國賽默飛世爾科技),自動組織染色封片工作站(日本櫻花儀器公司)。
1.3 試驗方法
1.3.1 試驗液制備取外科生物補片,按照6 cm2/mL的浸提比例,以0.9%氯化鈉注射液為浸提介質,(37±1) ℃,60 r/min振蕩浸提(72±2) h制備樣品試驗液。
1.3.2 動物分組隨機將動物分為介質對照組、環磷酰胺低劑量組(25 mg/kg)、環磷酰胺高劑量組(50 mg/kg)及樣品試驗組,每組6只,雌雄各半。
1.3.3 動物處理與取樣采用腹腔注射的方式,給予受試物容積為10 mL/kg,分長、短周期方案。每日給予受試物1次,短周期連續給予受試物3 d,于末次給予受試物后24 h,小鼠眼眶靜脈取血約100 μL 至含350 μL 抗凝劑管中;長周期連續給予受試物14 d 后按上述方法取血,同時無菌條件下摘取小鼠脾臟置于培養皿中。
1.3.4 血液樣本處理提前準備固定液(將2 mL甲醇加至15 mL離心管中,-80 ℃過夜),將血液樣本顛倒混合均勻,使用移液器吸取180 μL 加至對應已提前低溫預冷的固定液管中,置于-80 ℃條件下固定3 d;將固定血樣從冰箱中逐一取出,立即加入12 mL緩沖液,輕輕混勻后離心(300~400 g)10 min,棄上清液,保留大約50 μL用于重懸細胞,重懸后4 ℃保存樣本;取試劑盒提供的20 μL 瘧原蟲標準品與80 μL標記溶液I(每份樣本包含100 μL 緩沖液、1 μL RNA酶以及1 μL CD71 抗體配制)混合均勻,分別另取20 μL 瘧原蟲標準品、CD71-陰性樣品、陰性對照與陽性對照以及各組試驗樣本與80 μL標記溶液II(每份樣本包含100 μL標記溶液I以及0.5 μL CD61抗體配制)混合均勻,室溫避光孵育30 min,保證RNA 徹底降解;孵育結束后,加入1.5 μL DNA染液(每份樣本包含2 mL緩沖液以及50 μL DNA染料)上機進行流式檢測。
1.3.5 流式細胞術檢測小鼠外周血中的微核應用流式細胞儀數據采集軟件,利用瘧原蟲標準品以及CD71-陰性樣品調節儀器電壓、各通道的熒光補償。儀器校準后,以采集20 000 個網織紅細胞(reticulocytes,RET)作為數據采集終點,分別獲取樣品試驗組、介質對照組、環磷酰胺組小鼠外周血中的網織紅細胞微核(MN-RET)和成熟紅細胞微核(MN-NCE)等數據。
1.3.6 流式細胞術檢測脾臟細胞的凋亡以及脾臟病理檢查取部分小鼠脾臟,用一次性注射器活塞研磨脾臟,反復移行,使脾細胞分離;用PBS 沖洗,收集沖洗液并轉移至無菌離心管中;300 g 離心10 min 后棄上清,加入紅細胞裂解液,反應1 min,加入細胞培養液終止反應;300 g 離心10 min 后棄上清,用預冷的PBS沖洗脾臟細胞懸液,300 g離心5 min后,加入300 μL 緩沖液,每管加入5 μL Annexin V-FITC 混勻后,避光孵育15 min,孵育結束后每管加入5 μL PI染液,上機檢測;將剩余小鼠脾臟組織置于10%福爾馬林溶液中,常規石蠟切片、HE 染色,進行組織病理學檢查。
1.4 統計學方法
實驗數據以的形式表示,采用Student'st(等方差,雙尾)進行統計學分析,選擇與對照組比較的Dunnett 法進行兩兩比較,P<0.05 為差異具有統計學意義。
2 結果
2.1 流式細胞儀核準結果
用瘧原蟲標準品、CD71-陰性樣品校準儀器電壓以及熒光補償后的結果如圖1 所示。儀器校準后,用試劑盒所提供的陰性對照品與陽性對照品上機檢測后,RET 百分率、MN-RET 百分率數據均在參考值范圍內,如表1所示。

表1 試劑盒中陰性對照品與陽性對照品實測數值和對應的參考值范圍
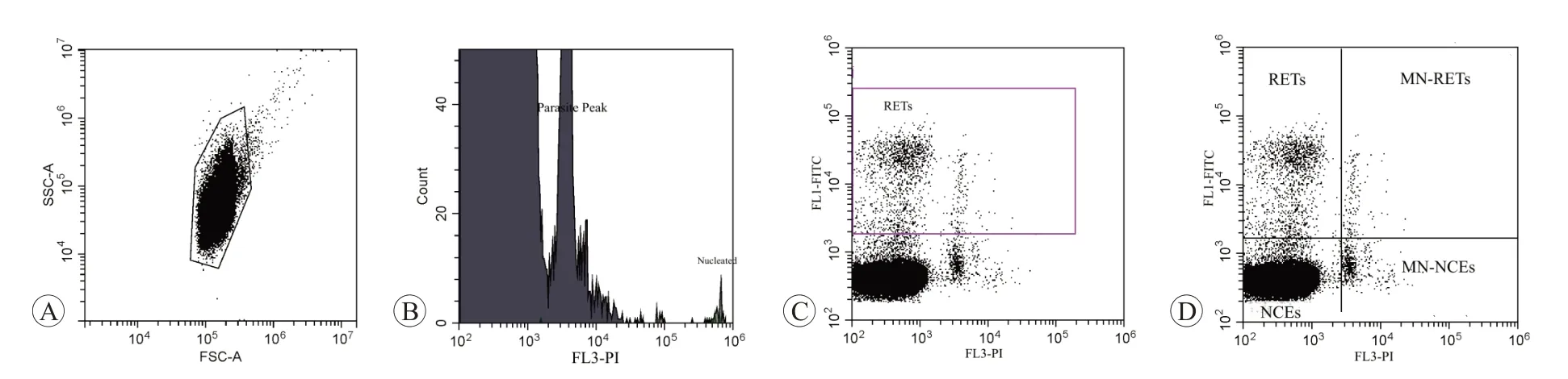
圖1 標準品校準儀器電壓及熒光補償
2.2 流式細胞術檢測小鼠外周血中的微核率
短周期給予受試物3 d 后,與介質對照組比較,樣品試驗組小鼠外周血中RET、MN-RET 和MN-NCE百分率均未見顯著差異(P>0.05);25、50 mg/kg 環磷酰胺組小鼠外周血中RET 百分率均顯著降低而MN-RET 百分率均顯著升高(均為P<0.01)。長周期給予受試物14 d后,與介質對照組比較,樣品試驗組小鼠外周血中RET、MN-RET 和MN-NCE 百分率亦未見顯著性差異,但是環磷酰胺兩個劑量組小鼠外周血中MN-NCE百分率均顯著升高(均為P<0.01),見表2。

表2 小鼠外周血微核試驗結果(%,x±s,n=6)
2.3 脾臟細胞凋亡情況及脾臟病理切片組織學觀察結果
長周期給予受試物14 d 后,用Annexin V-FITC與PI雙染法檢測脾臟細胞的凋亡情況。結果發現,與介質對照組相比,25、50 mg/kg環磷酰胺組晚期凋亡細胞率均顯著升高(P<0.05或P<0.01),如圖2所示。同時對脾臟進行HE 染色后組織病理學檢查發現,與介質對照組相比,樣品試驗組小鼠的脾臟無明顯病理性改變;50 mg/kg環磷酰胺組小鼠脾臟出現明顯的白髓萎縮、淋巴細胞減少,紅髓擴張、髓外造血增加等病理性改變,如圖3所示。

圖2 Annexin V-FITC與PI雙染檢測脾臟細胞凋亡結果
3 討論
可降解生物材料補片是伴隨免疫和組織工程學發展而產生的新興組織修復材料。隨著市場需求的發展,生物補片種類也不斷豐富,包括神經外科生物補片、生物疝補片、生物盆底補片、腹股溝疝生物補片等細分產品[6]。伴隨可降解生物材料類補片市場份額的不斷擴大,針對該類醫療器械產品的安全性評價問題逐漸引起關注。由于可降解材料的降解速度與預期降解產物濃度有很大的不確定性,一種或多種預期產物濃度的增加可能會改變體外生物學試驗體系的pH值/滲透壓,而體內條件下同時存在灌注及碳酸鹽平衡,所以體外試驗結果可能不能反映體內反應。《可吸收醫療器械生物學評價 第1部分:可吸收植入物指南》指出,若評價一種新可吸收材料的遺傳毒性風險,宜考慮進行一項體內試驗[7]。傳統的體內微核試驗閱片過程耗時、結果易受操作者主觀判斷的影響、統計能力有限[8-10]。因此,本研究通過流式細胞術對小鼠外周血中的微核進行分析,探索出評價可降解生物材料補片體內潛在遺傳毒性風險的方法。
試驗結果發現,樣品試驗組小鼠短周期(連續給予受試物3 d)與長周期(連續給予受試物14 d)外周血中的微核率相較于介質對照組均無顯著差異(P>0.05),表明可降解生物材料補片不存在遺傳毒性風險。但值得關注的是,在短期給予受試物條件下,25、50 mg/kg環磷酰胺組小鼠外周血中的MN-RET百分率相較于介質對照組顯著性升高(P<0.01),而MN-NCE 百分率無顯著性差異(P>0.05);長周期給予受試物條件下,25、50 mg/kg環磷酰胺組小鼠外周血中的MN-NCE百分率相較于介質對照組顯著性升高(P<0.01),而MN-RET 百分率無顯著性差異(P>0.05)。導致這種現象的原因可能與Torous 等[11]的研究結果一致,即流式細胞術檢測外周血微核時,MN-RET 百分率的增加與細胞分裂期的急性遺傳毒性有關;MN-NCE 百分率的增加表明可能與亞慢性或慢性接觸后累積的DNA損傷相關。所以在應用流式微核技術評價可降解生物材料補片的潛在遺傳毒性風險時,要根據不同的給藥周期選擇分析外周血中的MN-RET百分率或MN-NCE百分率來評價遺傳毒性風險。
對長周期給予受試物條件下的小鼠脾臟細胞進行凋亡檢測,結果發現,25、50 mg/kg環磷酰胺組脾臟細胞凋亡率顯著性高于介質對照組;同時對脾臟HE染色后組織病理學檢查發現,50 mg/kg環磷酰胺組小鼠脾臟出現明顯的白髓萎縮、淋巴細胞減少,紅髓擴張、髓外造血增加等病理性改變。有研究指出,對大鼠外周血中微核的檢測系統可為亞急性、亞慢性等毒理學研究提供更多的信息[12-15]。本研究的脾臟細胞凋亡結果、組織病理學檢查結果均與流式檢測小鼠外周血中MN-NCE的結果相一致,表明在長周期給藥后分析小鼠外周血中的MN-NCE,對一般毒理學研究有重要的價值。
本研究通過不同給藥周期條件下分析小鼠外周血中MN-RET、MN-NCE 對流式體內微核試驗結果的影響,首次探索了評價可降解生物材料補片體內遺傳毒性風險的方法。并通過將小鼠脾臟毒理學試驗結果和外周血微核試驗結果的分析比較,探索了將流式體內微核試驗結果與一般毒理學研究整合的可能性,對可降解生物材料補片類產品安全性評價有重要意義。

