陸地棉GhCPR5的克隆及其在抗病中的功能分析
許福春,趙靜若,張振楠,胡改元,龍璐
陸地棉的克隆及其在抗病中的功能分析
許福春1,2,趙靜若2,張振楠2,胡改元2,龍璐
1長治醫(yī)學院,山西長治 046000;2河南大學生命科學學院/棉花生物育種與綜合利用全國重點實驗室,河南開封 475000
【目的】通過克隆陸地棉,分析其蛋白結構、表達模式和生物學功能,探究其在棉花響應黃萎病菌與灰霉病菌侵染中的功能和作用機制,為棉花抗病機制研究和育種提供理論基礎和候選基因。【方法】根據(jù)棉花響應黃萎病菌侵染的轉錄組數(shù)據(jù)篩選到,并從陸地棉TM-1中克隆獲得的全長編碼序列。利用生物信息學技術分析GhCPR5的保守結構域、蛋白結構特征和同源基因的系統(tǒng)進化關系;利用實時熒光定量PCR(qPCR)分析在棉花根、莖、葉、胚珠、纖維、花瓣中的表達模式和黃萎病菌誘導的表達模式;構建病毒誘導的沉默載體TRV:,利用農(nóng)桿菌介導的瞬時轉化方法創(chuàng)建抑制表達植株,并借助RT-PCR和qPCR技術檢測的干涉效率。對TRV:和TRV:植株進行黃萎病菌和灰霉病菌接種,觀察比較TRV:和TRV:植株對病原菌的抗性差異;利用qPCR檢測TRV:和TRV:植株中防御相關基因的表達量,分析GhCPR5的作用機制。【結果】從陸地棉TM-1中克隆獲得,其CDS全長1 683 bp,編碼560個氨基酸,蛋白質相對分子量為62.883 kDa,等電點為9.01。多重序列比對和進化樹分析顯示,GhCPR5與榴蓮、可可等物種CPR5同源性較高。此外,GhCPR5與不同物種CPR5的C端蛋白結構高度保守,含有4—5個跨膜結構域。在棉花幼苗真葉中的表達量最高,莖中表達量最低,且其表達受黃萎病菌誘導。在正常條件下,抑制表達植株TRV:和對照植株TRV:在發(fā)育上無明顯差異。但是,接種黃萎病菌后,TRV:植株對黃萎病菌表現(xiàn)敏感,發(fā)病率和病情指數(shù)顯著高于TRV:植株。黃萎病菌和灰霉病菌的離體葉片接種和臺盼藍染色結果顯示,TRV:葉片上的病斑面積顯著高于TRV:葉片,說明下調表達降低了棉花對黃萎病菌和灰霉病菌的抗性。此外,抑制植株體內(nèi)表達量顯著上升,而、和的表達量顯著下降。【結論】GhCPR5正調控棉花抗病性,下調表達可顯著降低棉花對黃萎病菌和灰霉病菌的抗性。
棉花;抗病蛋白;黃萎病菌;灰霉病菌;基因表達
0 引言
【研究意義】棉花作為我國主要的經(jīng)濟作物之一,是天然纖維和植物油的重要原料,在國民經(jīng)濟發(fā)展中占據(jù)重要地位。然而,由黃萎病菌、枯萎病菌、灰霉病菌等植物病原菌引發(fā)的各種植物病害嚴重影響了棉花產(chǎn)量與品質。其中,由大麗輪枝菌()引起的黃萎病被認為是棉花的“癌癥”,主要通過維管組織向植株各部位擴散,是制約棉花產(chǎn)業(yè)發(fā)展的主要病害[1-2]。通常情況下,黃萎病菌以菌核體的形式在土壤中休眠,并在適宜環(huán)境下,從寄主根部傷口或幼根侵入,傳播迅速、為害廣泛。在我國,每年有一半以上的棉田遭受此病害[3-4]。盡管如此,目前還沒有控制黃萎病菌的有效方法和策略。此外,由灰葡萄孢菌()引起的棉鈴灰霉病分布廣泛,該病菌會造成棉花爛鈴或棉鈴干腐,嚴重影響了纖維品質。因此,發(fā)掘抗病功能基因、解析抗病機制、培育棉花抗病新品種對棉花產(chǎn)業(yè)發(fā)展具有重要意義。【前人研究進展】研究表明,木質素、棉酚、類黃酮等次生代謝物在棉花對黃萎病菌的抗性反應中發(fā)揮了重要作用。Xu等[5]發(fā)現(xiàn)黃萎病菌接種處理后,抗病品種海島棉體內(nèi)的木質素合成路徑基因表達顯著高于感病的陸地棉品種,且木質素含量增加,說明木質素參與棉花抗黃萎病菌。棉花主要次生代謝產(chǎn)物棉酚可抑制病原菌生長,抑制棉酚合成關鍵基因的表達可降低棉花對黃萎病菌的抗性[6]。漆酶也參與棉花抗病過程,在棉花中過表達漆酶基因和可增強棉花對黃萎病菌的抗性[7-8]。此外,調控木質素、類黃酮等次生物質合成的轉錄因子、、也參與調控棉花對黃萎病的抗性[9-11]。番茄是目前報道的唯一一個抗黃萎病的R基因,將轉化到棉花中并不能增強棉花對黃萎病菌V991的抗性,但提高了棉花對含有的黃萎病菌株V4的抗性[12]。激素信號路徑作為植物免疫調控網(wǎng)絡的重要組分,其中茉莉酸(jasmonic acid,JA)、水楊酸(salicylic acid,SA)、乙烯(ethylene,ETH)在棉花與黃萎病互作中發(fā)揮了重要作用[13-14]。黃萎病菌的侵染會改變棉花體內(nèi)的激素水平和相關基因的表達,在棉花中抑制JA合成或信號轉導相關基因、的表達可降低棉花對黃萎病菌的抗性[15-16]。參與逆境脅迫響應的有絲分裂原活化蛋白激酶MAPK信號路徑在棉花抗病反應中也發(fā)揮了重要作用,在棉花中過表達降低了棉花對黃萎病菌的抗性[17]。此外,灰霉病主要危害農(nóng)作物果實,如棉鈴、黃瓜、番茄、草莓等,我國目前對灰霉病的防治主要以化學防治為主。因此,發(fā)掘新的抗病基因,培育抗病品種對于農(nóng)作物產(chǎn)業(yè)發(fā)展具有重要意義。組成型表達的病程相關基因(constitutive expression of pathogenesis-related genes 5)作為一個重要防御相關基因,其功能在擬南芥、玉米、水稻等多種植物中被廣泛研究。擬南芥AtCPR5編碼一個核膜蛋白,被認為是核孔復合體的組成部分。在不同植物中,CPR5跨膜結構較為保守,C端包含4—5個跨膜結構域[18-19]。大量研究表明,是一個多功能基因,廣泛參與植物抗病反應、細胞增殖、細胞死亡、細胞衰老、細胞壁形成、茉莉酸信號途徑、水楊酸信號路徑、乙烯信號路徑、脫落酸途徑等過程[20-26]。最近,Wang等[27]根據(jù)擬南芥CPR5蛋白序列對海島棉、陸地棉、樹棉、草棉等不同基因組類型棉花中的進行全基因組鑒定,發(fā)現(xiàn)在棉花中沉默草棉后,沉默植株葉和葉柄上的表皮毛密度顯著低于對照植株,但并未研究在棉花抗病反應中的功能。【本研究切入點】病害是影響棉花產(chǎn)量和品質的重要因素之一,CPR5作為一個重要免疫蛋白,在植物抗病防御反應中發(fā)揮著重要作用,在擬南芥、水稻、玉米等物種中已被廣泛研究。但是,棉花中關于的研究較少,在棉花抗病過程中發(fā)揮的功能尚不清楚。通過棉花響應黃萎病菌的轉錄組數(shù)據(jù)篩選到一個,其在棉花抗病方面的功能有待發(fā)掘。【擬解決的關鍵問題】本研究通過分析陸地棉序列特征和黃萎病菌誘導表達模式,利用病毒誘導的基因沉默技術(virus induced gene silencing,VIGS)下調棉花體內(nèi)的表達,明確其在棉花抵御黃萎病菌和灰霉病菌中的作用,為棉花抗病機制研究和分子育種提供理論依據(jù)和候選基因。
1 材料與方法
1.1 材料和培養(yǎng)
所用棉花材料為陸地棉TM-1。挑選籽粒飽滿的種子,用無菌水浸泡5 h,然后將浸泡過的種子用濕潤的紗布包裹,放置于28 ℃生化培養(yǎng)箱中進行催芽。將胚根長度萌發(fā)較為一致的種子種于營養(yǎng)土中,并覆蓋一層薄膜保濕,放于光照培養(yǎng)箱中培養(yǎng),2 d后去除薄膜和種殼。培養(yǎng)條件為溫度25 ℃,濕度70%,光照/黑暗=16 h/ 8 h。
1.2 棉花總RNA提取、cDNA合成和PCR擴增
使用多糖多酚植物總RNA提取試劑盒DP441(天根生化科技,北京)提取棉花不同組織的總RNA。用HiScript? Ⅲ RT SuperMix for qPCR(+gDNA wiper)試劑盒(諾唯贊,南京)合成cDNA。將稀釋50倍的cDNA作為模板,進行RT-PCR和實時熒光定量PCR擴增試驗,內(nèi)參基因為陸地棉(登錄號:DQ116441)。RT-PCR擴增結果用1.2%瓊脂糖凝膠電泳進行檢測。qRT-PCR用ChamQTM SYBR? qPCR Master Mix定量試劑盒(諾唯贊,南京)完成,每個反應至少3個技術重復,用2-ΔCt方法計算目的基因的表達量。所用引物見表1。

表1 研究所用引物
1.3 GhCPR5的克隆和生物信息學分析
從CottonFGD(https://cottonfgd.org/)網(wǎng)站下載的全長序列,將此序列作為參考序列進行引物設計和PCR擴增,然后將擴增片段與TA克隆載體PGEM-T-easy連接,通過測序獲得的轉錄序列。使用在線網(wǎng)站Compute pI/Mw tool(http://web.expasy.org/compute_pi/)分析GhCPR5蛋白的等電點和分子量;從NCBI(http://www.ncbi.nlm. nih.gov/)網(wǎng)站下載GhCPR5的同源蛋白序列,利用DNAMAN軟件對GhCPR5和其同源蛋白進行序列比對;利用MEGA6鄰近法構建GhCPR5和同源蛋白的系統(tǒng)進化樹[28];使用TMHMM在線網(wǎng)站(http:// www.cbs.dtu.dk/services/TMHMM/)分析GhCPR5和同源蛋白的跨膜結構域;利用SMART在線網(wǎng)站(http://smart.embl-heidelberg.de/)分析CPR5蛋白的保守結構域。
1.4 GhCPR5表達模式分析
按照RNA提取試劑盒說明書提取陸地棉TM-1植株根、莖、真葉、子葉、胚珠、纖維和花瓣7個組織的RNA,并反轉錄成cDNA備用。以這些組織的cDNA為模板進行qRT-PCR擴增,分析在棉花不同組織中的表達水平。利用傷根法對生長至四葉一心的棉株進行黃萎病菌接種處理,水處理作為對照組。對處理1、4、12和24 h的根進行RNA提取和cDNA合成,方法參考1.2。以合成的cDNA為模板進行qRT-PCR擴增,以分析在黃萎病菌處理不同時間下的表達量。每個反應至少3個技術重復,用2-ΔCt方法計算的相對表達量。
1.5 GhCPR5干涉載體構建
采用酶切連接方法構建干涉載體,具體步驟如下:將的特異序列作為干涉區(qū)段,正向引物加上Ⅰ酶切位點,反向引物加上HⅠ酶切位點[6],然后以全長序列為模板進行PCR擴增。擴增產(chǎn)物和VIGS干涉載體TRV2同時用Ⅰ和HⅠ進行酶切,酶切3 h后純化回收,然后用T4連接酶進行連接反應。利用熱激法將連接產(chǎn)物轉化到大腸桿菌DH5α中,并對單克隆進行PCR檢測和測序分析,然后將測序正確的質粒轉化到農(nóng)桿菌GV3101中,備用。
1.6 GhCPR5沉默植株創(chuàng)建和干涉效率檢測
將-80 ℃保存的、、TRV:和TRV:農(nóng)桿菌菌株進行活化培養(yǎng)。利用離心機收集過夜培養(yǎng)的菌液,菌體用重懸液重懸,并將菌液OD600值調整至0.9。重懸液組分為10 mmol·L-1氯化鎂、10 mmol·L-12-(N-嗎啉)乙磺酸和200 μmol·L-1乙酰丁香酮。重懸菌液室溫靜置3 h后,將、TRV:和TRV:菌液分別與輔助菌液進行等體積混勻,利用注射器將混勻后的菌液分別注射到生長一周的TM-1棉花子葉中,然后在黑暗條件下培養(yǎng)16 h后放于正常光周期培養(yǎng)箱中繼續(xù)培養(yǎng),培養(yǎng)溫度為23 ℃。待陽性對照植株TRV:出現(xiàn)白化表型后,提取對照植株TRV:(注射菌液的植株)和基因沉默植株TRV:的RNA,并反轉錄成cDNA,利用RT-PCR和qRT-PCR技術檢測的干涉效率。每個反應至少3個技術重復,用2-ΔΔCt方法計算表達量。
1.7 黃萎病菌培養(yǎng)與棉株接菌處理
將300 μL黃萎病菌孢子液V991接種到PDA固體培養(yǎng)基上,置于25 ℃生化培養(yǎng)箱中黑暗培養(yǎng)5 d,利用無菌水沖洗出培養(yǎng)的黃萎病菌孢子,并將其濃度調整至2×106個/mL備用。棉花黃萎病菌整株接種采用傷根法進行接種[29],具體操作如下:將TRV:和TRV:植株從濕潤的營養(yǎng)土中取出,利用剪刀剪去主根和側根根尖,在濃度為2×106個/mL的孢子液中浸泡30 s,然后種回營養(yǎng)土中,置于光照培養(yǎng)箱中繼續(xù)培養(yǎng),觀察統(tǒng)計植株黃萎病發(fā)病情況。每個處理設置3個生物學重復,每個重復至少接種15棵棉花植株,然后計算植株的發(fā)病率和發(fā)病指數(shù)[17]。此外,對TRV:和TRV:發(fā)病植株進行真菌恢復培養(yǎng)試驗[30]。
對TRV:和TRV:植株進行離體葉片接種時,將黃萎病菌孢子濃度調整為2×107個/mL。具體操作如下:將相同葉齡、大小比較一致的棉花葉片放在托盤中,托盤底部放置兩張濕潤的濾紙。利用針頭在葉片相同部位的葉脈處扎出傷口,將10 μL孢子液滴在傷口處,然后用保鮮膜覆蓋葉片,25 ℃培養(yǎng)箱中培養(yǎng)。每天觀察葉片的發(fā)病情況,并拍照記錄。每個處理設置3個生物學重復,每個重復至少接種10片棉花真葉。
1.8 灰霉病菌培養(yǎng)與棉株接菌處理
將保存的灰霉病菌接種到PDA固體培養(yǎng)基上,25 ℃生化培養(yǎng)箱中進行活化培養(yǎng)。培養(yǎng)4 d后,用打孔器獲取大小一致的菌體,備用。將相同葉齡、大小比較一致的來自TRV:和TRV:植株的棉花葉片放在托盤中,底部放置兩張濕潤的濾紙。在葉片主脈中間扎出傷口,將菌體置于傷口處,然后覆蓋一層保鮮膜,置于25 ℃培養(yǎng)箱中培養(yǎng)[31]。每天觀察記錄葉片的發(fā)病情況,葉片病斑面積用Image J軟件進行統(tǒng)計。每個處理設置3個生物學重復,每個重復至少接種10片棉花真葉。
1.9 棉花葉片臺盼藍染色
用臺盼藍乳酸染色液對接菌后的棉花葉片進行染色,臺盼藍乳酸染色液組分為:10 mL 85%乳酸、10 mL水飽和酚、10 mL甘油、10 mL蒸餾水和15 mg臺盼藍染料。將來自TRV:和TRV:植株的棉花葉片分別置于玻璃瓶中,加入30 mL臺盼藍乳酸染色液,真空處理20 min。隨后100 ℃孵育8 min,37 ℃孵育4 h,25 ℃染色8 h。染色結束后用蒸餾水洗去多余染液,用2.5 g·mL-1的水合氯醛溶液進行脫色,對脫色的葉片進行拍照記錄。
2 結果
2.1 GhCPR5的克隆與序列分析
前期研究中,通過比較轉錄組分析在陸地棉TM-1中篩選到一個在轉錄水平響應黃萎病菌侵染的候選基因,將其命名為。隨后,從陸地棉TM-1基因組數(shù)據(jù)庫中下載的編碼序列(CDS),結果顯示,在A基因組()和D基因組()的CDS全長1 683 bp,編碼560個氨基酸,和編碼的蛋白質氨基酸序列相似性為96.61%。以陸地棉TM-1葉的cDNA為模板進行PCR擴增和測序分析,結果顯示,GhCPR5和Gh_D03G0427的氨基酸序列相似性為99.82%,只在C末端存在一個氨基酸差異,且GhCPR5和擬南芥AtCPR5(AT5G64930)在C端序列相似性較高(圖1-A)。此外,GhCPR5蛋白質相對分子量為62.883 kDa,等電點為9.01。將陸地棉GhCPR5氨基酸序列和擬南芥、玉米、水稻、大豆、可可、榴蓮、木槿、茶樹、木薯等其他物種的CPR5序列進行比對和進化樹分析,發(fā)現(xiàn)GhCPR5蛋白序列與錦葵科的可可和錦葵目的榴蓮CPR5序列同源性較高(圖1-B)。跨膜結構域預測分析顯示,GhCPR5在C端含有5個跨膜結構域(圖1-C),源自大豆、木薯、茶樹的CPR5分別包含4個跨膜結構域,而擬南芥、玉米、水稻、高粱、木槿、榴蓮、可可和黃麻植物的CPR5分別包括5個跨膜結構域,說明CPR5蛋白C端的跨膜結構域在植物界高度保守。
2.2 GhCPR5組織表達和黃萎病菌誘導表達模式分析
通過分析棉花幼苗真葉、子葉、莖和根,開花期的纖維、花瓣和胚珠中的表達量,發(fā)現(xiàn)在幼苗真葉中的表達量最高、在莖中的表達量最低,而在其他組織中的表達量約為內(nèi)參基因的0.02%—0.15%,說明相對的表達量較低(圖2-A)。此外,為探究的轉錄是否響應黃萎病菌的侵染,對四葉期的棉花幼苗進行黃萎病菌V991接種處理,進一步分析在黃萎病菌誘導下的基因表達情況。結果顯示,在棉花接種黃萎病菌1和4 h時,表達量顯著高于對照組。但是,在12和24 h時,表達量降低,且和對照組的表達量無顯著差異(圖2-B)。
2.3 GhCPR5抑制表達植株創(chuàng)建和基因干涉效率分析
為探究在棉花抵御病原菌侵染中的作用,構建了病毒誘導的沉默載體TRV:,并通過農(nóng)桿菌介導的瞬時轉化方法獲得沉默植株。結果顯示,陽性對照TRV:植株真葉出現(xiàn)明顯的白化表型,說明在棉花中利用VIGS技術可對目標基因實現(xiàn)快速、高效沉默(圖3-A)。此外,與對照植株TRV:相比,抑制表達植株TRV:在發(fā)育上無顯著差異(圖3-B),且TRV:植株體內(nèi)的表達量顯著低于TRV:植株(圖3-C)。結果表明,在正常生長條件下,降低棉花體內(nèi)表達不影響棉株生長發(fā)育。
2.4 抑制GhCPR5表達降低了棉花對黃萎病菌的抗性
對TRV:和TRV:植株進行整株黃萎病菌V991接種,結果表明,TRV:植株葉片發(fā)黃、萎蔫的程度顯著高于TRV:(圖4-A)。且與TRV:植株相比,TRV:植株莖稈維管組織的褐化程度較高(圖4-B),與TRV:植株發(fā)病較重的癥狀相符。真菌恢復培養(yǎng)試驗結果顯示,TRV:植株的莖段經(jīng)培養(yǎng)后生長的菌落較少,而TRV:植株莖段上生長的菌落較多(圖4-C)。發(fā)病率統(tǒng)計結果顯示,接種后第5天,TRV:植株發(fā)病率約為25.56%,而TRV:抑制表達植株發(fā)病率達到50%以上,顯著高于對照植株;接種后第7天,TRV:發(fā)病率達到50%,TRV:抑制表達植株發(fā)表率約為90.83%,統(tǒng)計分析顯示仍顯著高于對照植株;接種后第9天,TRV:和TRV:發(fā)病率均達到90%以上,兩者之間無顯著差異(圖4-D)。病情指數(shù)統(tǒng)計結果表明,在黃萎病菌接種后的第5、7和9天,TRV:植株病情指數(shù)均顯著高于TRV:植株(圖4-E)。
此外,對TRV:和TRV:植株的離體葉片進行黃萎病菌接種,結果顯示,TRV:植株葉片上的病斑面積顯著高于TRV:植株葉片上的病斑面積(圖5-A—B)。臺盼藍染色結果顯示,TRV:葉片上的壞死細胞量明顯高于對照植株葉片(圖5-C)。以上結果表明,在棉花中下調表達,降低了棉花對黃萎病菌的抗性。
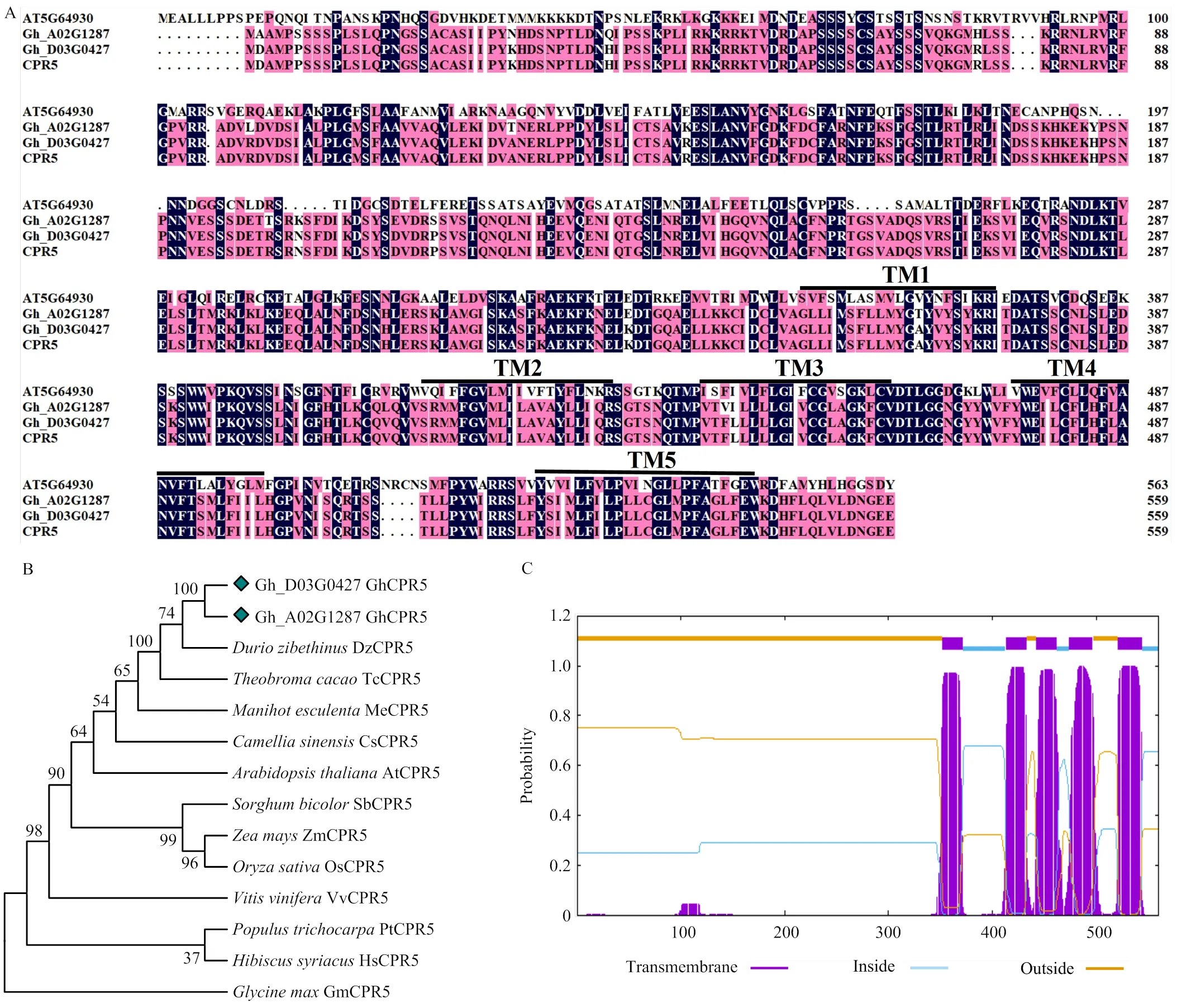
A:GhCPR5與擬南芥CPR5氨基酸序列比對。AT5G64930:擬南芥CPR5;Gh_A02G1287/Gh_D03G0427:陸地棉基因組庫中A、D基因組上的GhCPR5序列;CPR5:GhCPR5的擴增序列。B:GhCPR5與其他物種CPR5的系統(tǒng)進化樹。Dz:榴蓮,XP_022739926,Tc:可可,XP_007048101,Me:木薯,XP_021633464,Cs:茶樹,XP_028102180,At:擬南芥,AT5G64930,Sb:高粱,XP_002454622,Zm:玉米,NP_001146273,Os:水稻,XP_015643035,Vv:葡萄,XP_002280314,Pt:毛果楊,XP_006380467,Hs:木槿,XP_039044948,Gm:大豆,XP_006581733。C:GhCPR5蛋白跨膜結構域(TMs)預測
2.5 抑制棉花體內(nèi)GhCPR5表達降低了棉花對灰霉病菌的抗性
為檢測下調表達是否影響棉花對灰霉病菌的抗性,對TRV:和TRV:植株的離體葉片進行灰霉病菌接種試驗。結果顯示,TRV:葉片上的病斑面積顯著高于TRV:對照植株葉片的病斑面積(圖5-D—E)。此外,臺盼藍染色結果顯示,TRV:植株葉片上壞死細胞面積和灰霉病菌的菌絲量顯著高于對照植株葉片(圖5-F)。此結果表明,在棉花中下調表達,降低了棉花對灰霉病菌的抗性。
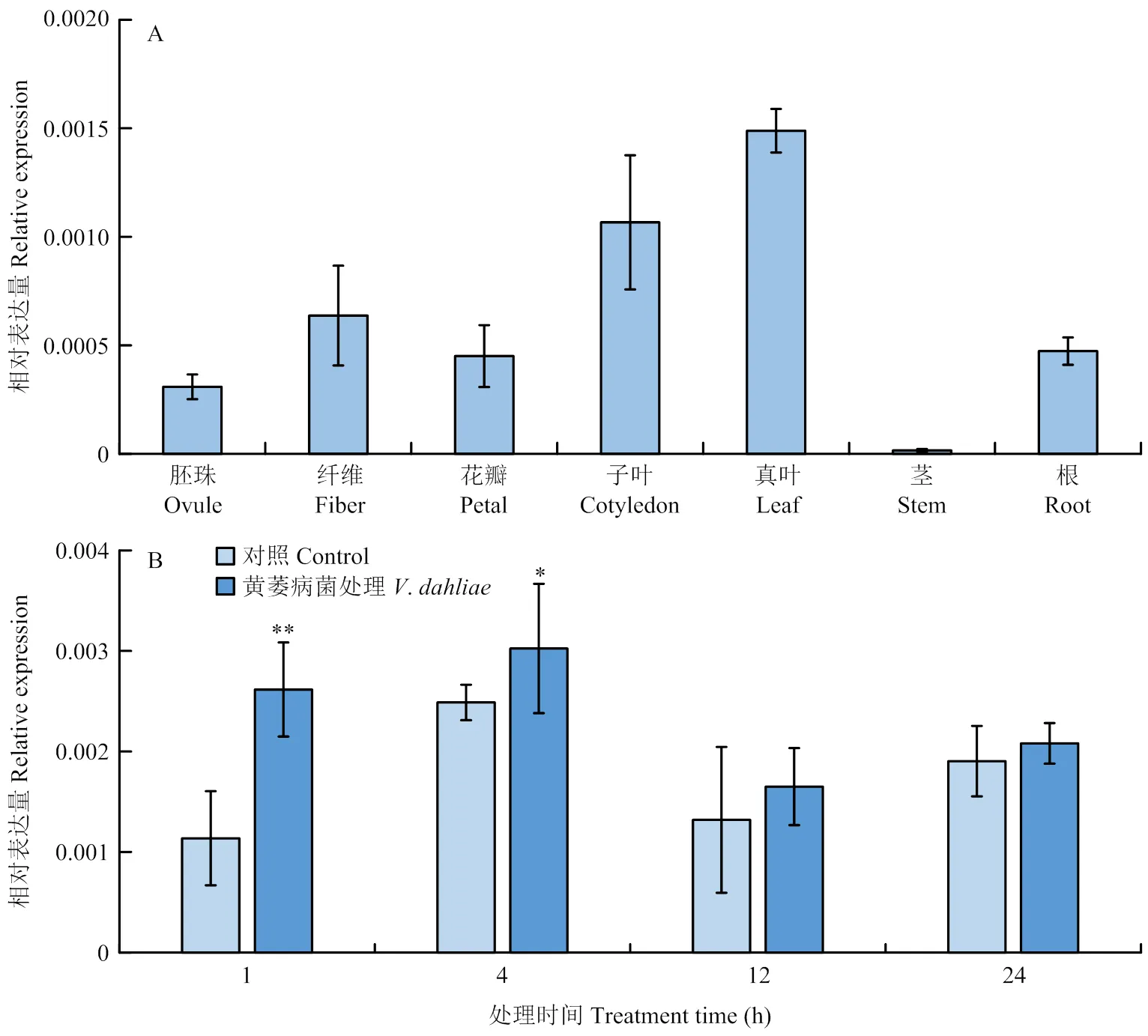
A:GhCPR5在不同棉花組織中的表達模式分析;B:GhCPR5在黃萎病菌誘導下的基因表達分析。*和**:在P<0.05和P<0.01時差異達到顯著和極顯著。下同
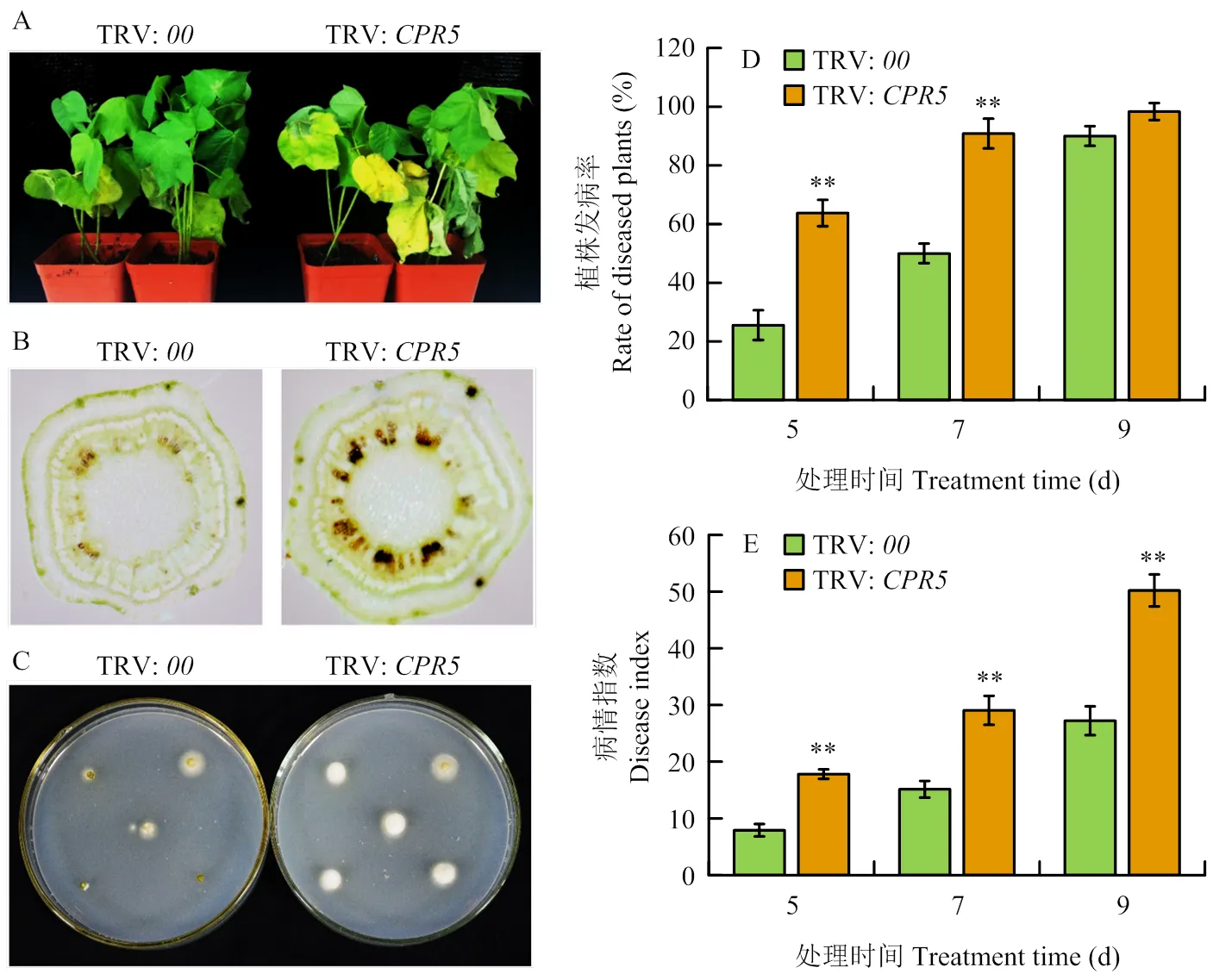
A:TRV:00和TRV:CPR5植株在接種黃萎病菌9 d后的整株發(fā)病情況;B:TRV:00和TRV:CPR5接種黃萎病菌9 d后莖稈橫切面觀察;C:TRV:00和TRV:CPR5植株接種黃萎病菌9 d后莖稈真菌恢復培養(yǎng);D:TRV:00和TRV:CPR5植株接種黃萎病菌后發(fā)病率統(tǒng)計分析;E:TRV:00和TRV:CPR5植株接種黃萎病菌不同天數(shù)的病情指數(shù)

A:TRV:00和TRV:CPR5植株葉片接種黃萎病菌3 d的病斑情況;B:黃萎病菌侵染TRV:00和TRV:CPR5葉片的病斑面積統(tǒng)計;C:TRV:00和TRV:CPR5葉片接種黃萎病菌后,葉片表面菌絲和壞死細胞的臺盼藍染色;D:TRV:00和TRV:CPR5植株葉片接種灰霉病菌4 d的表型觀察;E:灰霉病菌侵染TRV:00和TRV:CPR5葉片的病斑面積統(tǒng)計;F:TRV:00和TRV:CPR5葉片接種灰霉病菌后,葉片表面菌絲和壞死細胞的臺盼藍染色
2.6 GhCPR5抑制表達植株防御相關基因表達分析
為進一步探究在響應病原菌過程中可能參與的抗病信號路徑,檢測TRV:和TRV:植株在黃萎病菌侵染4 h時體內(nèi)JA信號路徑、SA信號路徑和一些防御相關基因的表達水平。結果顯示,與對照植株相比,沉默植株體內(nèi)JA信號路徑相關基因的表達量顯著高于對照植株,而抗病相關基因、和在TRV:植株中的表達量顯著低于TRV:植株(圖6)。此外,和SA信號通路中病程相關蛋白基因的表達量無顯著變化。此結果說明,棉株在受到病原菌侵染時,可能通過表達GhCPR5蛋白進一步激活JA信號路徑和誘導抗病相關蛋白的表達來提高棉花抗病性。

圖6 qRT-PCR分析防御相關基因在TRV:00和TRV:CPR5植株中的表達量
3 討論
3.1 GhCPR5與同源蛋白的結構保守性
生物信息學可分析蛋白結構、基因表達、基因啟動子元件等,為研究基因功能提供線索和參考依據(jù)。本研究通過分析GhCPR5及其同源蛋白的氨基酸序列,預測到GhCPR5蛋白C端有5個跨膜結構域,大豆、玉米和高粱等物種CPR5蛋白在C端也有4—5個跨膜結構。有文獻報道AtGhCPR5在C端有4—5個跨膜結構域[32],水稻有5個跨膜結構域[33]。系統(tǒng)進化樹分析顯示,棉花GhCPR5和可可、榴蓮、擬南芥等物種CPR5氨基酸序列同源性較高。此外,序列比對和蛋白結構分析結果表明植物界CPR5蛋白C端序列結構高度保守,這種保守性可能與其生物學功能相關。
3.2 GhCPR5與同源蛋白的功能差異性
擬南芥突變體植株表現(xiàn)為矮小、表皮毛異常、葉片早衰并有類病斑、水楊酸高積累、對致病菌抗性增強等性狀[20, 25, 32]。近期研究表明,突變體對丁香假單胞菌Pst hrcC菌株的感病性顯著高于對照植株,在植物模式觸發(fā)的免疫(pattern- triggered immunity,PTI)反應中起正調控作用,同時也說明CPR5在PTI和效應子引起的免疫反應調控中發(fā)揮著不同的功能[34]。我們的研究發(fā)現(xiàn)表達受黃萎病菌誘導,且在棉花中下調降低了棉花對病原菌的抗性,說明GhCPR5正調控棉花對病原菌的抗性。但是,下調表達不影響棉株生長和發(fā)育,棉花葉片也沒有出現(xiàn)類病斑。此結果表明,GhCPR5和AtCPR5功能在病原菌防御方面類似,都參與植物免疫過程;同時也表明不同植物間CPR5蛋白結構雖然保守,但具體生物學功能存在一定差異。
3.3 GhCPR5與JA信號的關系
JA及其衍生物是植物重要的信號分子,在植物應對生物與非生物脅迫中發(fā)揮重要作用,并被廣泛研究[35]。植物受到病原菌入侵時會激活JA合成途徑,合成的JA作為信號分子進一步激活下游防御信號路徑,誘導、、等防御相關基因表達,以提高植物對病原菌的抗性[36]。茉莉酸甲酯處理還會誘導植物萜類物質合成、苯丙氨酸代謝、JA合成、JA信號路徑等有利于增強植物抗性相關基因的表達[37]。棉花與黃萎病互作機制研究結果表明,JA合成以及信號傳導路徑在棉花抵御黃萎病菌侵染中發(fā)揮著重要作用。如,He等[38]發(fā)現(xiàn)在棉花中過表達JA信號路徑關鍵抑制因子會降低棉花對黃萎病菌的抗性,過表達激活JA合成路徑的轉錄因子可增強棉花對黃萎病菌的抗性。Wang等[16]發(fā)現(xiàn),在棉花中抑制長鏈非編碼RNA基因的表達,導致JA合成關鍵基因表達顯著下調,植株體內(nèi)JA含量降低,對黃萎病菌抗性減弱。在本研究中,沉默植株體內(nèi)JA信號路徑表達量顯著高于對照植株,而防御相關基因、、表達量顯著下調,說明病原菌侵染激發(fā)了TRV:植株體內(nèi)的JA信號路徑。但表達被抑制,導致植物防御相關基因不能正常表達,對病原菌防御能力降低,推測GhCPR5可能作用于JA信號路徑的下游。
4 結論
從陸地棉TM-1中克隆到,其全長1 683 bp,編碼560個氨基酸,且GhCPR5蛋白在結構上較為保守,具有5個跨膜結構域。在棉花幼苗真葉中表達量最高,莖中表達量最低,并受黃萎病菌誘導表達。在棉花中下調表達可降低棉花對黃萎病菌和灰霉病菌的抗性。
[1] SHABAN M, MIAO Y H, ULLAH A, KHAN A Q, MENGHWAR H, KHAN A H, AHMED M M, TABASSUM M A, ZHU L F. Physiological and molecular mechanism of defense in cotton against. Plant Physiology and Biochemistry, 2018, 125: 193-204.
[2] ZHANG J, HU H L, WANG X N, YANG Y H, ZHANG C J, ZHU H Q, SHI L, TANG C M, ZHAO M W. Dynamic infection ofin upland cotton. Plant Biology, 2020, 22(1): 90-105.
[3] LUO X M, XIE C J, DONG J Y, YANG X Y, SUI A P. Interactions betweenand its host: vegetative growth, pathogenicity, plant immunity. Applied Microbiology and Biotechnology, 2014, 98(16): 6921-6932.
[4] ZHANG X Y, CHENG W H, FENG Z D, ZHU Q H, SUN Y Q, LI Y J, SUN J. Transcriptomic analysis of gene expression ofupon treatment of the cotton root exudates. BMC Genomics, 2020, 21(1): 155.
[5] XU L, ZHU L F, TU L L, LIU L L, YUAN D J, JIN L, LONG L, ZHANG X L. Lignin metabolism has a central role in the resistance of cotton to the wilt fungusas revealed by RNA-Seq-dependent transcriptional analysis and histochemistry. Journal of Experimental Botany, 2011, 62(15): 5607-5621.
[6] GAO W, LONG L, ZHU L F, XU L, GAO W H, SUN L Q, LIU L L, ZHANG X L. Proteomic and virus-induced gene silencing (VIGS) analyses reveal that gossypol, brassinosteroids, and jasmonic acid contribute to the resistance of cotton to. Molecular & Cellular Proteomics, 2013, 12(12): 3690-3703.
[7] HU Q, MIN L, YANG X Y, JIN S X, ZHANG L, LI Y Y, MA Y Z, QI X W, LI D Q, LIU H B, LINDSEY K, ZHU L F, ZHANG X L. Laccasemodulates broad spectrum biotic stress tolerance via manipulating phenylpropanoid pathway and jasmonic acid synthesis. Plant Physiology, 2018, 176(2): 1808-1823.
[8] ZHANG Y, WU L Z, WANG X F, CHEN B, ZHAO J, CUI J, LI Z K, YANG J, WU L Q, WU J H, ZHANG G Y, MA Z Y. The cotton laccase geneenhanceswilt resistance via an increase in defence induced lignification and lignin components in the cell walls of plants. Molecular Plant Pathology, 2019, 20(3): 309-322.
[9] MA Q, WANG N H, MA L, LU J H, WANG H T, WANG C C, YU S X, WEI H L. The cotton bel1-like transcription factor GhBLH7-D06 negatively regulates the defense response against. International Journal of Molecular Sciences, 2020, 21(19): 7126.
[10] XIAO S H, HU Q, SHEN J L, LIU S M, YANG Z G, CHEN K, KLOSTERMAN S J, JAVORNIK B, ZHANG X L, ZHU L F. GhMYB4 downregulates lignin biosynthesis and enhances cotton resistance to. Plant Cell Reports, 2021, 40(4): 735-751.
[11] HU Q, XIAO S H, WANG X R, AO C W, ZHANG X L, ZHU L F.enhances cotton resistance tovia an increase in defense induced lignification and S monolignol content. Plant Science, 2021, 305: 110833.
[12] SONG Y, LIU L L, WANG Y D, VALKENBURG D J, ZHANG X L, ZHU L F, THOMMA B P H J. Transfer of tomato immune receptorconfers Ave1 dependentresistance in tobacco and cotton. Plant Biotechnology Journal, 2018, 16(2): 638-648.
[13] SONG R R, LI J P, XIE C J, JIAN W, YANG X Y. An overview of the molecular genetics of plant resistance to thewilt pathogen. International Journal of Molecular Sciences, 2020, 21(3): 1120.
[14] SHABAN M, KHAN A H, NOOR E, MALIK W, ALI H M W, SHEHZAD M, AKRAM U, QAYYUM A. A 13-lipoxygenase, GhLOX2, positively regulates cotton tolerance againstthrough JA-mediated pathway. Gene, 2021, 796/797: 145797.
[15] LIU S C, SUN R B, ZHANG X J, FENG Z L, WEI F, ZHAO L H, ZHANG Y L, ZHU L F, FENG H J, ZHU H Q. Genome wide analysis of OPR family genes in cotton identified a role for GhOPR9 inresistance. Genes, 2020, 11(10): 1134.
[16] WANG G N, WANG X F, ZHANG Y, YANG J, LI Z K, WU L Z, WU J H, WU N, LIU L X, LIU Z W, ZHANG M, WU L Q, ZHANG G Y, MA Z Y. Dynamic characteristics and functional analysis provide new insights into long non-coding RNA responsive toinfection in. BMC Plant Biology, 2021, 21(1): 68.
[17] LONG L, XU F C, ZHAO J R, LI B, XU L, GAO W.overexpression increases cotton sensitivity toby regulating salicylic acid signaling. Plant Science, 2020, 292: 110374.
[18] YOSHIDA S, ITO M, NISHIDA I, WATANABE A. Identification of a novel genethat has a repressive role in the induction of leaf senescence and pathogen-defence responses in. The Plant Journal, 2002, 29(4): 427-437.
[19] VAN D J. CPR5 modulates plant immunity via RNA processing. The Plant Cell, 2022, 34(5): 1437-1438.
[20] BOWLING S A, CLARKE J D, LIU Y, KLESSIG D F, DONG X. Themutant ofexpresses both NPR1-dependent and NPR1-independent resistance. The Plant Cell, 1997, 9(9): 1573-1584.
[21] BOCH J, VERBSKY M L, ROBERTSON T L, LARKIN J C, KUNKEL B N. Analysis of resistance gene-mediated defense responses inplants carrying a mutation in CPR5. Molecular Plant-Microbe Interactions, 1998, 11(12): 1196-1206.
[22] JING H C, ANDERSON L, STURRE M J G, HILLE J, DIJKWEL P P.is a senescence-regulatory gene with pleiotropic functions as predicted by the evolutionary theory of senescence. Journal of Experimental Botany, 2007, 58(14): 3885-3894.
[23] GAO G L, ZHANG S C, WANG C F, YANG X, WANG Y Q, SU X J, DU J J, YANG C W.independently regulates seed germination and postgermination arrest of development through LOX pathway and ABA signaling. PLoS One, 2011, 6(4): e19406.
[24] MENG Z, RUBERTI C, GONG Z Z, BRANDIZZI F. CPR5 modulates salicylic acid and the unfolded protein response to manage tradeoffs between plant growth and stress responses. The Plant Journal, 2017, 89(3): 486-501.
[25] PENG S, GUO D B, GUO Y, ZHAO H Y, MEI J, HAN Y K, GUAN R, WANG T H, SONG T, SUN K K, LIU Y H, MAO T, CHANG H, XUE J S, CAI Y F, CHEN D, WANG S. Constitutive expresser of pathogenesis-related genes 5 is an RNA-binding protein controlling plant immunity via an RNA processing complex. The Plant Cell, 2022, 34(5): 1724-1744.
[26] CHEN J C, SUI X Y, MA B R, LI Y T, LI N, QIAO L F, YU Y C, DONG C H.CPR5 plays a role in regulating nucleocytoplasmic transport of mRNAs in ethylene signaling pathway. Plant Cell Reports, 2022, 41(4): 1075-1085.
[27] WANG H, UMER M J, LIU F, CAI X Y, ZHENG J, XU Y C, HOU Y Q, ZHOU Z L. Genome-wide identification and characterization ofgenes inreveals their potential role in trichome development. Frontiers in Genetics, 2022, 13: 921096.
[28] TAMURA K, STECHER G, PETERSON D, FILIPSKI A, KUMAR S. MEGA6: Molecular evolutionary genetics analysis version 6.0. Molecular Biology and Evolution, 2013, 30(12): 2725-2729.
[29] LONG L, LIU J, GAO Y, XU F C, ZHAO J R, LI B, GAO W. Flavonoid accumulation in spontaneous cotton mutant results in red coloration and enhanced disease resistance. Plant Physiology and Biochemistry, 2019, 143: 40-49.
[30] FRADIN E F, ZHANG Z, JUAREZ AYALA J C, CASTROVERDE C D M, NAZAR R N, ROBB J, LIU C M, THOMMA B P H J. Genetic dissection ofwilt resistance mediated by tomato Ve1. Plant Physiology, 2009, 150(1): 320-332.
[31] GAO W, LONG L, XU L, LINDSEY K, ZHANG X L, ZHU L F. Suppression of the homeobox geneenhances resistance toandin cotton. Journal of Integrative Plant Biology, 2016, 58(5): 503-513.
[32] KIRIK V, BOUYER D, SCH?BINGER U, BECHTOLD N, HERZOG M, BONNEVILLE J M, HüLSKAMP M. CPR5 is involved in cell proliferation and cell death control and encodes a novel transmembrane protein. Current Biology, 2001, 11(23): 1891-1895.
[33] 劉鋒, 舒曦, 鄭艷華, 黎梓君, 陽成偉, 王亞琴. 水稻CPR5基因參與氧化脅迫響應. 熱帶亞熱帶植物學報, 2013, 21(4): 305-314.
LIU F, SHU X, ZHENG Y H, LI Z J, YANG C W, WANG Y Q. Involvement of rice CPR5 in response to oxidative stress. Journal of Tropical and Subtropical Botany, 2013, 21(4): 305-314. (in Chinese)
[34] MA M M, LI M, ZHOU R F, YU J B, WU Y, ZHANG X L, WANG J L, ZHOU J M, LIANG X X. CPR5 positively regulates pattern- triggered immunity via a mediator protein. Journal of Integrative Plant Biology, 2023, 65(7): 1613-1619.
[35] WANG Y, MOSTAFA S, ZENG W, JIN B. Function and mechanism of jasmonic acid in plant responses to abiotic and biotic stresses. International Journal of Molecular Sciences, 2021, 22(16): 8568.
[36] AMEYE M, AUDENAERT K, DE ZUTTER N, STEPPE K, VAN MEULEBROEK L, VANHAECKE L, DE VLEESSCHAUWER D, HAESAERT G, SMAGGHE G. Priming of wheat with the green leaf volatile Z-3-hexenyl acetate enhances defense againstbut boosts deoxynivalenol production. Plant Physiology, 2015, 167(4): 1671-1684.
[37] LIU D, ZHAO Q, CUI X, CHEN R, LI X, QIU B, GE F. A transcriptome analysis uncoversresistance toinduced by methyl jasmonate. Genes Genomics, 2019, 41(12): 1383-1396.
[38] HE X, ZHU L F, WASSAN G M, WANG Y J, MIAO Y H, SHABAN M, HU H Y, SUN H, ZHANG X L. GhJAZ2 attenuates cotton resistance to biotic stresses via the inhibition of the transcriptional activity of GhbHLH171. Molecular Plant Pathology, 2018, 19(4): 896-908.
Cloning and functional characterization of
XU FuChun1,2, ZHAO JingRuo2, ZHANG ZhenNan2, HU GaiYuan2, LONG Lu
1Changzhi Medical College, Changzhi 046000, Shanxi;2School of life sciences, Henan University/National Key Laboratory of Cotton Bio-breeding and Integrated Utilization, Kaifeng 475000, Henan
【Objective】This study on the function and mechanism of GhCPR5 in response to() and() in cotton analysed nucleotide sequence, protein structure, expression pattern, and biological function to provide a theoretical basis and genetic resources for cotton disease resistance and breeding mechanism research. 【Method】GhCPR5was identified from the unpublished transcriptome data of cotton responses toinfection. The full-length coding sequence of GhCPR5 was amplified from upland cotton TM-1. The conserved domain, protein structure, and phylogenetic relationship of GhCPR5 and homologous genes were analysed using bioinformatics techniques. Real-time fluorescence quantitative PCR (qPCR) was used to analyse the GhCPR5 expression patterns in cotton roots, stems, leaves, ovules, fibres, and petals, and the induced expression of GhCPR5 byinfection. The silencing fragments of GhCPR5 were amplified and inserted into the VIGS vector to generate the gene silencing construct TRV:. GhCPR5-silencing plants were created via-mediated transformation methods. RT-PCR and qPCR were used to analyse the silencing efficiency of GhCPR5 in TRV:plants. TRV:and TRV:plants were inoculated withand, respectively, to analyse the difference in resistance in TRV:and TRV:plants in response topathogens. To analyse defence signal pathways involving GhCPR5, the expression levels of defence-related genes in TRV:and TRV:plants were detected by qPCR. 【Result】The GhCPR5 cloned fromTM-1 is 1 683 bp long and encodes a 560 amino acidprotein. The relative molecular weight and isoelectric point of GhCPR5 are 62.883 kDa and 9.01, respectively. Multiple-sequence alignment and phylogenetic analysis showed that GhCPR5 is highly homologous with the CPR5 ofand. Furthermore, the C-terminals of GhCPR5 and CPR5 of other species are highly conserved and contain 4-5 transmembrane domains. The GhCPR5 expression level was induced byinfection and is highest in leaves and lowest in stems. Under normal conditions, no significant developmental differences were observed between theGhCPR5-silencing plants, TRV:, and the TRV:control plants.After inoculation with, the rate of disease and the disease index of TRV:plants were significantly higher than those of the control plants. Analysis of detached leaves inoculated withandand lactophenol-trypan blue staining showed that the lesions on the leavesof TRV:plants were much bigger than those of TRV:plants, indicating that silencing GhCPR5 made cotton less resistant toand. In addition, theexpression levels in TRV:plants were significantly higher than in TRV:plants, whereas the,, andexpression levels were markedly lower in TRV:plants. 【Conclusion】GhCPR5 positively regulates cotton disease resistance; the downregulated expression of GhCPR5 significantly reduced cotton resistance toand.
cotton; disease resistance protein;;; gene expression
10.3864/j.issn.0578-1752.2023.19.004
2023-05-05;
2023-06-12
山西省基礎研究計劃(202203021222310)、長治醫(yī)學院博士科研啟動基金(BS202206)、河南省科學技術研究項目(222300420402)
許福春,E-mail:henanxufuchun@163.com。趙靜若,E-mail:707398769@qq.com。許福春和趙靜若為同等貢獻作者。通信作者龍璐,E-mail:lulong1826@163.com
(責任編輯 李莉)

