長鏈非編碼RNA SLC26A4反義RNA 1通過Notch信號抑制乳腺癌細胞增殖與轉移
姜春峰 張娜 邢鑫 張玉萍 宋蕾
乳腺癌是女性最常見的惡性腫瘤,是女性腫瘤相關死亡的最主要原因[1]。盡管乳腺癌診治方面取得了較大進展,但預后仍不理想[1-2]。全面了解乳腺癌轉移進展機制對改善病人預后具有重要意義。長鏈非編碼RNA(long noncoding RNA,lncRNA)表達失調參與多種惡性腫瘤進展和轉移[3]。有研究發現,SLC26A4反義RNA 1(SLC26A4 antisense RNA 1,SLC26A4-AS1)與乳腺癌病人預后顯著相關[4]。SLC26A4-AS1是一種具有抗腫瘤功效的新型LncRNA分子,在甲狀腺癌伴隨淋巴結轉移組織表達缺失嚴重,可以通過促進TP53減弱MAPK通路活性抑制甲狀腺乳頭狀癌細胞的增殖和侵襲[5-6]。Notch信號通路調控關鍵靶基因轉錄活性,是多種癌癥的治療靶點[7]。本研究基于Notch信號通路探究SLC26A4-AS1調控乳腺癌增殖、遷移和侵襲的潛在機制。
對象與方法
一、對象
2017年6月~2020年12月期間收治原發性乳腺癌病人40例,均經病理組織學檢查確診,術前均無腫瘤治療史,收集乳腺癌組織及對應癌旁組織(距離癌組織邊緣5 cm以上)。本研究獲得我院倫理委員會批準和病人知情同意。本試驗所用的正常乳腺上皮細胞MCF-10A以及乳腺癌細胞系T47D、MDA-MB-231、MDA-MB-468和MCF7均購自中國科學院上海生物化學與細胞生物學研究所。
二、方法
1.試驗試劑:脂質體Lipofectamine?3000購自美國Thermo公司;RPMI-1640培養基、胎牛血清等購自美國Gibco公司;pcDNA3.1空載和pcDNA3.1-SLC26A4-AS1過表達載體購自安徽通用生物系統有限公司;引物合成自蘇州金唯智生物科技有限公司合成;反轉錄試劑盒One Step PrimeScript cDNA Synthesis Kit購自大連寶生物有限公司。
2.組織、細胞培養及處理:收集乳腺癌組織及距離腫瘤5cm以上的癌旁組織,各40例。用RPMI-1640培養基復蘇細胞,按照1∶9的比例加入10%的FBS;加入1%的雙抗,放置于37 ℃,5% CO2恒溫培養箱培養。待細胞生長至密度達約50%~60%時,將2.5 μg空載和SLC26A4-AS1過表達載體pcDNA3.1-SLC26A4-AS1分別與轉染試劑混合孵育15分鐘,轉染進MCF7細胞。轉染后48小時收集細胞用于后續試驗。細胞分組為:control、pcDNA3.1組、pcDNA3.1-SLC26A4-AS1組和pcDNA3.1-SLC26A4-AS1+Notch激動劑組。
3.熒光定量PCR(qRT-PCR)實驗:細胞轉染48小時后,吸取Trizol試劑800 μl加入每孔細胞中,提取細胞總RNA,反轉錄合成cDNA并進行熒光定量qRT-PCR檢測。SLC26A4-AS1的表達使用GAPDH作為內參,定量結果采用2-ΔΔCt表示。引物序列如下:
SLC26A4-AS1-F:5'-GGCTCCTAGAACCCACTC-3',
SLC26A4-AS1-R:5'-CCTCTGGCTCGCAGGTCAT-3';
Notch1-F:5'-TGCCAGACCAACATCAAC-3',
Notch1-R:5'-CTCATAGTCCTCGGATTGC-3';
Hes1-F:5'-ATTCCTCGTCCCCGGTGGCT-3',
Hes1-R:5'-CAGCTTGGAATGCCGCGAGCT-3';
GAPDH-F:5'-AAGAAGGTGGTGAAGCAGGC-3',
GAPDH-R:5'-TCCACCACCCAGTTGCTGTA-3'。
4.細胞增殖實驗:按照1×104/孔的密度將細胞接種至96孔板,待密度達到50%左右進行轉染,每組5個重復。在轉染0、24小時、48小時、72小時收集細胞,加入濃度為5 μg/μl的MTT溶液,孵育4小時利用DMSO終止反應。酶標儀測定細胞吸光度值(OD490),分析細胞增殖能力。
5.細胞劃痕實驗:取密度為5×105/ml細胞接種至六孔板,每組重復3個。待細胞長滿后使用無菌10 μl的Tip槍頭,垂直于孔板在細胞劃痕,顯微鏡拍照;繼續培養24小時后再次拍照。根據劃痕愈合區域分析細胞遷移能力。
6.細胞侵襲實驗:用含有1%FBS的培養基重懸細胞至密度1×105/ml,取100 μl細胞接種至含有基質膠的小室上室,下室加入含有10% FBS的培養基孵育24小時。4%多聚甲醛固定30分鐘,結晶紫染液染色15分鐘,顯微鏡拍照,分析細胞侵襲能力。
三、統計學分析

結果
3.SLC26A4-AS1對Notch信號的影響:control組和pcDNA3.1組MCF7細胞中Notch1的相對表達量分別為1.000±0.231和1.121±0.207,差異無統計學意義;pcDNA3.1-SLC26A4-AS1組MCF7細胞中Notch1的相對表達量為0.475±0.146,低于pcDNA3.1組(P<0.01)。control組和pcDNA3.1組MCF7細胞中Hes1的相對表達量分別為1.000±0.231和1.121±0.207,差異無統計學意義;pcDNA3.1-SLC26A4-AS1組MCF7細胞中Hes1的相對表達量為0.531±0.142,低于pcDNA3.1組(P<0.01)。
4.SLC26A4-AS1對乳腺癌細胞增殖的影響:control組和pcDNA3.1組MCF7細胞活力比較差異無統計學意義。pcDNA3.1-SLC26A4-AS1組MCF7細胞活力低于pcDNA3.1組(P<0.01)。pcDNA3.1-SLC26A4-AS1+Notch激動劑組MCF7細胞活力高于pcDNA3.1-SLC26A4-AS1組(P<0.01)。見圖1。

圖1 SLC26A4-AS1對MCF7細胞增殖的影響
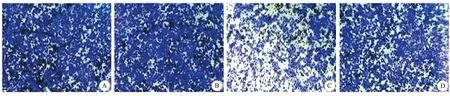
A:control組:鏡下可見大量細胞穿膜并聚集;B:pcDNA3.1組:鏡下可見大量細胞穿膜并聚集;C:pcDNA3.1-SLC26A4-AS1組:鏡下可見細胞穿膜并聚集,與pcDNA3.1組和pcDNA3.1-SLC26A4-AS1+Notch激動劑組比,穿膜細胞幾乎減半;D:cDNA3.1-SLC26A4-AS1+Notch激動劑組:鏡下可見大量細胞穿膜并聚集
討論
LncRNAs具有組織表達特異性,不同腫瘤組織中LncRNAs表達模式存在差異,大量的LncRNAs已被證明在乳腺癌進程中發揮調控作用,如H19、HOTAIR、MALAT1以及一些新鑒別的RACGAP1P、CBR3-AS1等[8-9]。SLC26A4-AS1是SLC26A4的反義非編碼轉錄本,在甲狀腺癌和膠質瘤中表達異常缺失,作為抑癌因子發揮功效[5-6,10]。SLC26A4-AS1可以同時與DDX5和E3連接酶TRIM25相互作用,通過泛素-蛋白酶體途徑促進DDX5的降解,同時抑制多個DNA雙鏈斷裂(DSBs)修復基因的表達[6]。SLC26A4-AS1還被發現在基底型乳腺癌發生DNA甲基化[11]。有學者鑒別乳腺癌特異性lncRNAs時發現SLC26A4-AS1處于競爭性內源性RNA(competing endogenous RNAs,ceRNA)網絡調控細胞分裂和周期的樞紐節點,其在乳腺癌組織中低表達有效預示病人預后不良[4]。本研究收集原發性乳腺癌病人癌組織及對應癌旁組織,qRT-PCR檢測顯示SLC26A4-AS1在乳腺癌組織表達下調;同時檢測還發現,SLC26A4-AS1在乳腺癌細胞中表達明顯低于正常乳腺上皮細胞,這與Wu等[4]測序結果吻合,暗示SLC26A4-AS1可能參與乳腺癌發展。為進一步探究SLC26A4-AS1影響乳腺癌惡性表達及潛在作用機制,在乳腺癌細胞MCF7中轉染pcDNA3.1-SLC26A4-AS1質粒上調其表達,檢測顯示,增強SLC26A4-AS1表達減弱MCF7細胞增殖能力、抑制細胞遷移和侵襲的發生。以上說明SLC26A4-AS1能夠抑制乳腺癌細胞增殖和轉移,緩解乳腺癌惡性表型。
Notch信號異常激活在腫瘤的啟動和維持中發揮著重要作用[12]。哺乳動物基因組編碼4個Notch受體(Notch1-4),其中Notch1是一種Ⅰ型跨膜異二聚體受體,被報道與腫瘤發生發展密切聯系[7,12]。Notch1通過與Notch配體(Delta、Jagged)產生相互作用啟動Notch信號傳導,通過蛋白酶切水解,激活下游基因靶標Hes1、Hes5、Hey1、Hey2等的轉錄[12-13]。lncRNAs分子通過Notch信號途徑間接或直接調控腫瘤細胞的轉移、增殖分化以及耐藥。Linc00514通過促進Jagged1介導的Notch信號通路,增加乳腺癌細胞IL-4和IL-6的分泌,誘導腫瘤相關巨噬細胞M2極化,加速乳腺癌轉移[14]。FEZF1-AS1可能作為miR-34a的內源性海綿上調Notch1表達,從而促進膠質瘤細胞轉移[15]。本研究發現,乳腺癌細胞MCF7中過表達SLC26A4-AS1明顯降低Notch1和Hes1表達,失活Notch信號。另外,在過表達SLC26A4-AS1的基礎上加入Notch激動劑處理MCF7細胞,檢測發現激活Notch信號通路明顯緩解了過表達SLC26A4-AS1對MCF7細胞增殖、遷移和侵襲的抑制作用,說明SLC26A4-AS1可以通過調控Notch信號通路抑制乳腺癌細胞增殖、遷移和侵襲。
本研究結果表明,SLC26A4-AS1在乳腺癌組織和細胞中呈低表達,SLC26A4-AS1過表達能夠抑制乳腺癌細胞的增殖、遷移和侵襲能力,其中分子機制可能與介導激活Notch信號通路有關。

