基于TLR3/TAK/NF-κB 信號通路探究壯宣飲對H1N1 流感病毒性肺炎大鼠肺損傷的保護作用
鄒 敏,翟 陽,肖持堅,梁 敏,徐怡輝,蘭小婉,梅小平
(1.廣西國際壯醫醫院兒科,廣西 南寧 530001; 2.廣西國際壯醫醫院腦病科,廣西 南寧 530001;3.廣西國際壯醫醫院內分泌代謝病科,廣西 南寧 530001)
病毒性呼吸道感染(如甲型流感病毒) 是世界范圍內常見且危及生命的疾病[1]。肺上皮細胞是甲型流感病毒復制的主要部位,肺下呼吸道感染可能會發展為致命的肺炎[2]。Toll 樣受體3 (toll-like receptors 3,TLR3) 在肺上皮細胞對甲型流感病毒的免疫反應中起關鍵作用[3]。在病毒復制過程中產生的雙鏈RNA (dsRNA) 被TLR3 感知,甲型流感病毒優先激活TLR3,TLR3 在感染致命的甲型流感病毒和隨后的炎癥過程中起關鍵作用[4]。轉化生長因子β激活激酶1 (transforming growth factor-β-activated kinase 1,TAK1) 已被證明是TLR 信號傳導介質,TLR3 通過促進TAK1 活化導致核因子-κB (nuclear factor-κB,NF-κB) 等下游反應元件激活,最終導致促炎因子釋放[5-6]。故針對TLR3/TAK1/NF-κB 信號通路開發更安全有效的抗炎抗病毒藥物具有重要意義。
中醫藥及特定方劑在病毒感染防治上具有其獨特的優勢和發展前景[7]。壯宣飲是在壯藥龍盤止咳方基礎上化裁而來,具扶正補虛、清熱宣肺、化痰止咳功效。現代藥理研究表明,壯藥龍盤止咳方對肺部炎癥損傷具有保護作用[8-9],還可能通過抑制TLR3/NF-KB 信號通路,減輕甲型流感病毒感染小鼠肺損傷[10]。而壯宣飲是否對流感病毒性肺炎具有保護作用尚未可知。因此,本研究采用甲型流感病毒的常見亞型H1N1 誘導建立流感病毒性肺炎大鼠模型,探究壯宣飲抗流感作用,并分析其潛在機制。
1 材料
1.1 動物 SPF 級雄性Sprague-Dawley (SD) 大鼠72 只,體質量300~350 g,7 ~8 周齡,購自濟南朋悅實驗動物繁育有限公司[實驗動物生產許可證號SCXK (魯) 2019-0003],飼養于廣西中醫藥大學[實驗動物使用許可證號SYXK (桂) 2019-0001],環境溫度(20±2)℃,相對濕度45% ~55%,保持12 h/12 h 光照/黑暗循環。動物實驗經廣西國際壯醫醫院動物倫理委員會審查通過 (倫理號GXZYY20210018)。
1.2 病毒 甲型流感病毒毒株A/PuertoRico/8/34 (PR8,H1N1) 由中國疾病預防控制中心提供。病毒接種在Madin-Darby 犬腎細胞(MDCK) 中進行純化,在10 日齡的雞胚中進行復制,通過噬斑測定確定病毒滴度。實驗開始前,在大鼠中預先滴定不同濃度病毒以確定合適的攻擊劑量,最終確定1×106PFU/mL 的濃度建立H1N1 肺炎大鼠模型。所有涉及病毒感染的實驗均在生物安全三級(BSL-3) 實驗室進行。
1.3 藥物 壯宣飲由龍脷葉10 g、魚腥草10 g、不出林5 g、柿葉5 g、盤龍參5 g、陳皮10 g、法半夏5 g、炙麻黃5 g、五味子5 g、白術8 g、炒麥芽8 g、甘草3 g 組成,均購自北京同仁堂南寧大藥房,經專家鑒定為正品,由廣西國際壯醫醫院制劑室制備。將上述藥材加水煎煮2 次后合并藥液,濃縮至生藥量0.7 g/mL。磷酸奧司他韋顆粒(宜昌東陽光長江藥業股份有限公司,國藥準字H20080763,15 mg,批號190614)。
1.4 試劑 蘇木精-伊紅(HE) 染色試劑盒(上海碧云天生物技術有限公司,貨號C0105S); 大鼠IL-6、TNF-α、IFN-γ ELISA 試劑盒(上海酶聯生物科技有限公司,貨號ml102828、ml002859、ml064291); 兔源一抗TLR3、TAK1、p-TAK1、NF-κB p65、p-NF-κB p65、β-actin (英國Abcam公司,貨號 ab137722、ab109526、ab109404、ab16502、ab76302、ab8227)。
1.5 儀器 iMark680 多功能酶標儀(美國Bio-Rad 公司);ABI Prism?7500型熒光定量PCR 儀(美國Applied Biosystems公司); BX53 光學顯微鏡(日本Olympus 公司)。
2 方法
2.1 分組、建模及給藥 將大鼠隨機分為對照組、模型組、奧司他韋組(13.5 mg/kg) 和壯宣飲高、中、低劑量組(14.0、7.0、3.5 g/kg),每組12 只,腹腔注射戊巴比妥鈉(40 mg/kg) 麻醉,除對照組外其余各組大鼠鼻內滴入100 μL 甲型流感病毒 (PR8) 病毒溶液 (1 × 106PFU/mL) 誘導建立感染肺炎模型[11]; 對照組滴入等量無菌生理鹽水,感染大鼠均未死亡。感染24 h 后,各給藥組灌胃給予相應劑量藥物,對照組灌胃給予等體積生理鹽水,每天2 次(早晚各1 次),持續5 d。
2.2 指標檢測
2.2.1 大鼠一般狀態 在實驗過程中觀察大鼠一般狀態變化,包括精神狀態、活動、飲食、毛色、體質量等。
2.2.2 支氣管肺泡灌洗液(BALF) 中炎性因子水平 給藥結束后,每組隨機選取6 只大鼠,在無菌條件下于頸部正中行氣管插管,分離氣管叉并結扎右側肺主支氣管,將2 mL 生理鹽水通過注射器緩慢注入左肺,重復3 次,回收BALF (約3 mL)。紗布過濾后將BALF 于4 ℃下2 000 r/min離心10 min,取上清液于-20 ℃冰箱中保存待測。通過ELISA 法檢測BALF 中TNF-α、IFN-γ、IL-6 水平。
2.2.3 肺濕/干重比 收集BALF 后處死大鼠,取左側肺組織,PBS 洗滌后濾紙干燥并稱量濕重,然后放入80 ℃烘箱中連續干燥48 h,再稱量干重,計算肺濕/干重比。
2.2.4 肺組織病理學觀察 剩余6 只大鼠處死后取肺組織,將左肺于4%多聚甲醛中固定用于組織病理學分析; 右肺置于-80 ℃保存。將固定的左肺組織用石蠟包埋,然后切5 μm 切片,經脫蠟水化后,用HE 染液進行染色,于光學顯微鏡下觀察,并評估肺損傷的嚴重程度[12]。評分標準為0 分,肺組織正常,未見明顯病理損傷; 1 分,肺組織炎性細胞浸潤低于25%,肺泡腔內無炎性分泌物; 2 分,肺組織炎性細胞浸潤范圍25% ~50%,肺泡腔內有少量炎性分泌物和炎性細胞; 3 分,肺組織炎性細胞浸潤范圍50% ~75%,肺泡腔內可見大量炎性分泌物和炎性細胞; 4分,肺受累范圍大于75%,肺泡腔內充滿炎性分泌物和炎性細胞并擴張。
2.2.5 RT-qPCR 法檢測肺組織H1N1 病毒載量 使用TRIzol 試劑提取右肺下葉組織總RNA,使用逆轉錄試劑盒將提取的RNA 逆轉錄成cDNA,使用SYBR ? Premix Ex TaqTMII 試劑盒在ABI Prism?7500 型熒光定量PCR 儀上進行RT-qPCR 反應。反應體系(20 μL) 為1 μL cDNA、10 μL 2×SYBR Green Supermix、正反向引物各1 μL、7 μL ddH2O。擴增條件為95 ℃5 min,95 ℃10 s,60 ℃30 s,72 ℃20 s,共40 個循環。以GAPDH為內參基因,2-ΔΔCT法計算病毒相對定量。H1N1 病毒M 基因正向引物序列5′-GAGAAAGAAGTCCTTGTGC-3′,反 向 引 物 序 列 5′-TCTATCATTCCAGTCCATCCC-3′;GAPDH正向引物序列5′-GACATCAAGAAGGTGGTGAAG-3′,反向引物序列 5′-GGAAATTGTGAGGGAGATGC-3′。
2.2.6 Western blot 法檢測肺組織TLR3/TAK1/NF-κB 信號通路相關蛋白表達 將右肺中、下葉組織加RIPA 緩沖液(含蛋白酶和磷酸酶抑制劑) 裂解30 min,4 ℃、12 000 r/min離心10 min,取上清液,即為總蛋白溶液。使用BCA試劑盒測量蛋白質濃度,經煮沸變性后取等量蛋白(30 μg),用10% SDS-PAGE 凝膠電泳分離,轉移到聚偏二氟乙烯(PVDF) 膜上,室溫下5% 脫脂牛奶封閉1 h,加一抗TLR3、TAK1、p-TAK1、IκBα、p-IκBα、p-NF-κB p65、NF-κB p65、β-actin (1 ∶2 000) 4 ℃孵育過夜,TBST洗膜3 次,與HRP 偶聯的二抗在室溫下孵育1 h。增強型化學發光試劑(ECL) 顯色,通過Image J 軟件量化條帶的灰度值,以β-actin 為內參計算目的蛋白表達量。
2.3 統計學分析 通過GraphPad Prism 8.0 軟件進行處理,數據以(±s) 表示,多組間比較采用單因素方差分析,組間兩兩比較采用SNK-q檢驗。以P<0.05 為差異具有統計學意義。
近年來,中國銀行云南省分行堅持科技引領,大力發展金融科技,借助大數據、人工智能等新技術、新手段,開展產品與服務模式創新,研發推廣中銀E貸、中銀慧投、移動柜臺等金融科技產品和終端,使傳統銀行服務網絡化、智能化,為客戶提供更加便捷和人性化的服務。同時,創新應用區塊鏈、人臉識別、指紋識別等生物識別技術,為客戶打造更加安全、快捷、方便的使用體驗。
3 結果
3.1 壯宣飲對流感病毒性肺炎大鼠一般狀態的影響 對照組大鼠精神狀態良好,皮毛潔白有光澤,飲食和呼吸均正常,行動和反應靈敏,體質量增加; 模型組大鼠精神萎靡,毛色枯黃無光澤,飲食減少,呼吸加快,行動遲緩,體質量降低; 奧司他韋組和壯宣飲高劑量組大鼠精神狀態較正常,皮毛有光澤,飲食增加,呼吸較平穩,體質量增加;壯宣飲中、低劑量組大鼠精神狀態一般,皮毛欠光澤,飲食尚可,呼吸有急促現象,行動和反應略遲鈍,體質量增加較少,大鼠整體狀態較模型組有所好轉,見表1。
表1 壯宣飲對流感病毒性肺炎大鼠體質量的影響(g,±s,n=12)

表1 壯宣飲對流感病毒性肺炎大鼠體質量的影響(g,±s,n=12)
注: 與對照組比較,**P<0.01; 與模型組比較,#P<0.05。
組別給藥前給藥后對照組319.65±28.29370.98±31.20模型組314.40±30.05325.46±27.35**奧司他韋組315.37±25.62359.80±30.71#壯宣飲高劑量組312.25±26.48361.25±28.04#壯宣飲中劑量組317.81±24.59342.30±26.18壯宣飲低劑量組316.60±25.02330.72±24.26
3.2 壯宣飲對流感病毒性肺炎大鼠BALF 中TNF-α、IFNγ、IL-6 水平的影響 與對照組比較,模型組大鼠BALF 中TNF-α、IFN-γ、IL-6 水平升高(P<0.01); 與模型組比較,奧司他韋組和壯宣飲各劑量組大鼠BALF 中TNF-α、IFNγ、IL-6 水平降低(P<0.01),并呈劑量依賴性,見表2。
表2 壯宣飲對流感病毒性肺炎大鼠BALF 中TNF-α、IFN-γ、IL-6 水平的影響(pg/mL,±s,n=6)
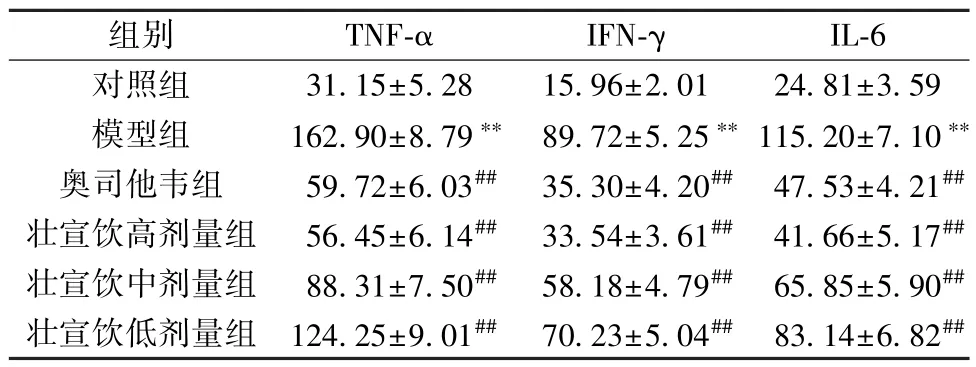
表2 壯宣飲對流感病毒性肺炎大鼠BALF 中TNF-α、IFN-γ、IL-6 水平的影響(pg/mL,±s,n=6)
注: 與對照組比較,**P<0.01; 與模型組比較,##P<0.01。
組別TNF-αIFN-γIL-6對照組31.15±5.2815.96±2.0124.81±3.59模型組162.90±8.79** 89.72±5.25** 115.20±7.10**奧司他韋組59.72±6.03## 35.30±4.20## 47.53±4.21##壯宣飲高劑量組56.45±6.14## 33.54±3.61## 41.66±5.17##壯宣飲中劑量組88.31±7.50## 58.18±4.79## 65.85±5.90##壯宣飲低劑量組 124.25±9.01## 70.23±5.04## 83.14±6.82##
3.3 壯宣飲對流感病毒性肺炎大鼠肺濕/干重比的影響 與對照組比較,模型組大鼠濕/干重比值升高(P<0.01);與模型組比較,奧司他韋組和壯宣飲各劑量組大鼠濕/干重比值降低(P<0.05,P<0.01),并呈劑量依賴性,見表3。
表3 壯宣飲對流感病毒性肺炎大鼠肺濕/干重比、組織病理學評分的影響(±s,n=6)

表3 壯宣飲對流感病毒性肺炎大鼠肺濕/干重比、組織病理學評分的影響(±s,n=6)
注: 與對照組比較,**P <0.01; 與模型組比較,#P <0.05,##P<0.01。
組別濕/干重比病理學評分/分對照組2.68±0.320.39±0.05模型組4.79±0.50**2.85±0.31**奧司他韋組3.25±0.38##1.47±0.19##壯宣飲高劑量組3.19±0.35##1.42±0.16##壯宣飲中劑量組3.64±0.42##1.89±0.20##壯宣飲低劑量組4.00±0.45#2.36±0.27##
3.4 壯宣飲對流感病毒性肺炎大鼠肺組織病理形態的影響 對照組大鼠肺泡壁正常,肺泡腔完整,無炎性細胞浸潤; 模型組可見肺泡壁增厚,肺泡腔內大量炎性細胞浸潤和滲出物,肺組織病理學評分較對照組升高(P<0.01);與模型組比較,奧司他韋組和壯宣飲各劑量組大鼠肺泡壁增厚不明顯,肺泡腔內炎性細胞浸潤和滲出物減少,肺組織病理學評分降低(P<0.01),并呈劑量依賴性,見表3、圖1。
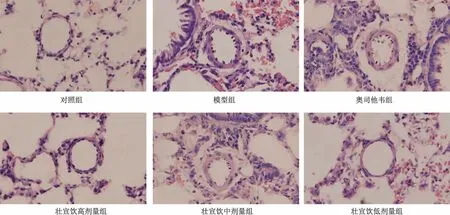
圖1 各組大鼠肺組織HE 染色(×200)
3.5 壯宣飲對流感病毒性肺炎大鼠肺組織H1N1 病毒載量的影響 與對照組比較,模型組大鼠肺組織中H1N1 病毒載量升高(P<0.01); 與模型組比較,奧司他韋組和壯宣飲各劑量組大鼠肺組織中H1N1 病毒載量降低(P<0.01),并呈劑量依賴性,見表4。
表4 壯宣飲對流感病毒性肺炎大鼠肺組織H1N1 病毒載量的影響(±s,n=6)

表4 壯宣飲對流感病毒性肺炎大鼠肺組織H1N1 病毒載量的影響(±s,n=6)
注: 與對照組比較,**P<0.01; 與模型組比較,##P<0.01。
組別H1N1 病毒拷貝數/cop對照組1.43±0.19模型組234 562.18±27 682.52**奧司他韋組68 357.41±10 857.08##壯宣飲高劑量組67 534.32±10 260.43##壯宣飲中劑量組113 580.60±16 428.75##壯宣飲低劑量組176 045.53±20 541.96##

圖2 各組大鼠肺組織TLR3/TAK1/NF-κB信號通路相關蛋白條帶
表5 壯宣飲對流感病毒性肺炎大鼠肺組織TLR3/TAK1/NF-κB 信號通路相關蛋白表達的影響(±s,n=6)
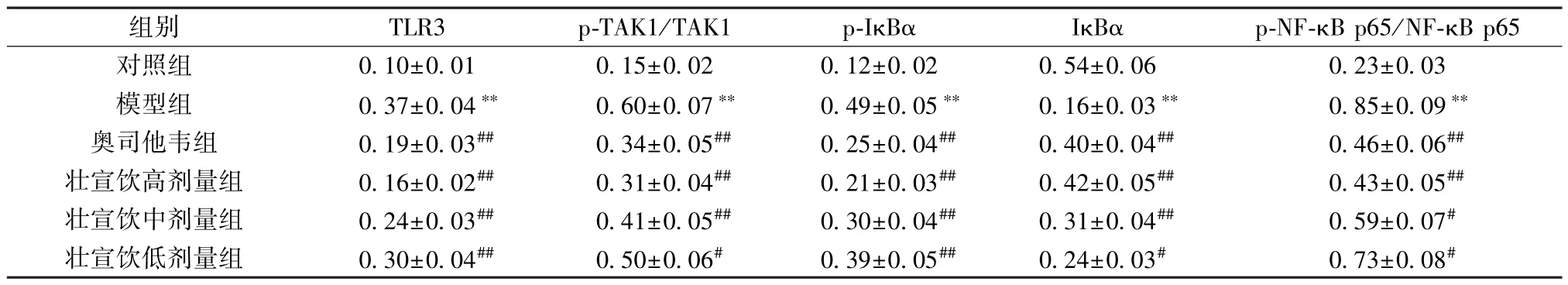
表5 壯宣飲對流感病毒性肺炎大鼠肺組織TLR3/TAK1/NF-κB 信號通路相關蛋白表達的影響(±s,n=6)
注: 與對照組比較,**P<0.01; 與模型組比較,#P<0.05,##P<0.01。
組別TLR3p-TAK1/TAK1p-IκBαIκBαp-NF-κB p65/NF-κB p65對照組0.10±0.010.15±0.020.12±0.020.54±0.060.23±0.03模型組0.37±0.04**0.60±0.07**0.49±0.05**0.16±0.03**0.85±0.09**奧司他韋組0.19±0.03##0.34±0.05##0.25±0.04##0.40±0.04##0.46±0.06##壯宣飲高劑量組0.16±0.02##0.31±0.04##0.21±0.03##0.42±0.05##0.43±0.05##壯宣飲中劑量組0.24±0.03##0.41±0.05##0.30±0.04##0.31±0.04##0.59±0.07#壯宣飲低劑量組0.30±0.04##0.50±0.06#0.39±0.05##0.24±0.03#0.73±0.08#
4 討論
流感病毒性肺炎屬中醫“疫病” 范疇,病變重心在肺,可累及脾胃。外邪侵肺,肺失宣肅,導致發熱、咳嗽等癥狀,濕熱郁阻中焦,脾胃運化失司,氣機郁滯,可見嘔吐、腹瀉[13-14]。因此,驅邪同時應兼以清熱化濕、扶正補虛。壯宣飲是在壯藥龍盤止咳方基礎上結合臨床經驗及參考多部醫書古籍研制而成。方中龍脷葉潤肺止咳; 盤龍參清熱毒、止咳化痰; 陳皮理氣健脾、燥濕化痰; 法半夏燥濕化痰、降逆止嘔,共為主藥通氣道,調谷道,使之藥直達咪缽(肺); 魚腥草清熱解毒、排膿消癰; 不出林清熱毒、除濕毒; 炙麻黃宣肺平喘; 五味子斂肺滋腎、益氣生津,與麻黃合用可宣肺祛邪、補肺益陰; 白術補氣健脾; 炒麥芽行氣消食、健脾開胃,共為幫藥。柿子葉通龍路; 甘草調和諸藥,共為帶藥。諸藥合用奏扶正補虛、清熱宣肺、化痰止咳之功。臨床研究表明,壯宣飲對呼吸系統急性感染性肺部炎癥、咳嗽、咯痰等癥狀有顯著療效,可促進肺部炎癥吸收。課題組前期研究表明,龍盤止咳方對甲型流感病毒感染肺炎小鼠有保護作用[10]。
過度炎癥浸潤、病毒誘導的組織破壞和繼發性細菌合并感染是與流感病毒感染相關的高發病率和死亡率的重要因素[15]。TNF-α、IFN-γ 和IL-6 是流感感染過程中重要促炎細胞因子,其上調可能導致患者氣道炎癥和肺組織破壞[16]。TNF-α 抑制劑依那西普可提高小鼠存活率并抑制炎性細胞因子過度產生,減少肺損傷[17]。本研究發現,H1N1感染大鼠肺組織中炎癥因子水平升高,肺濕/干重比增加,出現嚴重肺水腫,且肺泡腔內存在大量炎性細胞浸潤和滲出物,表明H1N1 感染引發大鼠肺部炎癥反應。本研究結果顯示,壯宣飲可降低H1N1 感染大鼠肺組織中促炎細胞因子水平,減輕肺水腫和肺部炎癥反應。
NF-κB 是應對損傷和感染的免疫和炎癥過程的主要調節因子[18]。TLR3 是RNA 病毒的主要先天免疫模式識別受體,通過轉錄因子NF-κB 觸發炎癥反應[19]。據報道,TLR3識別并結合dsRNA,導致TLR3 表達增強,TLR3 通過募集TRIF 和TRAF6,促進TAK1 活化,TAK1 磷酸化將與核因子κB 激酶β (IKKβ) 的抑制劑結合,導致IκBα 磷酸化降解,隨后NF-κB 核易位激活炎癥細胞因子的轉錄[20]。本研究結果顯示,H1N1 感染后大鼠肺組織中TLR3 蛋白表達、IκBα和TAK1 的磷酸化水平均升高,同時NF-κB p65 活化增加,表明H1N1 感染后TLR3/TAK1/NF-κB 信號通路的活化增強。給予壯宣飲干預后,H1N1 感染大鼠肺組織中TLR3 蛋白表達、IκBα、TAK1 和NF-κB p65 的磷酸化均降低,表明壯宣飲對H1N1 誘導的肺炎大鼠促炎細胞因子釋放的抑制作用可能是由于壯宣飲對TLR3 過表達和TAK1 磷酸化的抑制。
綜上所述,壯宣飲可降低促炎細胞因子的釋放,減輕H1N1 流感病毒性肺炎大鼠的肺損傷,可能與抑制TLR3/TAK1/NF-κB 信號通路有關。

