不同時點急性腎缺血再灌注損傷大鼠模型的構建與評價*
李 文, 李 偉, 程 豐, 王光策, 王鎖剛△
(1河南中醫藥大學,河南 鄭州 450046;2河南中醫藥大學第一附屬醫院泌尿外科,河南 鄭州 450003)
腎缺血再灌注損傷(ischemia-reperfusion injury,IRI)是引起急性腎小管壞死(acute tubular necrosis,ATN)、急性排斥反應(acute rejection, AR)和急性腎衰竭等嚴重腎臟疾病的重要原因,已成為影響移植受者/腎長期存活的主要障礙,因此,腎IRI 受到廣泛關注[1-3]。然而,目前對于急性腎IRI 動物模型的構建尚無明確統一的方法,對于更深入闡明急性腎IRI的發生機制,尤其是不同時點急性腎IRI引起腎組織病理損傷程度、細胞凋亡的情況和腎小管超細結構的改變等存在阻礙。本研究通過SD 大鼠隨機分組,構建不同缺血時間急性腎IRI模型,動態觀察大鼠腎功能相關指標、腎臟組織病理學、腎小管超微結構改變及細胞凋亡水平的變化,評價大鼠不同時間點急性腎IRI 造模效果,評估并確立合適的大鼠急性腎IRI 模型,為探究大鼠急性腎IRI 的發生機制提供實驗依據。
材 料 和 方 法
1 實驗動物
SPF 級健康雄性SD 大鼠30 只,由鄭州市華興實驗動物養殖場[許可證號:SYXK(豫)2016-0002]提供,體重(200±20) g,6~8 周齡,于標準SPF 級動物實驗室飼養,自由飲水,飼養于標準IVC 隔離式籠具中,溫度設定為20~25 ℃,相對濕度45%~70%,每天日光燈模擬照射12 h,保持良好的環境通風,提前一周進行各種適應性動物飼養。
2 實驗分組
將30 只雄性SD 大鼠采用隨機數字法[4]分為對照組(腎缺血0 min 組)和IRI 組(腎缺血5、15、30、45和60 min 組,均再灌注24 h),共6 組,每組5 只。實驗處理:(1)對照組:游離雙側腎蒂,但不夾閉;(2)IRI 組:游離雙側腎蒂,根據不同分組采用無創動脈夾夾閉大鼠雙側腎蒂5、15、30、45 和60 min 后取下,恢復血流,觀察腎臟顏色變化;逐層縫合背部傷口,各組大鼠腎臟再灌注時間均為24 h。
3 大鼠腎IRI模型的構建
根據課題組前期研究[5-6],應用2%戊巴比妥鈉(30 mg/kg 腹腔注射)麻醉;麻醉后,采取經背部入路夾閉雙側腎蒂方式建立SD 大鼠腎IRI 模型,手術過程如下:將大鼠固定在操作臺,呈俯臥位,用剃毛刀脫毛備皮,碘伏、酒精消毒后鋪巾,從背部脊柱正中位置切開皮膚,切口長約2~3 cm,于背部雙側肋弓下緣0.5 cm 位置處(雙側距脊柱中線約0.5~1.0 cm)鈍性分離至肌肉薄弱部位時分別切開一個縱行切口,從腹膜后間隙見腎周脂肪組織,用無菌棉簽小心地鈍性分離腎周脂肪,可見腎蒂及腎臟組織,檢查確認腎動靜脈位置及走形情況后,充分暴露腎蒂;對照組僅游離雙側腎蒂,但不夾閉腎蒂;IRI 組用無創動脈夾同時夾閉雙側腎蒂(雙側夾閉時間差不超過1 min),觀察腎蒂顏色變化,根據不同分組控制缺血時間(5、15、30、45 和60 min),同時取下雙側無創血管夾,恢復腎臟血流灌注,肉眼觀察腎臟顏色變化(由紫黑色逐漸變為暗紅色),提示腎臟血流再灌注良好,手術完畢,向腹腔內注射生理鹽水補充體液,然后逐層縫合切口。大鼠腎臟血流再灌注24 h 后取材,進行相關檢測,評估急性腎IRI 模型大鼠腎臟損傷情況。
4 取材
30 只大鼠腎缺血再灌注24 h,麻醉成功后,于腹部入路分離腹主動脈和腎臟[7],腹主動脈取血液標本2~3 mL,常溫靜置2 h 于高速離心機1 006.2×g離心10 min 后,移取上層血清儲存于-80 ℃冰箱,待用于檢測腎功能;將切取的大鼠雙側腎臟分別對半于2.5%戊二醛、4%多聚甲醛固定,留做病理檢測。
5 主要方法
5.1 腎功能相關指標測定 恢復血供后24 h 后腹主動脈取血,通過靜置、離心、留取血清后置于低溫冰箱-80 ℃層保存。應用全自動生化檢測儀,測定血尿素氮(blood urea nitrogen, BUN)、血肌酐(serum creatinine, SCr)和胱抑素C(cystatin C, Cys C)。
5.2 腎臟組織病理學觀察 將腎組織分批固定于4%多聚甲醛固定液中1~2 d,經過脫水(乙醇)、透明(二甲苯)、包埋(石蠟),用切片機切片(6~8 μm),然后再經過脫蠟、水化、脫汞后,進行糖原染色(PAS 染色);在光學顯微鏡(200倍)下觀察腎臟切片,并隨機選擇10 個有病變的視野按照Paller 半定量病理評估法標準對腎小管損傷進行病理評分[8-10]。
5.3 腎小管上皮超微結構觀察 將腎臟分批固定至2.5%戊二醛固定液(4 ℃)48 h,后4 ℃冰箱保存;進行脫水、包埋等程序性處理,后用超薄切片機進行切片,切片厚度約50 nm。再經染色、復染后,于透射電鏡(HT7800 HITACHI)下(9 900 倍)觀察腎小管上皮細胞超微結構(線粒體、內質網、微絨毛、細胞器及細胞核等)。每組隨機選取1 張切片,選取20 個細胞,進行記錄,計算病變指數(異常細胞數÷正常細胞數×100%)。
5.4 TUNEL 法檢測大鼠腎小管上皮細胞凋亡 選取合適的大鼠腎組織石蠟標本切片,進行脫蠟復水處理,將蛋白酶K 工作液覆蓋標本,在室溫黑暗環境下孵育20 min,用PBS 潤洗;再用甲基綠復染,染色30 s 后洗凈,再經歷脫水、透明、封片等程序性步驟;在將切片置于光學顯微鏡下觀察,采集圖像。用熒光劑標記顯色,于400 倍光學顯微鏡下觀察見凋亡細胞顯棕色。每張切片至少有代表性的20 個視野,進行記錄,計算凋亡指數。凋亡指數(%)=凋亡細胞數÷視野下總細胞數×100%。
6 統計學處理
計量資料數據均以均數±標準差(mean±SD)表示,采用SPSS 21.0 統計學軟件統計分析數據,多組實驗數據統計處理采用單因素方差分析。以P<0.05為差異有統計學意義。
結 果
1 急性腎IRI模型大鼠腎臟大體形態變化
SD大鼠經麻醉、消毒鋪巾后,經背部入路進入后腹膜分離出腎臟,腎臟呈扁豆狀,腎包膜張力尚可,色紅,鈍性分離雙側腎蒂,夾閉后肉眼下見腎臟顏色由鮮紅、暗紅、黑紫逐步變化。IRI組不同組間比較,大鼠腎臟缺血時間越長,腎臟顏色變化越顯著(從鮮紅、暗紅到暗紫),質軟,張力減小。開放血流后腎臟表面顏色逐漸恢復鮮紅,質韌,但腎缺血60 min 組再灌注后顏色改變較緩慢,甚至取材時仍為暗紅色。
2 不同時點急性腎IRI模型大鼠腎功能的變化
腎IRI 大鼠再灌注24 h 后,采血行腎功能檢測,結果顯示腎IRI 組腎功能相關指標(SCr、BUN 和Cys C)均高于對照組,IRI 組與對照組相比較,腎缺血5 min 組大鼠的SCr 和BUN 無顯著差異(P>0.05),而Cys C 有顯著差異(P<0.05);而其余四組(缺血15、30、45 和60 min 組)腎功能相關指標(SCr、BUN 和Cys C)均有顯著差異(P<0.01);且IRI組組間對比顯示腎缺血時間越長,腎功能相關指標(SCr、BUN 和Cys C)均顯著升高(P<0.05),見表1。
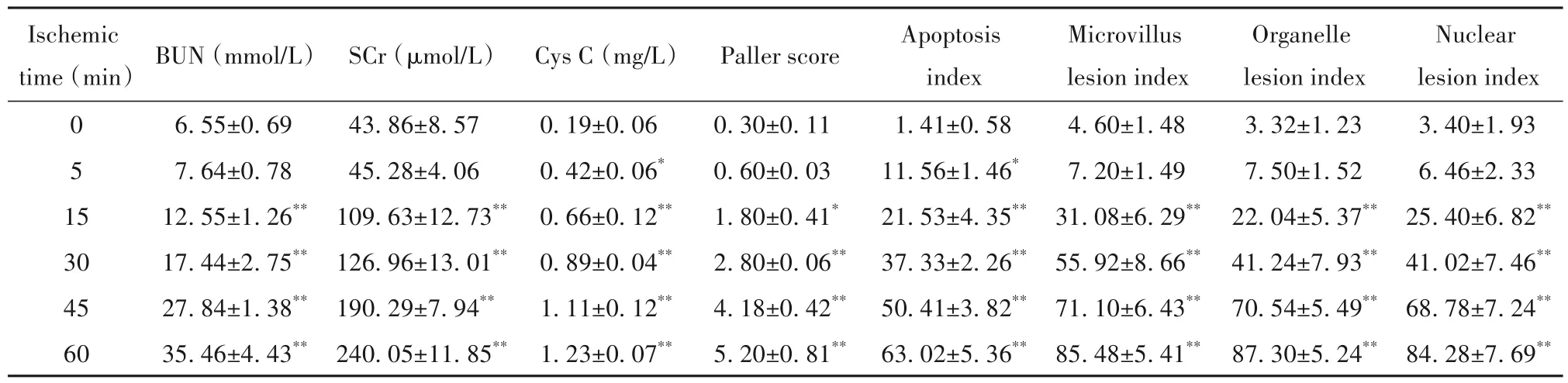
表1 不同時點各組相關指標變化Table 1.Changes of related indexes in acute renal IRI rats at different time points (Mean±SD.n=5)
3 不同時點急性腎IRI大鼠腎組織病理學變化
光學顯微鏡下觀察腎組織染色切片,除對照組外,IRI 組均有程度各異的腎小管擴張伴腔內壞死,上皮細胞水腫脫落;腎缺血≤30 min(缺血5、15 和30 min組)時,腎臟總體損傷程度較輕;腎缺血時間控制在45 min 時,相對≤30 min,腎小管上皮細胞明顯腫脹,小管擴張明顯,但壞死程度較輕;而腎缺血時間控制在60 min 時,腎臟則出現腎小管上皮細胞腫脹,胞漿淡染,可見空泡,甚至不同程度的壞死(圖1)。Paller 半定量病理評分結果顯示,與對照組相比,IRI組除了缺血5 min組無顯著差異(P>0.05),其余四組(缺血15、30、45 和60 min 組)均有顯著差異(P<0.05),見表1。
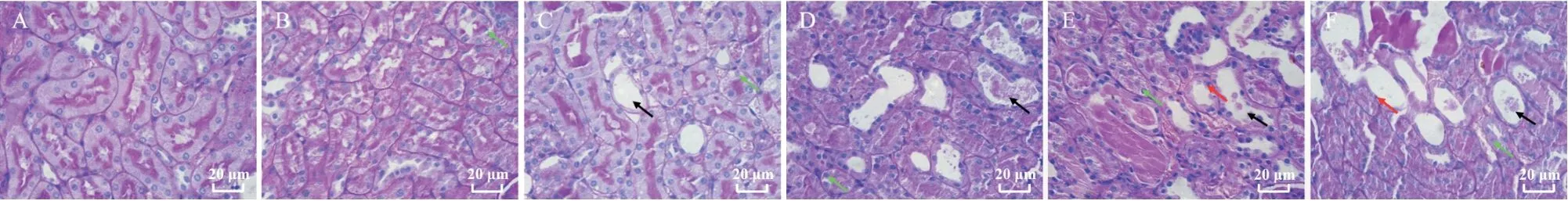
Figure 1.Renal histopathological changes in rats with renal IRI at different time points(scale bar=20 μm).A: ischemia for 0 min;B, C and D: ischemia for 5, 15 and 30 min,respectively [the overall degree of renal injury was mild (black arrows)]; E:ischemia for 45 min [renal tubule epithelial cells were markedly swollen, and tubules were dilated (green arrows) but less necrotic]; F: ischemia for 60 min [renal tubule epithelial cells swelling, cytoplasmic staining, vacuoles, necrosis, and degeneration of renal tubular epithelial cells with pyknosis or disappearance of nuclei were seen in some areas (red arrows)].圖1 不同時點腎IRI大鼠腎組織病理
4 不同時點急性腎IRI 大鼠腎小管上皮細胞超微結構的變化
在透射電鏡下觀察各組大鼠腎小管上皮細胞超微結構,對照組腎小管細胞核呈卵圓形,結構正常,膜表面微絨毛密集而規則排列,核糖體無脫落,內質網未見擴張;腎缺血≤30 min(對照組、缺血5 min 組、缺血15 min 組和缺血30 min 組)時,腎小管上皮細胞損傷相對較輕;腎缺血時間控制在45 min 時,腎小管上皮細胞損傷加重,細胞膜表面微絨毛脫落,大量線粒體腫脹及嵴變短、變少,以及大多數內質網腫脹、離斷;而腎缺血時間控制在60 min 時,腎小管上皮細胞損傷越加嚴重,腎小管上皮細胞腔面刷狀緣壞死脫落,部分細胞核發生變性、濃縮、壞死,線粒體水腫、嵴斷裂,內質網明顯腫脹、離斷(圖2)。腎小管細胞超微結構的病變指數與前述腎臟病理形態學變化一致,與對照組相比,IRI 組除了腎缺血5 min 組無顯著差異(P>0.05);其余四組(缺血15、30、45 和60 min組)均有顯著差異(P<0.01),見表1。

Figure 2.Ultrastructural changes of renal tubular epithelial cells in acute renal IRI rats at different time points (scale bar=1 μm).A:ischemia for 0 min (the nuclei of renal tubules were oval with normal structure, the microvilli on the membrane surface were dense and regularly arranged, the ribosomes were not shed, and the endoplasmic reticulum was not dilated); B, C and D: ischemia for 5, 15 and 30 min,respectively (the damage to renal tubular epithelial cells was relatively mild, and mild dilatation of the endoplasmic reticulum could be seen in some areas); E: ischemia for 45 min (the damage to renal tubule epithelial cells was aggregated, microvilli on the cell membrane surface were detached, a large number of mitochondria were swollen, cristae were shorted and reduced, and most of the endoplasmic reticulum was swollen and detached);F: ischemia for 60 min (the damage to renal tubule epithelial cells became increasingly serious, the brush border on the lumen surface of renal tubule epithelial cells was necrotic and exfoliated, some nuclei were degenerated, condensed and necrotic).The endoplasmic reticulum was dilated as shown by black arrows, and mitochondrial damage was accompanied by broken or absent mitochondrial cristae as shown by red arrow.圖2 不同時點急性腎IRI大鼠腎小管上皮細胞超微結構病變
5 不同時點腎IRI 模型大鼠腎小管上皮細胞凋亡情況
腎臟組織TUNEL 染色結果見圖3。IRI 組腎小管上皮細胞凋亡指數與對照組相比,均有顯著差異(P<0.05),并在一定的時間范圍內腎缺血時間越長,腎小管上皮凋亡水平越高,見表1。
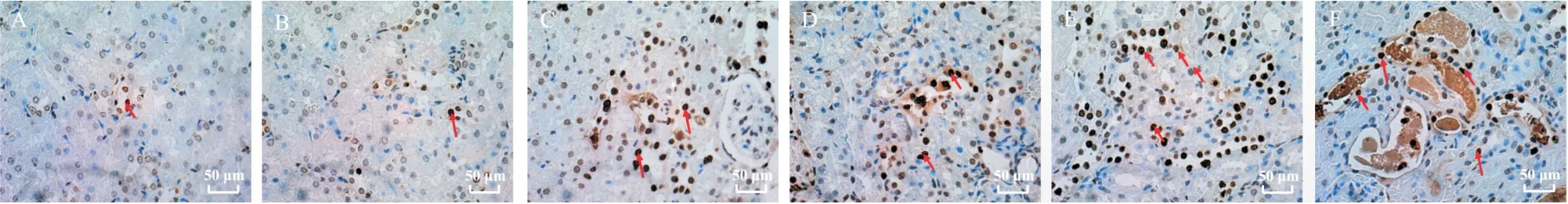
Figure 3.Apoptosis of renal tubular epithelial cells in acute renal IRI rats at different time points (TUNEL staining, scale bar=50μm).A: ischemia for 0 min; B: ischemia for 5 min; C: ischemia for 15 min; D: ischemia for 30 min; E: ischemia for 45 min; F: ischemia for 60 min.The apoptotic cells were brownish yellow (red arrows), and the TUNEL positive staining was mainly in the renal tubular epithelial cells.The level of apoptosis was relatively low in A, B, C and D, while the number of apoptotic cells increased significantly in E.The most apoptotic cells were shown in F.圖3 不同時點急性腎IRI大鼠腎小管上皮細胞凋亡
討 論
急性IRI 是腎臟外科手術和腎移植中的常見問題,通常造成急性腎功能損害,被認為是ARF與DGF的主要發病基礎。合適的腎IRI 大鼠模型構建是研究急性IRI 發生機制和防治的前提和基礎。研究不同時間點腎IRI模型大鼠的腎功能狀態、發生過程及腎損傷程度,有利于進一步評估預防機體有創性操作或術后腎損傷和保護腎功能狀態。
腎缺血后重新獲得血流灌注發生急性腎IRI,對腎臟造成二次打擊。腎IRI 完整的發生機制尚不明確,目前已經證實其機制和炎癥反應、細胞凋亡、細胞自噬、細胞內Ca2+超載、氧自由基損傷、微血管功能障礙有關,且涉及NO 含量變化、免疫損傷、信號通路等多種復雜因素,從而引起腎臟組織結構紊亂、功能代謝異常等病變[11-14]。構建合適的急性腎IRI 模型是研究急性腎IRI 發病機制和防治策略的重要保障[15]。目前急性腎IRI 大鼠模型主要通過經腹部或背部入路、單側腎動脈夾閉夾閉并切除對側腎臟、單側或雙側腎動脈和腎靜脈夾閉等方式進行構建[16-17];腎缺血時間通常控制在30~60 min,當腎缺血時間過短(少于30 min)時,腎臟能夠迅速通過代償恢復其功能,而當腎缺血時間過長(超過60 min)則會導致ATN 和ARF 的發生[18]。然而,關于不同時間點急性腎IRI 引起腎功能異常、腎組織病理損傷、腎小管上皮細胞超微結構變化和細胞凋亡等病理生理過程的研究較少。
腎急性IRI 動物模型的構建主要是通過手術利用無創微血管鉗誘發,但是其實驗結果高度依賴于缺血時間點的設定、細胞外液耗損、溫度控制和術后鎮痛藥的使用[19]。手術的入徑可以選擇動物的腹側(剖腹)或背側(腹膜后)進行,本研究參考有關文獻[20-21],對大鼠腎IRI 模型進行改良,采用經背側后腹膜入徑來構建急性腎IRI 模型,與前對比,優點明顯;首先結合大鼠匍匐爬行的生活習性,經腹部入徑造模的大鼠在蘇醒后傷口感染風險大大增加,影響大鼠體內的炎癥與氧化應激狀態;其次經背側后腹膜入徑,不用翻動腸管,大大減小了腸梗阻、腸黏連的發生率,較好的保護了胃腸道功能[5];而且腹側入徑IRI顯示,由于延遲恢復,減少了口服液體攝入量,BUN 水平將受到影響,但SCr 水平受水合狀態的影響較小[22]。雖然對造模方式進行了改良,但本研究仍存在一些不足之處:如研究采用的夾閉雙側腎蒂的方法與多數CKD 病人單側腎移植的狀態有所不同;而腎蒂中有腎動、靜脈、腎盂、淋巴管和神經等結構,直接夾閉腎蒂,腎靜脈、淋巴管和神經等造成的影響未納入考慮;以及簡單的夾閉腎蒂造成的大鼠免疫狀態的改變對實驗結果的影響沒有進行分析。
值得注意的是,對于再灌注時間的設定,在參考大量國內外研究后,在課題組進行的預實驗過程中,我們將再灌注時間設定為24 h 和72 h 進行對照,結果顯示,進行急性腎缺血再灌注模型的構建后,再灌注24 h時,大鼠腎臟損傷組間差異較為顯著;再灌注72 h 后,各組大鼠的腎功能趨于恢復正常。本研究主要觀察不同缺血時點對構建急性大鼠腎缺血再灌注模型的影響,故選取控制再灌注時間為24 h。并且后續將進一步展開研究再灌注不同時間點腎臟損傷的比較。
實驗設定了大鼠不同的腎缺血時間,評估急性腎IRI 大鼠的腎功能、病理形態學及超微結構的改變。IRI 組大鼠腎功能指標均明顯升高,腎小管上皮結構損傷更嚴重,且腎臟缺血時間越長,腎功能損害程度和腎小管上皮結構損傷程度越嚴重,而腎臟缺血時間控制在60 min 時大鼠腎功能減退腎小管上皮結構損傷最嚴重。
本研究顯示,腎缺血在30 min 范圍內,大鼠腎小管上皮細胞凋亡率相對較低;腎缺血時間超過45 min,凋亡率顯著升高;腎缺血60 min 時,凋亡率最高。上述結果提示,隨著腎臟缺血時間延長,腎IRI大鼠的腎小管上皮細胞凋亡率也逐漸上升。
綜合評估不同時間點腎IRI 大鼠模型的實驗研究,揭示了不同的腎缺血時間對大鼠腎功能、腎組織病理形態學、腎小管上皮細胞超微結構及細胞凋亡水平的影響程度不同。對于缺血時間的控制,研究表明缺血時間超過60 min 可導致急性腎小管壞死和腎功能衰竭,而缺血時間小于30 min 可導致腎小管快速增殖小管上皮細胞可能恢復小管損傷[23];實驗結果證實了腎缺血45 min 再灌注24 h 為經典的大鼠急性IRI模型。驗證了腎IRI是一個多因素參與的復雜的病理生理過程,為探究腎IRI 的多靶點、多途徑保護措施奠定了較為可靠的實驗基礎。

