臭氧水對人牙齦成纖維細胞的細胞毒性
徐超 何亞蘭 張娜娜 陳新民
牙科綜合治療臺水路系統(dental unit waterlines,DUWLs)由于內部管道系統復雜,難以拆卸,清潔和消毒效率受到限制,普遍存在嚴重的微生物污染[1]。有報道顯示:在未經處理的DUWLs水樣中每毫升細菌含量可高達數萬個[2],已分離出銅綠假單細胞菌、肺炎軍團菌、大腸埃希菌、阿米巴原蟲、真菌、分枝桿菌等具有較強致病力的病原菌。因此,如何控制 DUWLs 中的微生物,成為牙科診療中消毒和感染控制的重點。化學消毒法是目前對 DUWLs進行消毒與感染控制的主要方法。有報道采用低濃度的含氯消毒劑可以有效殺滅 DUWLs 中的浮游菌,去除生物膜[3]。由于氯氣在使用時會生成致癌物質(如三氯甲烷),因此被譽為綠色高氧化劑的臭氧目前被視為最佳的水處理選項[4]。臭氧的抗菌強度是氯化物的1.5 倍[5],能夠殺滅諸如金黃色葡萄球菌、銅綠假單胞菌、白色念珠菌、乙肝病毒等病原體[6]。然而,臭氧也是一種潛在的致癌或促癌因子[7],易對呼吸道,皮膚黏膜及角膜等組織造成損傷,使得這一臨床應用存在爭議。
臭氧易溶于水,臭氧水(ozone water,OW)的優點之一是在不損失臭氧消毒作用的前提下降低氣體毒性。李云愷等[8]報告認為OW可以替代含酒精的手部消毒劑,用于有皮膚問題的人。有研究[9]顯示OW可誘導牙髓細胞增殖,具有很好的生物相容性。已有研究將OW用于口腔綜合治療水系統中,2 mg/L的OW能在1 min內100%殺滅水循環系統中包括細菌、病毒、芽孢等所有病原微生物[10]。然而OW對口腔黏膜正常細胞的影響鮮有評價。因此,在OW應用于牙科綜合治療臺水路系統消毒之前,驗證其對人類口腔黏膜細胞的細胞毒性是很重要的。人牙齦成纖維細胞(human gingival fibroblast,HGF)是牙齦組織固有層的主要細胞,數量最多,不僅具有活躍的自身更新能力,而且可合成膠原纖維、彈性纖維及基質,在體內具有進一步增殖形成牙齦組織的潛力,是口腔黏膜中最重要的細胞之一[11]。此外,比起口腔黏膜上皮細胞,牙齦成纖維細胞更易于從組織中游離出貼壁,體外培養成活率高,老化速度慢。因此,體外建立牙齦成纖維細胞模型有利于實驗的順利開展。本研究旨在探討不同濃度OW對體外培養的HGF的細胞毒性,為臭氧水應用于DUWLs消毒提供有意義的參考。
1 資料與方法
1.1 研究對象
本研究中的HGF來源于原代培養。收集四川大學華西口腔醫院牙周科門診牙冠延長術后患者的健康牙齦,采用改良組織塊法和酶消化法相結合培養原代HGF,抗波形絲蛋白抗體和抗角蛋白抗體免疫細胞化學染色鑒定HGF特征,倒置相差顯微鏡(inverted phase contrast microscope,IPCM)(CK型,Olympus,日本)觀察和描繪生長曲線,選取具有穩定性能和增長速度好的第4代至第5代細胞[12]進行實驗。該研究得到甘肅省人民醫院醫學倫理委員會批準(批號: 2023-381)。
1.2 試驗步驟
1.2.1 OW的制備及測定方法 根據標準CJ/T3028.2-94規定,OW濃度的測定采用碘量法[13]。在環境溫度為25 ℃的實驗條件下,使用臭氧發生器(KS-J188型,成都肯格王三氧電器設備有限公司)來產生臭氧氣體,并將其通入帶塞的三角瓶中,其中盛有250 mL的滅菌蒸餾水。實驗設備運行時長為2 h。同時,在500 mL的帶塞錐形瓶中加入了20 mL的20%碘化鉀溶液。隨后吸取200 mL的樣本,將其加入另一個500 mL的錐形瓶中,其中已含有20%碘化鉀溶液,并添加了5 mL的3 mol/L硫酸溶液。然后封閉瓶口,并讓混合液均勻混合后靜置5 min。用0.005 mol/L的Na2S2O3標準溶液進行滴定,直至溶液呈現淡黃色。隨后,添加了0.5%淀粉指示劑1 mL,并繼續滴定,直至藍色完全消失。記錄Na2S2O3標準溶液的總用量,并重復了此實驗3 次。最后,根據以下公式計算出臭氧濃度:O3(mg/L)= 0.6×V(V為Na2S2O3消耗的毫升數)。
為減小實驗誤差,此實驗中所涉及的測量步驟均重復3 次,實驗結果取3 次的平均值,用蒸餾水迅速配置出實驗所需濃度的OW。
1.2.2 臭氧水干預實驗 將第四代HGF傳代至5 板24 孔培養板(Corning,美國),分為5 組(n=5),實驗前小心吸去各孔中培養基,取400 μL 4 種濃度OW分別加入對應孔中,對照組加入含10%FCS的培養基:O31組(1 mg/L)、O32組(2 mg/L)、O34組(4 mg/L)、O36 組(6 mg/L)、空白對照C組,分別作用1、5、10、20 min后進行各指標測定。
1.3 指標測定

1.3.2 MTT比色法測定細胞相對增值率的變化 將第四代HGF傳代至5板24孔培養板(Corning),分為5 組(n=5),第3日細胞貼壁牢固,實驗前小心吸去各孔中培養基,取400 μL 5 種濃度OW分別加入到各孔中,陰性對照組加入含10%FCS的培養基。分別在作用1、5、10、20 min后,去除藥物原液,每孔加入培養基200 μL, 5 mg/L的MTT溶液25 μL。放入CO2孵箱內繼續孵育4 h后從孵箱中取出,加入二甲基亞砜(DMSO,分析純,北京化工廠產品) 20 μL/孔終止培養,再次置入CO2孵箱內30 min后震蕩15 min,至所形成的結晶物完全溶解后,以無菌PBS調零, 連續波長多功能讀數系統(Varioskan Flash,Thermo Scientific,美國)測定各孔在波長490 nm或570 nm處的A值。按公式(RGR=實驗組A值/陰性對照組A值×100%)計算細胞相對增殖率(relative growth rate,RGR)。
1.4 統計學分析
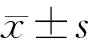
2 結 果
2.1 IPCM下HGF形態
IPCM下觀察:HGF呈放射狀或漩渦式生長,排列緊密有極性。胞體呈長梭形或星形,有2~4 個不規則細胞突起,有時互相接成網狀。胞體豐滿,胞漿均勻,透明度大,折光性強,顏色較深的2~3 個圓形或橢圓形的細胞核位于細胞中央,含少量致密顆粒,輪廓清晰光滑,細胞間界清楚(圖1)。抗波形絲蛋白染色陽性, 陽性顆粒在細胞質內分布均勻。胞漿內著棕黃色,胞核清晰無染色(圖2A)。抗角蛋白染色陰性(圖2B),胞漿內幾乎不著色,僅見蘇木精復染后的核形。

圖1 體外培養的HGFs (相差顯微鏡, ×200)Fig 1 In vitro cultured HGFs (Phase contrast microscope, ×200)
以培養時間為橫軸、吸光度值為縱軸繪制出的HGF的生長曲線(圖3),曲線呈“S”型。分為滯留期、對數生長期、平臺期3 個時期。第1天由于胰酶的損傷,細胞數略微下降,第2天開始明顯增長,第3天起細胞增殖迅速,進入對數生長期,第6天達到最高峰,隨后慢慢降低,進入平臺期,符合細胞的生長規律。其中對數生長期為接種后第3天~第6天。

圖3 HGF生長曲線 (MTT實驗, ×200)Fig 3 Growth curve of HGFs (MTT assay, ×200)
2.2 OW干預后HGF形態變化
對照組細胞(圖4A)呈放射狀或漩渦式生長,胞體呈長梭形或星形,有2~4 個不規則細胞突起,有時互相接成網狀。顏色較深的圓形或橢圓形的細胞核位于細胞中央,胞體豐滿,胞漿均勻,透明度大,折光性強,胞漿內無變性顆粒,輪廓清晰,光滑,突起粗大,偶見發亮的固縮脫落的壞死細胞;O31組、O32組在各時間點(圖4B)與C組比較無明顯差異;O34組在處理1、5 min后與C組相比,沒有明顯的細胞差異(圖4C)。然而,當處理時間延長至10 min和20 min時,觀察到細胞的顯著變化。細胞胞體變得肥大和腫脹,胞漿擴散變寬,呈現肥胖型態。細胞突起逐漸減少,細胞邊界模糊,胞漿內出現了大量顆粒狀物質,其中20 min組的情況明顯比10 min組更為嚴重,并伴隨著死細胞的增多(圖4D)。在O36組中,當細胞經過1 min的臭氧作用后,即出現胞體肥大和腫脹,突起明顯減少。在細胞密度較大的區域,細胞突起因細胞腫脹而幾乎不可見。而在經過20 min的處理后,細胞折射率明顯降低,細胞輪廓更加模糊。在高細胞密度區域,黑色顆粒密集覆蓋,幾乎沒有完整的細胞存在,出現大片細胞固縮脫落,呈現明亮的片狀漂浮于培養液中(圖4E)。這些結果強烈表明不同處理條件對細胞產生了顯著的影響。

圖4 各組細胞形態 (相差顯微鏡, ×200)Fig 4 Cell morophology of the groups (Phase contrast microscope, ×200)
2.3 MDA變化水平
1 min和5 min時點,與C組比較,O31組、O32幾乎沒有差異;O34組、O36組均升高(P<0.05),O36組較O34組高(P<0.05);在10 min時點在與C組比較,O31,O32組略有降低(P<0.05),O34,O36組均升高(P<0.01),O36組升高值較O34組的高(P<0.05);20 min時點與C組比較,O31,O32組均有降低(P<0.05),O34,O36組均升高(P<0.01),但與10 min時點相比,均略低于10 min時點的數值(P<0.05)(圖5)。

圖5 不同時點HGFs中內丙二醛含量Fig 5 MDA content of HGFs in different times
2.4 細胞毒性評價(mosmann's tetrazolium toxicity,MTT)
以C組的A均值作為100% 細胞增殖率,則各濃度組的RGR和細胞毒性按5 級毒性分級法評價[14]。
HGF經過不同濃度,不同時間的OW干預后的MTT檢測結果,RGR變化見(圖6)。與C組相比,在1、5 min時間組,O31組的臭氧干預后細胞的RGR趨于100%,毒性級別為0;O31組在10、20 min時間段以及O32組在4 個時間段的干預后的RGR均達到90%以上,毒性級別為1;O34組的臭氧除在1 min時段的RGR達到87%,毒性級別達到1,隨著時間的延長,其他3 個時間段的臭氧作用后RGR均低于65%,毒性級別均為2;而O36組的臭氧在1、5、10以及20 min時點RGR分別是74%、62%、58%和33%,毒性等級分別為2,2,2,3。

圖6 不同時點HGFs的相對增殖率Fig 6 RGR of HGFs in different times
同一時間組內不同濃度OW干預后的A值比較:1 min組:不同濃度OW干預后的A值無明顯統計學差異P>0.05,提示短時間內各濃度OW對細胞的毒性差別不大;5 min組、10 min組、20 min 3 組在不同濃度OW干預后的A值均具有明顯統計學差異P<0.05,提示5 min、10 min、20 min 3 組隨OW濃度的增加對HGF的細胞毒性增加。
不同時間段同一濃度的組間比較, O31組、O32組在OW干預后的A值在不同的時間點均無明顯統計學差異P>0.05,提示低濃度OW隨著時間的延長不會增加細胞毒性;O34組、O36組的A值在各時間點均具有明顯統計學差異P<0.05,提示高濃度OW隨著作用時間的延長細胞毒性增加。
3 討 論
臭氧是一種強氧化劑,可以氧化細胞內不飽和脂肪酸和蛋白質分子,導致細胞膜的通透性增加,細胞質外流,失去活性;細胞膜的破壞,促進了臭氧進一步擴散到細胞內,氧化細胞內酶或RNA、DNA,從而導致細胞的死亡, OW的毒性和溫度、濃度以及作用時間有關[15]。本實驗結果顯示,6 mg/L的OW短時間內就可以對細胞產生不可逆性的損傷,而2 mg/L的OW即使作用長達20 min,對HGF的損傷作用也很小。因此,在將OW應用于臨床時,注意保證作用效果的同時,盡量減小作用濃度和作用時間。臭氧因其強烈的不穩定性而不能以傳統方式儲存或運輸,而只能在需要時立即生成和使用。臭氧的穩定性受到多個因素影響,包括初始濃度越低、溫度越低以及pH值呈弱酸性時,其穩定性越高,半衰期也越長。這些條件下,臭氧分解為氧氣并釋放熱量的速度較慢。王華然等[16]的研究顯示:OW的濃度隨放置時間的延長而降低,在室溫中(25 ℃)的半衰期約為21 min。臭氧的半衰期取決于其存在的水質和溫度條件。在不同水質下,臭氧的半衰期分別為173 min(雙蒸水)、177 min(蒸餾水)、和19 min(自來水)。這表明水質越純,臭氧分解速率越慢,半衰期越長[17]。同時,溫度也對臭氧的分解速率產生影響。在不同溫度下,臭氧的半衰期分別為132 min(4 ℃)、128 min(10 ℃)、27 min(20 ℃)、和6 min(30 ℃)。溫度越高,臭氧分解越快,半衰期越短。這說明高溫條件下,臭氧更容易分解為氧氣。因此,本研究中的實驗均在室溫25 ℃的條件下進行,采用蒸餾水制取OW,減少水質、溫度變化對OW半衰期的影響。
臭氧分解產生的氧自由基能攻擊生物膜中的多不飽和脂肪酸,形成脂質過氧化物。在酸性環境下,過氧化脂質會發生分解,生成一種名為MDA的化合物。接著,MDA會與TBA結合,形成一種紅色色素。這種紅色色素具有吸收峰值,其波長為532 nm[18]。因此,在此波長下測得的吸光度值可反映出MDA的含量。MDA是脂質過氧化的終產物,具有能夠與蛋白質分子中的氨基發生相互作用的特性。這種相互作用會導致多肽鏈內或鏈間的交聯,結果是蛋白質和酶的失活。這種失活過程會引發細胞代謝異常,甚至導致細胞死亡。因此,通過測試MDA的含量,可以評估機體細胞受自由基攻擊后所遭受的損傷程度。同時,這個測試也間接反映了細胞清除氧自由基的能力[19]。因而測試MDA的含量多少可反映機體細胞受自由基攻擊后損傷的嚴重程度,同時又間接地反應了細胞清除氧自由基的能力。本研究中低濃度組(O31,O32組)在短時間OW作用下,與C組的MDA值相似,無明顯差異,提示對細胞無損傷。隨著干預時間的延長,低濃度組的MDA值逐漸低于C組,推測臭氧的存在可能導致細胞內抗氧化酶的消耗,從而引發細胞內磷酸戊糖代謝途徑和糖酵解過程的激活,增加了細胞內ATP、2、3-DPG及NADPH生成[20]。ATP不僅具備能量提供的功能,還在抵御臭氧引起的氧化應激損傷方面發揮著保護細胞的作用。同時,2、3-DPG能夠使氧解離曲線向右移動,從而增加細胞的氧供應。另外,NADPH的存在有助于維持細胞膜的完整性。這個過程對細胞的保護起到明顯作用。而在20min時間點,盡管O34、O36組的MDA值比C組高,但比10min時間點有略有降低,推測也是OW激活了部分損傷較小的細胞中的抗氧化功能,使損傷逆轉的結果。
MTT法是評價細胞毒性最常用的方法之一[17],它根據細胞的線粒體活性來測定細胞毒性,使用方便,重現性高。本研究利用MTT法評估HGF對不同劑量OW的生物反應。結果顯示:低于2 mg/L 的OW在各個時間點之間的結果均較穩定,隨著時間的推移,對細胞活力的影響沒有明顯的變化,這與Kü?ük等[9]的研究結果一致,觀察4 mg/L的OW對人牙髓細胞具有良好生物相容性,有促進牙髓細胞增殖的效果。結果顯示4 mg/L的OW干預組在4 個時間段內均表現出較高的細胞毒性,且隨著與OW作用時間的延長以及接觸濃度的增大,細胞毒性呈增大趨勢。OW的毒性具有溫度、時間和劑量依賴性[21],分析原因可能與實驗細胞對臭氧的敏感性差異,OW制備困難,且OW在制備后,其濃度會逐漸衰減,半衰期20~30 min,實驗條件不同,故不同文獻對OW的毒性研究的結果相差較大。
有一組細胞在不同濃度臭氧干預不同時間后,換含10%胎牛血清的細胞培養基繼續培養72 h,結果O31、O32、O34組的HGF生長良好,測得A值均趨近于C組,表明4 mg/L濃度范圍內的OW對HGF毒性作用可逆,而6.0 mg/L濃度OW作用過的細胞A值明顯低于陰性C組,可能是由于高濃度OW使大量細胞的死亡導致細胞數量的大量減少以及細胞的不可逆性損傷影響了細胞的增殖。
由于OW具有細胞相容性和生物殺滅作用,被認為是控制微生物的一種可行的替代品,將OW用于口腔臨床中很有潛力。但應注意保證作用效果的同時,有效控制OW的濃度和作用時間,并對接觸區域有效保護,將OW的濃度控制在2 mg/L以內是安全有效地。未來的研究還應關注細胞恢復能力的評價,可以規劃更長的實驗周期,選擇不同的細胞毒性評價方法,為進一步臨床應用提供證據。

