肝門部膽管癌門靜脈栓塞后剩余肝臟體積增生速度預測因素分析
黃 劍,張小鋒,閆少磊,徐振遠,王向東,何成健,周 靜,徐 偉,葛乃建,楊業發
肝門部膽管癌惡性程度很高、預后較差,僅20%~35%患者就診時符合手術指征[1],外科手術切除范圍大,術后并發癥多[2-3]。并發癥中最嚴重的是剩余肝臟體積(future liver remnant,FLR)保留不足導致的急性肝衰竭,發生率為22%~33%,病死率高達52%~68%,因此術前增加FLR 是防止術后肝衰竭最有效策略[3-6]。目前臨床上廣泛采用的增加FLR 方式為門靜脈栓塞(portal vein embolization,PVE),但術后仍有約32%患者無法完成根治性手術,主要原因為等待FLR 增生時腫瘤進展,其次為FLR 增生緩慢或不增生[7-8]。
本中心既往研究發現,PVE 后約3 周部分患者肝臟體積復測時FLR 增生不理想,不得不花更長時間等待增生。目前鮮見研究報道肝門部膽管癌PVE 后患者FLR 增生與時間的關系。本研究分析肝門部膽管癌PVE 后FLR 增生的影響因素及FLR 增生與時間的關系,以指導預測PVE 后大致外科手術時間。
1 材料與方法
1.1 一般資料
收集2017 年1 月至2022 年1 月在海軍軍醫大學附屬東方肝膽外科醫院完成PVE 治療的107例肝門部膽管癌患者臨床資料。排除臨床資料收集不全、失訪及未按要求接受2 次三維體積測定的44 例患者,最終63 例納入本次研究。
1.2 患者納入與排除標準
納入標準:①術前病理或臨床診斷為肝門部膽管惡性腫瘤;②有膽管癌根治術手術指征并簽署知情同意書;③FLR 經三維成像測定<45%;④肝功能Child-Pugh 分級為A 級,或梗阻性黃疸經皮經肝膽管引流術(PTCD)后膽紅素下降至85.5 μmol/L 以下。排除標準:①三維成像測定FLR≥45%;②腫瘤肝內轉移無法切除或肝外轉移;③Child-Pugh 分級為B/C 級;④預保留肝葉內門靜脈閉塞、血栓或癌栓無法穿刺;⑤伴有其他疾病不適合行PVE 或外科手術治療。
1.3 手術操作
患者PVE 前1 周內及PVE 后2 周后接受三維體積測量,主要計算左右半肝體積、腫瘤體積、全肝體積(total liver volume,TLV)、FLR,并計算FLR/TLV 比值[9]。PVE 手術:彩色超聲導引下21 G EV 針由對側路徑穿刺門靜脈左/右支并置管造影,黑泥鰍導絲聯合導管超選門靜脈一級分支,再微導管超選進入二級分支;以α-氰基丙烯酸正丁酯(NBCA)組織膠或聚乙烯醇(PVA)微球聯合彈簧圈栓塞門靜脈各分支,可于距門靜脈主干開口1 cm 遠側使用可解脫帶纖維毛彈簧圈(美國Boston 科技公司)栓塞,防止栓塞劑移位致異位栓塞[10]。待第2 次三維體積明確FLR 符合要求后,再行外科肝門部膽管癌根治切除術。
1.4 觀察指標
主要觀察指標:FLR 增生速度影響因素、FLR 增生速度[(PVE 后FLR/TLV-PVE 前FLR/TLV)/PVE后至復查肝臟增強CT 時間]及簡單預測增生速度模型公式。次要觀察指標:PVE 及外科手術并發癥、肝門部膽管癌手術率。
1.5 統計學分析
采用SPSS 23.0 軟件進行統計學分析。正態分布計量資料以均數±標準差表示,PVE 前后資料對比用配對t 檢驗;分類計算資料以例數或百分比表示,用χ2檢驗。多重線性回歸分析FLR 增生速度的影響因素。P<0.05 為差異有統計學意義。
2 結果
63 例患者中43 例因梗阻性黃疸PVE 前接受PTCD 減黃治療,8 例術前出現膽道感染。PVE 前后總膽紅素(total bilirubin,TBil)、白蛋白(ALB)、丙氨酸轉氨酶(ALT)、天冬氨酸轉氨酶(AST)、堿性磷酸酶(ALP)、國際標準化比值(INR)、血小板計數(PLT)比較,差異無統計學意義(均P>0.05),見表1。
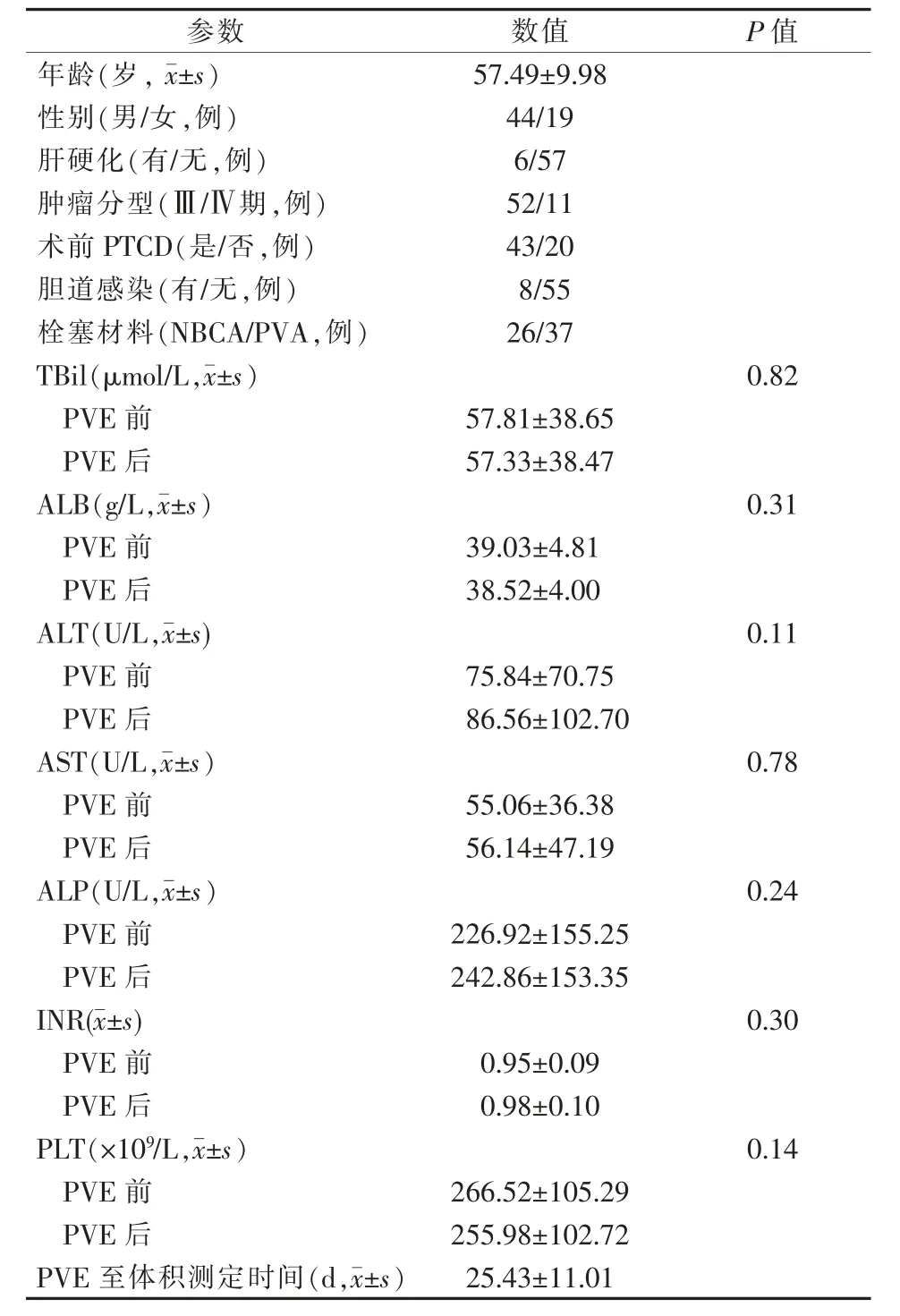
表1 患者一般臨床資料
PVE 前后體積變化見表2。PVE 后(25.43±11.01)d患者FLR、FLR/TLV 與PVE 前相比顯著增加(均P<0.05),每日FLR 增生速度為(0.47±0.29)%,PVA 組、NBCA 組分別為(0.40±0.27)%、(0.56±0.30)%(t=2.213,P=0.03)。多重線性回歸分析顯示,膽道感染(t=-2.07,P=0.04)、ALP 升高(t=-2.99,P=0.004)是FLR 增生速度的影響因素(見表3),且膽道感染及ALP 升高會減緩FLR 增生速度。獲得每日FLR/TVL 增生的簡單預測公式為:Y=0.61-0.001X1-0.22X2(Y 為FLR/TVL每日增生速度,X1為ALP,X2為膽道感染)。
表2 PVE 前后體積變化(±s)

表2 PVE 前后體積變化(±s)
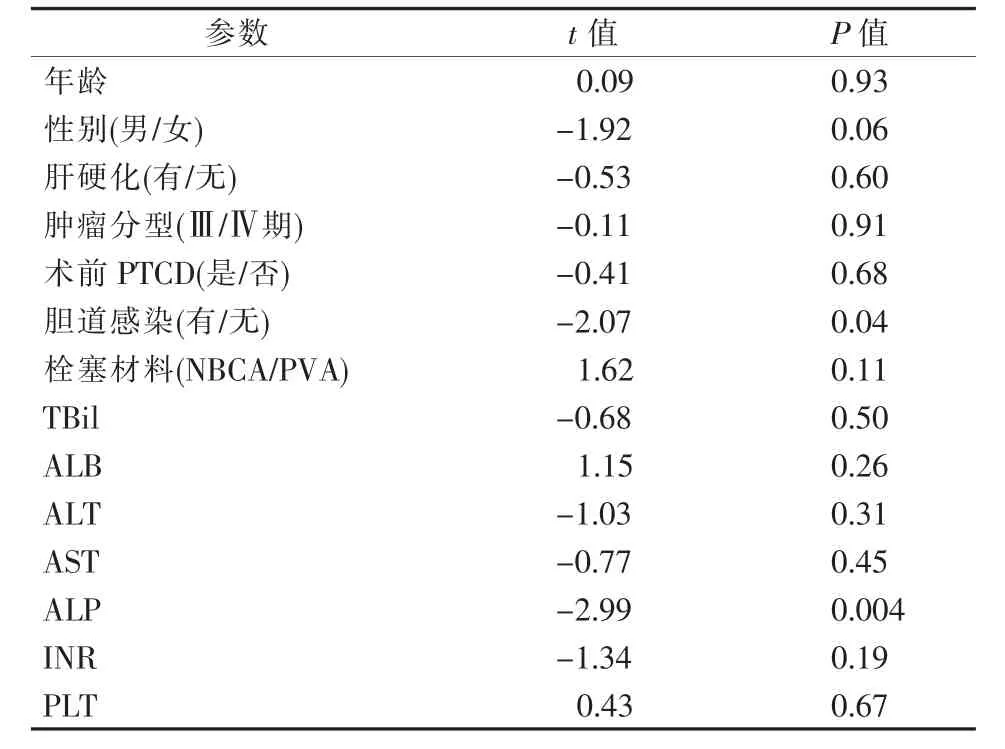
表3 多重線性回歸分析FLR 增生速度的影響因素
手術相關并發癥見表4。1 例栓塞部位膽汁瘤,1 例NBCA 膠脫落移位致門靜脈左支遠端誤栓,均未影響后續手術;1 例(1.59%)出現門靜脈主干血栓,致左肝體積較PVE 前縮小,失去手術指征。
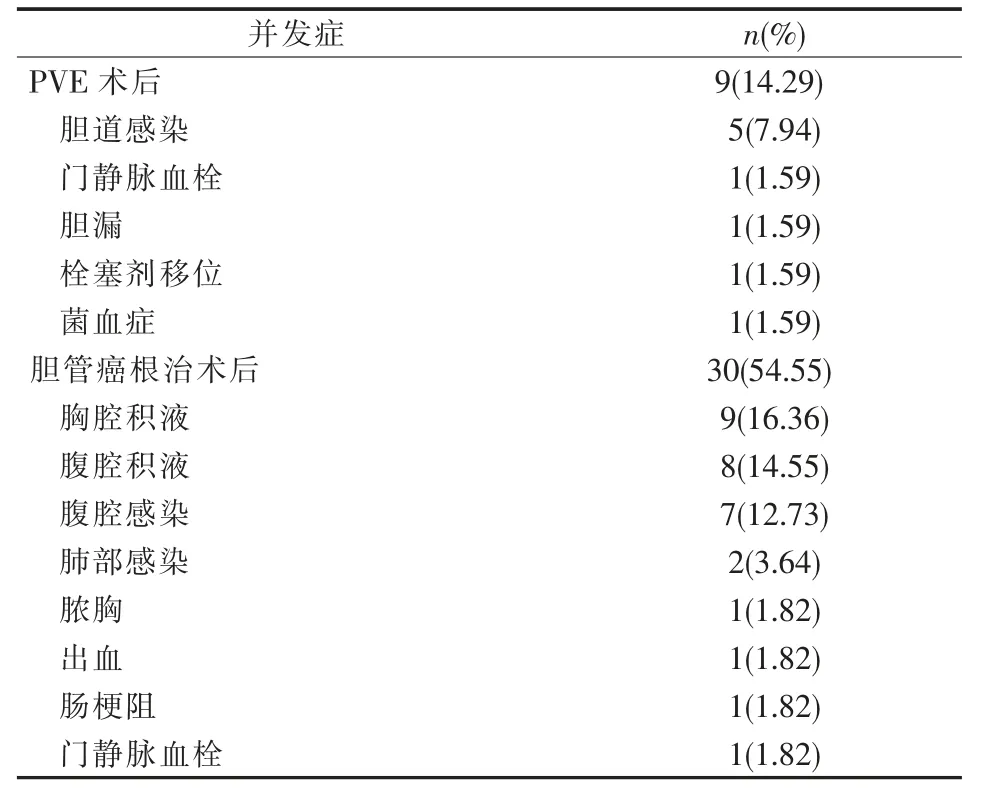
表4 手術相關3~4 級并發癥
PVE 后肝門部膽管癌根治術及預后顯示,63 例PVE 患者中55 例(87.30%)最后成功完成肝門部膽管癌根治術,8 例未接受肝門部膽管癌根治術患者中腫瘤進展及轉移5 例,FLR 增生不足2 例,PVE后門靜脈血栓致FLR 減少1 例。30、90 d 內各死亡2 例。
3 討論
肝門部膽管癌術后肝衰竭發生率及病死率均較高,主要原因為術后FLR 不足[3,6],FLR<45%患者術后因肝衰竭死亡高達29%,90 d 內病死率達31%[8]。PVE 是臨床上促進FLR 增生的標準治療方法,可有效拓寬肝門部膽管癌手術適應證,降低手術相關并發癥發生率及術后死亡率,但部分患者即使接受PVE,也仍無法完成二期手術切除腫瘤[2-3,6]。有Meta 分析發現,PVE 后仍無法二期手術切除肝惡性腫瘤患者占24.1%~36.0%,主要原因為腫瘤進展及肝臟增生不足[8]。本研究中PVE 至二期手術時間為(25.43±11.01)d,8 例(12.7%)未完成膽管癌根治術患者中5 例因等待FLR 增生時腫瘤進展,2 例為FLR 增生不足,1 例為PVE 術后門靜脈血栓致FLR 較術前反而減少。多項研究認為,PVE 至二期外科手術時間為16~49 d[3,11]。這很難讓臨床醫師把握,等待FLR 增生時間太長會因腫瘤進展失去手術機會,太短FLR 增生又不足。
提高FLR 增生速度有利于縮短二期手術時間,增加患者手術機會。PVE 多主張門靜脈近側聯合遠側全程栓塞,近側避免門靜脈再通,遠側減少動脈門靜脈分流[11-12]。國內外研究認為,NBCA 組織膠對FLR 增生的效果可能比PVA、明膠海綿等更好[13-14]。本中心2019 年前采用PVA 顆粒聯合彈簧圈行肝門部膽管癌術前PVE 治療,之后開始以NBCA 膠栓塞門靜脈,發現其促進FLR 增生的效果較好于PVA聯合彈簧圈[10]。本研究中多重線性回歸分析結果雖未說明栓塞材料優劣,但進一步獨立樣本t 檢驗對比了兩種材料對FLR 增生速度的影響,結果NBCA還是優于PVA(t=2.213,P=0.03),與既往國內外研究報道結果類似。
多種調控因子和相關因素均可影響肝細胞增生,主要生長因子包含肝細胞生長因子、內皮細胞生長因子及轉化生長因子-α,相關影響因素包含糖尿病、營養不良、年齡、感染、慢性肝臟炎癥及膽道梗阻等[15-17]。為了明確各因素對FLR 增生速度的影響及簡單預測增生速度的模型,本研究對患者各因素行多重線性回歸分析,結果顯示膽道感染及ALP是影響FLR 增生速度的因素。肝門部膽管癌常伴發梗阻性黃疸及膽道感染。膽道感染后肝實質內出現嚴重炎癥反應,各種炎癥因子損傷破壞肝細胞可導致肝細胞增生不良[15]。膽道梗阻檢驗上表現為TBil和ALP 升高,ALP 值代表肝臟膽汁淤積程度,膽汁淤積嚴重時肝細胞增生也較慢[16]。本研究顯示TBil并非影響FLR 增生速度的因素,可能與43 例患者術前接受PTCD 減黃治療有關,PVE 前TBil 并不能真實反應肝臟膽汁淤積程度;肝硬化也不是FLR 增生速度的影響因素,僅有6 例患者有肝硬化且并不嚴重,肝門部膽管癌與肝細胞癌病因不同,與乙型肝炎、肝硬化關系并不大,故小樣本病例不一定能反應真實情況。本研究最終得到每日FLR/TVL 增生的簡單預測公式為:Y=0.61-0.001X1-0.22X2,可簡單預測PVE后復測FLR 時間,避免盲目選擇手術時間。
本研究存在一定局限性:①患者第2 次測量肝臟FLR 時間因無確切的體積增生模型,均依據國內外研究估算2~6 周,故不排除部分患者可能會因等待時間太長錯過手術機會;②有44 例患者未納入研究,今后將嚴格加強患者診治規范與隨訪;③樣本量相對較小,不排除可信度下降,需進一步擴大樣本量,以改良FLR/TVL 增生估算公式。
綜上所述,PVE 可有效促進肝門部膽管癌患者FLR 增生,膽道感染及ALP 升高會減緩FLR 增生速度,FLR/TVL 增生速度簡易預測公式有助于指導選擇二期手術時間。尚需通過擴大樣本量,進一步提高PVE 后FLR 增生速度模型的準確性和實用性。

