烏頭堿調控miR-181d-5p/DDX3軸對宮頸癌HeLa細胞增殖、凋亡的影響
趙丹丹 張素娥 苗立業 王巖
摘要:目的 探討烏頭堿通過調控微小RNA-181d-5p(miR-181d-5p)/DEAD-box RNA解旋酶3(DDX3)軸對宮頸癌HeLa細胞增殖、凋亡的影響。方法 使用不同劑量烏頭堿處理宮頸癌HeLa細胞,四甲基偶氮唑鹽法檢測細胞增殖確定給藥劑量。將HeLa細胞分為對照組(正常培養,不進行處理),烏頭堿低劑量組(4 mg/L)、中劑量組(8 mg/L)、高劑量組(16 mg/L),順鉑組(5 mg/L),烏頭堿高劑量+miR-NC組[16 mg/L烏頭堿+轉染miR-181d-5p siRNA陰性對照(miR-NC)質粒]及烏頭堿高劑量+miR-181d-5p低表達組[16 mg/L烏頭堿+轉染miR-181d-5p小干擾RNA(siRNA)質粒]。平板克隆形成實驗及流式細胞儀分別檢測各組HeLa細胞克隆形成數與凋亡情況;實時熒光定量PCR檢測HeLa細胞中miR-181d-5p和DDX3 mRNA表達水平;蛋白免疫印跡法檢測HeLa細胞中DDX3、細胞周期蛋白D1(Cyclin D1)、增殖細胞核抗原(PCNA)、B淋巴細胞瘤-2(Bcl-2)、Bcl-2相關X蛋白(Bax)、胱天蛋白酶-3(Caspase-3)蛋白表達水平;雙螢光素酶報告基因實驗驗證miR-181d-5p與DDX3的靶向關系。結果 以0.5~64 mg/L的烏頭堿分別處理HeLa細胞24 h、48 h、72 h后,對HeLa細胞均有不同程度的抑制作用,選擇劑量為4 mg/L、8 mg/L、16 mg/L的烏頭堿用于后續實驗。與對照組比較,烏頭堿低、中、高劑量組及順鉑組HeLa細胞克隆形成數、DDX3 mRNA和蛋白、Cyclin D1、PCNA、Bcl-2蛋白表達水平依次降低(P<0.05),凋亡率、miR-181d-5p、Bax、Caspase-3蛋白表達水平依次升高(P<0.05);與烏頭堿高劑量組和烏頭堿高劑量+miR-NC組比較,烏頭堿高劑量+miR-181d-5p低表達組HeLa細胞克隆形成數、DDX3 mRNA和蛋白、Cyclin D1、PCNA、Bcl-2蛋白表達水平升高(P<0.05),凋亡率、miR-181d-5p、Bax、Caspase-3蛋白表達水平降低(P<0.05);雙螢光素酶報告基因檢測證實miR-181d-5p與DDX3存在靶向關系。結論 烏頭堿可調控miR-181d-5p/DDX3軸,促進miR-181d-5p表達,抑制DDX3表達,進而抑制宮頸癌HeLa細胞增殖,促進細胞凋亡。
關鍵詞:烏頭堿;微小RNA-181d-5p;DEAD-box RNA解旋酶3;宮頸癌HeLa細胞
中圖分類號:R737.33文獻標志碼:ADOI:10.11958/20221825
Effects of aconitine regulating miR-181d-5p/DDX3 axis on proliferation and apoptosis of
HeLa cells of cervical cancer
ZHAO Dandan ZHANG Sue MIAO Liye WANG Yan
1 Department of Obstetrics, 2 Department of Gynecology, the Fourth Hospital of Shijiazhuang, Shijiazhuang 050032, China
Abstract: Objective To investigate effects of aconitine on proliferation and apoptosis of cervical cancer HeLa cells by regulating the microRNA-181d-5p (miR-181d-5p)/DEAD-box RNA helicase 3 (DDX3) axis. Methods Cervical cancer HeLa cells were treated with different doses of aconitine, and cell proliferation was detected by tetramethylazolium salt method to determine the dose. HeLa cells were divided into the control group (normal culture, no treatment), the aconitine low dose group (4 mg/L), the aconitine medium dose group (8 mg/L), the aconitine high dose group (16 mg/L), the cisplatin group (5 mg/L), the aconitine high dose + miR-NC group [16 mg/L aconitine + transfected with miR-181d-5p siRNA negative control (miR-NC) plasmid] and the aconitine high dose + miR-181d-5p low expression group [16 mg/L aconitine + transfected miR-181d-5p small interfering RNA (siRNA) plasmid]. Plate clone formation experiment and flow cytometry were used to detect the clonal formation number and apoptosis of HeLa cells in each group. Expression levels of miR-181d-5p and DDX3 messenger RNA (mRNA) in HeLa cells were detected by real-time fluorescent quantitative PCR. Western blot assay was used to detect expression levels of DDX3, Cyclin D1, proliferating cell nuclear antigen (PCNA), B cell lymphocytoma-2 (Bcl-2), Bcl-2 related X protein (Bax) and Caspase-3 protein in HeLa cells. Dual luciferase reporter gene experiment was used to verify the targeting relationship between miR-181d-5p and DDX3. Results HeLa cells were treated with 0.5-64 mg/L aconitine for 24 h, 48 h and 72 h, respectively, and HeLa cells were inhibited to varying degrees. Aconitine doses of 4 mg/L, 8 mg/L and 16 mg/L were selected for follow-up experiments. Compared with the control group, HeLa cell clonal formation number, DDX3 mRNA and protein, Cyclin D1, PCNA and Bcl-2 protein expression levels were decreased successively in the aconitine low, medium and high dose groups and the cisplatin groups (P<0.05), and the apoptosis rate, expression levels of miR-181d-5p, Bax and Caspase-3 protein were increased successively (P<0.05). Compared with the aconitine high dose group and the aconitine high dose + miR-NC group, HeLa cell clonal formation number, DDX3 mRNA and protein, Cyclin D1, PCNA and Bcl-2 protein expression levels were increased in the aconitine high dose + miR-181d-5p low expression group (P<0.05), and the apoptosis rate, expression levels of miR-181d-5p, Bax and Caspase-3 protein were decreased (P<0.05). Dual luciferase reporter gene detection confirmed the targeting relationship between miR-181d-5p and DDX3. Conclusion Aconitine can regulate the miR-181d-5p/DDX3 axis, promote the expression of miR-181d-5p, inhibit the expression of DDX3, and then inhibit the proliferation of cervical cancer HeLa cells and promote cell apoptosis.
Key words: aconitine; microRNA-181d-5p; DEAD-box RNA helicase 3; cervical cancer HeLa cells
宮頸癌是女性生殖系統常見的惡性腫瘤,其發病率呈年輕化趨勢,早期宮頸癌以手術治療為主,晚期及復發性宮頸癌以放化療為主,耐藥導致晚期患者預后較差[1]。尋找療效高、毒副作用小的藥物對于宮頸癌的治療具有重要意義[2]。烏頭堿是烏頭、附子等中草藥的有效成分,具有鎮靜、抗炎、鎮痛作用[3]。研究表明烏頭堿亦具有抗腫瘤作用,可抑制肝癌細胞的增殖、遷移和侵襲[4-5],但其對宮頸癌的作用尚不清楚。微小RNA-181d-5p(miR-181d-5p)為microRNA一種,在腎細胞癌、非小細胞肺癌中表達下調,上調miR-181d-5p表達可抑制腫瘤細胞增殖,促進細胞凋亡[6-7]。StarBase數據庫預測顯示,miR-181d-5p可靶向調控DEAD-box RNA解旋酶3(DEAD-box RNA helicase 3,DDX3)表達。DDX3是具有ATP酶依賴性的DEAD盒RNA解旋酶,在基因轉錄、剪接與翻譯過程中發揮調控作用。研究顯示,DDX3在宮頸癌中表達上調,其過表達可促進宮頸癌細胞的增殖、遷移和侵襲[8]。miR-181d-5p是否靶向調控DDX3影響宮頸癌細胞增殖與凋亡尚未可知。本研究通過體外培養宮頸癌HeLa細胞,探索烏頭堿對HeLa細胞增殖、凋亡及對miR-181d-5p/DDX3軸的影響,探索烏頭堿在宮頸癌中的作用機制。
1 材料與方法
1.1 主要試劑與儀器 人宮頸癌HeLa細胞購自合肥合生生物工程有限公司。烏頭堿(原料藥,純度≥98%)、順鉑(原料藥,純度≥99.5%)、DMEM/F12培養基、Lipofectamine 3000試劑盒、TRIzol試劑、ECL顯色液均購自成都曼斯特生物科技有限公司;miR-181d-5p小干擾RNA(siRNA)質粒、miR-181d-5p siRNA陰性對照(miR-NC)質粒、DDX3野生型(DDX3-WT)質粒、DDX3突變型(DDX3-MUT)質粒、miR-181d-5p模擬物(mimics)質粒、miR-181d-5p mimics陰性對照質粒、miR-181d-5p、U6引物均由廣州銳博生物有限公司合成;四甲基偶氮唑鹽(MTT)、螢光素酶檢測試劑盒、逆轉錄試劑盒均購自美國Sigma-Aldrich公司;PCR試劑盒(SYBR qPCR mix)、AnnexinV-FITC/PI凋亡檢測試劑盒、蛋白提取試劑盒、羊抗鼠二抗均購自北京啟維益成科技有限公司;鼠源DDX3、細胞周期蛋白D1(Cyclin D1)、增殖細胞核抗原(PCNA)、B淋巴細胞瘤-2(Bcl-2)、Bcl-2相關X蛋白(Bax)、胱天蛋白酶-3(Caspase-3)、β-肌動蛋白(β-actin)單克隆抗體均購自英國Abcam公司。酶標儀(型號SYNERGY H1)、顯微鏡(型號MVX10)、實時熒光定量PCR(qPCR)儀(型號SLAN-96P)均購自西安淳風生物科技有限公司;流式細胞儀(型號Fortessa X-20)、凝膠成像系統(型號E5001-SDB)均購自廊坊縱世科技有限公司。
1.2 方法
1.2.1 MTT法檢測不同劑量烏頭堿對HeLa細胞增殖的影響 宮頸癌HeLa細胞接種于DMEM/F12培養基中(含有10%胎牛血清及1%鏈霉素與青霉素)培養。取對數生長期細胞,按照5×104個/孔接種于96孔板中,分別使用劑量為0.5、1、2、4、8、16、32、64 mg/L的烏頭堿(用DMEM/F12培養液稀釋)處理HeLa細胞,分別培養24、48和72 h后,每孔加入10 μL的MTT溶液,孵育4 h再加入150 μL二甲基亞砜溶液終止反應,在酶標儀490 nm波長處檢測吸光度(A)值,另設只添加MTT溶液、二甲基亞砜的HeLa細胞作為空白組。細胞增殖抑制率(%)=(1-各劑量烏頭堿組A值/空白組A值)×100%。
1.2.2 HeLa細胞培養及分組 取對數生長期的HeLa細胞,按照1.2×106個/孔接種于6孔板中,使用DMEM/F12培養基進行培養,分為對照組(正常培養,不進行處理)、烏頭堿低劑量組、烏頭堿中劑量組、烏頭堿高劑量組、順鉑組、烏頭堿高劑量+miR-NC組、烏頭堿高劑量+miR-181d-5p低表達組。烏頭堿低、中、高劑量組和順鉑組分別向含有HeLa細胞的DMEM/F12培養基中加入劑量為4、8、16 mg/L烏頭堿和5 mg/L順鉑[9];烏頭堿高劑量+miR-NC組、烏頭堿高劑量+miR-181d-5p低表達組分別采用Lipofectamine 3000試劑盒轉染miR-NC質粒、miR-181d-5p siRNA質粒,嚴格按照試劑盒說明書操作,然后再向培養基中加入劑量為16 mg/L的烏頭堿。每組重復6次。
1.2.3 平板克隆形成實驗 取對數生長期的HeLa細胞,以每孔800個細胞接種于6孔板中,置于37 ℃、5%CO2培養箱中培養14 d,每隔2~3 d換液并觀察細胞形態,培養皿中出現肉眼可見的克隆時,使用4%多聚甲醛固定15 min,0.1%結晶紫染色30 min,觀察細胞克隆形成數。
1.2.4 流式細胞儀檢測HeLa細胞凋亡 細胞培養48 h后,胰酶消化細胞,PBS重懸,每孔分別加入5 μL的AnnexinV-FITC和PI,避光孵育20 min,流式細胞儀檢測細胞凋亡情況,細胞凋亡率為早期凋亡與晚期凋亡細胞占總細胞的百分比。
1.2.5 qPCR檢測HeLa細胞中miR-181d-5p和DDX3 mRNA的表達 細胞培養48 h后,TRIzol試劑提取細胞總RNA,逆轉錄試劑盒合成cDNA后,采用qPCR法檢測各組HeLa細胞中miR-181d-5p和DDX3 mRNA相對表達量。miR-181d-5p上游引物:5'-GCAAACATTCATTGTTGTCGGT-3',下游引物:5'-CCAGTGCAGGGTCCGAGGT,產物大小22 bp;DDX3上游引物:5'-ATCCTGGACTCAGCAGTCAGATGC-3',下游引物:5'-TGCGTAATGGCATGGTAACTTAAT-3',產物大小20 bp;U6上游引物:5'-CGCTTCGGCAGCACATATACTA-3',下游引物:5'-GGAACGCTTCACGAATTTGC-3',產物大小15 bp。PCR反應體系25 μL,其中SYBR qPCR Mix 12.5 ?L,cDNA 模板1 ?L,上下游引物各0.5 ?L,加ddH2O至25 μL。反應條件:95 ℃ 60 s;95 ℃ 15 s,60 ℃ 15 s,72 ℃ 45 s,40個循環。以U6為內參,采用2-??Ct法計算miR-181d-5p和DDX3 mRNA相對表達量。
1.2.6 蛋白免疫印跡法檢測HeLa細胞中DDX3、Cyclin D1、PCNA、Bax、Bcl-2、Caspase-3蛋白的表達 細胞培養48 h后,提取各組細胞總蛋白,BCA法測定蛋白濃度,取30 μg蛋白加上樣緩沖液煮沸變性后,電泳分離蛋白,濕轉法轉膜,加入5%的牛血清白蛋白封閉1 h,分別加入鼠源DDX3(1∶1 030)、Cyclin D1(1∶1 030)、PCNA(1∶1 030)、Bax(1∶1 460)、Bcl-2(1∶1 460)、Caspase-3(1∶1 460)、β-actin(1∶1 000)抗體,4 ℃孵育過夜,PBST漂洗3次,加羊抗鼠二抗室溫孵育2 h,ECL顯色液顯色,凝膠成像系統顯影,以β-actin為內參,Image J軟件分析目的蛋白相對表達量。
1.2.7 雙螢光素酶報告基因實驗 通過靶基因在線預測網站StarBase(https://starbase.sysu.edu.cn/)預測miR-181d-5p與DDX3是否存在靶向結合位點。將HeLa細胞按照5×105個/孔接種于24孔板,培養24 h后,分別將DDX3-WT和DDX3-MUT質粒與miR-181d-5p mimics、miR-181d-5p mimics陰性對照質粒共轉染HeLa細胞24 h,檢測各組細胞相對螢光素酶活性。
1.3 統計學方法 采用SPSS 25.0進行數據分析,符合正態分布的計量資料以x±s表示,2組間比較采用獨立樣本t檢驗;多組間比較采用單因素方差分析,組間多重比較行SNK-q檢驗。P<0.05為差異有統計學意義。
2 結果
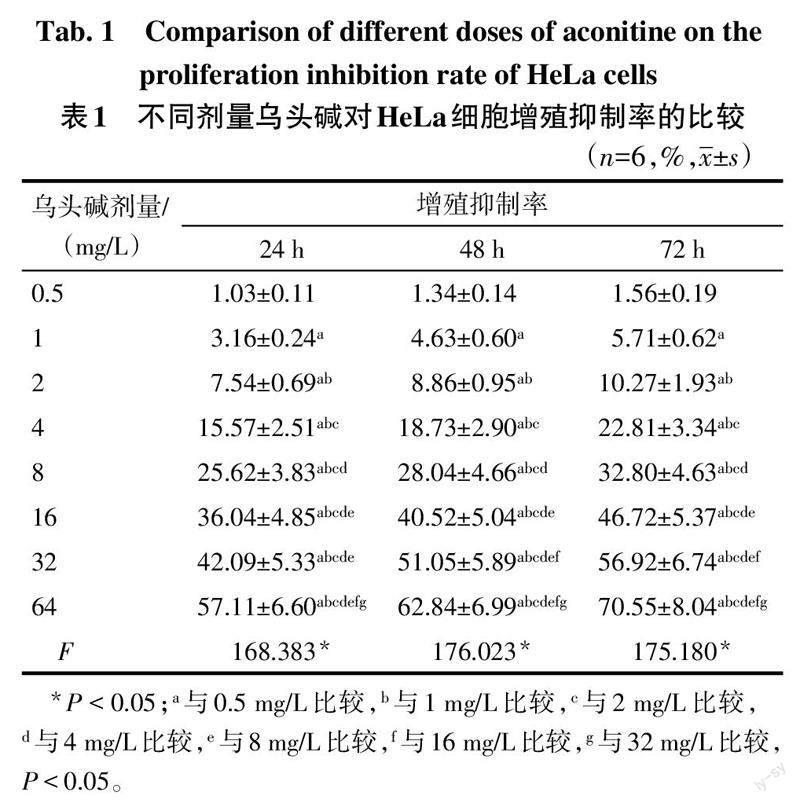
2.1 不同劑量烏頭堿對HeLa細胞增殖的影響 使用0.5~64 mg/L的烏頭堿分別處理HeLa細胞24 h、48 h、72 h,隨烏頭堿劑量的增高,其對HeLa細胞的增殖抑制作用呈增強趨勢(P<0.05),見表1。為保證一定的細胞存活數量以及蛋白質提取量,選擇4 mg/L、8 mg/L、16 mg/L的烏頭堿用于后續實驗。
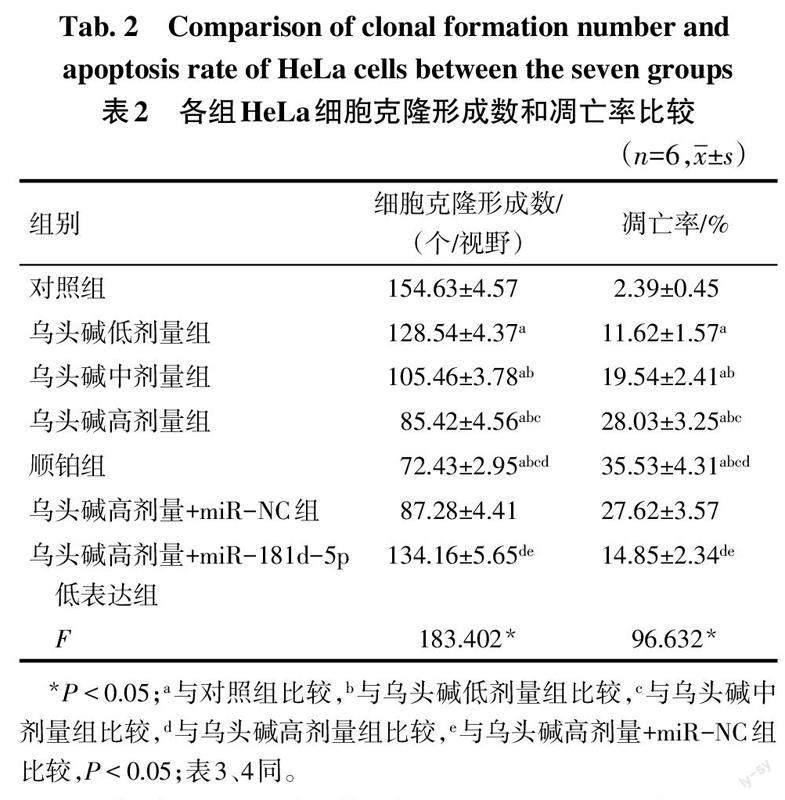
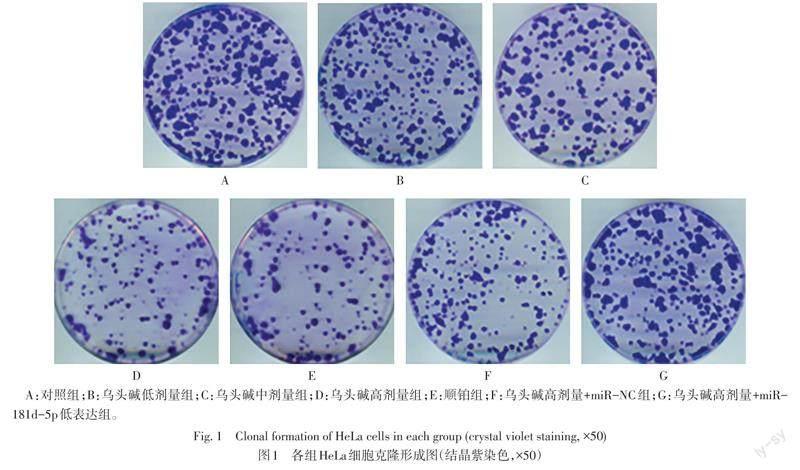
2.2 各組HeLa細胞克隆形成數和凋亡率比較 與對照組比較,烏頭堿低、中、高劑量組及順鉑組HeLa細胞克隆形成數依次降低,凋亡率依次升高(P<0.05);與烏頭堿高劑量組和烏頭堿高劑量+miR-NC組比較,烏頭堿高劑量+miR-181d-5p低表達組HeLa細胞克隆形成數增多,凋亡率降低(P<0.05)。見表2,圖1、2。
2.3 各組HeLa細胞中miR-181d-5p和DDX3 mRNA表達水平比較 與對照組比較,烏頭堿低、中、高劑量組及順鉑組HeLa細胞中miR-181d-5p表達水平依次升高,DDX3 mRNA表達水平依次降低(P<0.05);與烏頭堿高劑量組和烏頭堿高劑量+miR-NC組比較,烏頭堿高劑量+miR-181d-5p低表達組HeLa細胞中miR-181d-5p表達水平降低,DDX3 mRNA表達水平升高(P<0.05)。見表3。
2.4 各組HeLa細胞中DDX3、Cyclin D1、PCNA、Bax、Bcl-2、Caspase-3蛋白表達水平比較 與對照組比較,烏頭堿低、中、高劑量組及順鉑組HeLa細胞中DDX3、Cyclin D1、PCNA、Bcl-2蛋白表達水平依次降低,Bax、Caspase-3蛋白表達水平依次升高(P<0.05);與烏頭堿高劑量組和烏頭堿高劑量+miR-NC組比較,烏頭堿高劑量+miR-181d-5p低表達組HeLa細胞中DDX3、Cyclin D1、PCNA、Bcl-2蛋白表達水平升高,Bax、Caspase-3蛋白表達水平降低(P<0.05)。見圖3、表4。
2.5 miR-181d-5p與DDX3的靶向關系 StarBase數據庫預測顯示,miR-181d-5p與DDX3 mRNA 3'UTR區有結合位點,見圖4。雙螢光素酶報告基因檢測結果顯示,與共轉染DDX3-WT和miR-181d-5p mimics陰性對照組比較,共轉染DDX3-WT和miR-181d-5p mimics組相對螢光素酶活性降低(P<0.05),見圖5。證明miR-181d-5p與DDX3存在靶向關系。
3 討論
烏頭堿是烏頭類生物堿,具有抗心力衰竭、抗炎、免疫抑制及鎮痛等多種藥理學作用,具有廣闊的臨床應用前景[10]。在抗腫瘤方面,烏頭堿可通過多種途徑(如核因子-κB通路、雌激素受體)抑制腫瘤細胞的增殖與遷移,促進細胞凋亡[11-12]。本研究使用0.5~64 mg/L的烏頭堿分別處理HeLa細胞24 h、48 h、72 h后,結果顯示,烏頭堿對HeLa細胞增殖均有不同程度的抑制作用。Wang等[13]研究表明,烏頭堿可誘導卵巢癌A2780細胞凋亡和DNA損傷,抑制卵巢癌生長。另有研究顯示,烏頭堿通過下調核因子-κB表達以劑量和時間依賴性方式抑制胰腺癌細胞生長,促進細胞凋亡,且在胰腺癌的異種移植小鼠模型中,烏頭堿可抑制腫瘤生長并增加細胞凋亡[14]。本研究結果顯示,使用4、8、16 mg/L的烏頭堿處理HeLa細胞后,HeLa細胞克隆形成數、Cyclin D1、PCNA、Bcl-2蛋白表達水平依次降低,凋亡率、Bax、Caspase-3蛋白表達水平依次升高,表明烏頭堿可抑制宮頸癌HeLa細胞增殖,促進細胞凋亡,與在其他腫瘤中研究[13-14]結果類似,提示烏頭堿在宮頸癌中表現為抗腫瘤作用,但烏頭堿對HeLa細胞增殖、凋亡影響的具體作用機制尚不清楚。
有研究顯示miR-181d-5p在不同腫瘤中發揮促癌或抑癌的作用,如在結腸癌細胞中表達上調,抑制其表達可抑制結腸癌細胞的增殖、遷移、侵襲能力[15]。而miR-181d-5p在肺腺癌、膠質瘤中表達下調,發揮抑癌作用,上調其表達可抑制腫瘤細胞增殖,促進細胞凋亡[16-17]。本研究結果表明,烏頭堿可能具有上調miR-181d-5p表達的作用,與烏頭堿高劑量組和烏頭堿高劑量+miR-NC組比較,烏頭堿高劑量+miR-181d-5p低表達組HeLa細胞克隆形成數、Cyclin D1、PCNA、Bcl-2蛋白表達水平升高,凋亡率、miR-181d-5p、Bax、Caspase-3蛋白表達水平降低,表明抑制miR-181d-5p表達可逆轉烏頭堿對HeLa細胞增殖的抑制作用和凋亡的促進作用,提示miR-181d-5p在宮頸癌中可能發揮抑癌基因的作用,這與李祥雙等[18]研究結果類似。以上研究提示烏頭堿可能通過上調miR-181d-5p表達從而抑制HeLa細胞增殖,促進細胞凋亡,這與miR-181d-5p在宮頸癌細胞中的作用有一定關系。
miRNA通過靶向調控下游基因的表達而發揮生物學功能。本研究通過雙螢光素酶報告基因檢測顯示,miR-181d-5p與DDX3存在靶向關系。DDX3是依賴ATP的RNA解旋酶,可參與RNA轉錄、翻譯和降解等過程,DDX3還可參與細胞周期與細胞凋亡的調控,在腫瘤的發生發展中發揮重要作用,高表達的DDX3與卵巢癌侵襲和乳腺癌患者不良預后有關[19-20]。研究顯示,環狀RNA 0035266通過miR-181d-5p/DDX3分子軸促進4-甲基亞硝胺基-1-3-吡啶基-1-丁酮+脂多糖誘導的人支氣管上皮細胞中的炎癥反應[21]。本研究使用4、8、16 mg/L烏頭堿處理宮頸癌細胞后,DDX3 mRNA和蛋白表達水平依次降低;而烏頭堿高劑量+miR-181d-5p低表達組HeLa細胞中DDX3 mRNA和蛋白表達水平高于烏頭堿高劑量組和烏頭堿高劑量+miR-NC組,進一步證實miR-181d-5p與DDX3的靶向調控關系。以上結果表明烏頭堿通過上調miR-181d-5p表達,抑制DDX3表達,抑制HeLa細胞增殖,誘導細胞凋亡,這對于宮頸癌的治療有一定積極意義。
綜上所述,烏頭堿可抑制宮頸癌HeLa細胞增殖,促進細胞凋亡,可能是通過調控miR-181d-5p/DDX3軸發揮作用。本研究僅對烏頭堿的作用機制進行了初步探究,研究結果尚未能在動物模型中予以驗證,因此其涉及的相關分子通路仍有待今后進一步研究。
參考文獻
[1] 彭巧華,呂衛國. 2022年第1版《NCCN子宮頸癌臨床實踐指南》解讀[J]. 實用腫瘤雜志,2022,37(3):205-214. PENG Q H,LYU W G. Interpretation of NCCN guidelines for cervical cancer,version 1. 2022[J]. Journal of Practical Oncology,2022,37(3):205-214. doi:10.13267/j.cnki.syzlzz.2022.034.
[2] ZHAO M,GU R Y,DING S R,et al. Risk factors of cervical cancer among ethnic minorities in Yunnan Province,China:a case-control study[J]. Eur J Cancer Prev,2022,31(3):287-292. doi:10.1097/CEJ.0000000000000704.
[3] LI L,ZHANG L,LIAO T,et al. Advances on pharmacology and toxicology of aconitine[J]. Fundam Clin Pharmacol,2022,36(4):601-611. doi:10.1111/fcp.12761.
[4] SONG N,MA J,ZHANG X,et al. Lappaconitine hydrochloride induces apoptosis and S phase cell cycle arrest through MAPK signaling pathway in human liver cancer HepG2 cells[J]. Pharmacogn Mag,2021,17(74):334-341.doi:10.4103/pm.pm_251_20.
[5] 熊慧生,蔣參,高瑞,等. 烏頭堿對肝癌MHCC97細胞生長、侵襲和遷移的調控作用及機制研究[J]. 中國免疫學雜志,2018,34(5):688-691. XIONG H S,JIANG C,GAO R,et al. Regulatory effects and mechanism of aconitine on proliferation,invasion and migration of hepatoma carcinoma cell MHCC97[J]. Chinese Journal of Immunology,2018,34(5):688-691. doi:10.3969/j.issn.1000-484X.2018.05.009.
[6] DING M,ZHAO X,CHEN X,et al. Cancer-associated fibroblasts promote the stemness and progression of renal cell carcinoma via exosomal miR-181d-5p[J]. Cell Death Discov,2022,8(1):439. doi:10.1038/s41420-022-01219-7.
[7] 夏炳輝,張振山,姚天宇,等. miR-181-5p下調人非小細胞肺癌細胞KLF6表達并抑制其增殖、遷移和侵襲[J]. 生物技術,2022,32(5):587-591. XIA B H,ZHANG Z S,YAO T Y,et al. miR-181-5p down-regulates the expression of human non-small cell lung cancer cell KLF6 and inhibits its proliferation,migration and invasion[J]. Biotechnology,2022,32(5):587-591. doi:10.16519/j.cnki.1004-311x.2022.05.0093.
[8] 郭芳芳,趙瑞皎,李杜娟,等. DDX3表達上調在人宮頸癌細胞增殖中的作用分析[J]. 中華病理學雜志,2021,50(2):119-124. GUO F F,ZHAO R J,LI D J,et al. Role of up-regulated DDX3 in the proliferation of human cervical cancer cells[J]. Chin J Pathol,2021,50(2):119-124. doi:10.3760/cma.j.cn112151-20200519-00394.
[9] 李萍,姬白嫣,魏娟,等. 藏紅花素對人宮頸癌Hela細胞順鉑耐藥性的影響[J]. 新鄉醫學院學報,2021,38(5):401-405. LI P,JI B Y,WEI J,et al. Effect of crocin on cisplatin resistance of human cervical cancer Hela cells[J]. Journal of Xinxiang Medical University,2021,38(5):401-405. doi:10.7683/xxyxyxb.2021.05.001.
[10] GAO Y,FAN H,NIE A,et al. Aconitine:A review of its pharmacokinetics,pharmacology,toxicology and detoxification[J]. J Ethnopharmacol,2022,293:115270. doi:10.1016/j.jep.2022.115270.
[11] LUAN S,GAO Y,LIANG X,et al. Aconitine linoleate,a natural lipo-diterpenoid alkaloid,stimulates anti-proliferative activity reversing doxorubicin resistance in MCF-7/ADR breast cancer cells as a selective topoisomerase Ⅱα inhibitor[J]. Naunyn Schmiedebergs Arch Pharmacol,2022,395(1):65-76. doi:10.1007/s00210-021-02172-5.
[12] 周小劍,李玉華,唐湘,等. 烏頭堿抑制食管癌EC-1細胞增殖與侵襲并誘導其凋亡作用研究[J]. 中國醫藥生物技術,2019,14(4):335-340. ZHOU X J,LI Y H,TANG X,et al. Aconitine inhibits the proliferation and invasion while induces the apoptosis of esophageal cancer EC-1 cells[J]. Chinese Medicinal Biotechnology,2019,14(4):335-340. doi:10.3969/j.issn.1673-713X.2019.04.008.
[13] WANG X,LIN Y,ZHENG Y. Antitumor effects of aconitine in A2780 cells via estrogen receptor β-mediated apoptosis,DNA damage and migration[J]. Mol Med Rep,2020,22(3):2318-2328. doi:10.3892/mmr.2020.11322.
[14] JI B L,XIA L P,ZHOU F X,et al. Aconitine induces cell apoptosis in human pancreatic cancer via NF-κB signaling pathway[J]. Eur Rev Med Pharmacol Sci,2016,20(23):4955-4964.
[15] 柯東平,朱金祥,毛俊倩,等. miR-181d-5p對人結腸癌細胞凋亡的影響及機制[J]. 貴州醫科大學學報,2019,44(7):814-820. KE D P,ZHU J X,MAO J Q,et al. Effect and mechanism of microRNA-181d-5p on apoptosis of human colon cancer cells[J]. Journal of Guizhou Medical University,2019,44 (7):814-820. doi:10.19367/j.cnki.1000-2707.2019.07.014.
[16] DONG X,LIU Y,DENG X,et al. C1GALT1,Negatively regulated by miR-181d-5p,promotes tumor progression via upregulating RAC1 in lung adenocarcinoma[J]. Front Cell Dev Biol,2021,9:707970. doi:10.3389/fcell.2021.707970.
[17] KHALIL S,FABBRI E,SANTANGELO A,et al. miRNA array screening reveals cooperative MGMT-regulation between miR-181d-5p and miR-409-3p in glioblastoma[J]. Oncotarget,2016,7(19):28195-28206. doi:10.18632/oncotarget.8618.
[18] 李祥雙,于海霞,葉燕珍,等. miR-181d-5p對宮頸癌細胞放射敏感性的影響及機制[J]. 山東醫藥,2022,62(22):42-46. LI X S,YU H X,YE Y Z,et al. Influence and mechanism of miR-181d-5p on radiosensitivity of cervical cancer cells[J]. Shandong Medical Journal,2022,62(22):42-46. doi:10.3969/j.issn.1002-266X.2022.22.010.
[19] NI J,CHEN L,LING L,et al. MicroRNA-196a promotes cell proliferation and inhibits apoptosis in human ovarian cancer by directly targeting DDX3 and regulating the PTEN/PI3K/AKT signaling pathway[J]. Mol Med Rep,2020,22(2):1277-1284. doi:10.3892/mmr.2020.11236.
[20] VAN DER POL C C,MOELANS C B,MANSON Q F,et al. Cytoplasmic DDX3 as prognosticator in male breast cancer[J]. Virchows Arch,2021,479(4):647-655. doi:10.1007/s00428-021-03107-4.
[21] HUA Q,LIU Y,LI M,et al. Tobacco-related exposure upregulates Circ_0035266 to exacerbate inflammatory responses in human bronchial epithelial cells[J]. Toxicol Sci,2021,179(1):70-83. doi:10.1093/toxsci/kfaa163.
(2022-11-14收稿 2023-03-14修回)
(本文編輯 陳麗潔)

