舒筋活血膠囊通過JAK2/STAT3通路緩解大鼠膝骨關節炎的機制研究
李宏軍 錢亮 鄧新超 余庭 吳巖 吳紅麗

摘要:目的 探討舒筋活血膠囊調控酪氨酸蛋白激酶2(JAK2)/信號轉導及轉錄激活蛋白3(STAT3)信號通路對大鼠膝骨關節炎(KOA)的影響及其機制。方法 采用Hulth法制備大鼠KOA模型,將60只大鼠分為假手術組(Sham組)、KOA組、舒筋活血膠囊組(SJHX組)(472.5 mg/kg 舒筋活血膠囊灌胃)、AG490組(5.0 mg/kg的JAK2抑制劑AG490腹腔注射),每組15只。HE染色與番紅O-固綠染色觀察滑膜組織與軟骨組織病理變化,酶聯免疫吸附試驗(ELISA)檢測血清白細胞介素(IL)-10、IL-1β、腫瘤壞死因子α(TNF-α)水平,免疫熒光法檢測M1/M2型巨噬細胞極化,免疫組化染色檢測IL-1β、誘導型一氧化氮合成酶(iNOS)、基質金屬蛋白酶(MMP)-13蛋白表達,Western blot檢測JAK2/STAT3通路相關蛋白。結果 與Sham組比較,KOA組大鼠關節面不平整,滑膜組織與軟骨組織結構破壞,病理評分增加,血清IL-1β、TNF-α水平明顯升高,IL-10水平降低,滑膜組織IL-1β、iNOS、MMP-13、p-JAK2/JAK2、p-STAT3/STAT3表達水平及M1、M2型巨噬細胞、M1/M2比值升高(P<0.05);與KOA組比較,SJHX組與AG490組大鼠滑膜組織與軟骨組織病理損傷減輕,病理評分降低,血清IL-1β、TNF-α水平降低,IL-10水平升高,滑膜組織IL-1β、iNOS、MMP-13、p-JAK2/JAK2、p-STAT3/STAT3表達水平及M1巨噬細胞、M1/M2比值降低(P<0.05)。結論 舒筋活血膠囊可通過抑制JAK2/STAT3信號通路激活,調節M1/M2巨噬細胞極化,改善KOA大鼠滑膜炎癥狀。
關鍵詞:骨關節炎,膝;活血舒筋;巨噬細胞;Janus激酶2;STAT3轉錄因子;舒筋活血膠囊
中圖分類號:R684.3文獻標志碼:ADOI:10.11958/20221924
Mechanism of Shujin Huoxue Capsule in relieving knee osteoarthritis in
rats through JAK2/STAT3 pathway
LI HongjunQIAN LiangDENG Xinchao YU Ting WU Yan WU Hongli
1 Department of Wound Repair and Peripheral Vascular Disease, the First Hospital of Wuhan, Wuhan 430030, China;
2 Department of Orthopedics, the Eighth Hospital of Wuhan
Abstract: Objective To investigate the effect and mechanism of Shujin Huoxue Capsule on knee osteoarthritis (KOA) in rats by regulating tyrosine protein kinase 2 (JAK2)/signal transduction and transcription-activating protein 3 (STAT3) signaling pathway. Methods The Hulth method was used to prepare rat KOA model. Sixty rats were divided into the Sham group, the KOA group, the Shujin Huoxue Capsule (SJHX) group (472.5 mg/kg Shujin Huoxue Capsule gavage) and the AG490 group (5.0 mg/kg JAK2 inhibitor AG490 intraperitoneally) with 15 rats in each group. The pathological changes of synovial tissue and cartilage tissue were observed by HE staining and Safranin O-fast green staining. Serum levels of interleukin-10 (IL-10), IL-1b and tumor necrosis factor-a (TNF-a) were detected by enzyme-linked immunosorbent assay (ELISA). M1/M2 macrophage polarization was detected by immunofluorescence assay. The expression levels of IL-1β, inducible nitric oxide synthase (iNOS) and matrix metalloproteinase 13 (MMP-13) were detected by immunohistochemical staining. JAK2/STAT3 pathway related proteins were detected by Western blot assay. Results Compared with the Sham group, the articular surface was uneven in? rats of the KOA group. The synovial tissue and cartilage tissue were destroyed,? pathological scores were increased. Serum levels of IL-1β and TNF-α were obviously increased, and the level of IL-10 was obviously reduced. Expression levels of IL-1β, iNOS, MMP-13, p-JAK2/JAK2 and p-STAT3/STAT3 in synovial tissue, and the proportions of M1, M2 macrophages and M1/M2 were obviously increased (P<0.05). Compared with the KOA group, the pathological damage of synovial tissue and cartilage tissue was reduced in the SJHX group and the AG490 group. Pathological scores were reduced. Serum levels of IL-1β and TNF-α were obviously reduced, and the level of IL-10 was obviously increased. Expression levels of IL-1β, iNOS, MMP-13, p-JAK2/JAK2, p-STAT3/STAT3 in synovial tissue, and the proportions of M1, M2 macrophages and M1/M2 were obviously reduced (P<0.05). Conclusion Shujin Huoxue Capsule can improve the symptoms of synovitis in KOA rats by inhibiting the activation of JAK2/STAT3 signaling pathway and regulating the polarization of M1/M2 macrophages.
Key words: osteoarthritis, knee; activating blood and relaxing muscle tendon; macrophages; Janus kinase 2; STAT3 transcription factor; Shujin Huoxue Capsule
膝骨關節炎(knee osteoarthritis,KOA)是常見的慢性關節炎,主要表現為關節滑膜炎癥、軟骨丟失、軟骨下骨改變等特征[1]。先天免疫在KOA的進展中發揮重要作用,巨噬細胞是免疫系統的重要組成部分,在不同模式刺激下可極化為不同的表型,M1型巨噬細胞促進炎性因子分泌,加重炎癥反應,M2型巨噬細胞誘導生長因子,具有抗炎和促進組織修復作用,巨噬細胞極化與KOA的發生發展密切相關[1-2]。研究發現,酪氨酸蛋白激酶2(JAK2)/信號轉導及轉錄激活蛋白3(STAT3)信號通路參與調控巨噬細胞極化[3]。JAK2/STAT3信號通路還參與軟骨破壞的過程,抑制JAK2/STAT3通路的激活可降低炎癥反應,改善佐劑性關節炎的軟骨損傷[4]。舒筋活血膠囊由紅花、狗脊、槲寄生等中藥組成,具有舒筋活絡,活血散瘀的功效,在臨床上用于治療KOA、類風濕性關節炎(rheumatoid arthritis,RA)等[5-6]。舒筋活血膠囊對KOA巨噬細胞極化的影響及作用機制尚不清楚,本研究旨在探索舒筋活血膠囊對KOA巨噬細胞極化的影響及可能的作用機制。
1 材料與方法
1.1 材料
1.1.1 動物與藥物 SD雄性大鼠60只,SPF級,6~7周齡,200~230 g,購自廣東至遠生物醫藥科技有限公司,動物生產許可證號:SCXK(粵)2021-0057,適應性飼養1周后開始實驗。舒筋活血膠囊(0.35 g,國藥準字Z20050630)購自湖南德康制藥股份有限公司。
1.1.2 主要試劑與儀器 JAK2抑制劑AG490購自碧云天生物科技有限公司;蘇木精-伊紅(HE)染色試劑盒、番紅O-固綠軟骨染色液購自上海源葉生物科技有限公司;兔抗鼠CD68、CD206、F4/80一抗、Alexa Fluor? 488標記與Alexa Fluor? 647標記的羊抗兔IgG二抗購自Abcam公司;大鼠腫瘤壞死因子(TNF)-α、白細胞介素(IL)-1β、IL-10酶聯免疫吸附試驗(ELISA)檢測試劑盒購自上海酶聯生物科技有限公司;兔抗鼠IL-1β、誘導型一氧化氮合成酶(iNOS)一抗購自Santa Cruz公司;兔抗鼠基質金屬蛋白酶(MMP)-13、p-JAK2、JAK2、p-STAT3、STAT3、β-actin一抗及HRP標記的羊抗兔IgG二抗購自索萊寶生物科技有限公司。垂直電泳系統購自Bio-rad公司,共聚焦顯微鏡及正置顯微鏡購自日本Olympus公司,Varioskan LUX多功能酶標儀購自Thermo Fisher Scientific公司。
1.2 研究方法
1.2.1 實驗動物分組及模型制備 按照隨機數字表法將大鼠分為假手術組(Sham組)、KOA組、舒筋活血膠囊組(SJHX組)、JAK2抑制劑組(AG490組),每組15只。采用Hulth法[7-8]制備KOA模型,腹腔注射2%戊巴比妥鈉麻醉大鼠,選取右膝關節,打開關節腔,切斷內側半月板前角以及前交叉和內側副韌帶,再切除內側半月板。Sham組打開關節腔后不做處理,再縫合關節囊及皮膚,術后給予大鼠40萬U青霉素臀大肌注射3 d,術后自由活動,6周后造模結束。
實驗藥物劑量根據人與大鼠體表面積換算來確定,造模結束后,SJHX組大鼠給予472.5 mg/(kg·d)舒筋活血膠囊,灌胃給藥,每日1次,AG490組使用5.0 mg/kg的JAK2抑制劑AG490腹腔注射,Sham組與KOA組大鼠給予等量的生理鹽水,每日1次,連續給藥8周。
1.2.2 標本采集 末次給藥24 h,摘眼球取血后,3 000×g離心15 min,取血清,-80 ℃保存。每組隨機(抽簽法)抽取5只大鼠,剝離右側膝關節滑膜及軟骨組織,4%多聚甲醛固定,石蠟包埋。另外10只大鼠取滑膜組織,-80 ℃保存。
1.2.3 滑膜組織與軟骨組織病理學觀察 將石蠟膜包埋的組織與軟骨組織切片,經脫蠟水化后,分別采用HE染色與番紅O-固綠染色,觀察滑膜組織與軟骨組織病理變化,并進行Krenn滑膜炎評分與Mankin評分。
1.2.4 血清IL-10、IL-1β、TNF-α水平檢測 根據試劑盒說明書,采用ELISA法檢測血清IL-10、IL-1β、TNF-α水平。
1.2.5 滑膜組織免疫熒光染色 取大鼠滑膜組織冰凍切片,使用0.3%PBST透化后分別加入CD68(1∶100)、CD206(1∶500)、F4/80(1∶500)一抗孵育,再加入熒光標記的IgG二抗(1∶1 000),孵育,DAPI復染細胞核,共聚焦顯微鏡下拍照,計算CD68+(M1)、CD206+(M2)占F4/80+(M0)細胞比例數,并根據各組細胞比例數,計算M1/M2比值。
1.2.6 免疫組化染色檢測IL-1β、iNOS以及MMP-13蛋白表達 滑膜組織切片經脫蠟及抗原修復后,分別加入IL-1β、iNOS、MMP-13抗體稀釋液(1∶1 000稀釋),再加入二抗(1∶1 500稀釋)室溫孵育1 h,PBS洗滌后DAB顯色,蘇木素復染,IL-1β、iNOS、MMP-13蛋白陽性表達為棕黃色顆粒,采用Image J軟件分析,計算積分光密度,對IL-1β、iNOS、MMP-13蛋白表達定量分析。
1.2.7 Western blot檢測蛋白表達 取大鼠滑膜組織,加入液氮研磨后,加入RIPA裂解液離心提取總蛋白。經定量分析后,取30 μg蛋白煮沸變性,進行SDS-PAGE電泳并轉膜,封閉后分別加入p-JAK2、JAK2、p-STAT3、STAT3(均1∶1 000稀釋)及β-actin(1∶1 500稀釋)一抗,4 ℃孵育過夜,加入二抗(1∶2 000)37 ℃孵育1 h,ECL顯色后,以β-actin為內參,采用Imge J軟件分析蛋白相對表達。
1.3 統計學方法 采用SPSS 25.0軟件進行數據分析。符合正態分布的計量數據用x±s表示,多組間比較采用單因素方差分析,組間多重比較采用LSD-t檢驗,P<0.05為差異有統計學意義。
2 結果
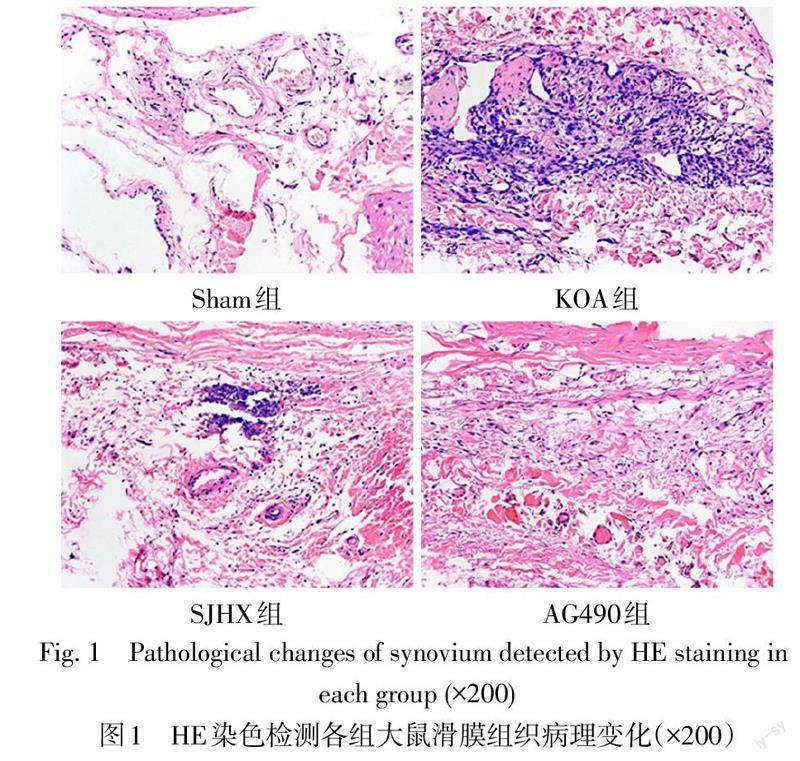
2.1 各組大鼠滑膜組織HE染色結果 Sham組大鼠滑膜和軟骨組織結構正常,滑膜細胞排列整齊,軟骨表面光滑,KOA組大鼠關節表面不平整,滑膜增生肥厚,細胞形態不規則,局部炎性浸潤明顯,Krenn評分較Sham組增加(P<0.05);SJHX組與AG490組大鼠滑膜厚度減少,炎性浸潤減輕,Krenn評分較KOA組降低(P<0.05);見圖1、表1。
2.2 各組大鼠軟骨組織番紅O-固綠染色結果比較 Sham組可見正常軟骨組織被染成紅色,結構規則,關節面正常,軟骨下骨為綠色;KOA組關節面不平整,見明顯的結構破壞和關節間隙狹窄,Mankin評分較Sham組升高(P<0.05);SJHX組與AG490組軟骨損傷明顯改善,Mankin評分較KOA組下降(P<0.05);見圖2、表1。
2.3 各組大鼠血清IL-10、IL-1β、TNF-α水平比較 與Sham組比較,KOA組大鼠血清IL-1β、TNF-α水平升高,IL-10水平降低(P<0.05);與KOA組比較,SJHX組、AG490組血清IL-1β、TNF-α水平降低,IL-10水平升高(P<0.05),見表2。
2.4 各組大鼠滑膜組織IL-1β、iNOS、MMP-13蛋白表達比較 與Sham組比較,KOA組大鼠滑膜組織中陽性顆粒增多,IL-1β、iNOS、MMP-13表達水平增加;與KOA組比較,SJHX組、AG490組大鼠滑膜組織陽性顆粒減少,IL-1β、iNOS、MMP-13表達水平降低;見圖3、表3。
2.5 各組大鼠滑膜組織免疫熒光染色結果 F4/80+為未分化巨噬細胞M0,CD68+、CD206+分別為M1、M2型巨噬細胞。與Sham組比較,KOA組M1、M2型巨噬細胞及M1/M2比值升高(P<0.05);與KOA組比較,SJHX組、AG490組的M1型巨噬細胞及M1/M2比值降低(P<0.05),M2差異無統計學意義(P>0.05);見圖4、5,表4。
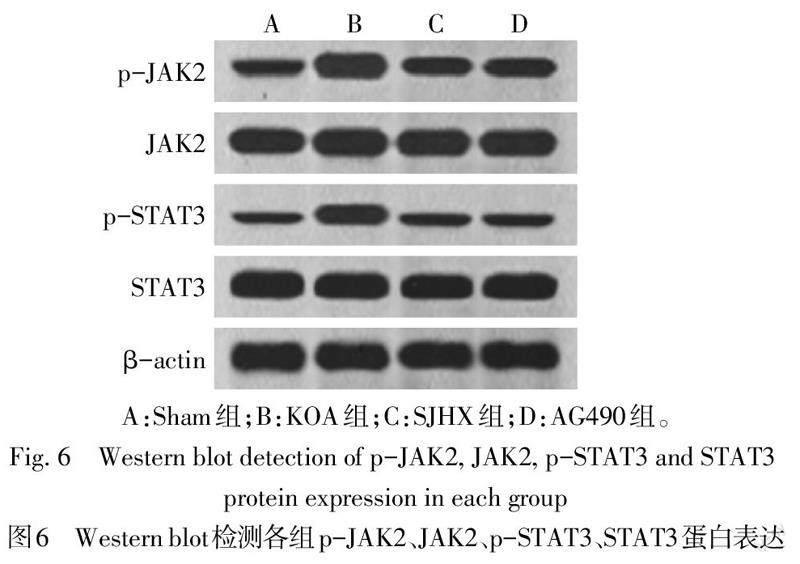
2.6 各組大鼠JAK2/STAT3通路相關蛋白表達比較 KOA組大鼠滑膜組織p-JAK2/JAK2、p-STAT3/STAT3比值高于Sham組(P<0.05);與KOA組比較,SJHX組、AG490組大鼠滑膜組織p-JAK2/JAK2、p-STAT3/STAT3比值降低(P<0.05);見圖6、表5。
3 討論
滑膜炎是KOA的病理表現之一,滑膜炎的炎癥反應與KOA的嚴重程度密切相關,高發病率、高致殘率是KOA的特點,目前尚缺乏有效的治療方法[9]。
中醫學認為KOA屬“痹證”、“骨痹”范疇,以肝腎虧虛、氣血不足為本,以風寒濕邪內蘊、瘀血阻絡為標,中醫采用活血化瘀、清熱止痛等藥物進行治療[10-11]。本研究結果顯示,使用舒筋活血膠囊治療后,KOA模型大鼠滑膜與軟骨病理損傷減輕,炎癥減輕,表明舒筋活血膠囊具有改善KOA的作用。舒筋活血膠囊由紅花、槲寄生、狗脊、澤蘭葉、雞血藤等多味中藥組成,紅花可活血通經,散瘀止痛,狗脊與槲寄生具有補肝腎、除風濕、強筋骨的作用,澤蘭葉與雞血藤具有活血通絡、舒筋活血的功效,絡石藤與伸筋草具有袪風通絡的功效,香附具有疏肝理氣、和中止痛的功效,諸藥合用具有舒筋活絡,活血散瘀之功效。
巨噬細胞是具有高度異質性的免疫細胞,受組織微環境與病理條件的影響,可極化為M1型與M2型,M1/M2失衡在KOA的發生發展中發揮重要作用。M1型巨噬細胞可分泌TNF-α、IL-1β、IL-6等促炎因子,影響軟骨細胞合成、軟骨細胞分解代謝,抑制軟骨形成,促進關節炎(OA)的發生或進展。M2型巨噬細胞可產生IL-10、轉化生長因子(TGF)-β等抗炎因子,參與抗炎反應,有利于組織修復、傷口愈合等,可抑制或延緩OA的進展[12]。因此,促進巨噬細胞M1型向M2型轉化是治療OA的一個新方向。有研究報道,一些中藥可通過調節巨噬細胞極化緩解OA[13]。在KOA的發生發展過程中,關節損傷可引發滑膜毛細血管通透性增加,引發關節炎癥反應。在KOA大鼠中,外周血或關節液中炎性因子如TNF-α、IL-6等水平增加[14]。關節損傷的炎癥反應或老化應激激活滑膜巨噬細胞[15]。M1型巨噬細胞誘導活化后,可表達CD86、INOS等基因,分泌IL-1β、TNF-α等細胞因子,加重炎癥反應,IL-1β可誘導MMP-13合成,是OA軟骨蛻變的關鍵因子,M2活化后表達胰島素樣生長因子-1(IGF-1)和CD206,分泌IL-10等抗炎因子,加速炎癥消退,促進血管生成[16]。研究顯示,穿山龍總皂苷可通過調控M1/M2型巨噬細胞極化,抑制炎癥反應,改善痛風性關節炎[17]。本研究使用舒筋活血膠囊治療后,KOA模型大鼠血清IL-1β、TNF-α水平降低,IL-10水平升高,M1型巨噬細胞及M1/M2比值明顯降低,提示舒筋活血膠囊通過降低M1型巨噬細胞比例,改善M1/M2失衡,抑制炎癥反應,改善KOA滑膜炎癥狀。
JAK2/STAT3信號通路在參與炎癥反應、氧化應激、細胞生長與凋亡等多種生理過程中發揮重要調控作用[18-19]。OA中TNF-α、IL-1β等炎性因子可激活JAK2/STAT3信號通路,促進OA的發生發展,抑制JAK2/STAT3通路激活,可調節軟骨細胞代謝與凋亡[20]。張艷玲等[21]研究表明,溫針灸可通過抑制JAK2、STAT3磷酸化及MMP-9蛋白表達,抑制JAK2/STAT3信號通路的激活,降低促炎因子分泌,減輕KOA兔軟骨損傷。本研究結果顯示,舒筋活血膠囊治療KOA大鼠后,滑膜組織p-JAK2/JAK2、p-STAT3/STAT3表達水平明顯降低,提示舒筋活血膠囊可抑制JAK2/STAT3信號通路激活。此外,使用JAK2抑制劑AG490可明顯改善KOA大鼠滑膜與軟骨病理損傷,舒筋活血膠囊與AG490的作用結果類似。以上結果表明,舒筋活血膠囊可抑制JAK2/STAT3信號通路激活,調節M1/M2型巨噬細胞極化,改善KOA大鼠滑膜炎癥狀。本研究還存在一定不足,未檢測滑膜液炎性因子水平,僅檢測滑膜組織相關蛋白表達,對于滑膜組織巨噬細胞檢測僅使用免疫熒光檢測,未進行流式細胞儀分析,故結果可能存在一定偏倚。舒筋活血膠囊對KOA的具體作用機制仍需做更深入的研究。
參考文獻
[1] CURRY Z A,BELING A,BORG-STEIN J. Knee osteoarthritis in midlife women:unique considerations and comprehensive management[J]. Menopause,2022,29(6):748-755. doi:10.1097/GME.0000000000001966.
[2] XIE J,HUANG Z,YU X,et al. Clinical implications of macrophage dysfunction in the development of osteoarthritis of the knee[J]. Cytokine Growth Factor Rev,2019,46(1):36-44. doi:10.1016/j.cytogfr.2019.03.004.
[3] ZHONG Y,GU L,YE Y,et al. JAK2/STAT3 axis intermediates microglia/macrophage polarization during cerebral ischemia/reperfusion injury[J]. Neuroscience,2022,496(1):119-128. doi:10.1016/j.neuroscience.2022.05.016.
[4] 雷黎,姜輝,劉健,等. 五味溫通除痹膠囊對佐劑性關節炎大鼠Jak2/Stat3信號通路的調控作用[J]. 中藥藥理與臨床,2019,35(4):174-178. LEI L,JIANG H,LIU J,et al. Effects of Wuwei Wentong Jiebi Capsule on Jak2/Stat3 signaling pathway in adjuvant arthritis rats [J]. Pharmacology and Clinics of Chinese Materia Medica,2019,35(4):174-178. doi:10.13412/j.cnki.zyyl.2019.04.035.
[5] 靳志海,葛滿意,李高強,等. 舒筋活血膠囊聯合艾瑞昔布治療膝骨關節炎的臨床研究[J]. 現代藥物與臨床,2019,34(2):481-484. JIN Z H,GE M Y,LI G Q,et al. Clinical study of Shujinhuoxue capsule combined with eroxib in the treatment of knee osteoarthritis [J]. Drugs & Clinic,2019,34(2):481-484. doi:10.7501/j.issn.1674-5515.2019.02.046.
[6] 張亞. 舒筋活血膠囊治療類風濕性關節炎的藥效物質基礎及藥代動力學研究[D]. 杭州:浙江工業大學,2021. ZHANG Y. Study on pharmacodynamic substance basis and pharmacokinetics of Shujinhuoxue Capsule in the treatment of rheumatoid arthritis [D]. Hangzhou:Zhejiang University of Technology,2021.
[7] 危一飛,程桯,肖瀟,等. 防己黃芪消腫方調控滑膜巨噬細胞極化治療膝骨關節炎滑膜炎[J]. 中國實驗方劑學雜志,2022,28(13):112-122. WEI Y F,CHENG W,XIAO X,et al. Fangji Huangqi Xiaozhong Fang regulates the polarization of synovial macrophages in treatment of synovitis of knee osteoarthritis [J]. Chinese Journal of Experimental Traditional Medical Formulae,2022,28 (13):112-122. doi:10.13422/j.carol carroll nki syfjx. 20220703.
[8] 李金鵬,劉濤,何志軍,等. 消腫止痛合劑對大鼠膝骨性關節炎軟骨中AMPK/mTOR信號通路影響的實驗研究[J]. 中國骨質疏松雜志,2020,26(2):231-235. LI J P,LIU T,HE Z J,et al. Effect of Xiaozhongzhitong Mixture on AMPK/mTOR signaling pathway in cartilage of knee osteoarthritis in rats[J]. Chin J Osteopor,2020,26(2):231-235. doi:10.3969/j.issn.1006-7108.2020.02.015.
[9] SIDDIQ M A B,CLEGG D,JANSEN T L,et al. Emerging and new treatment options for knee osteoarthritis[J]. Curr Rheumatol Rev,2022,18(1):20-32. doi:10.2174/1573397117666211116111738.
[10] 劉洋,孫權,楊砥,等. 右歸丸對骨性關節炎模型大鼠TGF-β1/Smads信號通路的影響[J]. 中國骨質疏松雜志,2021,27(10):1419-1424. LIU Y,SUN Q,YANG D,et al. Effect of Yougui Pill on TGF-β1/Smads signaling pathway in osteoarthritis model rats[J]. Chin J Osteopor,2021,27(10):1419-1424. doi:10.3969/j.iSSN. 1006-7108.2021.10.003.
[11] 谷右天,楊占華,安龍,等. 舒筋活血湯治療老年膝骨關節炎的效果分析[J]. 吉林中醫藥,2020,40(9):1209-1212. GU Y T,YANG Z H,AN L,et al. Relaxing tendons decoction for the treatment of senile knee osteoarthritis analysis[J]. Jilin J Tradit Chin Med,2020,40(9):1209-1212. doi:10.13463/j.cnki.jlzyy.2020.09.025.
[12] SUN Y,ZUO Z,KUANG Y. An emerging target in the battle against osteoarthritis:macrophage polarization[J]. Int J Mol Sci,2020,21(22):8513-8532. doi:10.3390/ijms21228513.
[13] TIAN Z,ZENG F,ZHAO C,et al. Angelicin alleviates post-trauma osteoarthritis progression by regulating macrophage polarization via STAT3 signaling pathway[J]. Front Pharmacol,2021,12(1):1-11. doi:10.3389/fphar.2021.669213.
[14] 楊利斌,楊林,趙恩典,等. miR-106a-5p過表達對ACLT誘導的骨關節炎大鼠軟骨退變和細胞外基質降解的修復及血清炎癥因子的影響[J]. 中國免疫學雜志,2021,37(13):1553-1557. YANG L B,YANG L,ZHAO Y H,et al. Effects of miR-106a-5p overexpression on the repair of cartilage degeneration and extracellular matrix degradation and serum inflammatory cytokines in ACLT-induced osteoarthritis rats [J]. Chin J Immunology,2021,37(13):1553-1557. doi:10.3969/j.issn.1000-484X.2021.13.004.
[15] FATTORI V,STAURENGO-FERRARI L,ZANINELLI T H,et al. IL-33 enhances macrophage release of IL-1β and promotes pain and inflammation in gouty arthritis[J]. Inflamm Res,2020,69(12):1271-1282. doi:10.1007/s00011-020-01399-x.
[16] GRIFFIN T M,SCANZELLO C R. Innate inflammation and synovial macrophages in osteoarthritis pathophysiology[J]. Clin Exp Rheumatol,2019,120(5):57-63.
[17] 周琦,孫慧娟,劉樹民. 穿山龍總皂苷調控巨噬細胞M1/M2極化治療痛風性關節炎的作用機制[J]. 中國實驗方劑學雜志,2021,27(24):92-99. ZHOU Q,SUN H J,LIU S M. Effect of total saponins of Pangolin on macrophage M1/M2 polarization in the treatment of gout arthritis[J]. Chinese Journal of Experimental Traditional Medical Formulae,2021,27(24):92-99. doi:10.13422/j.cnki.syfjx.20212340.
[18] ZHU J,TANG Y,WU Q,et al. HIF-1α facilitates osteocyte-mediated osteoclastogenesis by activating JAK2/STAT3 pathway in vitro[J]. J Cell Physiol,2019,234(11):21182-21192. doi:10.1002/jcp.28721.
[19] TONG J,FANG J,ZHU T,et al. Pentagalloylglucose reduces AGE-induced inflammation by activating Nrf2/HO-1 and inhibiting the JAK2/STAT3 pathway in mesangial cells[J]. J Pharmacol Sci,2021,147(4):305-314. doi:10.1016/j.jphs.2021.08.006.
[20] TENGY,NI G,ZHANG W,et al. TRIM59 attenuates IL-1β-driven cartilage matrix degradation in osteoarthritis via direct suppression of NF-κB and JAK2/STAT3 signaling pathway[J]. Biochem Biophys Res Commun,2020,529(1):28-34. doi:10.1016/j.bbrc.2020.05.130.
[21] 張艷玲,劉君偉,李春,等. 基于JAK2/STAT3信號通路探討溫針灸改善膝關節骨關節炎兔軟骨損傷的機制[J]. 針刺研究,2022,47(12):1088-1094. ZHANG Y L,LIU J W,LI C,et al. Based on JAK2/STAT3 signal pathway,to explore the mechanism of warming acupuncture and moxibustion to improve cartilage injury in rabbits with knee osteoarthritis[J]. Acupunct Res,2022,47(12):1088-1094. doi:10.13702/j.1000-0607.20211331.
(2022-11-22收稿 2022-12-20修回)
(本文編輯 李國琪)

