不同年齡段的早發性卵巢功能不全患者進行激素替代治療對骨密度療效的比較
續曉蓓,郭雪桃,王葉葉,解 富
0 引言
早發性卵巢功能不全(Premature ovarian insufficiency,POI)是指女性在40歲以前出現月經紊亂(如停經或月經稀少),由卵巢活動衰退引起促性腺激素偏高、雌激素偏低的臨床綜合征。流行病學資料顯示,40歲以下POI的發病率為1/100,30歲以下為1/1 000,20歲以下為1/10 000,可為原發性或繼發性[1]。近年來,該病發病率逐年上升。既往研究發現,POI患者的年齡越小,發病率越低,對健康的危害越大,對骨代謝的影響也越大。在此期間,雌激素對不同年齡段女性骨量增加的療效是不同的[2]。大量研究表明,女性20歲前是骨量急劇增加的時間,可達峰值骨量(Peak bone mass,PBM)的90%~95%[3-6],21~30歲骨量增加緩慢,直到30歲左右才完成剩余的5%~10%,由此達到PBM[6-10],此后隨年齡的增加骨量開始丟失[11-13]。20歲之前為骨量“快速積累期”,21~30歲為“鞏固期”[14]。因此,本研究將納入的POI患者分為≤20歲、21~30歲和>30歲3個年齡組,比較激素替代療法(Hormone replacement therapy,HRT)對各年齡組骨密度的療效,旨在把握骨量增加的最佳時機,獲得其最大范圍內的峰值骨量。
1 資料與方法
1.1 研究對象與分組 回顧性收集山西醫科大學第一醫院婦科內分泌門診2009年10月至2020年9月確診為POI并進行HRT治療的患者。納入標準:①符合POI診斷標準;②未發現對骨密度有影響的相關疾病;③繼發性閉經患者;④病例資料完整;⑤停經或月經稀發年齡、確診POI年齡、開始HRT治療年齡相差不超過12個月。排除標準:①HRT禁忌證;②髖部、腰椎骨折史及血栓史;③影響骨骼代謝藥物使用史;④治療1個月前性激素類藥物使用史;⑤有嚴重疾病和精神病等。符合研究條件的患者共計98例,≤20歲組平均年齡(17.12±1.83)歲,21~30歲組平均年齡(26.28±3.21)歲,31~40歲組平均年齡(36.54±3.23)歲。治療方案為雌孕激素序貫治療,包括周期序貫[戊酸雌二醇片/戊酸雌二醇醋酸環丙孕酮片復合包裝(2 mg/1 mg)9例、戊酸雌二醇加黃體酮(2 mg/100 mg)13例、結合雌激素加黃體酮(0.625 mg/100 mg)12例]和連續序貫[雌二醇片/雌二醇地屈孕酮片復合包裝(1 mg/10 mg)21例、雌二醇片/雌二醇地屈孕酮片復合包裝(2 mg/10 mg)43例]。本研究經我院倫理委員會批準(倫理批號:KYLL-2023-065)。
1.2 研究方法 收集病史基本情況,包括年齡、末次月經、初潮時間、生育史等;同時進行體格檢查及輔助檢查(性激素檢查、盆腔彩超、頸動脈超聲及骨密度等)基本臨床檢查,并選擇有HRT適應證且無禁忌證的POI女性進行治療,同時進行健康指導(包括飲食、運動、心理等方面的指導)。
骨密度(Bone mineral density,BMD)檢測:采用美國Hologic公司生產的雙能X射線吸收儀測定左側股骨頸、髖骨、腰L1及總腰椎骨密度及Z值,測定面積骨密度,單位為g/cm2。骨密度水平的判斷采用同一種族數據庫計算出的Z值,將Z值≤2SD(標準差)定義為“同一年齡段低于預期范圍”或低骨量[15-16],Z值=(測量的骨密度-平均骨密度)/平均骨密度在同齡人群中的標準差,適用于兒童、青少年及絕經前婦女。國際骨質疏松基金提出,Z值≤-2.0可用于定義未達到骨量峰值的青年低骨量[3]。
1.3 觀察指標 患者一般資料:身高、體重、收縮壓、舒張壓、腰圍及腰臀比;骨密度:左側股骨頸、髖骨、腰L1及總腰椎骨密度及Z值。
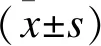
2 結果
2.1 三組患者基線資料比較 三組患者治療前收縮壓、舒張壓、身高、體重、腰圍及腰臀比,差異無統計學意義(P>0.05)。見表1。

表1 各年齡段女性基線資料比較
2.2 三組患者治療前后骨密度及Z值的比較 ≤20歲組、21~30歲組和31~40歲組患者治療前后比較:①≤20歲組和21~30歲組治療后左側股骨頸、髖骨、腰L1及總腰椎的骨密度及Z值與治療前相比顯著增加,差異有統計學意義(P<0.05)。②31~40歲組患者腰L1及總腰椎治療后的骨密度及Z值與治療前相比顯著增加,差異有統計學意義(P<0.05);而左股骨頸、髖骨與治療前相比,僅Z值增加,差異有統計學意義(t=2.574,P=0.015;t=2.355,P=0.025);骨密度與治療前相比,增幅較小,差異無統計學意義(t=1.797,P=0.082;t=1.955,P=0.059)。見表2。

表2 不同年齡組POI患者治療1年前后骨密度及Z值比較(g/cm2)
2.3 三組患者治療前后骨密度及Z值差值的組間比較 ≤20歲組、21~30歲組和31~40歲組患者各部位治療前后差值組間比較,結果顯示:①骨密度:3個年齡組左側股骨頸、髖骨、腰L1、總腰椎治療前后骨密度的增幅比較,差異有統計學意義(P均<0.05)。②Z值:3個年齡組左側股骨頸、腰L1、總腰椎治療后Z值的增幅比較,差異有統計學意義(F=6.426,P=0.002;F=13.082,P<0.001;F=12.913,P<0.001);三組間僅左側髖骨治療前后Z值增幅差異比較無統計學意義(F=2.676,P=0.074)。見表3。

表3 不同年齡組POI患者治療1年前后骨密度及Z值差值的組間比較(g/cm2)
2.4 3組患者骨量異常率比較 各年齡組骨量異常率[Z≤-2.0(低骨量)]治療前后比較:①≤20歲組:左髖、總腰椎治療前后比較,差異有統計學意義(P<0.05);②21~30歲、31~40歲組:左髖、總腰椎治療前后比較,差異無統計學意義(P>0.05)。 見表4。

表4 不同年齡組POI患者左髖及腰椎治療1年前后Z值≤-2(低骨量)發生率的比較[例(%)]
3 討論
POI是一種與雌激素缺乏相關的疾病,可導致骨礦物質密度降低,骨質疏松癥和骨折的風險增加。對于未達PBM的年輕患者,POI會造成比正常絕經女性骨量流失更嚴重的情況。研究顯示,峰值骨量的微小增加會極大地推遲骨質疏松發生的年齡。在一個數學模型中,通過實驗變量來預測峰值骨量、絕經期和年齡相關的骨丟失對骨質疏松癥發展的相對影響,計算出峰值骨量增加10%可能會使骨質疏松癥的發生推遲13年[8]。該結論提示了峰值骨密度可能是影響骨質疏松癥發生發展的最重要單一因素。
年齡是比骨量更重要的骨折風險決定因素[17]。骨骼健康的基礎于子宮內開始建立[11]。兒童和青少年時期是骨骼發育最迅速的階段,占總骨量的30%~40%[11]。從幼兒期到青春期后期,骨形成大于骨吸收,骨量穩定積累,約90%~95%的骨量積累在20歲左右完成[3-6],而另外5%~10%的骨積累直到30歲左右完成,由此達到峰值骨量[6-10]。此后,骨吸收大于骨形成,骨量開始流失[11-13]。雌激素是女性骨骼穩態的主要調節因子[11]。年齡不同,雌激素對骨骼所起的作用也不同。青春期雌激素缺乏會嚴重影響骨骼礦化,導致成年后PBM降低,增加未來骨折的風險。同時,研究顯示,初潮早,骨密度較高,初潮晚,骨密度較低[18]。這種聯系與雌激素較早和較長時間的影響有關。因此,本研究將POI患者分為≤20歲組、21~30歲組、31~40歲組,治療后,3個年齡組骨量均有增加,但≤20歲組骨密度及Z值的增幅更高,且在≤20歲組,無論是髖骨還是腰椎,治療后骨密度改善率均最明顯,與上述結論一致。因此,年齡越小的POI患者,越應及早接受雌激素補充治療,否則會錯過骨骼生長的最佳時機,無法達到骨密度的最高峰。
骨骼對雌激素作用的敏感性高低與部位有關[12]。髖部骨骼的生長通常發生在青春期之前,而腰椎的生長則大多發生在青春期之后。Hosie等[19]的研究表明,與股骨頸或全髖相比,腰椎對雌激素治療的反應更靈敏。這與骨小梁在腰椎與髖部占比不同有關[2]。骨小梁在腰椎中的占比高于髖部[20],而雌激素對骨小梁的作用更強,因此,雌激素對腰椎骨密度的影響更大,產生更大的雌激素剝奪效應[2,21-22]。
此外,影響POI患者BMD的決定因素除了雌激素,還有飲食成分(如能量、蛋白質、鈣)、1,25-(OH)2-維生素D3、胰島素樣生長因子-1(IGF-1)、機械力(體力活動、體重)和暴露于危險因素(吸煙、飲酒)等。因此,在通過內分泌治療改善患者骨密度的同時,積極攝入奶制品增加每日的鈣和蛋白質,預防或糾正維生素D缺乏率,增加負重體育活動,這些都有可能改善和維持骨骼健康,防止POI患者在以后的生活中發生骨折。
綜上,POI患者在接受HRT后,骨密度均明顯升高。年齡越小,骨密度和Z值的增幅越大,療效越佳。因此,POI患者更應及早接受治療,獲得年齡范圍內可達到的最大骨量。此外,影響POI患者骨密度的因素還包括鈣攝入、維生素D濃度、負重鍛煉情況、吸煙、飲酒等,考慮這些因素的病例數量太少,無法納入統計來進一步計算除年齡以外其他因素對骨密度的影響。因此,關于HRT對不同年齡段POI患者骨密度的影響,尚需擴大樣本量、延長治療時間后進一步研究。

