克拉霉素通過抑制小鼠母胎炎癥預防早產和降低新生小鼠死亡率的研究
王海燕,黃守國,蒙秋,張靜
早產是全球新生兒死亡和患病的主要原因,特別是在發(fā)展中國家[1],是全球范圍內導致新生兒患病和死亡的主要原因[2]。根據2018 年的全球統(tǒng)計數據,大約有1 500 萬例早產,其中約70% 屬于自發(fā)性早產[3]。自發(fā)性早產涉及多種病理生理過程,包括羊膜腔感染和炎癥[4]。
相對于由病原體引發(fā)的羊膜炎,無菌性羊膜炎癥在自發(fā)性早產中更為常見[5]。這種無菌性炎癥是由內源性危險信號(也稱為警報素)觸發(fā)的。這些警報素包括高遷移率族蛋白B1(high-mobility group box 1, HMGB1)、白細胞介素(interleukin, IL)-1α、IL-33、熱休克蛋白和S100 蛋白等[6]。當細胞受到損傷或應激時,這些警報素會被釋放到細胞外,從而激活先天免疫系統(tǒng)和炎癥反應[7]。HMGB1 是一種高度保守的非組蛋白,具有多種生物學功能,包括穩(wěn)定核小體和促進基因轉錄[8]。當細胞受到損傷或壞死時,HMGB1 會被釋放到細胞外,作為一種炎癥介質,與多種受體[如Toll 樣受體4(toll-like receptor 4, TLR4)]結合,激活下游信號通路,并誘導多種參與炎癥反應的細胞因子(簡稱炎癥因子)[如IL、趨化因子、干擾素-γ (interferon-γ, IFNG)和腫瘤壞死因子 (tumor necrosis factor, TNF)等]的表達和釋放。
有研究表明,早產產婦的HMGB1 水平顯著增加[9],而羊水中HMGB1 水平較高的產婦分娩速度更快。這意味著HMGB1 可能作為早產的一個重要預測因子[10]。最近的研究還發(fā)現(xiàn),特定的抗生素(如克拉霉素)不僅具有抗微生物活性,而且在羊膜腔內具有抗炎作用。然而,國內關于通過抑制HMGB1 來緩解早產和新生兒不良結局的研究還很少[12-13]。因此本次研究旨在探究克拉霉素治療能否通過抑制HMGB1 誘導的炎癥反應并進一步評估其對早產和新生小鼠不良結局的影響。
1 材料和方法
1.1 實驗儀器與材料
1.1.1 動物 無特定病原體(specific pathogen free, SPF)級別8 周大C57BL/6(B6)小鼠購自上海南方模式生物科技股份有限公司(生產許可證號:SCXK(滬)2019-0002)。
1.1.2 主要儀器 VEVO3100 小動物超聲成像系統(tǒng)(加拿大VisualSonics 公司);30 G × ?一次性無菌注射器(美國Becton Dickinson 公司);紅外攝像機(日本SONY 公司);Bioanalyzer 2100 生物分析儀(美國Agilent 公司);Luminex FLEXMAP 3D(美國Luminex 公司)。
1.1.3 主要試劑 異氟醚(河北一品制藥有限公司);重組人HMGB1 蛋白(美國Abcam 公司);磷酸鹽緩沖液(phosphate buffered saline, PBS;上海埃澤思生物科技有限公司);克拉霉素(美國Sigma Aldrich 公司);二甲基亞砜(dimethyl sulfoxide, DMSO;美國Sigma Aldrich 公司);QIAshredders 試劑盒(德國Qiagen 公司);無RNase 的DNase 溶液(德國Qiagen 公司);RNeasy Mini 試劑盒(德國Qiagen 公司);SuperScript IV VILO Master Mix 試劑盒(美國Thermofisher 公司);RNAlater 溶液(美國Thermofisher 公司);Cytokine & Chemokine 36-Plex Mouse Procarta-Plex? Panel 1A 試劑盒(美國Thermofisher 公司)
1.2 實驗方法
1.2.1 小鼠早產模型建立以及分組 雌雄小鼠分籠飼養(yǎng),食水充足,溫度23 ℃,濕度40%~70%,12/12 h 光周期。1 周后,同表型雌雄小鼠1∶2 合籠交配。每天8 時到9 時檢測陰栓確定交配成功,記為妊娠第0 天[14]。分籠飼養(yǎng)交配成功的雌雄小鼠,監(jiān)測雌鼠體重,妊娠第12 天體重增加>2 g 為懷孕[6]。
用HMGB1 羊膜給藥,通過促進炎癥反應誘導早產和分娩。妊娠第13 天的雌鼠(n=40)吸入2%異氟醚麻醉。剔除胸腹部毛,保持體溫(37 ± 1)℃,監(jiān)測呼吸和心率。超聲引導下用注射器向每只雌鼠羊膜內注射100 μl 重組人HMGB1(9 ng)磷酸鹽緩沖液,該劑量參考無菌羊膜內炎癥女性羊水濃度[15]。超聲確認羊膜腔內注射成功。超聲后,加熱燈下恢復小鼠:10 min 內恢復正常活動。實驗過程中有3 只小鼠死亡,余37 只鼠,隨機分為實驗組(n=19)和對照組(n=18)。恢復后,紅外攝像機視頻記錄小鼠,確定胎齡、早產率、新生小鼠出生和第1 周死亡率[6]。
1.2.2 干預治療 實驗組雌鼠在第13 天通過HMGB1 羊膜給藥后,在第6、12、24、48、72、96 h 時皮下注射75 mg/kg 克拉霉素進行干預治療;對照組雌鼠則在以上6 個時間點皮下注射75 mg/kg DMSO。將溶于DMSO 的克拉霉素和DMSO 溶于無菌5%葡萄糖水。治療間隔通過錄像機觀察懷孕雌鼠,評估妊娠和新生小鼠的情況。克拉霉素的劑量根據Tagliabue 等[16]研究確定。
1.2.3 羊膜腔內注射HMGB1 的雌鼠的組織取樣 在妊娠第14 天干預治療后,從對照組和實驗組2 組隨機各選取5 只,在第18 天干預治療后2 h(即HMGB1 注射后98 h)安樂死并進行收集蛻膜、子宮、子宮頸、胎兒胎膜、胎盤、胎肺、胎腸、胎肝和胎脾,液氮中速凍并-80 ℃保存。RNA 分離、cDNA合成和逆轉錄定量PCR 分析按試劑盒使用說明進行。從每個羊膜囊中收集羊水。羊水樣品4 ℃下3 000 r/min 離心(離心半徑15 cm) 10 min,分離上清液-20 ℃保存。
1.2.4 懷孕雌鼠妊娠和新生小鼠結局檢測 參考Gomez-Lopez 等[17]的研究和Garcia-Flore 等[18]的研究方法,連續(xù)監(jiān)測對照組(n=13)和實驗組(n=14)懷孕雌鼠以記錄妊娠情況,主要測量結果包括早產率和新生小鼠死亡率。妊娠時長為出現(xiàn)陰栓到出現(xiàn)第1 個新生小鼠時間。懷孕第19 天之前分娩則視為早產,早產率為每組小鼠中在懷孕第19 天之前分娩比例。晚期早產為第18 天到第19 天分娩[19]。產后每天觀察新生小鼠,評估小鼠的體重和存活情況,統(tǒng)計死亡率。出生后第1 周內死亡的小鼠體重不參與比較。
1.2.5 實時熒光定量PCR 測定組織中炎癥因子表達水平 雌性小鼠組織樣本使用Trizol 試劑(Invitrogen, Carlsbad, CA)進行均質化,并通過離心法分離總RNA。RNA 的純度和濃度通過NanoDrop 分光光度計進行檢測,接受的A260/A280 比值范圍為1.8~2.0。隨后,使用DNase I(Invitrogen)對RNA樣本進行處理以去除可能的DNA 污染。利用SuperScript IV VILO Master Mix 進行cDNA 的合成,并通過分光光度法測定其濃度。qPCR 分析在Bio-Mark 系統(tǒng)中進行,反應體積為20 μl,包括10 μl 的2X Master Mix,1 μl 的20 μm 引物,2 μl 的模板cDNA,以及7 μl 的無菌水。PCR 反應條件為預變性在95 ℃進行3 min,變性在95 ℃進行15 s,退火在60 ℃進行30 s,延伸在72 ℃進行30 s,總循環(huán)次數為40 次。內參基因采用GAPDH,用于歸一化目標基因的表達量。引物信息參見表1。數據分析采用采用2-ΔΔCt法計算相對基因表達量。

表1 逆轉錄定量PCR 引物序列
1.2.5 多重免疫測定羊水中炎癥因子的濃度 根據試劑盒說明,通過ProcartaPlex 評估羊水樣本的細胞因子濃度。根據Romero 等[20]的研究結果,本次研究測定與羊膜內炎癥有關的細胞因子IL-6、IL-1β、TNF、IL-1α、IL-10、IFNG、CCL2(MCP-1)、CCL4(MIP-1α)、CCL5(RANTES)、CXCL1(GRO-α)和CXCL10(IP-10)。使用超高通量液態(tài)芯片檢測系統(tǒng)計算分析物濃度。
1.3 統(tǒng)計學處理
采用GraphPad Prism 8.0.1 統(tǒng)計學軟件進行數據分析。計量資料以±s 表示,采用獨立樣本t檢驗;計數資料以頻數和百分比(%)表示,組間比較采用χ2檢驗。Kaplan-Meier 生存曲線用于繪制新生小鼠生存情況。P<0.05 表示差異有統(tǒng)計學意義。
2 結果
2.1 克拉霉素治療對早產和新生小鼠死亡的影響
與對照組相比,通過克拉霉素處理的雌鼠妊娠期延長。實驗組早產率為7.13%(1/14);對照組早產率為46.15%(6/13),2 組相比差異有統(tǒng)計學意義(P=0.033)。Kaplan-Meier 生存曲線分析結果顯示,與對照組相比,實驗組中有更大比例的新生小鼠能夠存活到3 周齡,如圖1 所示(P=0.031)。2 組新生小鼠的體重在第1、2、3 周均差異無統(tǒng)計學意義(P>0.05)。見表2。
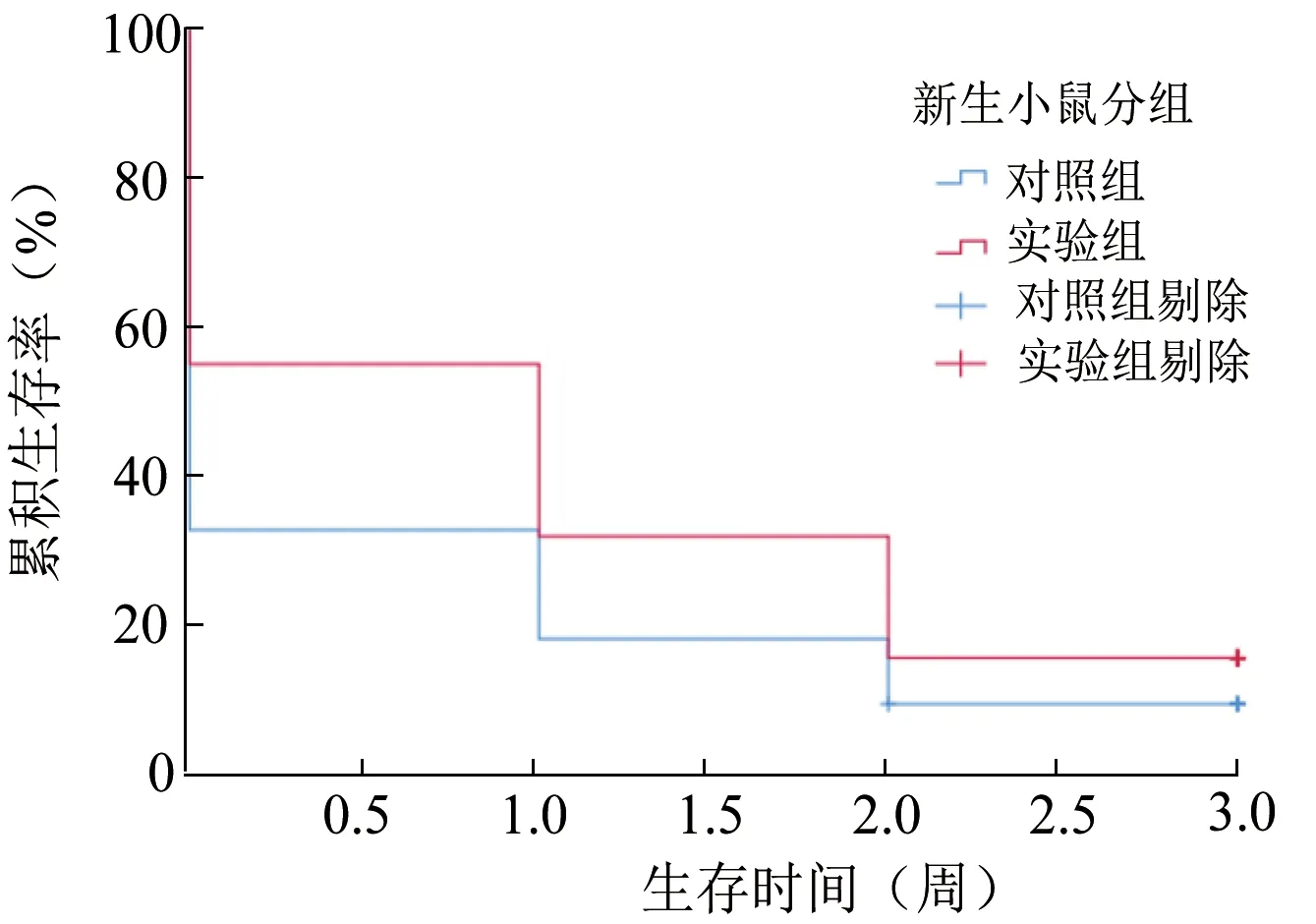
圖1 新生小鼠生存分析
表2 對照組和實驗組第1、2、3 周齡新生小鼠體重情況(±s)
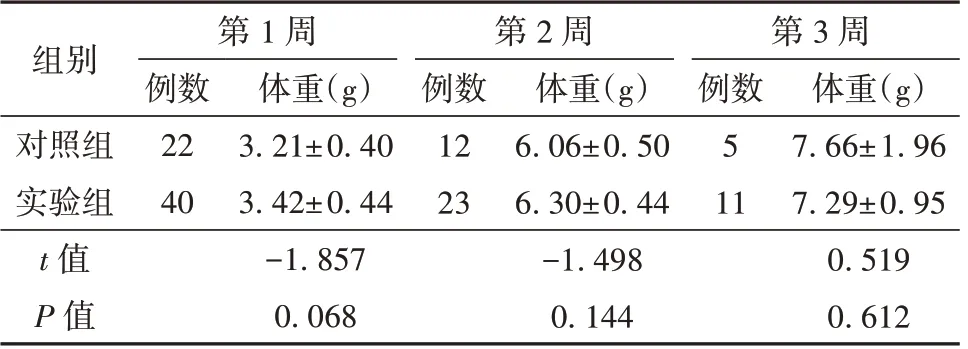
表2 對照組和實驗組第1、2、3 周齡新生小鼠體重情況(±s)
組別對照組實驗組t 值P 值第1 周第2 周第3 周例數22 40體重(g)3.21±0.40 3.42±0.44-1.857 0.068例數12 23體重(g)6.06±0.50 6.30±0.44-1.498 0.144例數5 11體重(g)7.66±1.96 7.29±0.95 0.519 0.612
2.2 克拉霉素治療對分娩相關炎癥因子基因表達水平的影響
分娩是通過子宮收縮、宮頸擴張、胎膜以及子宮蛻膜等共同作用發(fā)生的。實驗組雌鼠與對照組雌鼠相比,實驗組的炎癥因子基因IL-1α、IL-1β 和干擾素-γ(interferon gamma, IFNG)在子宮的表達水平降低;在子宮頸中間隙連接蛋白α-1 基因(gap junction alpha-1 protein, GJA1)和基質金屬蛋白酶9基因(matrix metalloprotein 9, MMP-9)的表達明顯降低;在胎膜中,核因子κB(nuclear factor kappa-lightchain-enhancer of activated B cell, NF-κB)和半胱天冬氨酸蛋白酶11(caspase 11, CASP-11)的表達也有所下降;在蛻膜中IL-1α、IL12B、CCL22、前列腺素內過氧化物合酶(prostaglandin-endoperoxide synthase 2, PTGS2)和催產素受體基因(oxytocin receptor, Oxtr)的表達降低,IL10 的表達增加。見表3。
表3 雌鼠子宮、子宮頸、胎膜、蛻膜相關炎癥基因表達水平(±s)
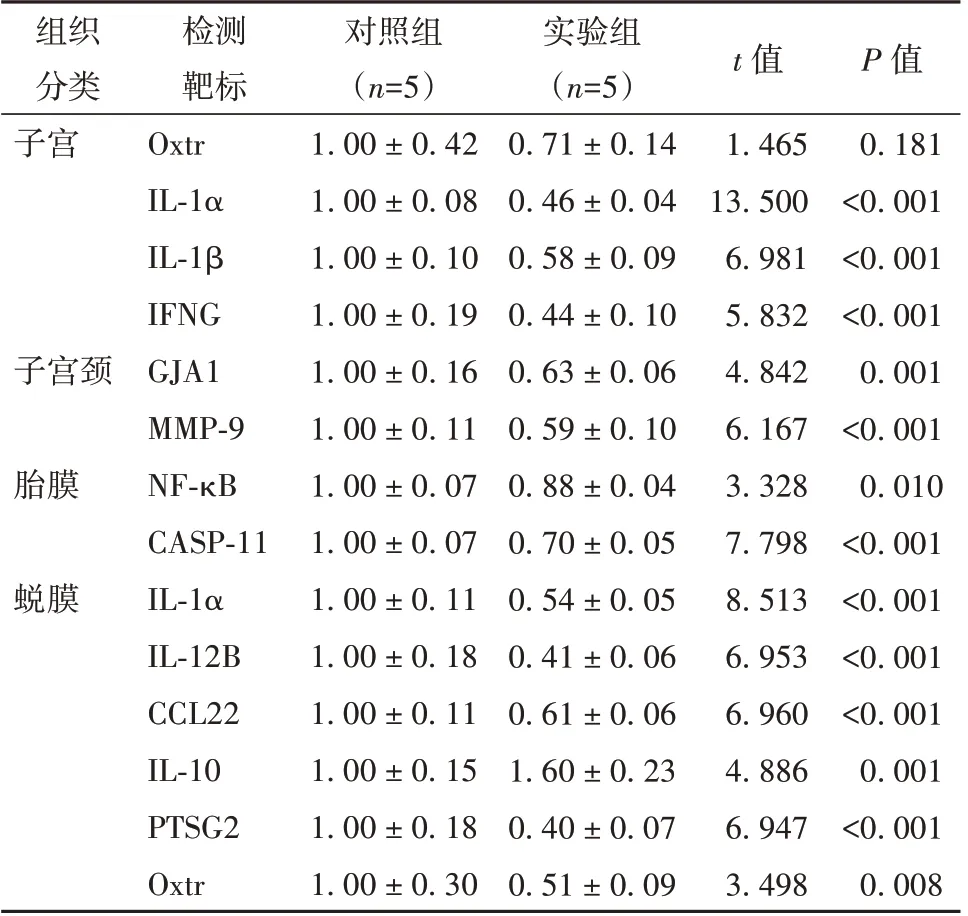
表3 雌鼠子宮、子宮頸、胎膜、蛻膜相關炎癥基因表達水平(±s)
注:OXTR 為催產素受體,IL-1α 為白細胞介素-1α,IL-1β 為白細胞介素-1β,IFNG 為干擾素-γ,GJA1 為縫隙連接蛋白α1,MMP-9為基質金屬蛋白酶-9,CCL22 為C-C 基序趨化因子配體22,IL-10 為白細胞介素-10,PTSG2 為前列腺素內過氧化物合酶2,NF-κB 為核因子κB,CASP-11 為半胱天冬氨酸蛋白酶11
組織分類子宮檢測靶標Oxtr IL-1α IL-1β IFNG GJA1 MMP-9 NF-κB CASP-11 IL-1α IL-12B CCL22 IL-10 PTSG2 Oxtr對照組(n=5)1.00 ± 0.42 1.00 ± 0.08 1.00 ± 0.10 1.00 ± 0.19 1.00 ± 0.16 1.00 ± 0.11 1.00 ± 0.07 1.00 ± 0.07 1.00 ± 0.11 1.00 ± 0.18 1.00 ± 0.11 1.00 ± 0.15 1.00 ± 0.18 1.00 ± 0.30實驗組(n=5)0.71 ± 0.14 0.46 ± 0.04 0.58 ± 0.09 0.44 ± 0.10 0.63 ± 0.06 0.59 ± 0.10 0.88 ± 0.04 0.70 ± 0.05 0.54 ± 0.05 0.41 ± 0.06 0.61 ± 0.06 1.60 ± 0.23 0.40 ± 0.07 0.51 ± 0.09 P 值0.181<0.001<0.001<0.001 0.001<0.001 0.010<0.001<0.001<0.001<0.001 0.001<0.001 0.008子宮頸胎膜蛻膜t 值1.465 13.500 6.981 5.832 4.842 6.167 3.328 7.798 8.513 6.953 6.960 4.886 6.947 3.498
2.3 克拉霉素治療對雌鼠羊膜腔內炎癥因子濃度變化的影響
實驗組和對照組雌鼠羊水中所評估的所有炎癥因子濃度如表4 所示,2 組雌鼠羊水中的IL-6、IL-1β、TNF、IL-1α、IL-10、IFNG、CCL5、CXCL10 濃度相比,差異無統(tǒng)計學意義(P>0.05)。
表4 雌鼠羊水中相關細胞因子濃度(pg/ml, ±s)
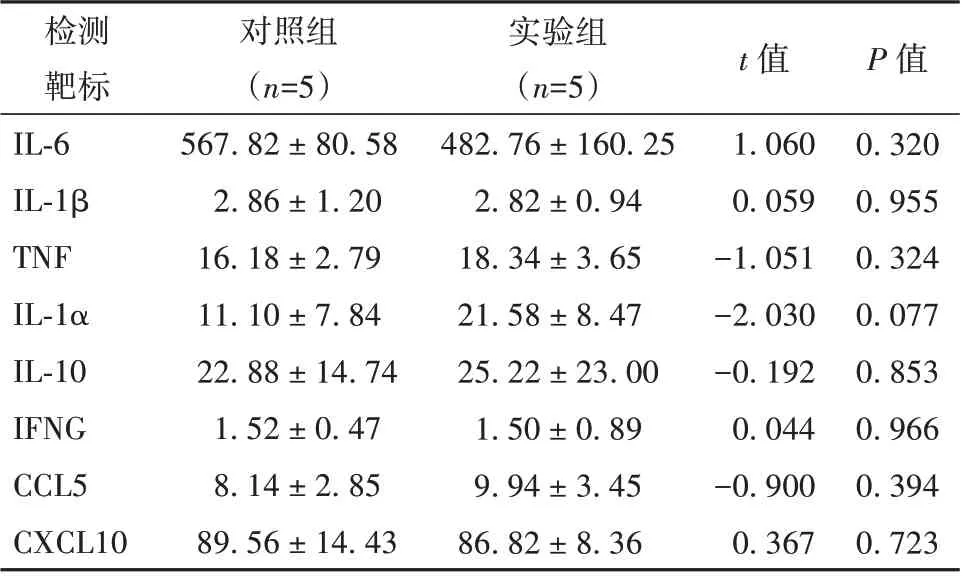
表4 雌鼠羊水中相關細胞因子濃度(pg/ml, ±s)
注:IL-6 為白細胞介素6,IL-1β 為白細胞介素1 亞單位β,TNF為腫瘤壞死因子,IL-1α 為白細胞介素1α,IL-10 為白細胞介素10,IFNG 為干擾素γ,CCL5 為C-C 型趨化因子5,CXCL10 為C-X-C 型趨化因子10
檢測靶標IL-6 IL-1β TNF IL-1α IL-10 IFNG CCL5 CXCL10對照組(n=5)567.82 ± 80.58 2.86 ± 1.20 16.18 ± 2.79 11.10 ± 7.84 22.88 ± 14.74 1.52 ± 0.47 8.14 ± 2.85 89.56 ± 14.43實驗組(n=5)482.76 ± 160.25 2.82 ± 0.94 18.34 ± 3.65 21.58 ± 8.47 25.22 ± 23.00 1.50 ± 0.89 9.94 ± 3.45 86.82 ± 8.36 P 值0.320 0.955 0.324 0.077 0.853 0.966 0.394 0.723 t 值1.060 0.059-1.051-2.030-0.192 0.044-0.900 0.367
2.4 克拉霉素治療對雌鼠胎盤炎癥因子表達水平的影響
克拉霉素治療對雌鼠胎盤的影響如表5 所示。相比于對照組雌鼠,實驗組雌鼠胎盤組織中炎癥因子基因IL-6 和TNF 降低(P<0.05)。此外,炎癥因子的多個轉錄物包括IL-12B、趨化因子配體CCL3、CCL5、CCL22、CXCL9、CXCL10、Toll 樣受體9(Tolllike receptor 9, TLR9)和含核苷酸結合寡聚化域蛋白1(nucleotide-binding oligomerization domain 1,NOD1)在實驗組雌鼠胎盤中也出現(xiàn)下調(P<0.05)。
表5 雌鼠胎盤中炎癥因子基因的表達(±s)

表5 雌鼠胎盤中炎癥因子基因的表達(±s)
注:IL-6 為白細胞介素6,TNF 為腫瘤壞死因子,IL-12B 為白細胞介素12 亞單位β,CCL3 為C-C 型趨化因子3,CCL5 為C-C 型趨化因子5,CCL22 為C-C 型趨化因子22,CXCL9 為C-X-C 型趨化因子9,CXCL10 為C-X-C 型趨化因子10,TLR9 為Toll 樣受體9,NOD為核苷酸結合寡聚化結構域
檢測靶標IL-6 TNF IL-12B CCL3 CCL5 CCL22 CXCL9 CXCL10 TLR9 NOD1對照組(n=5)1.00 ± 0.21 1.00 ± 0.07 1.00 ± 0.09 1.00 ± 0.15 1.00 ± 0.16 1.00 ± 0.14 1.00 ± 0.16 1.00 ± 0.08 1.00 ± 0.05 1.00 ± 0.07實驗組(n=5)0.55 ± 0.04 0.54 ± 0.10 0.51 ± 0.08 0.60 ± 0.06 0.54 ± 0.07 0.47 ± 0.10 0.51 ± 0.06 0.63 ± 0.06 0.74 ± 0.06 0.72 ± 0.05 P 值0.043 0.011 0.017 0.044 0.029 0.028 0.039<0.001 0.009 0.010 t 值2.401 3.303 2.997 2.391 2.662 2.667 2.470 8.273 3.435 3.342
2.5 克拉霉素治療對小鼠胎兒體內器官炎癥因子表達水平的影響
克拉霉素治療對小鼠胎兒的影響如表6 所示,相比于對照組,實驗組小鼠胎兒的胎肺中IL-12B,胎腸中NF-κB2、IFNG、CCL5、CXCL9、TLR4 和TLR9,胎肝中IL-1α、TNF、CASP-1、CASP-11、NOD1、CCL5、CCL22、CXCL9、CXCL10,以及胎脾中IL-6、IL-18 的表達水平均出現(xiàn)明顯下調(P<0.05)。
表6 實驗組小鼠胎兒的肺、腸、肝臟和脾臟相關炎癥因子基因表達水平(±s)
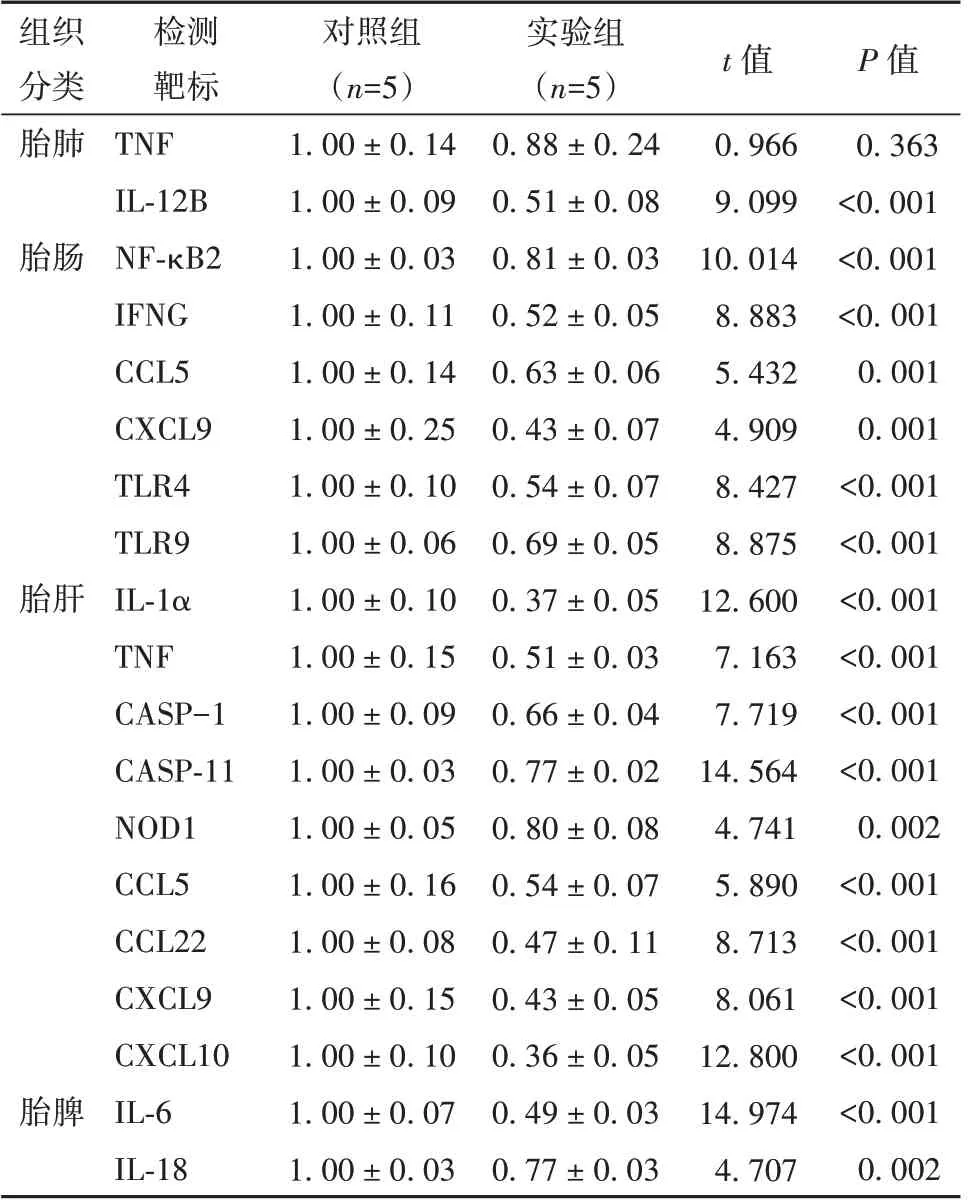
表6 實驗組小鼠胎兒的肺、腸、肝臟和脾臟相關炎癥因子基因表達水平(±s)
注:TNF 為腫瘤壞死因子,IL-12B 為白細胞介素12 亞單位β,NF-κB2 為核因子κB2 亞單位,IFNG 為干擾素γ,CCL5 為C-C 基序趨化因子配體5,CXCL9 為C-X-C 基序趨化因子配體9,TLR4 為Toll 樣受體4,TLR9 為Toll 樣受體9,IL-1α 為白細胞介素1α,CASP-1 為半胱天冬氨酸蛋白酶1,CASP-11 為半胱天冬氨酸蛋白酶11,NOD1 為核苷酸結合寡聚化結構域1,CCL22 為C-C 基序趨化因子配體22,CXCL10 為C-X-C 基序趨化因子配體10
組織分類胎肺檢測靶標TNF IL-12B NF-κB2 IFNG CCL5 CXCL9 TLR4 TLR9 IL-1α TNF CASP-1 CASP-11 NOD1 CCL5 CCL22 CXCL9 CXCL10 IL-6 IL-18對照組(n=5)1.00 ± 0.14 1.00 ± 0.09 1.00 ± 0.03 1.00 ± 0.11 1.00 ± 0.14 1.00 ± 0.25 1.00 ± 0.10 1.00 ± 0.06 1.00 ± 0.10 1.00 ± 0.15 1.00 ± 0.09 1.00 ± 0.03 1.00 ± 0.05 1.00 ± 0.16 1.00 ± 0.08 1.00 ± 0.15 1.00 ± 0.10 1.00 ± 0.07 1.00 ± 0.03實驗組(n=5)0.88 ± 0.24 0.51 ± 0.08 0.81 ± 0.03 0.52 ± 0.05 0.63 ± 0.06 0.43 ± 0.07 0.54 ± 0.07 0.69 ± 0.05 0.37 ± 0.05 0.51 ± 0.03 0.66 ± 0.04 0.77 ± 0.02 0.80 ± 0.08 0.54 ± 0.07 0.47 ± 0.11 0.43 ± 0.05 0.36 ± 0.05 0.49 ± 0.03 0.77 ± 0.03 t 值0.966 9.099 10.014 8.883 5.432 4.909 8.427 8.875 12.600 7.163 7.719 14.564 4.741 5.890 8.713 8.061 12.800 14.974 4.707 P 值0.363<0.001<0.001<0.001 0.001 0.001<0.001<0.001<0.001<0.001<0.001<0.001 0.002<0.001<0.001<0.001<0.001<0.001 0.002胎腸胎肝胎脾
3 討論
早產是一種包括多種病因的綜合征,也是全世界孕產婦及新生兒發(fā)病率和死亡率的主要原因[21]。HMGB1 作為一種炎癥介質,可以通過結合不同的受體,如RAGE、TLR4、TLR9 等,激活不同的信號通路,如NF-κB、MAPK、PI3K/Akt 等,誘導羊膜-胎盤-子宮組織中的炎癥因子表達或釋放,從而破壞羊膜完整性、增加羊水感染風險、促進宮頸成熟和子宮收縮[10]。有研究表明,特定的抗生素(如克拉霉素)對羊膜腔內感染的女性表現(xiàn)出抗微生物特性以及抗炎作用[12-13]。本研究旨在探究克拉霉素是否能抑制HMGB1 引發(fā)的炎癥反應,以及其對降低早產和新生小鼠不良結局的影響。實驗結果顯示,克拉霉素顯著降低了早產率和提高了新生小鼠的存活率,從而驗證了本研究的目標和預期。
本研究結果顯示,通過克拉霉素處理的實驗組雌鼠妊娠期延長,早產率為7.13%(1/14 只),遠低于未用克拉霉素治療對照組雌鼠的早產率46.15%(6/13 只)。此外還發(fā)現(xiàn)接受克拉霉素干預的雌鼠中有更大比例的新生小鼠能夠存活到3 周齡。這表明克拉霉素治療可預防羊膜腔內警報素HMGB1誘導的早產和新生小鼠死亡。本研究也探討了克拉霉素預防早產和新生小鼠不良結局的機制。分娩通過子宮收縮、宮頸擴張、胎膜以及子宮蛻膜等共同作用,還涉及多種促炎介質的表達[22]。本研究通過測定對照組與實驗組雌鼠子宮、子宮頸、胎膜和蛻膜相關炎癥因子基因表達來判斷克拉霉素對分娩共同途徑是否有影響。實驗組的炎癥因子基因IL-1α、IL-1β 和IFNG 在子宮的表達水平降低;在子宮頸中GJA1 和MMP-9 的表達明顯降低;在胎膜中,CASP-11 的表達也有所下降;在蛻膜中IL-1α、IL-12B、CCL22、PTGS2、Oxtr 的表達降低,IL-10 的表達增加。這表明克拉霉素在宮內組織中發(fā)揮了抗炎作用,影響到分娩的共同途徑。Oxtr 以及炎癥因子基因IL-1α、IL-1β 和IFNG 是子宮收縮的關鍵調節(jié)因子[23],GJA1 和MMP-9 是參與宮頸收縮和成熟的關鍵轉錄物[24],有研究表明克拉霉素通過降低收縮性相關蛋白的基因表達來干擾常見的分娩途徑,這些蛋白在早產和足月分娩時會增加[25]。克拉霉素能夠通過干擾線粒體蛋白4-硝基苯基磷酸酶結構域和非神經元突觸體相關蛋白25 樣蛋白同源物-1和-2 來抑制NF-κB 介導的促炎細胞因子的產生[26]。這些數據表明克拉霉素主要通過干擾子宮內母體組織中的炎癥反應來預防早產。本研究不僅提供了一種潛在的治療早產的方法,而且還揭示了克拉霉素在抑制炎癥反應方面的作用機制。這一發(fā)現(xiàn)具有重要的理論價值,同時也為臨床醫(yī)學提供了新的治療方案。
為了探究克拉霉素對雌鼠羊水和胎盤的影響,本次研究對對照組和實驗組雌鼠的羊水和胎盤進行了檢測。與國內外類似的研究相比,本研究明確了克拉霉素對HMGB1 的抑制作用,并詳細探究了其作用機制。這一點是本研究的主要創(chuàng)新之處。結果顯示,使用克拉霉素治療的實驗組雌鼠和未用克拉霉素治療的對照組雌鼠羊水中評估的所有細胞因子濃度相比沒有顯著差異。實驗組雌鼠胎盤組織中炎癥因子的多個轉錄物也出現(xiàn)明顯下調。這表明克拉霉素改善新生小鼠結局并非完全通過降低羊膜腔內炎癥因子濃度來實現(xiàn),但克拉霉素可減少羊膜腔內HMGB1 誘導的胎盤炎癥。這一結果可能與克拉霉素藥物本身有關。大環(huán)內酯類藥物如阿奇霉素或者紅霉素治療能夠減少羊膜腔、胎兒肺和/或胎兒皮膚中脲原體誘導的炎癥標志物[27]。此外,克拉霉素已成功用于減輕肺部病變患者的炎癥,如哮喘、支氣管擴張和囊性纖維化[28]。總的來說,這些數據表明克拉霉素提高新生小鼠存活率的機制包括抑制胎兒器官的炎癥。但需要進一步的論證來研究接受克拉霉素治療的雌鼠所生的新生兒是否具有免疫能力。
克拉霉素作為一種廣譜的大環(huán)內酯類抗生素,除了具有抗菌作用外,還具有抗炎和免疫調節(jié)作用。克拉霉素針對HMGB1 的直接分子機制尚不完全清楚,但有一些研究提出了一些可能的途徑和機制,例如克拉霉素可以抑制LPS 誘導的巨噬細胞中NF-κB 信號通路的激活,從而降低其下游基因HMGB1 的表達。本研究中也發(fā)現(xiàn)克拉霉素治療對雌鼠胎兒的胎腸中NF-κB2 表達水平均明顯下調。后續(xù)可以進一步從NF-κB 信號通路來研究克拉霉素針對HMGB1 的分子機制。本研究局限于動物模型,因此其結果可能不能完全適用于人類。此外,樣本量相對較小,可能存在統(tǒng)計誤差。未來的研究應進一步探究克拉霉素在不同炎癥模型中的作用,以及其在人體內的安全性和有效性。這將有助于更全面地了解克拉霉素的治療潛力和應用范圍。
綜上所述,在無菌羊膜腔內炎癥的情況下,克拉霉素可用于預防早產和提高新生小鼠存活率。克拉霉素預防早產的機制涉及干擾子宮內母體組織(子宮蛻膜和子宮頸)中的炎癥級聯(lián)反應來預防早產。此外,克拉霉素在抑制胎兒炎癥反應方面表現(xiàn)出了明顯作用,進而改善了新生小鼠結局。

