老年持續性房顫患者認知衰弱狀況及影響因素研究
方瑋,王光輝,馬建慧,崔蓮,劉麗麗,馬建新
全球人口正在迅速老齡化,與年齡相關的衰弱和認知功能障礙等成為老年醫學領域研究的熱點。認知衰弱[1]是國際老年病協會于2013 年提出的,即排除阿爾茨海默病和其他類型癡呆,同時存在軀體衰弱和認知障礙。研究表明,認知衰弱不僅會增加老年住院患者的不良臨床結局,還會導致更高的致殘率[2-3]。多項研究證實,房顫與衰弱、認知障礙之間有顯著相關性[4-5],但關于房顫與認知衰弱相關性的研究報道尚少。本研究旨在分析老年房顫患者認知衰弱情況及其影響因素,提高臨床對老年房顫患者認知衰弱的早期識別,以期制定有效的干預措施,改善患者預后。
1 對象與方法
1.1 研究對象
選取2020 年1 月至2021 年12 月在解放軍第三○五醫院住院治療、年齡≥65 歲的105 例老年持續性房顫患者作為研究對象。根據Fried 衰弱表型(frailty phenotype, FP)和臨床癡呆評定量表(clinical dementia rating scale, CDR)進行評估,若軀體衰弱和認知障礙同時存在則定義為認知衰弱。本研究中認知衰弱的定義為排除阿爾茨海默病或其他類型癡呆,同時存在衰弱(FP≥3 分)和認知障礙(CDR=0.5 分)。本研究中105 例患者按是否存在認知衰弱劃分為認知衰弱組(30 例)和無認知衰弱組(75 例)。2 組患者性別、文化水平、婚姻狀況、獨居情況、吸煙和飲酒情況比較,差異無統計學意義(P>0.05),具有可比性。見表1。
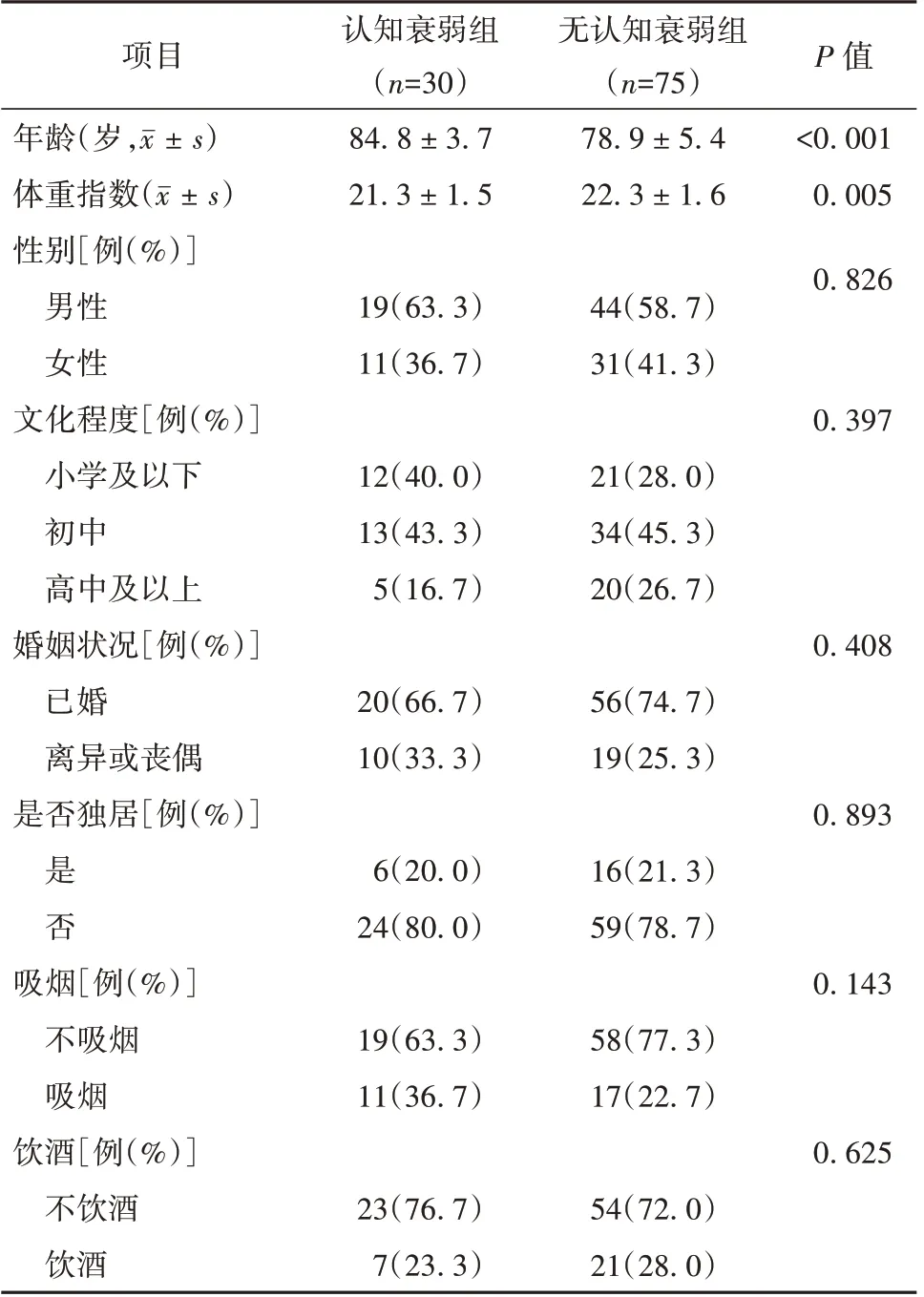
表1 認知衰弱組與無認知衰弱組患者基本資料比較
1.1.1 納入標準 (1)年齡≥65 歲;(2)依據心房顫動診斷標準[6],經心電圖或動態心電圖檢查為持續性房顫患者。(3)意識清楚,能正常溝通交流患者;(4)簽訂知情同意書并自愿加入研究的住院患者。本研究經醫院倫理委員會批準(18BJZ44)。
1.1.2 排除標準 (1)感染急性期或疾病終末期者;(2)溝通障礙,生活不能自理者;(3)已明確診斷為癡呆或精神疾病者。
1.2 研究方法
1.2.1 一般臨床資料 采用自行設計的問卷,由專業人員收集患者年齡、體重指數(body mass index,BMI)、性別、文化水平、婚姻狀態、獨居狀況、吸煙史、飲酒史等,詳細詢問既往史,如慢性病患病情況、跌倒史、多重用藥史(目前服用藥物≥5 種),采集血常規、肝腎功能、血脂、電解質等檢驗指標,并對所有患者進行老年綜合評估。
1.2.2 老年綜合評估 (1)衰弱評估:采用FP 評估,包括非自主體重下降、乏力、體能消耗下降、行走緩慢、握力下降5 項指標。符合上述3 項指標以上提示存在衰弱。(2)認知功能評估:采用CDR 評估,該量表由社會認知、記憶力、定向力、判斷問題及解決問題能力、家居生活及業余愛好、個人生活自理能力等6 個方面內容構成。本研究中CDR 評分為0.5 分即判定為認知障礙。(3)日常活動能力評估:采用Barthel 指數評定量表評估,共10 個條目,依據患者依賴他人程度進行評分。評分原則:100 分為生活自理,不需依賴;61~99 分表示有輕度依賴;≤60 分表示有中重度依賴。(4)營養狀況評估:采用營養風險篩查2002 版(nutritional risk screening 2002, NRS2002)評估,總分≥3 分提示存在營養不良風險或營養不良。(5)抑郁狀態評估:采用簡易老年抑郁量表(geriatric depression scale, GDS-5)評估,該量表包括5 個條目,總分為5 分。≥2 分提示存在抑郁。(6)肌少癥評估:采用改良版的簡易5 項評分問卷評估,總分20 分,≥11 分即肌肉質量減少(10 分)且肌肉功能下降(至少1 分)者被診斷為肌少癥。(7)睡眠評估:采用阿森斯失眠評估量表(Athens insomnia scale, AIS)評估,總分24 分。AIS評分標準:<4 分為無睡眠障礙、4~6 分為可疑失眠,>6 分為存在失眠。
1.3 統計學處理
應用SPSS 20.0 軟件分析所得數據,符合正態分布的計量資料以±s 表示,組間比較采用t檢驗,非正態分布的以中位數[M(P25,P75)]表示,組間比較采用非參數秩和檢驗;計數資料以例數和百分比(%)表示,組間比較采用χ2檢驗或Fisher 確切概率法。采用二元Logistic 回歸分析預測老年持續性房顫患者合并認知衰弱的獨立影響因素。P<0.05表示差異有統計學意義。
2 結果
2.1 認知衰弱組與無認知衰弱組實驗室指標比較
與無認知衰弱組比較,認知衰弱組的白蛋白水平更低,差異有統計學意義(P<0.05),其余實驗室指標比較差異均無統計學意義(P>0.05)。見表2。
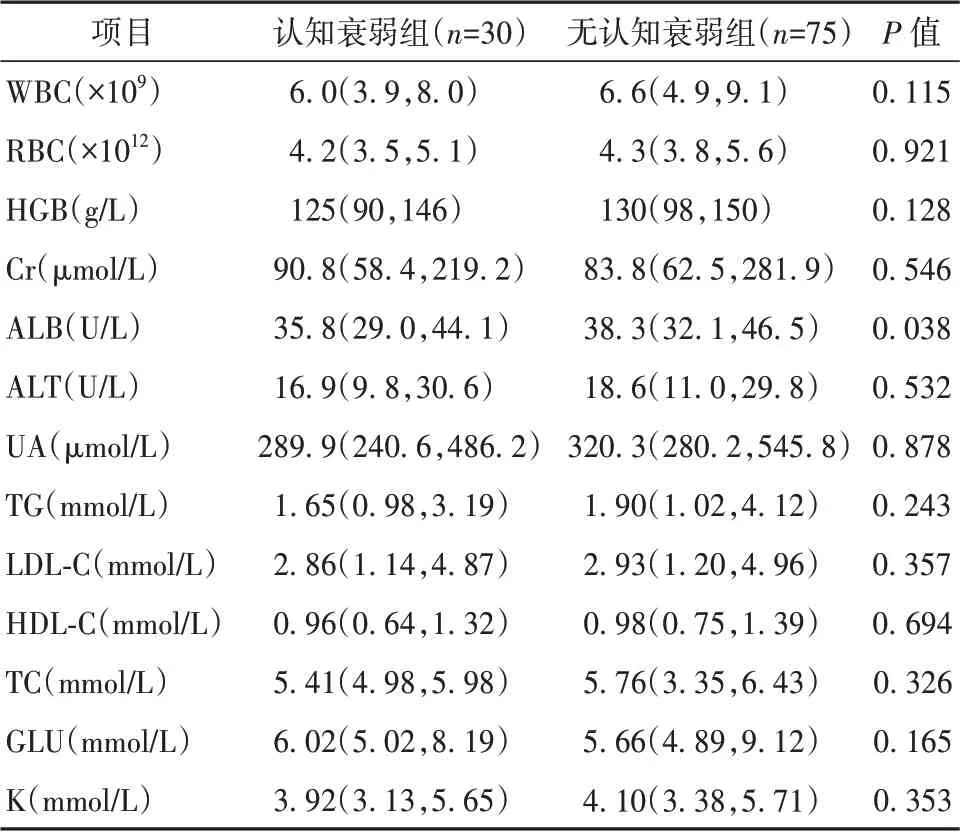
表2 認知衰弱組與無認知衰弱組實驗室指標比較[M(P25,P75)]
2.2 認知衰弱組與無認知衰弱組慢病患病情況比較
與無認知衰弱組比較,認知衰弱組中高血壓、2 型糖尿病占比偏高,差異有統計學意義(P<0.05)。其他慢病占比比較差異無統計學意義(P>0.05),見表3。
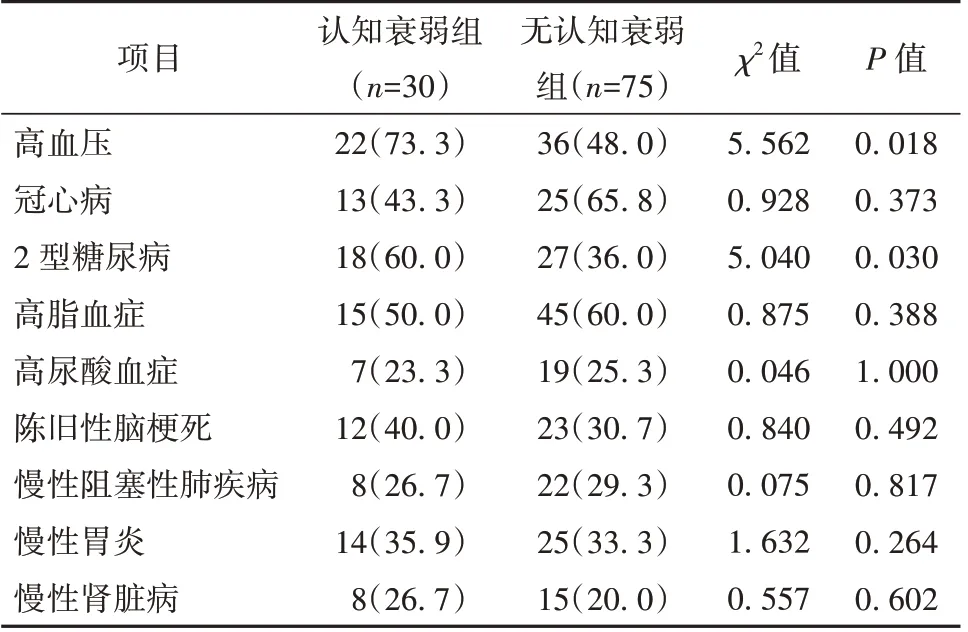
表3 認知衰弱組與無認知衰弱組慢病患病情況比較[例(%)]
2.3 認知衰弱組與無認知衰弱組老年患者綜合評估情況比較
與無認知衰弱組比較,認知衰弱組中日常活動能力依賴程度、營養不良風險、抑郁、睡眠障礙、肌少癥、跌倒史、多重用藥史等占比更高,差異有統計學意義(P<0.05)。見表4。
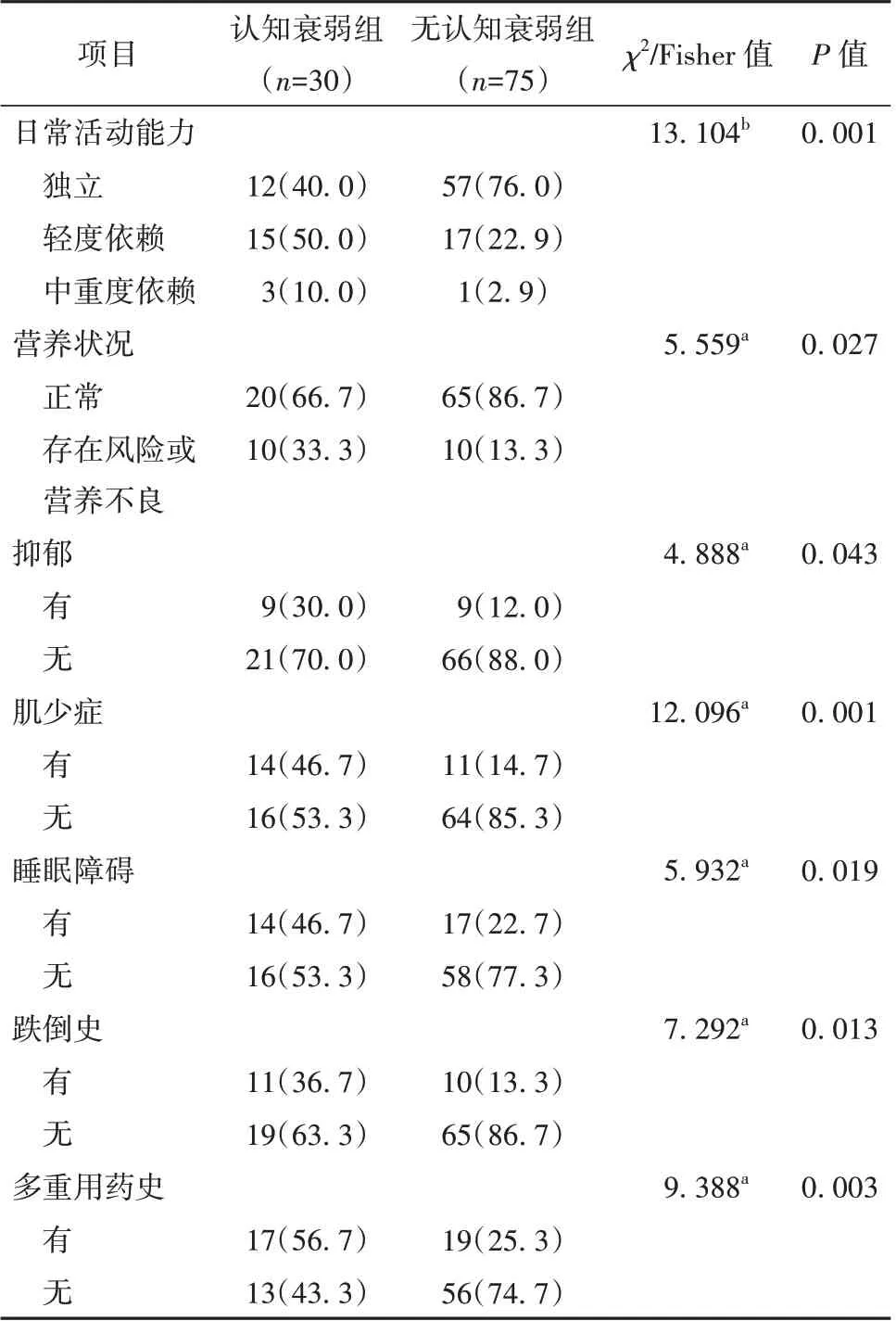
表4 認知衰弱組與無認知衰弱組老年患者綜合評估情況比較[例(%)]
2.4 Logistic 回歸分析預測認知衰弱的危險因素
以有無認知衰弱為因變量,單因素分析中有統計學意義的影響因素為自變量進行二元Logistic 回歸分析。結果顯示,年齡、肌少癥、抑郁是老年持續性房顫患者發生認知衰弱的獨立影響因素。見表5。
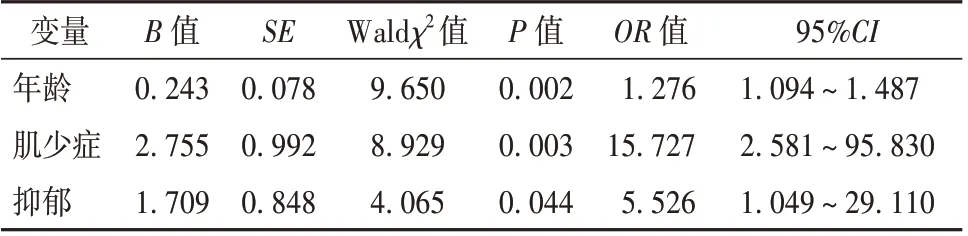
表5 老年持續性房顫患者認知衰弱影響因素的Logistic 回歸分析
3 討論
既往研究報道,老年房顫患者發生衰弱、認知障礙的風險增高[7],而與單獨的衰弱或認知功能障礙相比較,認知衰弱使老年人不良事件結局的風險顯著增加[8]。本研究中,老年持續性房顫患者認知衰弱發病率為33.3%,占比較高。因此,了解老年房顫患者發生認知衰弱的影響因素,早期識別認知衰弱人群,對改善患者預后有著重要意義。
認知衰弱受年齡、共病等多種因素影響[9]。本研究結果顯示,高齡、高血壓、糖尿病、低白蛋白、營養不良、日常活動能力依賴程度高、抑郁、睡眠障礙、肌少癥、跌倒史、多重用藥史均為老年持續性房顫患者發生認知衰弱的影響因素。隨著年齡增加,老年人慢病患病率也在增加[10]。慢病可使老年住院患者功能狀態和生活質量下降,加速衰弱的發展;同時,慢病造成的神經、血管損害也會引發認知障礙。本研究中,與無認知衰弱組比較,合并高血壓、糖尿病的老年持續性房顫患者更易發生認知衰弱,與張爽等[11]報道的一致。此外,低白蛋白和營養不良不僅會使體重和肌肉質量減少,還會引起認知功能下降[12]。
既往研究報道,抑郁發病機制與認知衰弱的潛在發病機制有一定相關性[13],老年房顫患者容易合并抑郁不良情緒。肌少癥不僅與軀體衰弱有顯著相關,也是認知障礙的預測因子[14]。本研究Logistic回歸分析顯示,年齡、肌少癥、抑郁是老年持續性房顫患者發生認知衰弱的獨立危險因素。因此,對于高齡、肌少癥患者進行早期干預,在治療基礎病的同時,還應關注老年患者的情緒狀態。
綜上所述,對老年房顫患者,尤其是高齡、合并肌少癥、抑郁的患者,應及早進行老年綜合評估,對認知衰弱影響因素進行篩查,并制定有針對性和個體化的干預措施,預防老年患者認知衰弱的發生與發展。本研究的局限性:(1)研究對象為持續性房顫的住院患者,樣本量小,缺乏代表性;(2)研究方法為橫斷面研究,只能反映各變量與認知衰弱的影響關系,不能反映老年持續性房顫患者合并認知衰弱的不良結局。(3)目前認知衰弱的評估和診斷標準尚無統一標準,可能會對結果產生一定影響。

