可充氟磷酸銅正極材料的合成與表征
孫立志,盧曉鵬,侯宇航,周賢界
可充氟磷酸銅正極材料的合成與表征
孫立志,盧曉鵬,侯宇航,周賢界
(深圳市眾誠達應用材料股份有限公司,廣東深圳 518000)
本文通過優化水熱法,建立一種多氟少水的合成方法,克服了傳統固相法產物不純和合成方法復雜等不足,成功合成了高純度無水的氟磷酸銅材料,并首次表征了材料的可逆充放電性能。電化學測試結果表現出接近理論值(447 mAh/g)的比容量(432 mAh/g)和較好的循環性能,展現了氟磷酸銅材料良好的電化學性能和應用前景。
水熱法正極材料比容量可逆充放電
0 引言
鋰離子電池技術在不斷發展[1?4],研究人員對新型脫嵌材料也在不斷地進行創新設計,但是在高比容量化合物這方面進展緩慢,原因是傳統的脫嵌化合物很難達到超過1個Li的可逆脫嵌,從而使其在應用上存在局限性[5?6]。而轉換型材料則可以充分利用過渡金屬所有的氧化態,從而發揮出較高的比容量[7?9],這也是這類正極材料具備優勢的地方。轉換型材料有很多種,但由于有些過渡金屬的化合物轉化電位較低,不適合用于正極材料中,具有高轉化電位的化合物,如金屬氟化物和聚陰離子銅的化合物,已經作為正極材料報道[10?14]。其中,聚陰離子型正極材料(如LiFePO4材料)由于具備良好的安全性能,環境友好,價格低廉等優點,已成為研究熱點。1976年REA和KOSTINER首次報道了聚陰離子材料Cu2(PO4)F的晶體結構信息[15]。2009年Skrzypczak,Badway和Amatucci等人[16]報道了轉換型Cu2(PO4)F聚陰離子材料可作為一次鋰離子電池正極材料,但未對其可逆循環方面的性能進行研究。Cu2(PO4)F材料的理論比容量高達447 mAh/g,若能對其實現可逆充放過程,其將會成為正極材料領域的潛在熱門材料之一。
本文通過優化傳統的水熱合成方法[17],成功制備了高純度無水Cu2(PO4)F正極材料,并對其微觀結構和電化學性能進行了相關的表征。
1 實驗
1.1 儀器與試劑
實驗所用磷酸二氫銨、硝酸銅、氫氟酸和乙炔黑均為購自不同廠家的市售原料。
球磨機(長沙米琪)用于正極漿料的制備;手套箱(德國布勞恩)用于紐扣式電池的組裝;X射線衍射儀(德國布魯克AXS公司)用于材料晶型的確定;掃描電鏡(日本電子掃描電鏡JSM-IT200)用于測試材料的形貌;熱重分析儀(德國埃爾特TGA Thermostep)用于測定材料的熱穩定性。
1.2 材料的制備
本文通過水熱法合成了Cu2(PO4)F正極材料,下面是這種方法的合成步驟:
1) 先稱取0.575 g磷酸二氫銨和1.88 g硝酸銅放入110℃烘箱中干燥,將2 mL氫氟酸加入20 mL聚四氟乙烯內襯反應釜中,然后將反應釜放入110℃烘箱中除去水,2 h后將原料加入反應釜中,在240℃下反應72 h,水洗至中性,抽濾后于90℃下烘干得到氟磷酸銅(Cu2(PO4)F)。
2) 為了提高Cu2(PO4)F材料的電導率,對材料進行了球磨包碳。方法是:取合成出的Cu2(PO4)F材料0.9 g與0.1 g乙炔黑混合,在瑪瑙球磨罐中球磨5 h,轉速為500 r/min,即可以得到Cu2(PO4)F/C復合材料。
2 結果與討論
2.1 材料的形貌表征
圖1是Cu2(PO4)F材料在不同放大倍數下的SEM圖片,其中圖(a)、圖(b)、圖(c)和圖(d)分別為放大100、175、1000和875倍后的圖。在較低的掃描倍率下,材料呈現較大的不規則塊狀顆粒,粒徑約為幾十微米,結晶度良好。

圖1 不同放大倍數下Cu2(PO4)F材料的SEM圖
2.2 材料的結構表征
圖2是用氟水熱法制得的Cu2(PO4)F材料XRD譜圖的實驗譜、計算譜以及二者的差譜。從圖中可以看出,制得的無水Cu2(PO4)F材料屬于單斜晶系的C2/c空間群(PDF No. 01-70-0201),粉末精修得到的晶胞參數為:a = 12.737 ?、b = 6.182 ?、c = 9.962 ?、β= 119.15、V = 685.06 ?3,與文獻報道的標準Cu2(PO4)F晶胞參數一致[15],圖3為標準Cu2(PO4)F晶體的結構圖。

圖2 Cu2(PO4)F材料的XRD譜圖的精修譜及其實驗譜的差譜

圖3 Cu2(PO4)F材料的晶體結構圖
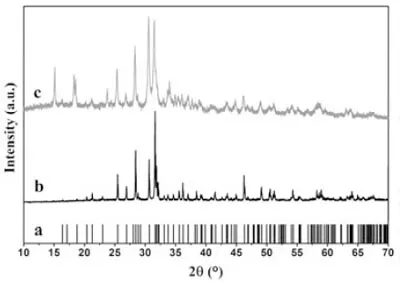
圖4 Cu2(PO4)F和Cu2(PO4)F/C的XRD譜圖
圖4是合成出的Cu2(PO4)F材料和Cu2(PO4)F/C復合材料的XRD譜圖。圖中a是Cu2(PO4)F標準卡片的衍射峰位置,b和c分別為制得的Cu2(PO4)F和Cu2(PO4)F/C復合材料的XRD衍射曲線。從圖中可以看出,制得的Cu2(PO4)F與報道的標準Cu2(PO4)F的衍射指標符合得非常好。另外,Cu2(PO4)F/C復合材料中,大部分相是Cu2(PO4)F,其他衍射峰表示的物相為乙炔黑,通過元素分析測試結果(表1所示)可知,復合材料的碳含量為9.24%。對于電化學性能的表征,本研究是基于材料中具有電化學活性的Cu2(PO4)F的質量來計算。
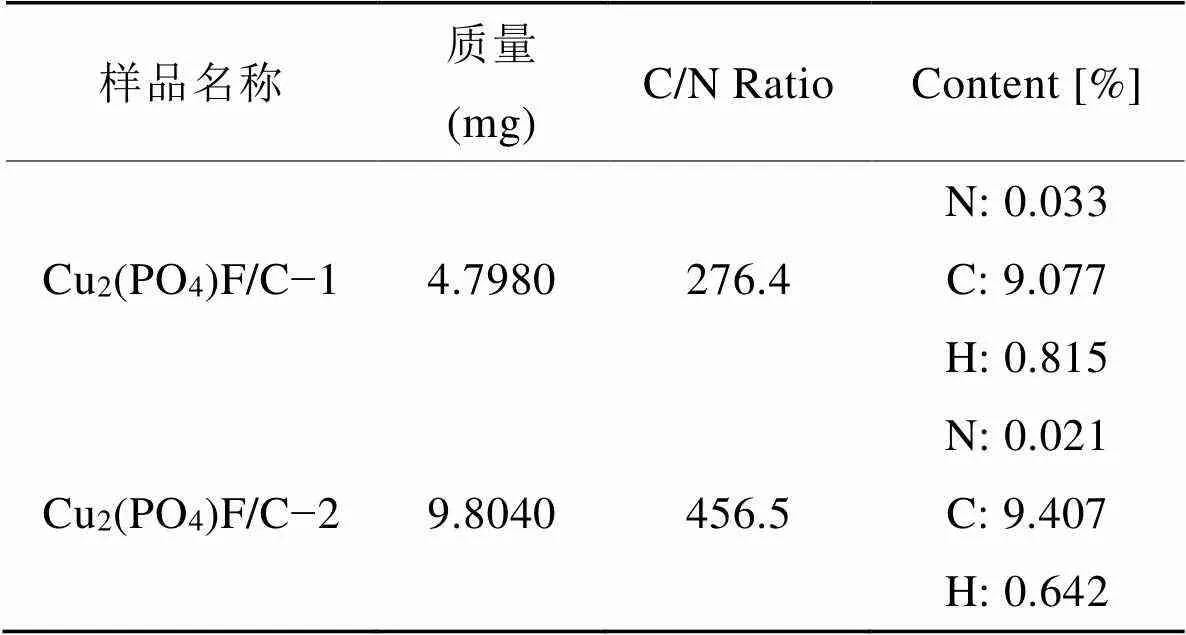
表1 Cu2(PO4)F/C復合材料碳元素含量的元素分析
2.3 材料的紅外表征
實驗采用傅里葉變換紅外光譜法對Cu2(PO4)F進行表征測試,圖5為其紅外光譜圖。查閱相關文獻[18]可知,1022 cm-1以及972 cm-1處最強的吸收峰對應P?O伸縮振動峰,同時629 cm-1、598 cm-1和563 cm-1處較強的吸收峰對應了P?O基團的面外彎曲振動峰。此外,通過紅外譜圖可知實驗得到的Cu2(PO4)F樣品具有不含水和羥基的特征。
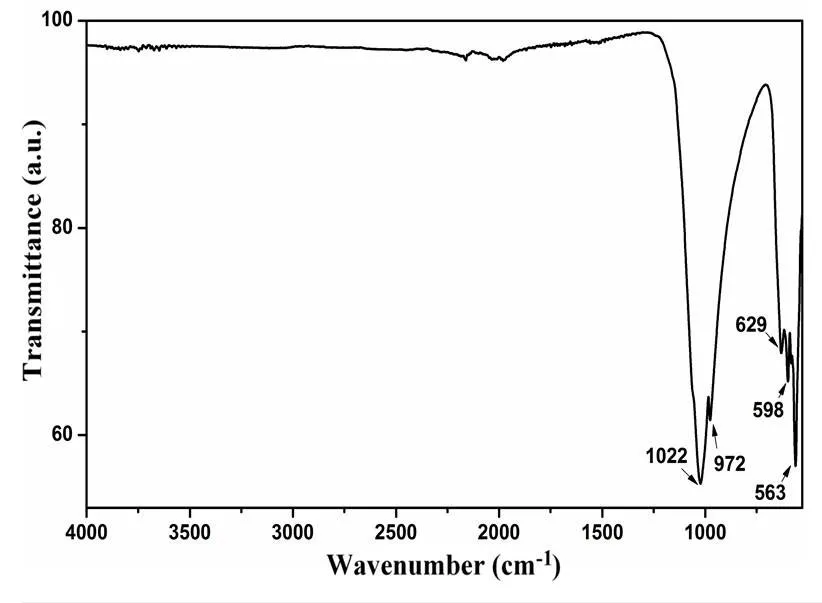
圖5 Cu2(PO4)F材料的紅外光譜圖
2.4 材料的TG-DTA表征
圖6為Cu2(PO4)F材料在空氣中以10℃/min的速率從30℃加熱至500℃的失重曲線。從整個30℃到500℃的溫度范圍中的TG曲線來看,材料出現0.12 %的失重,可以認為與理論上的不失重相吻合。進一步證明了實驗得到的Cu2(PO4)F樣品具有不含水和羥基的特征。
2.5 材料的電化學性能表征
實驗首次對氟水熱法合成的Cu2(PO4)F和Cu2(PO4)F/C復合材料進行了充放電測試。圖7為在電流密度為40 mA/g下,Cu2(PO4)F材料前兩圈的充放電曲線;圖8為在電流密度為40 mA/g下,Cu2(PO4)F/C復合材料前兩圈的充放電曲線。
未包覆C的Cu2(PO4)F材料在首圈放電比容量高達423 mAh/g,與理論的比容量447 mAh/g相差不大,說明Cu2(PO4)F中的Cu已經全部轉換為單質Cu,伴隨著4個Li的轉換。但在第二圈放電時,放電容量只有175 mAh/g,說明未包覆C的材料可逆性還有待改善。第一圈的放電電壓平臺是2.4 V,比較平穩,而第二圈放電平臺為2.8 V,但很快就傾斜下降,說明第一圈與第二圈材料的放電反應并不是完全相同的,具體過程有待進一步實驗探究。
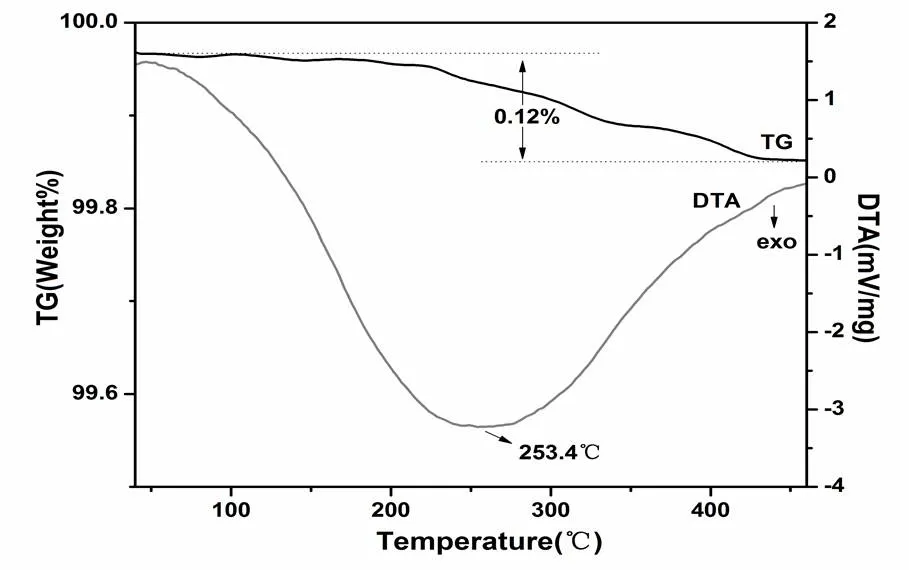
圖6 Cu2(PO4)F材料在空氣中的熱力學曲線
包覆C的Cu2(PO4)F/C復合材料首圈放電比容量高達432 mAh/g,高于未包覆C的Cu2(PO4)F材料,并且在第二圈放電時,材料表現出了良好的可逆性,放電容量高達402 mAh/g,這也是我們首次看到關于氟磷酸銅材料具有電化學可逆充放電性能的實例。第一圈和第二圈的放電電壓平臺都在2.5 V左右,比較平穩,相比較未包覆C的Cu2(PO4)F材料有了很大的改善,這些可能與碳包覆后電子電導得到了提高有關。
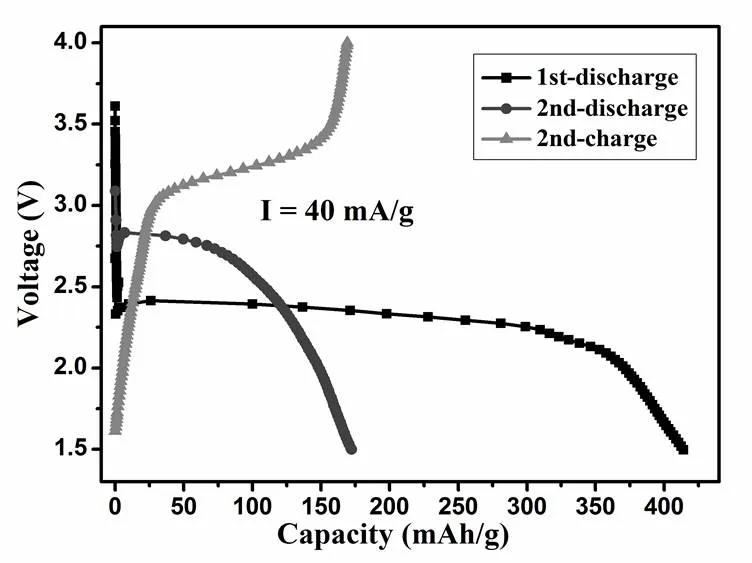
圖7 Cu2(PO4)F材料前兩圈的充放電曲線
實驗也首次對Cu2(PO4)F材料的可逆循環性能進行了測試。圖9是Cu2(PO4)F材料在不同電流密度下前5圈的電化學循環性能曲線。圖10是包覆C的Cu2(PO4)F/C復合材料在不同電流密度下前5圈的電化學循性能曲線。
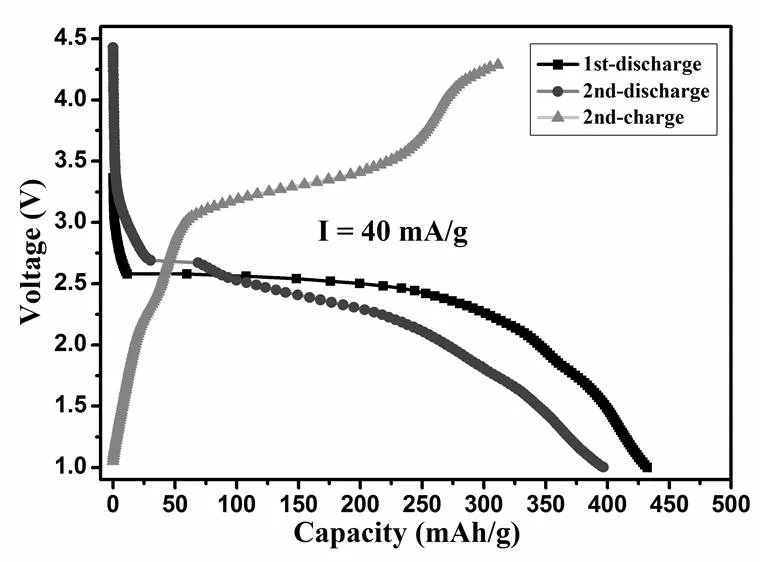
圖8 Cu2(PO4)F/C復合材料前兩圈的充放電曲線
從圖9可以看出,未包覆C的Cu2(PO4)F材料在40 mA/g的電流密度下,首圈放電容量為423 mAh/g,并且在第二圈放電時僅有175 mAh/g的比容量。當在不同電流密度下循環充放電時,不管是小電流密度還是大電流密度都表現得比較差,當循環至第5圈之后,全部電流密度下的比容量都低于50 mAh/g。
而如圖10所示,包覆C的Cu2(PO4)F/C復合材料性能比較優異。在40 mA/g的電流密度下充放電時,第二圈的放電比容量高達402 mAh/g,5圈之后材料的放電比容量仍能達到250 mAh/g,容量保持率為62.5%。電流密度提高2倍和10倍時,前幾圈放電比容量有所下降,但循環性能較40 mA/g時有所改善,說明在小電流密度下深度充放電時,反應的可逆進行程度比較低。
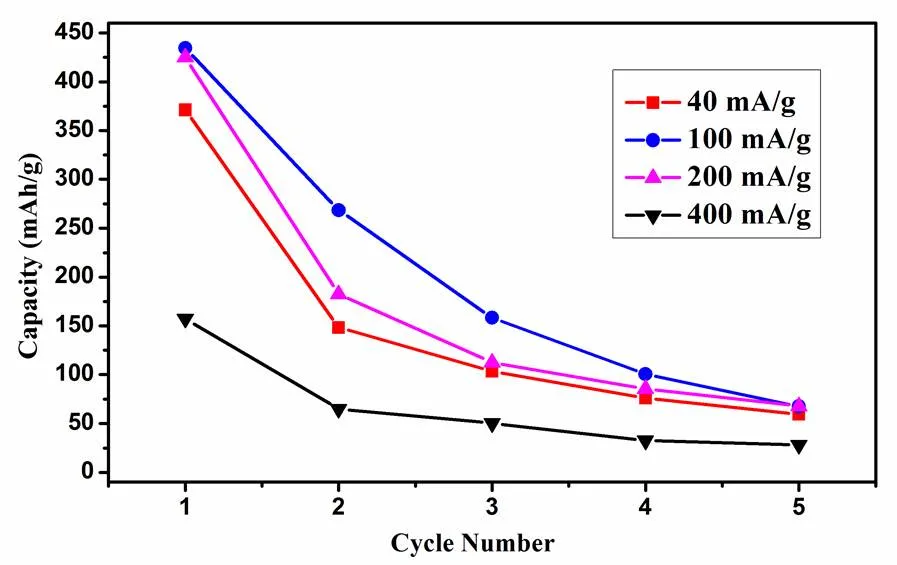
圖9 Cu2(PO4)F材料的電化學循環性能曲線
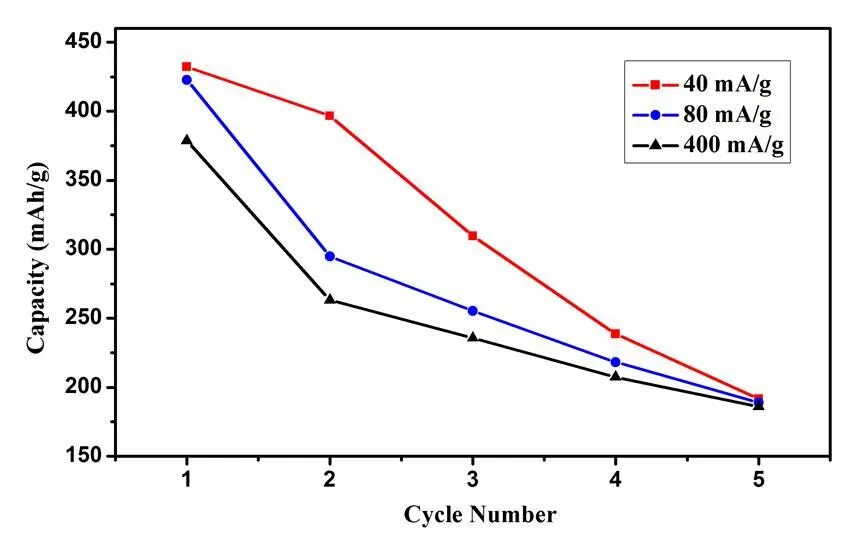
圖10 Cu2(PO4)F/C復合材料的電化學循性能曲線
總體上,在不同電流密度下材料的放電比容量循環性能較之未包覆C的Cu2(PO4)F材料有所改善,部分材料在循環過程中逐漸失活,這可能與制備出來的材料尺寸較大為微米級、顆粒不夠均勻等有關系。具體原因和電化學反應機理還需做進一步研究。
作為一種轉換型正極材料,氟磷酸銅在完全放電后生成Cu單質、LiF和Li3PO4,材料充電時又會被氧化,理論上具有一定的可逆性,通過對氧化后的產物進行表征和確定,對探究材料的電化學反應機理有指導性意義。因此,本研究對不同材料電化學表征后的樣品進行了非原位XRD測試,希望能確定電化學反應后樣品的物相,如圖11所示。

圖11 充放電反應后不同極片的XRD圖譜。a: 包覆C材料的XRD圖譜;b: 未包覆C材料的XRD圖譜,其中豎線表示Al和LiF的特征峰
由XRD圖譜可以看出,當材料進行多次充放電循環之后,Cu2(PO4)F和Cu2(PO4)F/C材料在圖譜中未見Cu單質和Li3PO4的特征峰,只觀察到LiF和鋁集流體的特征峰。根據之前的報道[16]可以推斷,材料經過多次充放電后的產物只剩下LiF,其他物質可能以非晶態形式存在,又或者Cu單質被電解液氧化成了Cu+,以離子形式存在于電解液中。以上Cu2(PO4)F和Cu2(PO4)F/C材料的變化是不可逆的,從而在機理上影響了這種轉換型材料的可逆循環性能。非晶化、不可逆、易氧化等是轉換型正極材料具有的普遍缺點,本研究采用的非原位XRD測試方法無法確認材料在電化學反應中Cu價態的變化過程,導致無法進一步確定電化學反應機理,這使得在研究電化學反應過程中相組成和反應機理上依然存在較大挑戰。
3 結論
1) 通過氟水熱法合成了高純度的氟磷酸銅正極材料,首次報道了這種材料的可逆循環性能,并對其電化學性能進行了表征。相比之前的研究成果,氟水熱法合成的材料具有更高的純度,表現出更加優異的一次電池的比容量。
2) 包覆C后的Cu2(PO4)F/C復合材料,由于具有較高的電導率,因此比未包覆C的材料具有更加優異的電化學性能。Cu2(PO4)F/C復合材料40 mA/g下,首圈放電比容量高達432 mAh/g,十分接近材料的理論比容量(447 mAh/g),第二圈的放電比容量為402 mAh/g,5圈之后材料的放電比容量仍能達到250 mAh/g,表現出了一定的可逆循環性能。但由于材料的初始尺寸較大,10圈之后,電化學性能較差,需要在合成工藝的控制上做進一步的研究加以解決。
[1] Scrosati B, Abraham K M, Van Schalkwijk W, et al. Lithium batteries: advanced technologies and applications[M]. Hoboken, New Jersey: Wiley, 2013.
[2] Islam M S, Fisher C A J. Energy storage: rechargeable lithium batteries[M]//Walsh A, Sokol A A, Catlow C R A. Computational approaches to energy materials. New Jersey: Wiley-Blackwell, 2013: 109-129.
[3] Hu M, Pang X L, Zhou Z. Recent progress in high-voltage lithium ion batteries[J]. J Power Sources, 2013, 237: 229-242.
[4] Gwon H, Hong J, Kim H, et al. Recent progress on flexible lithium rechargeable batteries[J]. Energy Environ Sci, 2014, 7(2): 538-551.
[5] Goodenough J B, Kim Y. Challenges for rechargeable Li batteries?[J]. Chem Mater, 2010, 22(3): 587-603.
[6] Tarascon J M, Armand M. Issues and challenges facing rechargeable lithium batteries[J]. Nature, 2001, 414(6861): 359-367.
[7] Amatucci G G, Pereira N. Fluoride based electrode materials for advanced energy storage devices[J]. J Fluor Chem, 2007, 128(4): 243-262.
[8] Armand M, Tarascon J M. Building better batteries[J]. Nature, 2008, 451(7179): 652-657.
[9] Yamakawa N, Jiang M, Key B, et al. Identifying the local structures formed during lithiation of the conversion material, iron fluoride, in a Li ion battery: a solid-state NMR, X-ray diffraction, and pair distribution function analysis study[J]. J Am Chem Soc, 2009, 131(30): 10525-10536.
[10] Schwieger J N, Kraytsberg A, Ein-Eli Y. Copper sulfates as cathode materials for Li batteries[J]. J Power Sources, 2011, 196(3): 1461-1468.
[11] Li T, Li L, Cao Y L, et al. Reversible three-electron redox behaviors of FeF3nanocrystals as high-capacity cathode-active materials for Li-ion batteries[J]. J Phys Chem C, 2010, 114(7): 3190-3195.
[12] Wang F, Robert R, Chernova N A, et al. Conversion reaction mechanisms in lithium ion batteries: study of the binary metal fluoride electrodes[J]. J Am Chem Soc, 2011, 133(46): 18828-18836.
[13] Scrosati B, Garche J. Lithium batteries: status, prospects and future[J]. J Power Sources, 2010, 195(9): 2419-2430.
[14] Badway F, Cosandey F, Pereira N, et al. Carbon metal fluoride nanocomposites: high-capacity reversible metal fluoride conversion materials as rechargeable positive electrodes for Li batteries[J]. J Electrochem Soc, 2003, 150(10): A1318.
[15] Rea J R, Kostiner E. The crystal structure of copper fluorophosphate, Cu2(PO4)F[J]. Acta Crystallogr B, 1976, 32(7): 1944-1947.
[16] Skrzypczak A, Badway F, Amatucci G G. Electrochemical properties of a copper fluorophosphate electrode material fabricated by mechanochemical synthesis[J]. Electrochem Solid-State Lett, 2009, 12(4): A66-A68.
[17] Armstrong J A, Williams E R, Weller M T. Fluoride-rich, hydrofluorothermal routes to functional transition metal (Mn, Fe, Co, Cu) fluorophosphates[J]. J Am Chem Soc, 2011, 133(21): 8252-8263.
[18] Koleva V G. Vibrational behavior of the phosphates ions in dittmarite-type compoundsM′M″PO4·H2O (M′=K+, NH4+; M″=Mn2+, Co2+, Ni2+)[J]. Spectrochim Acta A Mol Biomol Spectrosc, 2007, 66(2): 413-418.
Synthesis and characterization of rechargeable copper fluorinated phosphate cathode materials
Sun Lizhi, Lu Xiaopeng, Hou Yuhang, Zhou Xianjie
(Shenzhen Zhongchengda Applied Material Co., LTD, Shenzhen 518000, Guangdong, China)
TM912
A
1003-4862(2023)11-0072-05
2023-06-08
孫立志(1988-),男,工程師,研究方向:貴金屬。E-mail: tslz2007@163.com

