富血小板血漿聯合MIPPO治療閉合性脛骨干骨折的臨床療效觀察
孫炳龍,周立芳,董桂鑫,叢海波*
(1.青島大學附屬威海市中心醫院創傷外科,山東 威海 264400;2.山東省文登整骨醫院麻醉科,山東 威海 264400;3.青島大學附屬威海市中心醫院骨科,山東 威海 264400)
脛骨骨折臨床較為常見,成年人脛骨干骨折約占脛腓骨骨折的24.75%[1],手術方式包括傳統切開復位、髓內釘等多種類型[2]。但傳統切開復位會對患者造成較大創傷、破壞脛骨軟組織保護,易導致延遲愈合及不愈合;應用髓內釘擴髓也會破壞骨內膜,影響骨血運,后期易遺留膝關節疼痛。據臨床統計,脛骨干骨折不愈合發生率為5%,其中在脛骨干中下段骨折的延遲愈合發生率高達92.40%[3]。因脛骨骨折修復時間長,治療不當易出現骨折不愈合、骨髓炎等問題,如何加速骨折愈合,縮短治療周期,成為廣大骨科醫師迫切解決的問題之一。富血小板血漿是通過對患者自身血液進行離心,從而提高血小板濃度的一種自體血漿治療。血小板α顆粒中含有大量的生長因子和介質[轉化生長因子(transforming growth factor,TGF)-β1,血小板源性生長因子(platelet derived growth factor,PDGF),堿式成纖維生長因子(basic fibrgblast growth factor,bFGF),血管內皮生長因子(vascular endothelial growth factor,VEGF),表皮生長因子(epidermal growth factor,EGF),胰島素樣生長因子(insulin-like growth factors,IGF)-1等],這些生長因子和介質通過離心過程被濃縮,可以在損傷局部發揮作用,改善骨與軟組織愈合條件[4-5]。本研究選取青島大學附屬威海市中心醫院自2019年1月到2020年5月收治的62例新鮮閉合脛骨干骨折患者,治療組采用骨折斷端注射富血小板血漿(platelet-rich plasma,PRP)治療新鮮閉合性脛骨干骨折患者,并與對照組非PRP注射治療患者對比,效果良好,現報告如下。
1 資料與方法
1.1 納入與排除標準 納入標準:(1)年齡18~60歲的單側閉合性脛骨干骨折患者;(2)新鮮骨折(受傷后2周以內就診);(3)術前患者踝關節功能正常。排除標準:(1)病理性骨折;(2)開放性骨折;(3)合并其他疾病,如導致骨質疏松的代謝性疾病、肝腎功能異常、免疫缺陷性等;(4)合并糖尿病、痛風、系統性紅斑狼瘡、動脈疾患等基礎疾病。
1.2 一般資料 選取新鮮閉合脛骨干骨折患者62例,按照隨機數字表法將患者分為對照組和治療組,每組各31例。對照組采用微創經皮鋼板內固定術(minimally invasive percutaneous plate osteosynthesis,MIPPO)的同時骨折斷端應用PRP治療,對照組為單純用MIPPO術治療,不應用PRP。治療組31例,男19例,女12例;年齡19~60歲,平均(38.48±12.01)歲;患肢:右側14例,左側17例。對照組31例,男21例,女10例;年齡19~57歲,平均(39.77±12.31)歲;患肢:右側12例,左側19例。兩組術前一般資料比較差異無統計學意義(P>0.05)。本研究獲得青島大學附屬威海市中心醫院醫學倫理委員會批準,所有患者均知情并同意。
1.3 手術方法 局部腫脹輕者急診手術,腫脹嚴重者先行跟骨牽引或外固定支具臨時固定,給予抬高患肢、消腫等對癥治療,待腫脹消退后擇期手術。兩組手術均采用硬膜外麻醉,仰臥位。合并腓骨骨折者,高位腓骨骨折不予以處理,中段及下段的腓骨骨折先行腓骨骨折切開復位,解剖復位后應用鎖定重建鈦板內固定,之后再行脛骨骨折手術。于內踝處縱行切開長2~3 cm切口,注意保護大隱靜脈,分離皮下組織,于骨膜外向近端插入適宜長度脛骨遠端內側鎖定鈦板,再應用2把點狀復位鉗復位脛骨骨折。對于斷端有蝶形骨塊或較長螺旋形骨塊者,局部應用克氏針固定。C型臂下復位滿意后應用同等長度鈦板于皮外準確定位,做多個小切口,依次旋入螺釘。治療組同時抽取抗凝枸櫞酸葡萄糖A(anticoagulant citrate dextrose A,ACD-A)抗凝劑5 mL,自體靜脈血45 mL,應用Aghaloo法,通過2遍離心的方法提取出血小板濃縮物PRP 5 mL,將PRP打入骨折斷端。縫合切口,術后不需外固定。
1.4 術后處理 術后給予常規抗感染、消腫止痛、預防血栓形成等藥物治療。術后第2天拍攝X線片,定期復查X線片至骨折愈合。術后根據患者疼痛耐受情況指導患者膝、踝關節伸屈鍛煉,并適當拄雙拐不負重行走,術后2周切口愈合良好后拆除縫線。
1.5 療效觀察指標 記錄并比較兩組患者手術時間、術中出血量、骨折愈合時間、完全負重時間、并發癥發生情況、術后12個月Johner-Wruhs優良率等。X線顯示骨折斷端3/4已連接,完全負重后無痛為骨折愈合;6個月后無愈合跡象為延遲愈合;9個月后無明顯愈合跡象為骨折不愈合。Johner-Wruhs標準包括不愈合與感染、血管神經損傷、有無旋轉/短縮/成角畸形、膝踝關節活動度、疼痛程度、步態、日常活動等,滿分100分,90~100為優,75~89為良,50~74為中,<50分為差。
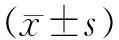
2 結 果
所有患者均獲得隨訪,隨訪時間12個月以上。兩組患者觀察平均手術時間、術中出血量比較,差異無統計學意義(P>0.05)。治療組患者完全負重時間(11.30±1.77)周,對照組患者完全負重時間(14.31±5.80)周,治療組患者完全負重時間早于對照組,差異有統計學意義(P<0.05)。治療組骨折愈合時間為(12.87±1.91)周,對照組為(16.26±5.88)周;治療組的骨折愈合時間較對照組短,差異有統計學意義(P<0.05,見表1)。術后兩組患者均無深層感染,鋼板斷裂、松動等情況發生。治療組患者骨折均愈合,術后無明顯并發癥發生。對照組1例淺表感染,經換藥切口愈合;1例延遲愈合,至術后11個月骨折愈合。術后12個月Johner-Wruhs標準評價療效,治療組優良率93.55%,對照組優良率70.97%,兩組比較差異有統計學意義(P<0.05,見表2)。
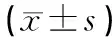
表1 兩組患者手術情況及術后恢復情況比較

表2 兩組術后12個月Johner-Wruhs功能評價比較
典型病例為一49歲女性患者,因“右下肢車禍傷后疼痛活動受限3 h”入院,既往體健。查體:左小腿腫脹、畸形,可見異常活動,可觸及骨擦感,足背動脈搏動有力,左足皮膚感覺正常,末梢血運好。入院診斷:左脛腓骨骨折。入院后予以消腫、鎮痛、預防血栓等治療,擇期行左腓骨骨折切開復位內固定+脛骨骨折MIPPO+PRP注射術。術后第2天指導患者股四頭肌及踝泵鍛煉,術后1周應用雙拐患肢不負重下地,術后1個月患肢部分負重。術后10周完全負重,并恢復日常輕體力活動(見圖1~5)。

圖1 術前X線片示脛腓骨骨折 圖2 術后第1天X線片示骨折復位良好 圖3 術后1個月X線片可見少量骨痂 圖4 術后3個月X線片示骨折線模糊 圖5 術后5個月X線片示脛骨骨折愈合
3 討 論
長骨干骨折術后不愈合是臨床常見、嚴重的并發癥,發生率在臨床高達5%~10%[6]。近年來,盡管脛骨干部骨折的治療效果顯著提高,但由于術中破壞組織血運、術后處理不當,仍易導致骨折延遲愈合或不愈合、斷端畸形愈合、甚至感染等嚴重并發癥。骨折不愈合需要長期治療,需要相當大的醫療開銷,嚴重影響患者生活質量,因此在早期采取積極措施避免并發癥具有重要意義[7]。脛骨有著特殊的解剖結構,其中下1/3段前內側表面軟組織覆蓋少,此處骨折因滋養血管易損傷且皮膚條件脆弱,容易引發局部血運障礙[8]。為提高脛骨骨折愈合率,牢固、堅強的內固定裝置及骨折斷端良好的血運極其重要[9]。目前主要的治療方法以髓內釘固定及鎖定鋼板固定為主,脛骨以干骺端髓腔寬闊,髓內釘固定存在微動,破壞骨內膜血運,容易導致骨折不愈合。切開復位內固定技術手術切口大,廣泛分離斷端軟組織,破壞斷端血運,同樣容易導致骨折不愈合[10]。
MIPPO技術是生物學接骨術(biological osteosynthesis,BO)理論進展的產物,在該理論指導下,應用MIPPO技術復位脛骨骨折,僅需在鋼板置入部位切開并進行剝離,有效避免對骨折端軟組織血運過度破壞。通過內固定支架的設計,減少對骨膜的破壞,極大地保留骨折斷端血運,有效減輕手術對肢體造成的創傷,為骨痂生長及骨折愈合提供良好的基礎[11]。目前臨床傾向于將MIPPO技術與鎖定加壓鋼板(locking compression plate,LCP)相結合使用,因其鋼板與螺釘有堅強的角穩定性,抗旋、抗扭轉力量更佳,且幾乎不與骨膜加壓,有利于骨折端血流灌注,符合BO理論觀念[12]。本研究均采用脛骨遠端內側解剖鎖定鈦板,其外形及弧度與脛骨遠端內側的解剖形狀相匹配,無需精準的預彎鋼板,不涉及骨膜剝離,間接復位后點式接觸能最大限度地保留骨的血液供應,同時可發揮橋接作用,分散骨折斷端的應力,增加骨折的穩定性。通過長鋼板、低密度螺釘以相對穩定的彈性固定,刺激及誘導骨痂的形成,更符合微創技術理念[13-14]。
骨折愈合時間的縮短意味著能夠更早實現肢體的功能活動,從而降低相關并發癥發生。骨不連的主要因素包括力學因素和生物學因素,為骨折愈合提供良好內環境考慮,輔助治療手段在骨折手術中的綜合應用也成趨勢。成功的骨折愈合的前提是具有良好的機械穩定性及合適的微環境。PRP是自體靜脈全血被離心后得到的富含生長因子的自體血小板血漿,其中富含多種對創面愈合起重要作用的生長因子:包括PDGF、IGF、TGF-β、骨形態發生蛋白(bone morphogenetic protein,BMP)、VEGF、EGF等[15],目前大量文獻報道這些生長因子可顯著促進骨折的修復并在體外對骨髓基質干細胞的增殖與分化有明顯的促進作用。因此,近年來PRP在多個醫療領域得到了廣泛應用,將PRP應用于骨與軟骨再生領域,同樣取得了良好的治療效果[16-18]。
PRP中的生物活性分子在局部環境中起到了四種主要作用:增殖、遷移、細胞分化和血管生成。在各項研究中顯示,富血小板血漿促進骨折愈合的機制主要包括以下幾個方面:(1)通過血小板膜分泌的生長因子與受體細胞藕聯,從而激活細胞第二信號,加速細胞膠原合成與增殖,促進血管新生、基質形成、膠原合成和類骨質形成;(2)部分生長因子在骨折愈合中起著直接促進作用,在愈合過程早期可以形成復雜的調控機制,多層面對骨折修復起到調控作用,促進骨折斷端的修復;例如活化的PDGF附著在成骨細胞和破骨細胞、軟骨細胞上的跨膜受體,刺激有絲分裂、骨質重塑,吞噬骨質愈合過程中的損傷細胞;TGF-β是一種有效的軟骨誘導生長因子,在骨質愈合、軟骨增生和軟骨內骨化起著重要的作用;VEGF可以與成骨蛋白協同作用,通過增加細胞聚集、加速血管新生,以促進軟骨吸收和骨質鈣化[19-20]。富血小板血漿提供了生長因子于局部大量釋放的機會,可以使炎癥因子聚集、活性蛋白濃度增加、血管廣泛生成,加速骨折愈合[21-23];(3)在體外實驗中,發現通過向培養基中添加PRP可促進人骨髓間充質干細胞(mesenchymal stem cells,MSCs)的增殖和分化,在人脂肪干細胞(adipose-derived stem cells,ADSCs)中也可以看到PRP對成骨分化的影響[24]。此外,PRP可以通過重組細胞骨架來提高細胞的趨化性,加速細胞的遷移,從而影響成骨樣細胞的活躍性[25]。同時,PRP的抗菌作用也被報道指出,這在骨科手術的治療中起到非常有利的幫助[26]。
PRP取材方便,制備相對簡單,臨床療效值得肯定,但應用中仍存在問題需進一步研究。目前就血液成分的濃度及最佳的PRP制劑并沒有普遍的共識,使得目前市場上有許多不同的PRP套裝。不同廠商的PRP系統具有獨特的屬性,它們的血小板捕獲效率、分離方法(一步或兩步離心)、離心速度以及收集管系統和操作的類型不同。PRP的制備方法及所含成分未得到臨床研究的充分驗證,仍需更多臨床試驗提供制備PRP最佳的方式[27]。例如:(1)PRP中血小板最佳提取濃度;(2)不同濃度的血小板及生長因子對骨修復的作用;(3)PRP中白細胞數量多少對骨組織及軟組織修復的影響;(4)如何選擇性激活血小板,讓其釋放不同功能的生長因子,避免激活過多生長因子引起相互之間發生對抗。
關于PRP和急性骨折治療的一篇綜述中表明,在8項關于PRP促進骨愈合方面的RCT實驗中,有6項PRP治療后的患者影像學顯示出了更好的結果,1項沒有明顯的差別;5項實驗報道了PRP治療后的臨床結果(包括功能主觀評分和/或客觀測量和/或PRP治療后的并發癥),在其中2項研究中,PRP治療中顯示了更好的臨床效果[28]。盡管基礎科學表明PRP對骨愈合有一些有利的潛在作用,血小板濃縮物也已在其他醫學領域成功地用于增強骨和軟組織再生,但將使用PRP治療作為常規促進骨愈合的方式并沒有達成共識[29-30]。
綜上所述,PRP是一種有前途的治療方式,使用安全。本研究中脛骨干骨折患者采用MIPPO技術結合PRP局部注射治療,能夠促進骨痂生長及骨折愈合,提高術后肢體功能活動,具有臨床應用價值。然而,PRP的療效高度依賴于其濃度及適應證,不同制備方式也有一定影響;同時,本研究樣本數少,PRP制備方式的各異性,均限制了對PRP療效的解釋,未來更多高質量、大型的臨床試驗將是進一步驗證PRP療效的關鍵。

