鈦表面有序微米凹坑結(jié)構(gòu)的構(gòu)筑及其對BMSCs成骨活性的影響
曾秀霞 賴穎真 賀于奇 黃俊徽 許志強
機械拋光純鈦已廣泛應用于骨內(nèi)植物,但其屬于生物惰性材料,難于直接與骨組織發(fā)生緊密鍵合[1]。改造鈦基材料的表面形貌特性以提升其生物活性至關重要[2]。既往常用噴砂或酸蝕等方式來構(gòu)筑表面微觀形貌,但制備的結(jié)構(gòu)大多是無序和各向異性,不能模仿天然骨組織的有序特征而呈現(xiàn)出較低的成骨活性[3]。學者們已嘗試通過3D打印、微銑削和激光刻蝕等方法來構(gòu)筑有序微米形貌,但是這些方法通常價格昂貴且難以應用于形狀復雜的骨內(nèi)植入物[4]。本研究采用簡單的電化學刻蝕法,在純鈦表面構(gòu)筑出了仿細胞尺寸的有序微米凹坑陣列結(jié)構(gòu),并通過與骨髓間充質(zhì)干細胞(BMSCs)共培養(yǎng),對其成骨活性進行評價。
1 材料與方法
1.1 試樣制備
純鈦圓片(直徑14.5 mm,厚度1 mm,寶雞市德鑫鈦業(yè)有限公司)砂紙逐級打磨拋光并除油預處理后,隨機分為A、B、C 3 組(n=3)。A組未再做任何處理;B組用1.5 wt% HF酸蝕15 min;C組進行電化學刻蝕處理,石墨片和預處理的鈦圓片分別為陰極和陽極,以0.5~5 mol/L NaCl -0.5~5 mol/L HF混合溶液為電解質(zhì),在10~15 V恒定電位下進行電化學刻蝕處理15 min。3 組試樣450 ℃熱處理2 h后超聲清洗并干燥,各種檢測及細胞接種前再進行紫外線消毒30 min。
1.2 理化性能表征
1.2.1 表面形貌觀察 SEM(S4800,Hitach公司,日本)觀察試樣表面形貌特征。
1.2.2 表面接觸角測試 在室溫環(huán)境下,利用接觸角測試儀(DSA100,KRUSS公司,德國)采用懸滴法測量試樣表面液體的靜態(tài)水接觸角。
1.2.3 3D輪廓圖及表面粗糙度 在環(huán)境溫度(20±2) ℃下,使用VK-X250K型號激光顯微系統(tǒng)[VK-X250K型號,基恩士(中國)有限公司]對各試樣表面三維形貌進行檢測,以獲得試樣3D輪廓圖并測量各試樣表面糙度數(shù)值。
1.2.4 蛋白吸附檢測 各組鈦試樣置于24 孔板中,加入1 mL含10%FBS的DMEM低糖培養(yǎng)基,孵育2 h后,加入1%十二烷基硫酸鈉溶液置搖床上振蕩,用增強型BCA蛋白濃度測定其蛋白濃度。
1.3 細胞培養(yǎng)
選用SD大鼠BMSCs(廣州賽業(yè)生物科技有限公司),選擇生長良好的P3~P5為實驗細胞。
1.4 細胞實驗
1.4.1 細胞形態(tài)觀察 試樣置于24孔板中,BMSCs接種密度為2×104/孔。培養(yǎng)2 d后,試樣固定、脫水和噴金,SEM觀察試樣表面黏附的細胞形態(tài)。
1.4.2 細胞黏附 BMSCs接種密度為4×104/孔,培養(yǎng)2 h后MTT法檢測細胞黏附,具體步驟按照廠家說明進行。
1.4.3 細胞增殖 BMSCs接種密度為2×104/孔,培養(yǎng)1、 3、 7 d后MTT法檢測細胞增殖。
1.4.4 細胞膠原分泌 BMSCs接種密度為2×104/孔,培養(yǎng)14 d后固定,選用溶解在飽和苦味酸中的0.1%天狼星紅對細胞分泌的膠原進行染色18 h,然后用0.1 mol/L的乙酸反復漂洗試樣,直至無紅顏色析出為止,體視顯微鏡照相。為了進一步定量比較,加入洗脫液(用0.2 mol/L氫氧化鈉和甲醇以體積1∶1的比例配置)震蕩15 min將試樣表面的染料洗脫下來,采用用酶標儀在波長540 nm下測其A值。
1.4.5 細胞外基質(zhì)(ECM)礦化 BMSCs接種密度為2×104/孔,培養(yǎng)14 d后固定,選用茜素紅S染色液(1%,pH=4.2)對細胞分泌的ECM染色 5~10 min,然后用三級水輕柔漂洗鈦試樣5 次,直至不再脫色,體式顯微鏡照相。為了進一步定量比較,用10%氯化十六烷基吡啶來溶解鈦試樣表面的茜素紅S染料,采用酶標儀(SpectraMax iD3型,Molecular Devices公司,美國)在波長620 nm下檢測A值。
1.5 統(tǒng)計學分析
2 結(jié) 果
2.1 理化性能表征
2.1.1 表面形貌 如圖1,A組可見沿拋光方向平行排列的細小微溝槽結(jié)構(gòu);B組低倍鏡下可見邊緣銳利的無序溝壑狀結(jié)構(gòu),高倍鏡下見稀疏分布的邊緣圓鈍的納米點狀顆粒;C組低倍鏡下可見約為20 μm大小的有序微米凹坑陣列,高倍下可見密集分布的頂部較圓鈍的納米凸起顆粒。
2.1.2 接觸角和親水性 如圖2,3 組試樣的接觸角大小關系依次是A 圖2 3 組樣本表面接觸角 2.1.3 3D輪廓圖及表面粗糙度3D輪廓圖(圖3)可見,A組表面呈現(xiàn)輕微起伏的細小劃痕溝槽且較光滑,B組表面可見無序溝壑結(jié)構(gòu),C組表面可見規(guī)整有序的微米凹坑結(jié)構(gòu)。表面粗糙度定量比較得知,其大小關系依次是A 圖3 3 組試樣表面粗糙度比較 2.1.4 早期蛋白吸附 3 組試樣表面早期蛋白吸附相比具有統(tǒng)計學意義,其大小依次是A 圖4 3 組試樣2 h的蛋白吸附量比較 2.2.1 細胞形態(tài)及黏附 如圖5,A組表面黏附的BMSCs順著拋光劃痕排列更多地呈現(xiàn)出梭狀形態(tài),而B組和C組的BMSCs更傾向于多邊形黏附形態(tài)。其C組表面細胞可緊密地黏附在一個微米凹坑表面,也可跨越多個微米凹坑,細胞鋪展拉伸更明顯,并且伸出較多細長的偽足與周邊的細胞呈現(xiàn)緊密連接。 圖5 3 組試樣表面BMSCs的細胞黏附 2.2.2 細胞黏附 如圖6,C組試樣2 h細胞黏附量顯著大于A組和B組。 圖6 3 組試樣表面細胞增殖情況 2.2.3 細胞增殖 如圖6,盡管7 d時A組和B組相比沒有統(tǒng)計學差異,總體來說,B組和C組表面BMSCs的細胞增殖均受到了一定程度的抑制。但是細胞增殖在3 組試樣表面均呈現(xiàn)出時間依賴性,其隨著時間的推移而明顯增加。 2.2.4 細胞膠原分泌 如圖7,3 組試樣表面BMSCs均分泌了一定量的細胞膠原,定量結(jié)果比較其大小依次是A 圖7 3 組試樣表面BMSCs的細胞膠原分泌(×50) 2.2.5 ECM礦化檢測 如圖8,3 組試樣表面BMSCs均形成了紅色的礦化結(jié)節(jié),定量結(jié)果比較其大小依次是A 骨內(nèi)植入物植入體內(nèi)與血液接觸時,材料表面首先快速地吸附血清中的蛋白,以介導隨后的細胞響應[5]。一般來說,材料表面的親水性越好,越有利于表面的蛋白吸附,進而為后續(xù)的細胞黏附提供有利環(huán)境[6]。經(jīng)過電化學刻蝕處理的C組試樣,材料表面比表面積增大,粗糙度值上升,親水性提升,從而顯著地提升了表面的蛋白吸附量,有利于后續(xù)的細胞黏附和生長。C組試樣表面還具有精細的納米柱凸起,可能也會提供更多的吸附位點,協(xié)助表面蛋白吸附和細胞黏附[7]。而且C組試樣表面有序微米凹坑的直徑約為20 μm,這同未鋪展開的BMSCs尺寸相當,可能也有利于BMSCs的早期黏附[8]。所以細胞黏附結(jié)果顯示,相比其它兩組試樣,C組試樣表面早期細胞黏附量最多。 研究發(fā)現(xiàn),BMSCs在材料上的黏附方式和其他多數(shù)細胞類似也是通過粘著斑實現(xiàn)[9]。細胞通過粘著斑系統(tǒng)來感知材料表面拓撲結(jié)構(gòu),表現(xiàn)為表面拓撲結(jié)構(gòu)引起細胞形態(tài)改變,導致細胞骨架力信號改變后介導細胞基因表達[10]。在細胞早期黏附時,還未形成ECM,吸附到材料表面的這些蛋白團簇被用于充當了初始的ECM,把材料的表面形貌特征通過粘著斑傳遞給黏附的細胞。微米結(jié)構(gòu)因易形成蛋白吸附的位點,進而集聚蛋白團簇,從而通過粘著斑來指導貼壁細胞的形狀和方向[11]。從細胞在不同鈦試樣上的黏附形態(tài)可見,A試樣上BMSCs在沿拋光方向平行排列的細小微溝槽上呈梭狀黏附,B組和C組上的BMSC因為溝壑和凹坑結(jié)構(gòu)更傾向于多邊形黏附形態(tài)。其中C組試樣上的BMSCs可以順利黏附在與其尺寸相當?shù)母鱾€微米凹坑表面,然后逐漸鋪展并跨過各個凹坑,伸出偽足同周圍細胞形成廣泛的連接,促進了細胞間的廣泛通信。 研究表面,BMSCs形態(tài)呈現(xiàn)為多邊形以及伸展的形態(tài),表明細胞骨架拉伸程度高,成骨分化傾向越明顯[12]。而且微米凹坑間細胞通過偽足形成的直接連接也是細胞間相互通信的一種方式,這種細胞通信會使得相鄰細胞之間的細胞質(zhì)保持連續(xù)性,從而有利于細胞成骨分化[7]。因此,相比對照組純鈦,B組和C組樣本上BMSCs的膠原分泌和ECM礦化有了明顯的提升,特別在C組樣本提升更明顯而展示最優(yōu)的成骨分化能力。既往研究表明,微米結(jié)構(gòu)有利于細胞成骨分化,但不利于細胞增殖,因為細胞分化和細胞增殖間存在互為抑制的關系[13]。該研究也得出同樣的結(jié)論,經(jīng)過表面微米改性處理的B組和C組樣本表面BMSCs的細胞增殖均受到了一定程度的抑制。但是在早期骨形成階段,細胞成骨分化可能比初始的細胞增殖更加重要[14]。而且實驗中3 組試樣的細胞增殖也隨著時間的推移而明顯增加,說明均具有良好的生物相容性。 綜上所述,有序微米結(jié)構(gòu)的C組試樣可以促進BMSCs的細胞黏附和成骨分化,并在一定程度上支持其細胞增殖,具有良好的成骨活性。而且其制備工藝簡單便捷也適用于形狀復雜的種植體,有望成為一種良好的骨內(nèi)植物表面處理技術。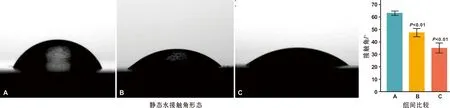


2.2 細胞實驗



3 討 論

