腔內介入術中藥物涂層球囊與普通球囊治療下肢動脈硬化閉塞癥的對比研究
戴建虎 ,卞 虎,趙正興,袁威威
(淮安市第五人民醫院介入與血管外科,江蘇 淮安 223300)
下肢動脈硬化閉塞癥是因下肢動脈硬化斑塊形成引起了下肢血流不通暢,臨床多表現為下肢涼、麻木、無力、間歇性跛行等。球囊被廣泛應用于治療多種人體自然管腔的疾病,可有效擴張血管管腔,使血流通暢,但術后由于血管壁回縮、夾層等原因,血管再狹窄率較高[1]。藥物涂層球囊于球囊表面通過超聲波霧化將抗細胞增殖藥物均勻涂于球囊上,隨著球囊擴張,使藥物迅速進入血管壁組織中,從而抑制血管再狹窄[2]。本研究旨在探討腔內介入術中藥物涂層球囊與普通球囊治療下肢動脈硬化閉塞癥的臨床效果,現報道如下。
1 資料與方法
1.1 一般資料選取淮安市第五人民醫院2018 年11 月至2022 年11 月收治的50 例下肢動脈硬化閉塞癥患者,根據隨機數字表法分為兩組,各25 例。對照組患者中男性16 例,女性9 例;年齡51~83 歲,平均(68.24±6.42)歲;病程1~3 年,平均(1.86±0.42)年;平均血管壁病變5~15 cm,平均(10.25±2.36) cm。觀察組患者中男性17 例,女性8 例;年齡50~82 歲,平均(68.04±6.37)歲;病程1~3 年,平均(1.81±0.43)年;血管病變長度5~16 cm,平均(10.17±2.32) cm。兩組患者一般資料比較,差異無統計學意義(P>0.05),有可比性。納入標準:符合《下肢動脈硬化性閉塞癥治療指南》[3]中的相關標準;首次確診為下肢動脈硬化閉塞證;Rutherford 分級為2~5 級;可耐受介入手術;至少存在1 支通暢的遠端流出道。排除標準:有介入手術史,存在精神系統疾病,心、肺功能嚴重損傷藥物過敏;凝血功能異常;合并有惡性腫瘤。研究經院內醫學倫理委員會批準實施,且所有患者及家屬均知曉并已簽署知情同意書。
1.2 治療方法兩組患者均進行常規治療前準備,首先進行各項生化檢查確認是否可進行手術,其次于治療前連續服用3 d 阿司匹林腸溶片(邯鄲滏榮制藥有限公司,國藥準字H13023363,規格:25 mg/片),100 mg/次,1 次/d;硫酸氯吡格雷片[深圳信立泰藥業股份有限公司,國藥準字H20203616,規格:75 mg/片(按C16H16CINO2S計)],75 mg/次,1 次/d,并進行對癥治療,控制血壓、血糖、血脂水平。術前行下肢血管CT 造影檢查,并進行血管重建,確定下肢血管病變情況。手術時患者呈仰臥位,消毒鋪巾后進行局麻,局麻生效后進行同側股動脈順行性穿刺,如順行性穿刺失敗則進行對側股動脈逆行穿刺,放置6F 血管鞘于股總動脈并注射低分子量肝素鈉注射液(昆明積大制藥股份有限公司,國藥準字H20053200,規格:0.3 mL∶3 200 IU),初始劑量為80 IU/kg 體質量,后續根據手術時間對肝素劑量進行補充,以導管導絲技術通過血管狹窄病變處,并再次推注造影劑確認導管及導絲遠端是否在血管真腔內。此后,對照組患者以普通球囊對病變段血管進行擴張,球囊直徑與病變段血管相同,壓力維持在6~8 kPa 持續擴張3~4 min。觀察組患者則先以普通球囊對病變段血管進行預擴張,選用直徑小于病變段血管0.5~1 mm 的球囊,持續擴張1~2 min 后改用與病變段血管相同直徑的藥物涂層球囊進行擴張,壓力維持在6~8 kPa持續擴張2~3 min。擴張完畢后對兩組患者靶血管再次造影檢查血管通暢情況,并視情況進行補救性支架植入。術后,兩組患者患肢均制動12 h,并連續注射3 d 低分子量肝素鈉注射液,并以阿司匹林腸溶片及硫酸氯吡格雷片進行抗血小板治療,持續治療6 個月,并進行定期隨訪。
1.3 觀察指標①臨床療效。治療6 個月后,患者遠端動脈恢復搏動,下肢涼、麻木、無力、間歇性跛行等癥狀完全消失,創面完全愈合,判定為治愈;隨訪期間患者肢體末梢血液循環及臨床癥狀得到明顯改善,且創面愈合良好,判定為顯效;隨訪期間患者肢體末梢血液循環及臨床癥狀有緩解,且創面有所愈合,判定為有效;隨訪期間患者末梢循環、臨床癥狀、創面情況均未得到改善,判定為無效[6]。總有效率=治愈率+顯效率+有效率。②患肢踝肱指數、靶動脈血管狹窄程度、靶動脈血管內徑、晚期管腔丟失情況。分別于治療前及治療6 個月后以彩色多普勒超聲診斷系統(深圳開立生物醫療科技股份有限公司,型號:P22S)及醫用全自動電子血壓計[愛安德電子(深圳)有限公司,型號:TM-2657VP]檢測肱動脈、踝動脈收縮壓,并進行計算,踝肱指數=踝部收縮壓值/肱動脈收縮壓值;以多普勒超聲檢測靶動脈血管狹窄程度、靶動脈血管內徑;檢測最小管腔直徑(MLD)變化,以術后即刻MLD 與治療6 個月后時MLD 差值為靶血管晚期管腔丟失。③血清內皮素-1(ET-1)、高遷移率族蛋白B1(HMGB1)、基質金屬蛋白酶-9(MMP-9)水平。分別在治療前及治療6 個月后抽取患者空腹狀態下肘部靜脈血4 mL,進行離心(轉速3 000 r/min,時間10 min),取得血清,以酶聯免疫吸附法檢測標本中ET-1 水平,以全自動發光免疫分析法檢測標本中HMGB1、 MMP-9 水平。④并發癥及靶血管通暢率。記錄隨訪期間穿刺部位血腫、感染、造影劑腎病、假性動脈瘤的發生情況,并記錄治療期間靶血管通暢情況,靶血管病變狹窄率小于50%,判定為通暢。
1.4 統計學方法采用SPSS 26.0 統計學軟件進行分析數據,計數資料以[例(%)]顯示,采用χ2檢驗;計量資料經S-W 檢驗符合正態分布,用(±s)表示,組間比較采用獨立t檢驗,治療前后比較采用配對t檢驗。以P<0.05為差異有統計學意義。
2 結果
2.1 兩組患者臨床療效比較觀察組患者臨床總有效率高于對照組,差異有統計學意義(P<0.05),見表1。
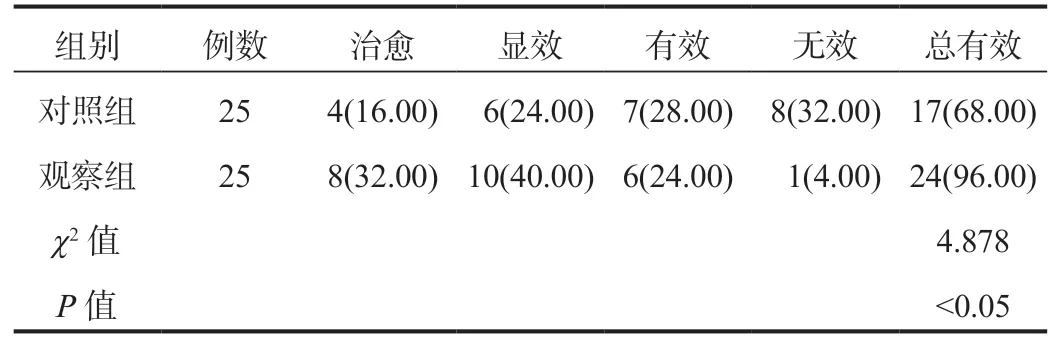
表1 兩組患者臨床療效比較[例(%)]
2.2 兩組患者患肢踝肱指數、靶動脈血管狹窄程度、靶動脈血管內徑、晚期管腔丟失情況比較與治療前比,治療6 個月后兩組患者患肢踝肱指數均升高,且觀察組較對照組更高;靶動脈血管狹窄程度均降低,且觀察組較對照組更低;靶動脈血管內徑均延長,且觀察組較對照組更長;晚期管腔丟失情況相比,觀察組較對照組更短,差異均有統計學意義(均P<0.05),見表2。
表2 兩組患者患肢踝肱指數、靶動脈血管狹窄程度、靶動脈血管內徑、晚期管腔丟失情況比較( ±s)
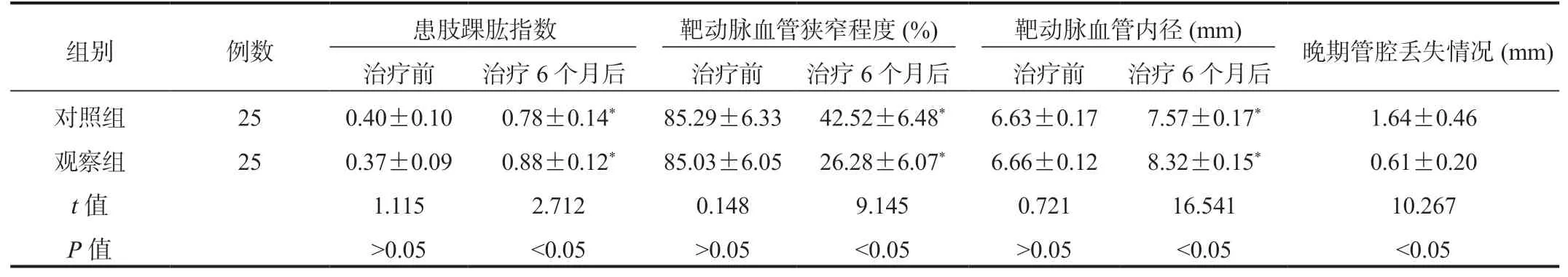
表2 兩組患者患肢踝肱指數、靶動脈血管狹窄程度、靶動脈血管內徑、晚期管腔丟失情況比較( ±s)
注:與治療前比,*P<0.05。
?
2.3 兩組患者血清ET-1、HMGB1、MMP-9 水平比較與治療前比,治療6 個月后兩組患者血清ET-1、HMGB1、MMP-9 水平均降低,且觀察組較對照組更低,差異均有統計學意義(均P<0.05),見表3。
表3 兩組患者血清ET-1、HMGB1、MMP-9 水平比較( ±s)
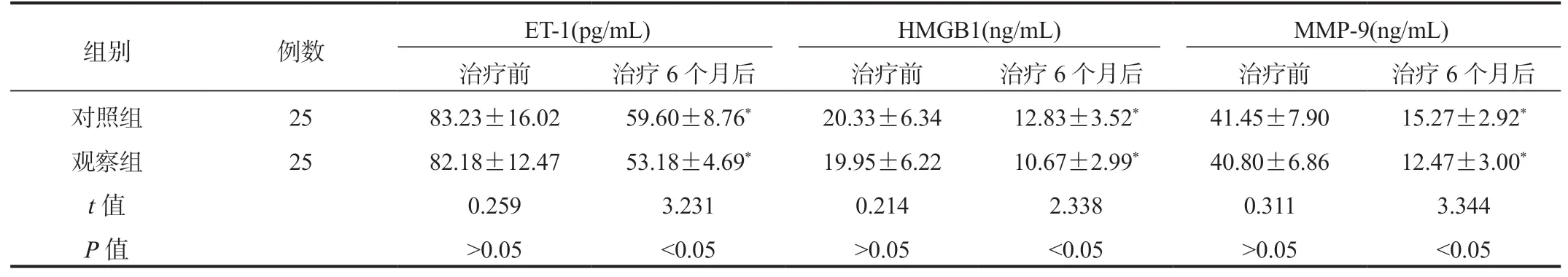
表3 兩組患者血清ET-1、HMGB1、MMP-9 水平比較( ±s)
注:與治療前比,*P<0.05。ET-1:血清內皮素-1;HMGB1:高遷移率族蛋白B1;MMP-9:基質金屬蛋白酶-9。
?
2.4 兩組患者并發癥及靶血管通暢情況比較治療期間兩組患者并發癥總發生率經比較,差異無統計學意義(P>0.05);治療期間觀察組患者靶血管通暢率高于對照組,差異有統計學意義(P<0.05),見表4。
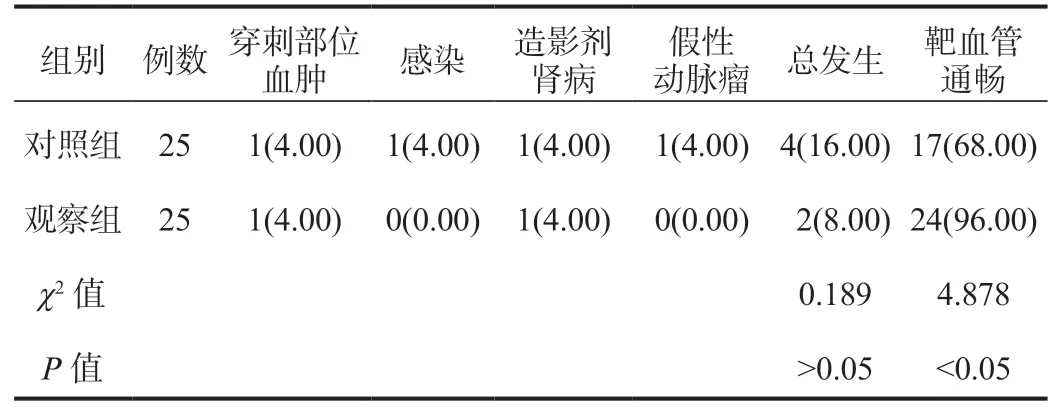
表4 兩組患者并發癥及靶血管通暢情況比較[例(%)]
3 討論
下肢動脈硬化閉塞癥主要的病因是動脈發生了粥樣硬化,主要是血管的狹窄和閉塞發生在下肢,所以下肢的血液供應減少導致下肢動脈狹窄,引起肢體慢性缺血的疾病發生[5]。球囊擴張是下肢動脈硬化閉塞癥首選的一線治療方案,但球囊擴張會對血管內皮形成一定刺激,導致血管內膜平滑肌細胞過度增生、遷移,加上血管的彈性回縮,易引發術后再狹窄[6]。
藥物涂層球囊可通過局部向動脈血管壁應用抗內膜增生的藥物,抑制擴張的血管平滑肌細胞的增殖,從而預防再次發生狹窄。其對支架內再狹窄有較好的療效,有預防血栓形成、降低病死率的優點[7-8]。本研究結果顯示,觀察組患者臨床總有效率、患肢踝肱更高,靶動脈血管狹窄程度更低,靶動脈血管內徑更長,患者晚期管腔丟失長度更短,表明下肢動脈硬化閉塞癥患者在腔內介入術中應用藥物涂層球囊效果更佳,能長期有效地改善血管閉塞情況。
ET-1 是一種血管收縮性多肽,當粥樣斑塊損傷血管內皮細胞時,就會導致ET-1 大量釋放;HMGB1 是一種可誘導發生強烈炎癥反應的細胞因子,其水平升高代表動脈粥樣硬化加重;MMP-9 水平升高代表斑塊破裂風險加大,會使病情進一步發展。藥物涂層球囊一方面能夠通過物理擴張效應使狹窄血管恢復通暢,另一方面,球囊表面所涂抹的抑制動脈內膜增生的藥物在球囊擴張后能夠使藥物與血管內膜緊密貼合,使藥物能夠在內膜表面達到較高濃度,從而抑制細胞增殖,減少對血管內皮的損傷,改善炎癥反應[9-10]。本研究結果顯示,治療6 個月后觀察組血清ET-1、HMGB1、MMP-9 水平均低于對照組,靶血管通暢率高于對照組;兩組并發癥總發生率比較,差異無統計學意義,表明下肢動脈硬化閉塞癥患者在腔內介入術中應用藥物涂層球囊可有效抑制內膜增生,降低炎癥反應,更好地維持血管通暢,安全性良好。
綜上,相較于以普通球囊治療下肢動脈硬化閉塞癥,在腔內介入術中應用藥物涂層球囊治療效果更佳,不僅能長期有效地改善血管閉塞情況,還可抑制內膜增生,降低炎癥反應,保證安全性良好的同時亦能夠更好地維持血管通暢,具有臨床應用推廣價值。

