基于思維模型建構二輪復習策略研究
——以“電化學選擇題”為例
馬芹 王富強 強晶
1 寧夏大學化學化工學院 銀川 750000 2 吳忠市濱河中學 寧夏吳忠 751100
1 問題的提出
化學學科知識冗雜,高中學生所學科目眾多,且在高考的重壓下,二輪復習時間緊、內容多、任務重,教師為及時完成教學任務而不得不采用直線式講授教學和題海戰術機械訓練來推進復習進度,在知識點梳理方面,這種復習方式讓學生感覺知識點凌亂、難記憶且難復現等,不能很好地關聯和重構知識間的聯系從而理解和靈活應用知識;在解題方面,學生對題干關鍵信息提取困難,且難以將所獲得的信息與所學的知識進行匹配,對于綜合性強、文字多且情景陌生的題目常常無從下手,甚至做過的題也會反復出錯等,久而久之,學生對化學產生畏懼和抵抗心理,教師和學生均陷入“唯分數論”的苦海而身心俱疲。
在新高考背景下,化學試卷命題更趨向于情景化設計,更注重試題的開放性及靈活性,目的是改善教學中“死記硬背及機械訓練”的現狀而發揮高考選拔性功能和育人功能[2],化學試卷的考查內容具有更加注重教材基礎知識并有適當延伸,注重裝置圖像試題的辨識與匹配,引入新材料和新情景增大試卷難度,聯系生產生活實際并關注學術前沿等特點。
2 問題解決策略
高考常考的電池類型有很多,有新型的燃料電池,如酸性和堿性燃料電池及質子交換膜燃料電池等;新型的一次電池包括Mg-H2O2電池、鈉硫電池、鋰釩氧化物電池等,新型的可充電池有鋅銀電池、鎳鐵和鎳鉻電池、高鐵電池、鋰離子電池、鈉電池及鈉的硫蓄電池及全釩液電池等。通過研究高考化學試題中的“電化學選擇題”發現,由于裝置圖能使所需呈現的內容更加直觀、簡潔且包含的信息量大,故大多“電化學選擇題”以裝置圖為載體進行考查,既能考查學生對相關知識掌握和理解的程度,還能考查學生的讀圖能力、獲取和處理信息的能力等,完全符合高考的命題趨勢。情景化和新穎化的新材料電化學裝置試題是近幾年考查的熱點,其考查的內容往往是高起低落,具體指試題往往結合電池的最新熱點而使題干信息陌生且新穎,但真正的落腳點還是對原電池及電解池工作原理的考查,因此輔助學生真正理解與掌握電池的工作原理并靈活運用才是關鍵。思維模型是將人腦的思維過程可視化呈現的有效方式,可有效地關聯和重構知識間的聯系,能高效地實現將所學知識簡單化、形象化及邏輯化地呈現而形成知識體系,便于學生快速理清知識間的聯系和掌握知識的本質,并能成為工具高效地輔助學生靈活解題。
3 電池模型的構建及解題策略研究
電化學是高中化學的重點內容之一,該部分內容與生產生活實際緊密聯系,也是高考必考的內容之一。本文統計了2018—2022年高考全國卷中電化學選擇題所考查電池的類別及涉及的知識,具體的統計結果如表1所示。

表1 2018—2022年高考全國卷中電化學選擇題情況統計
根據表1 可知,近五年電化學選擇題所考查的內容都是電池的工作原理,旨在考查學生的綜合應用能力。有的涉及離子交換膜,難度不大,但得分率卻不高,其原因可能是學生對電池的基礎知識沒有吃透,學生獲取關鍵信息能力素養較差,面對新型化學電池有畏懼情緒,做題更多關注的是正確率而不進行歸納總結和舉一反三等。針對以上問題,本研究嘗試基于思維模型構建電化學知識網絡圖、電池模型圖、解題思維模型,引導學生自主構建思維模型、完善思維模型及應用思維模型,通過學生自主構建電化學知識思維模型,可將學生思考的思維過程可視化,有利于教師和學生自己進行及時的評價與反饋,調整教學策略和學習方法,還能幫助學生構建可遷移的知識體系認知模型,從而提高學生的認知能力。在解題方面,基于模型可幫助學生快速找到解題思路,形成對化學問題分析及解決路徑的正確認識而靈活解題[3]。通過引導學生構建模型、運用模型而幫助學生樹立能量觀、變化觀及微粒觀的化學思想,進一步落實對學生五大核心素養的培養。
3.1 構建電化學知識思維模型
電化學知識思維模型知識網絡如圖1所示。
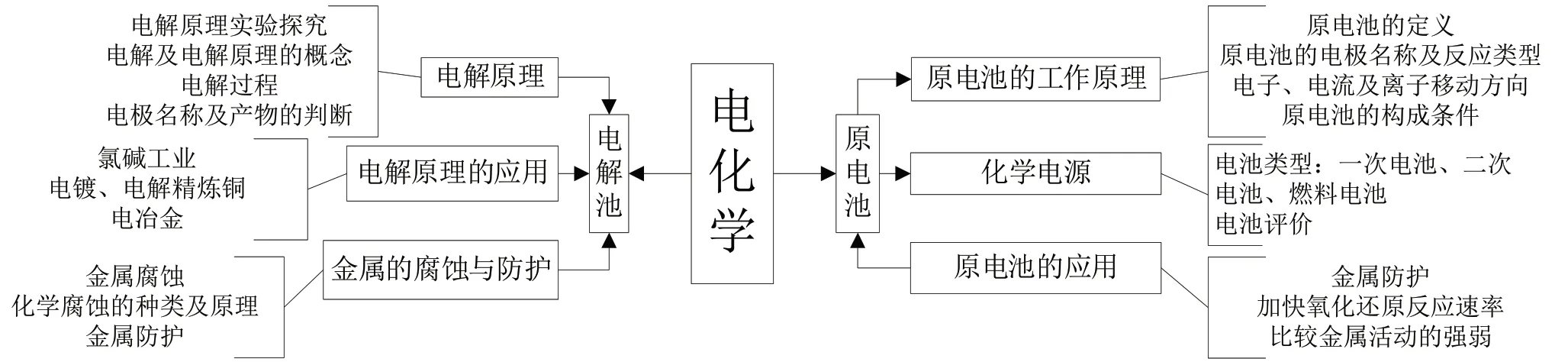
圖1 電化學知識思維模型知識網絡圖
3.2 構建各電池思維模型
3.2.1 原電池思維模型
原電池思維模型如圖2所示。
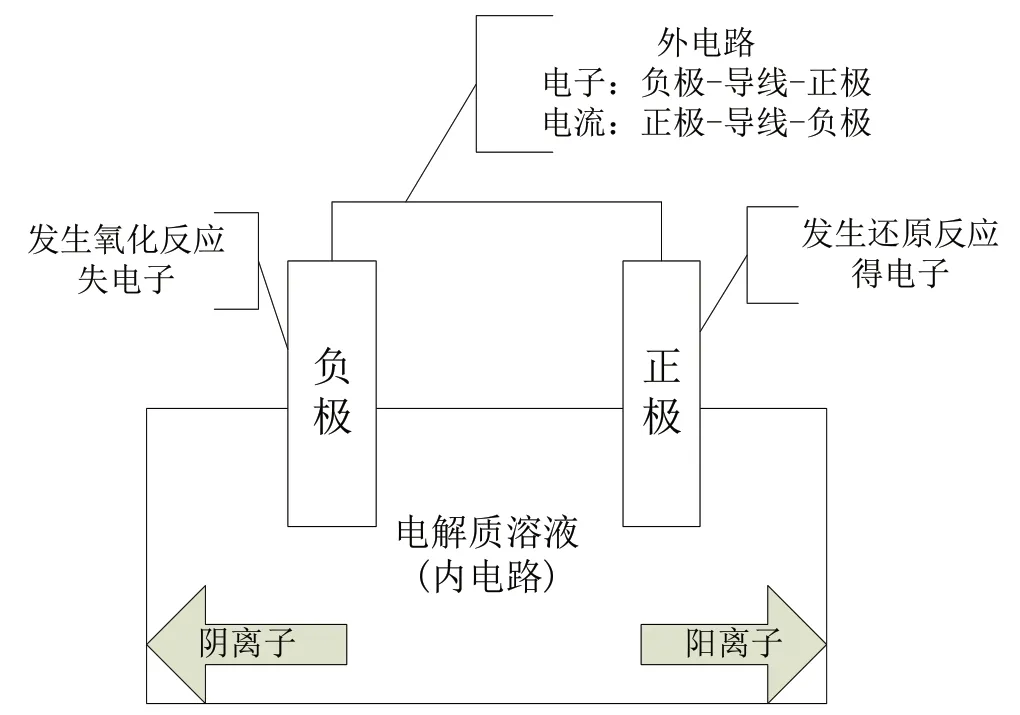
圖2 原電池思維模型
【考點解析】注重考查單液原電池和雙液原電池的工作原理(包括原電池的定義,原電池的構成條件,電極的名稱,電極反應類型,電極的產物,電極反應方程式的書寫與正誤判斷,電子、電流及離子移動方向的判斷,工作一段時間后電解質溶液濃度的變化,pH 的變化等)、原電池的應用(化學燃料電池及新材料電池、形成原電池能加快反應速率、比較金屬活動性等),該類題在高考題中比較簡單。
3.2.2 電解池思維模型
電解池思維模型如圖3所示。
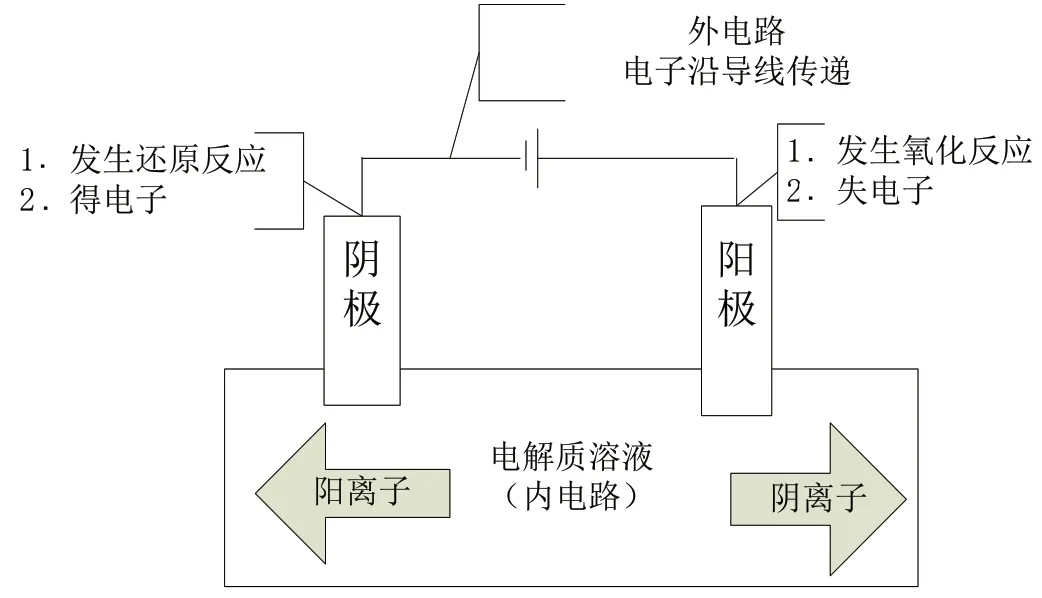
圖3 電解池思維模型
【考點解析】注重考查電解池的工作原理(包括電解池的定義,電解池的構成條件,電解池的電極名稱,陰陽電極的反應類型,陰陽極電極產物和反應方程式的書寫及正誤判斷,電子、電流及離子移動方向的判斷,通電一段時間后電解質溶液濃度的變化、pH 的變化等)、電解池應用(電解飽和食鹽水、銅的電解精煉、電鍍及電冶鋁等),該類題在高考題中稍微有難度。
3.2.3 可充電池思維模型
可充電池思維模型如圖4所示。
【考點解析】根據圖4 可知,可充電池放電過程利用的是原電池原理,而充電過程利用的是電解池原理,由于二次電池設置問題角度多且綜合性強,能實現電極材料的循環利用,故在近幾年的高考中是考查的熱點題型。
3.3 構建電化學解題思維模型及解題策略分析
3.3.1 構建解題思維模型
構建四步解題策略,具體如下。
第一步,判斷電池類別——引導學生根據題干及裝置圖提取關鍵信息,如最簡便的方法是從定義的角度出發看有沒有外接電源,如無外接電源則為原電池,若有外接電源則為電解池。
第二步,判斷電池的電極名稱——引導學生仔細閱讀裝置圖所呈現的信息并結合選項看,判斷方法包括根據物質的轉化的化合價變化、電極反應方程式、電極得失電子情況、離子及電子移動方向、電極反應類型及各電極活潑性等。
第三步,書寫對應的電極反應方程式,具體題目具體分析,要根據電解質溶液的環境、放電順序等進行書寫。
第四步,結合題干所給信息和選項問題靈活解題。
3.3.2 構建四步解題思維模型的優勢
根據四步解題策略繪制解題思維導圖,一方面幫助學生理清解題思路,另一方面顯現知識點如何應用解題,解題后在教師的引導下自己總結完善該題的思維模型圖,后續在此基礎上歸納和總結同類型的題,使學生更深層次理解知識點和把握考試方向,再遇到同類型的題或者同考點的題,可以快速匹配知識點及解題方法而提高解題速率。雖然題是做不完的,但題的類型是固定的。在學習過程中,利用構建思維模型總結錯題和學習中存在的問題等具有一定的優勢及有效性,教師要引導、輔助學生快速解題,并對所存在的問題進行有效解決,進而深刻理解電化學知識。
3.4 案例分析
【2022年全國甲卷4】一種水性電解液Zn-MnO2離子選擇雙隔膜電池如圖所示(KOH 溶液中,Zn2+以Zn(OH)42-存在)。電池放電時,下列敘述錯誤的是( )
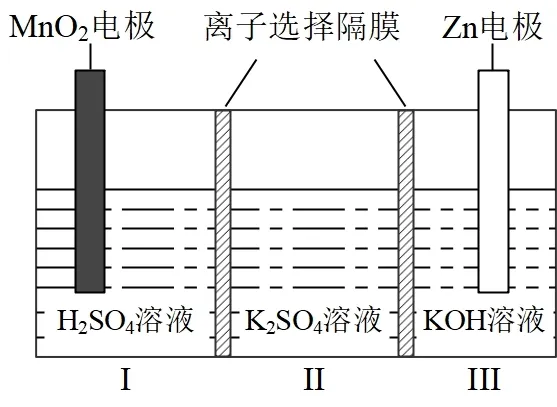
A.Ⅱ區的K+通過隔膜向Ⅲ區遷移
B.Ⅰ區的SO42-通過隔膜向Ⅱ區遷移
C.MnO2電極反應:MnO2+2e-+4H+=Mn2++2H2O
D.電池總反應:Zn+4OH-+MnO2+4H+=Zn(OH)42-+Mn2++2H2O
【借助思維模型解題】
第一步,判斷電池類別。根據電池裝置圖像所呈現的信息分析該電池為原電池,考查原電池的工作原理。
第二步,根據金屬活動順序,Ⅲ區Zn 為電池的負極,Ⅰ區MnO2為電池的正極,Ⅱ區為兩個離子選擇隔膜所形成的區域。
第三步,書寫電極反應方程式。電極反應為Zn-2e-+4OH-=Zn(OH)42-,電極反應為MnO2+2e-+4H+=Mn2++2H2O;Zn+4OH-+MnO2+4H+=Zn(OH)42-+Mn2++2H2O 為電池的總反應方程式,故CD 正確。
第四步,靈活解題。該電池在工作過程中,兩個離子選擇隔膜并沒有指明是陽離子隔膜還是陰離子隔膜,故陰、陽離子都可以通過隔膜,根據原電池離子遵循“正正負負”的規律,因此Ⅰ區消耗H+得到Mn2+,Ⅱ區的K+向Ⅰ區移動或Ⅰ區的SO42-向Ⅱ區移動,Ⅲ區消耗OH-,生成Zn(OH)42-,Ⅱ區的SO42-向Ⅲ區移動或Ⅲ區的K+向Ⅱ區移動,故Ⅱ區的K+只能向Ⅰ區移動,A 項錯誤,B 項正確,故該題正確選項為A。
【2021年全國卷7】乙酸醛是一種重要的化工中間體,可采用如圖所示的電化學裝置合成。圖中的雙極膜中間層中的H2O 解離為H+和OH-,并在直流電場作用下分別向兩極遷移。下列說法正確的是( )
A.KBr在上述電化學合成過程中只起電解質作用
C.制得2mol 乙醛酸,理論上外電路中遷移了1mol 電子
D.雙極膜中間層中的在外電場作用下向鉛電極方向遷移
【借助思維模型解題】
第一步,判斷電池類別。根據電池裝置圖像有外接電源,判斷其為電解池,考查電解池的工作原理。
第二步,根據箭頭表示物質間的轉化順序判斷出電解池的陰陽極(或者結合有機物加氧或者去氫為氧化反應,加氫去氧為還原反應,判斷電解池的兩個電極名稱)。鉛電極上羧基失氧發生還原反應為陰極,石墨電極為陽極。
第三步,書寫電極反應方程式。陽極電極方程式為2Br--2e-=Br2,陰極電極反應方程式為
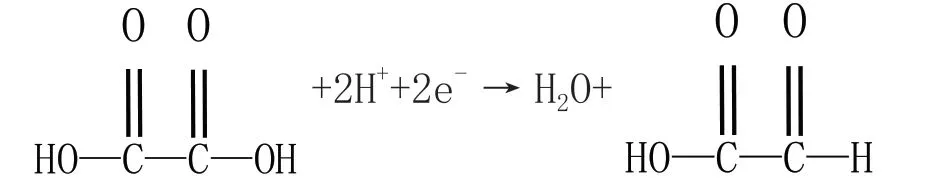
故B 項錯誤。
第四步,靈活解題。由于乙二醛分子中的一個醛基氧化得到羧基而生成了Br-,該離子參與反應,故能起到電解質和催化作用,故A 項錯誤;結合陽極區乙二醛得到乙二酸寫出電解池的總反應方程式,在通電和KBr 作催化劑的條件下,乙二酸和乙二醛反應轉移2mol 電子得到兩分子的乙醛酸,故C 項錯誤;根據電解池離子移動遵循“陰陽相吸”的原則,H+應該移向陰極(鉛電極),故D 項正確。
【2022年全國乙卷12】Li-O2電池比能量高,在汽車、航天等領域具有良好的應用前景。近年來科學家研究了一種光照充電Li-O2電池(如圖所示),光照時,光催化電極產生電子(e-)和空穴(h+),驅動陰極反應(Li++e-=Li)和陽極反應(Li2O2+2h+=2Li++O2)對電池進行充電。下列敘述錯誤的是( )
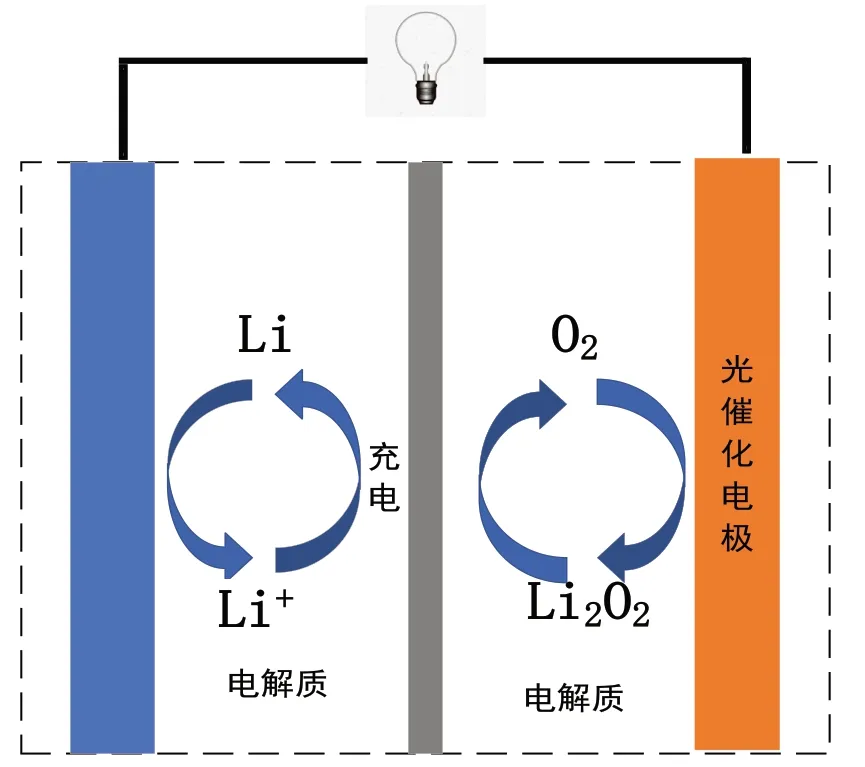
A.充電時,電池的總反應Li2O2=2Li+O2
B.充電效率與光照產生的電子和空穴量有關
C.放電時,Li+從正極穿過離子交換膜向負極遷移
D.放電時,正極發生反應O2+2Li+2e-=Li2O2
【借助思維模型解題】
第一步,判斷電池類別。根據電池裝置圖像無外接電源,可判斷其為原電池,考查可充電池的工作原理。
第二步,根據箭頭表示物質間的轉化順序,依據化合價判斷出原電池正負極,根據可逆電池放電過程利用原電池工作原理,Li—Li+得出該電極為負極,則O2—Li2O2該電極為正極,根據原電池離子移動方向確定C 項為正確選項。
第三步:書寫電極反應方程式。放電過程中金屬鋰為負極,電極方程式為Li+e-=Li+,則光催化電極為正極,電極方程式為O2+2Li+2e-=Li2O2,根據題干所給的信息,充電過程陰極為金屬鋰電極,反應為Li++e-=Li;陽極為光催化電極,反應為Li2O2+2h+=2Li++O2,排除A 項和D 選項。
第四步,靈活解題。根據可充電池充電時的反應原理,光催化電極產生電極和空穴,陰陽極的反應會有電子的得失,因而充電效率與光照產生的電子和空穴量有關,故B 項也排除。
4 結束語
在知識總結方面,可借助思維模型圖梳理一節課、一本書及一門學科的知識,有效地將書變薄而達到高效記憶的目的;在解題方面,可將其有效地應用到一道題、一類題、一章節習題、一個專題習題的分析及總結中,從而提高學生的解題思維。基于思維模型實現高效復習,減少死記硬背和機械訓練,助力學生真正地理解知識并靈活地遷移應用知識解題,可以很好地優化二輪復習的教與學,值得推廣應用。

