miR-374靶向下調TRIM35表達可促進乳腺癌細胞增殖和侵襲
王 蓉 邢連翔 黃克亮 李 欣
(1.上海交通大學醫學院附屬第九人民醫院黃浦分院檢驗科,上海 200011;2.上海市臨床檢驗中心,上海 200016)
世界癌癥研究基金會的統計結果顯示,乳腺癌是全球女性癌癥相關死亡的第二大原因,全球每年有超過45萬例與乳腺癌相關的死亡病例[1]。盡管臨床目前已廣泛采用根治性手術和輔助化療對乳腺癌進行治療,但遠隔轉移和復發仍是乳腺癌預后不良的主要原因[3]。因此,了解乳腺癌發生、發展的病理機制,并確定具體靶點,有助于準確診斷乳腺癌,并提供有效的治療策略。
微小RNA(microRNA,miRNA)參與了腫瘤的發生、發展,作為腫瘤抑制因子或癌基因發揮作用,miRNA的異常表達已在許多不同類型的惡性腫瘤中得到證實,且與腫瘤進展密切相關[3]。有研究結果表明,乳腺癌組織中miR-374表達顯著升高,可作為乳腺癌的診斷標志物[4]。miR-374是否通過介導靶基因發揮作用尚不清楚。三基序蛋白35(tripartite motifcontaining protein 35,TRIM35;又稱MAIR或Hls5)是包含三聯基序的單蛋白E3連接酶家族成員,具有誘導細胞凋亡的活性[5]。此外,TRIM35已被確認為一種腫瘤抑制因子,可抑制各種惡性腫瘤(如肝細胞肝癌)細胞的增殖、克隆形成和致瘤性[6]。目前,關于miR-374功能的潛在機制尚不明確,本研究團隊前期通過生物信息學分析,發現miR-374可能的靶點為TRIM37,但miR-374是否通過靶向TRIM35發揮作用尚不清楚。本研究擬通過檢測乳腺癌組織中miR-374和TRIM35的表達,并探討miR-374對MCF-7細胞增殖和侵襲的影響,分析miR-374與TRIM35之間的關系,及其在乳腺癌發生、發展中的作用。
1 材料和方法
1.1 研究對象
選取2020年1月—2021年12月上海交通大學醫學院附屬第九人民醫院黃浦分院確診的乳腺癌患者42例,年齡45~66歲。所有患者均符合中國抗癌協會乳腺癌專業委員會發布的《中國抗癌協會乳腺癌診治指南與規范(2021年版)》[7],術前未接受抗腫瘤治療,無其他惡性腫瘤病史。收集術中切除的乳腺癌組織和距腫瘤切緣2 cm以上的癌旁組織(經病理檢查確認)。收集所有患者的臨床資料。本研究經上海交通大學醫學院附屬第九人民醫院黃浦分院倫理委員會批準(2019-001號),所有患者均自愿參加本研究并簽署書面知情同意書。
1.2 細胞培養和分組
將乳腺癌細胞系MCF-7(中國科學院典型培養物保藏中心細胞庫)置于含10%胎牛血清(fetal bovine serum,FBS)和1%青霉素-鏈霉素(美國Sigma-Aldrich公司)的RPMI-1640培養基中,在37 ℃ 5%CO2條件下培養。于細胞匯合度為80%~90%時傳代,取對數生長期的細胞,用于后續實驗。
將MCF-7細胞根據不同處理方法分為3組:對照組(未作任何處理)、干擾組(加入100 nmol/L miR-374抑制劑10 μL,與細胞共孵育48 h)和空載體組(加入100 nmol/L隨機序列10 μL,與細胞共孵育48 h)。miR-374抑制劑和隨機序列均購自生工生物工程(上海)股份有限公司。
1.3 細胞增殖試驗
將各組細胞以1×105個/孔的密度接種于96孔培養板中,分別培養24、48、72 h。采用MTT試劑盒(上海碧云天生物技術有限公司)測定細胞的增殖情況,嚴格按試劑盒說明書進行操作。簡要步驟:將10 μL MTT試劑(5 mg/mL)添加到每個孔中,37 ℃溫育4 h,棄去培養基,加入150 μL二甲基亞砜,在振動器上震動10 min,然后采用DNM-9602酶標儀(北京普朗新技術有限公司)測量490 nm處的吸光度(A)值。
1.4 逆轉錄定量聚合酶鏈反應(reverse transcription quantitative polymerase chain reaction,RT-qPCR)檢測 miR-374和TRIM35表達
采用TRIzol試劑(美國ThermoFisher Scientific公司)從各組細胞或癌組織、癌旁組織中提取總RNA,嚴格按試劑盒說明書進行操作。將RNA用M-MLV逆轉錄酶[天根生化科技(北京)有限公司]逆轉錄為cDNA。采用SYBR Premix ExTaq試劑盒(日本TaKaRa公司)在ABI 7300實時PCR系統上進行聚合酶鏈反應(polymerase chain reaction,PCR)擴增。miR-374和TRIM35引物由上海捷瑞生物工程有限公司合成,引物序列見表1。反應條件:94 ℃3 min;94 ℃ 30 s,62 ℃ 30 s,74 ℃ 30 s,36個循環;74 ℃延長3 min。TRIM35的內參為GAPDH,miR-374的內參為U6。采用2-ΔΔCt計算miR-374和TRIM35的相對表達量。

表1 引物序列
1.5 雙熒光素酶報告基因測定
通過Targetscan7.2在線數據庫(http://www.targetscan.org/vert_72/)確認TRIM35的3'-非編碼區(untranslated region,UTR),包含預測的miR-374特異性結合位點,采用PCR從基因組DNA中擴增TRIM35的3'-UTR基因片段。反應條件:95 ℃ 3 min;95 ℃ 20 s,60 ℃30 s,72 ℃ 30 s,45個循環。正向引物序列為5'-CATCGCCAAGCACAATCAGG-3',反向引物序列為5'-GCGTTTTCGGCTCTTGTGTT-3'。將擴增出的基因片段插入到pMIR-REPORT熒光素酶報告載體中,獲得野生型熒光素酶報告基因質粒p-TRIM35-wt,將其與pGL3-對照質粒的螢火蟲熒光素酶基因融合,限制性內切酶為KpnⅠ和XhoⅠ。使用快速定點突變試劑盒(美國New England Biolabs公司)將2個位點突變(3'-UTR-965A/G和3'-UTR-969T/C)引入WT-TRIM35-3'-UTR,構建突變體(MUT)TRIM35-3'-UTR。將TRIM35報告基因質粒野生型(p-TRIM35-wt)或突變型(p-TRIM35-mut)分別與miR-374共轉染人胚胎腎細胞系HEK-293T(中國科學院上海生命科學研究院細胞資源中心),miR-NC采用隨機序列作為miRNA陰性對照。細胞在含10% FBS(以色列Biological Industries公司)的Dulbecco改良Eagle培養基(Dulbecco's modified Eagle medium,DMEM)(美國ThermoFisher Scientific公司)中培養。轉染24 h后,采用雙熒光素酶報告分析系統(美國Promega公司)測定熒光素酶活性。
1.6 Transwell試驗檢測miR-374抑制劑對乳腺癌侵襲性的抑制作用
試驗前48 h將MCF-7細胞接種到10 cm培養皿中,每個端口2×105個細胞。試驗前16 h更換無血清培養基。將Matrigel添加到Transwell小室(美國Corning公司)的上室。將3.5×104個細胞接種于24孔細胞小室中,在Transwell小室的下室中加入0.8 mL含10%血清的培養基。常規培養24 h后,用75%乙醇固定,1.2%結晶紫染色。在ECLIPSE Ci光學顯微鏡(日本尼康公司)(×100)下隨機選取3個視野進行細胞計數。
1.7 統計學方法
采用SPSS 20.0軟件進行統計分析。呈正態分布的計量資料以±s表示,2個組之間比較采用t檢驗,多組間比較采用單因素方差分析,兩兩比較采用Tukey法。計數資料以例或率表示,組間比較采用χ2檢驗。采用Pearson相關分析評估miR-374與TRIM35的相關性。以P<0.05為差異有統計學意義。
2 結果
2.1 乳腺癌組織和癌旁組織miR-374、TRIM35相對表達量比較和兩者之間的相關性
癌組織miR-374相對表達量(7.21±1.14)顯著高于癌旁組織(3.83±0.81)(P<0.001),TRIM35相對表達量(9.23±1.26)顯著低于癌旁組織(9.98±0.92)(P<0.001)。Pearson相關分析結果顯示,miR-374與TRIM35呈負相關(r=-0.114,P<0.01)。見圖1。

圖1 癌組織和癌旁組織miR-374、TRIM35相對表達量比較和兩者之間的相關性
2.2 不同臨床病理特征乳腺癌患者miR-374相對表達量比較
不同腫瘤大小和有無淋巴轉移、遠隔轉移的乳腺癌患者之間miR-374相對表達量差異均有統計學意義(P<0.05)。不同年齡和TNM分期的乳腺癌患者之間miR-374相對表達量差異均無統計學意義(P>0.05)。見表2。

表2 不同臨床病理特征乳腺癌患者miR-374相對表達量比較
2.3 干擾組、對照組和空載體組miR-374相對表達量比較
干擾組miR-374相對表達量為0.41±0.05,顯著低于對照組(0.82±0.04)和空載體組(0.81±0.07)(P<0.001)。見圖2。
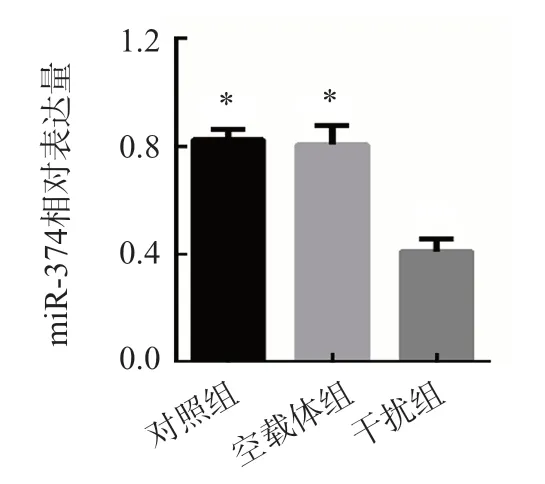
圖2 干擾組、對照組和空載體組miR-374相對表達量比較
2.4 miR-374干擾對MCF-7細胞增殖的影響
干擾組培養48、72 h后的MCF-7細胞增殖率顯著低于空載體組或對照組(P<0.001)。見圖3。

圖3 miR-374干擾對MCF-7細胞增殖的影響
2.5 miRNA干擾對MCF-7細胞侵襲能力的影響
干擾組侵襲細胞數顯著低于空載體組和對照組(P<0.001)。見圖4。

圖4 miR-374干擾對MCF-7細胞侵襲性的影響(×100)
2.6 miR-374干擾對TRIM35表達的影響
干擾組TRIM35相對表達量為1.58±0.21,顯著高于空載體組(1.14±0.06)和對照組(1.06±0.03)(P<0.001)。見圖5。

圖5 miR-374干擾對TRIM35相對表達量的影響
2.7 miR-374對TRIM35轉錄調控的影響
熒光素酶報告基因檢測結果顯示,HEK-293T細胞共轉染miR-374和p-TRIM35-wt時,熒光素酶活性被顯著抑制(P<0.001);共轉染miR-374和p-TRIM35-mut時,熒光素酶活性未被抑制(P>0.05)。見圖6。

圖6 miR-374對TRIM35轉錄調控的影響
3 討論
乳腺癌是全球癌癥死亡的第五大原因[8]。盡管隨著手術、放療、化療、內分泌治療、靶向治療等技術的發展,乳腺癌患者的死亡率有所下降,但全身治療預防轉移的效果較差[9],腫瘤轉移仍是大多數乳腺癌患者死亡的根本原因[10]。
miRNA是小的單鏈非編碼RNA(18~22個核苷酸),通過識別特定靶mRNA導致其靶向降解或翻譯抑制,在轉錄后水平調節基因表達。miRNA與乳腺癌的進展密切相關[4,11],在診斷和治療中表現出顯著的潛力[12-13]。ZHANG等[14]的研究結果顯示,乳腺癌患者miR-26b-5p、miR-106b-5p、miR-142-3p、miR-142-5p、miR-185-5p和miR-362-5p表達上調,可作為乳腺癌診斷和預后評估的潛在生物標志物。miR-374家族成員(包括miR-374a、miR-374b和miR-374c)作為lncRNA FTX的剪接片段,位于人類染色體 Xq13.2的X失活中心[15]。HE等[16]的研究結果顯示,前列腺癌組織中miR-374表達降低,可作為前列腺癌無生化復發生存的獨立預測因子。RAHIMI等[17]的研究結果顯示,慢性淋巴細胞白血病患者miRNA-32、miRNA-98和miR-374異常表達。GAO等[18]的研究發現,miR-374通過靶向GATA3抑制SEMA3B表達,可促進神經膠質瘤進展。本研究結果顯示,乳腺癌組織miR-374相對表達量顯著升高,抑制miR-374表達可導致MCF-7細胞的增殖率顯著降低,提示miR-374可能具有致癌基因的作用。
TRIM蛋白家族是E3泛素連接酶RING結構域家族的成員,由1個RING指結構域、2個B-box結構域和1個C-末端結構域組成,充當E3泛素連接酶,參與細胞的各種生理過程[19]。TRIM35是TRIM家族的一員,在腫瘤的惡性進展中具有重要作用[20]。TRIM35低表達可促進肝細胞肝癌細胞的惡性增殖[21],而增加TRIM35的表達可顯著抑制乳腺癌細胞的增殖、轉移和侵襲[22]。有研究結果顯示,TRIM35表達升高可抑制乳腺癌細胞的生長、克隆形成和致瘤性,提示TRIM35具有抗腫瘤能力[23]。TRIM35可通過增加丙酮酸脫氫酶激酶1的泛素化使蛋白激酶B(protein kinase B,PKB;又稱Akt)信號失活,從而抑制乳腺癌細胞增殖,促進細胞凋亡[12]。WU等[24]的研究結果顯示,TRIM35通過泛素化調節丙酮酸激酶M1/2蛋白四聚體和二聚體的轉變,并通過調節 Warburg效應,影響乳腺癌的惡性生物學行為。生物信息學分析結果顯示,TRIM35是miR-374的潛在直接靶標,miR-374或可直接負向調節TRIM35 mRNA的表達。為了證實這一假設,本研究采用miR-374抑制劑轉染MCF-7細胞,結果顯示,抑制miR-374可誘導TRIM35表達增強,表明miR-374可反向調節TRIM35表達;雙熒光素酶報告基因檢測結果證實miR-374可與TRIM35的3'-UTR直接結合。由此可見,miR-374可通過靶向TRIM35來增強乳腺癌細胞的增殖活性和侵襲能力。
綜上所述,miR-374可促進MCF-7細胞的增殖和轉移,并通過直接結合其mRNA轉錄本負調控TRIM35的表達,提示miR-374可能在乳腺癌的發病機制中發揮重要作用。

