基于網絡藥理學和實驗驗證探討二氫楊梅素改善db/db小鼠腎纖維化的作用機制
劉醒然,牛夢竹,高 原,寇現娟,2*
1武漢體育學院運動醫學院;2武漢體育學院運動訓練監控湖北省重點實驗室,武漢 430079;3廣西醫科大學體育與健康學院,南寧 530021
糖尿病腎病(diabetic kidney disease,DKD)是2型糖尿病(diabetes mellitus type 2,T2DM)主要的微血管并發癥之一,也是終末期腎病的主要病因。其主要特征是腎小球基底膜的增厚、系膜和腎小管間質的基質擴張以及足細胞丟失,導致微量白蛋白尿的發展和腎功能下降[1]。隨著DKD的持續發展,腎臟組織的顯微結構出現持續炎癥及損傷,導致彌漫性間質纖維化破壞正常腎臟顯微結構,最終發展成腎纖維化(renal fibrosis,RF)。而目前緩解DKD發展成RF的手段多集中于通過改善DKD來實現。但對于包括DKD在內的多數糖尿病并發癥的發生機制仍未闡明,以至于DKD演變為RF過程中的復雜機制也未清晰,導致DKD及RF的治療效果不盡人意[2]。因此探明DKD的發病機制以及發現新的治療靶點來抑制DKD的發展迫在眉睫。
二氫楊梅素(dihydromyricetin,DHM)是一種天然黃酮類化合物,具有多種藥理作用,包括抗炎、抗氧化、清除自由基、改善線粒體功能障礙、調節自噬等[3,4]。目前多項研究表明DHM在治療代謝性疾病方面具有巨大潛力,其不僅可以通過誘導自噬、改善氧化應激、抑制炎癥、提高線粒體活性等途徑改善胰島素抵抗,降低血糖水平[5];同時對多種糖尿病并發癥具有良好的改善作用,如:糖尿病腦病[6]、糖尿病心肌病[7]等。但DHM改善糖尿病并發癥相關研究并不充分,相關藥理機制仍需進一步探究。此外,DHM是否能夠進一步改善DKD所導致的RF研究較少,治療作用尚不明確。
網絡藥理學可以在龐大的生物發生過程網絡背景下,基于中藥成分的結構,結合其生物效應,聯合疾病相關靶點進而構建“藥物—成分—靶點—疾病”互作網絡,是探索中藥有效成分、分子機制以及潛在靶點的有效手段。分子對接可以模擬分子和蛋白質之間的相互作用,預測配體和受體的構象,對親和力和結合模式進行計算和預測以驗證藥物成分對主要靶點的具體作用方式。因此,本研究采用網絡藥理學方式,篩選并預測DHM作用于DKD以及RF的潛在靶點,構建“成分—靶點—疾病”互作網絡,結合分子對接以及體內實驗對預測的主要靶點進行驗證,探討二氫楊梅素改善db/db小鼠腎纖維化的分子機制,為DHM的臨床應用提供一定的理論依據。
1 材料與方法
1.1 材料
1.1.1 實驗動物
6周齡SPF級雄性m/m小鼠10只,體重23±2 g,6周齡db/db小鼠20只,體重39±2 g,購買自常州卡文斯實驗動物有限公司,實驗動物許可證號SCXK(蘇)(2016-0010)。飼養于濕度40%~55%、溫度22~26 ℃,自由飲食飲水,保持良好的通風環境。實驗期間均以普通飼料喂養。普通飼料均由武漢市萬千佳興生物科技有限公司提供。本實驗經武漢體育學院動物實驗倫理委員會批準(倫理審查批準號:0087-202010-1301)。
1.1.2 藥物與試劑
二氫楊梅素(純度98%,批號ALB-202106,美國ALB Technology Limited公司);小鼠尿微量白蛋白ELISA試劑盒(批號2M-KMLJM219762m,南京卡米洛生物工程有限公司);血尿素氮(blood urea nitrogen,BUN)和血清肌酐(serum creatinine,Scr)試劑盒(批號分別為C013-2-1、C011-2-1,南京建成生物工程研究所);Notch1、Notch胞內結構域(Notch intracellular domain,NICD)抗體(批號分別為20687-1-AP、20687-1-AP,Proteintech公司);split多毛增強子1(hairy and enhancer of split1,Hes1)和發狀分裂增強子1(hairy/enhancer-of-split related with YRPW motif 1,Hey1)抗體(批號分別為ab71559、ab154077,Abcam公司);第10號染色體缺失的磷酸酶及張力蛋白同源物(phosphatase and tensin homologue deleted on chromosome ten,PTEN)、蛋白激酶B(protein kinase B,AKT)、p-AKT抗體(批號分別為9188T、4691T、13038T,Cell Signaling Technology)。
1.1.3 儀器
DYY-6C型垂直電泳儀(北京市六一儀器廠);EPS-300型轉膜儀器(海天能科技有限公司);低溫高速離心機(5415R,Eppendorf);K3型酶標儀(賽默飛);超聲波細胞粉碎機(JY99-IIDN,寧波新芝生物科技股份有限公司);熒光及化學放光儀(ChemiScope 6300,上海勤翔);顯微鏡(IXplore SpinSR,Olympus corporation);數顯恒溫水浴鍋(HH-4,金壇市友連儀器研究所)。
1.2 方法
1.2.1 網絡藥理學研究
1.2.1.1 DHM作用靶點預測與疾病靶點獲取
通過TCMSP(https://tcmsp-e.com/)數據庫獲取DHM化學結構的mol文件,并通過Pubchem(https://pubchem.ncbi.nlm.nih.gov/)和Drugbank(https://go.drugbank.com/)數據庫進行驗證,驗證后將所獲mol文件上傳至PharmMapper(http://www.lilab-ecust.cn/pharmmapper/)數據庫對DHM的作用靶點進行預測,通過uniprot(https://www.uniprot.org/)數據庫對所預測靶點名稱進行規范化處理。以“diabetic nephropathy”“diabetic kidney disease”“renal fibrosis”為關鍵詞,采用DisGeNET(https://www.disgenet.org/)數據庫進行檢索,分別獲取“DKD”“RF”的靶點。
1.2.1.2 “藥物—靶點—疾病”網絡的構建
將獲取的DHM、DKD以及RF的靶點上傳至微生信(https://www.bioinformatics.com.cn/)在線平臺進行Venn圖繪制并獲取交集基因。而后將交集基因導入Cytoscape 3.9.1軟件構建“藥物—靶點—疾病”可視化互作網絡。
1.2.1.3 PPI網絡的構建
將交集基因導入String(https://string-db.org/)數據庫進行蛋白質相互作用分析,并將分析結果導入Cytoscape 3.9.1軟件,采用插件cytoHubba對分析結果進行網絡拓撲參數進行分析,并以度值(degree)為參考依據選取前10位基因進行可視化處理,同時作為后期實驗驗證的靶基因選取依據。
1.2.1.4 GO功能富集分析和KEGG通路富集分析
采用David(https://david.ncifcrf.gov/)數據庫對交集基因進行基因本體論(gene ontology,GO)和京都基因與基因組百科全書(Kyoto Encyclopedia of Genes and Genomes,KEGG)富集分析,分別篩選KEGG富集分析和GO分析中的生物過程(biological process,BP)、分子功能(molecular function,MF)、細胞成分(cellular component,CC)的前10條結果上傳至微生信平臺進行可視化處理。
1.2.1.5 分子對接
選取PPI網絡中degree值前5位的靶基因并結合我們前期研究基礎選取靶基因與DHM進行分子對接驗證。通過查閱文獻報道和PDB(https://www.rcsb.org/)數據庫獲取靶基因蛋白結構的pdb文件。采用Pymol 2.5.5軟件對TCMSP數據庫獲取的DHM分子結構去除水分子和小分子配體,采用AutoDock Tools 1.5.6對DHM結構文件和靶基因蛋白結構文件進行加氫、定義受體和配體、分配扭轉鍵等構象處理;采用autogrid4設置對接盒子,AutoDock4進行分子對接并獲取最低結合能組合。最后使用Pymol進行結果可視化處理。
1.2.2 動物實驗驗證
1.2.2.1 動物分組與模型建立
實驗小鼠適應性喂養1周后,將6周齡的m/m小鼠和db/db小鼠隨機分為對照組(NC組)、2型糖尿病腎病組(DKD組)、DHM藥物干預組(DHM組),每組各10只。NC組正常喂養不做干預,DHM藥物干預組灌胃DHM(基于前期研究結果選擇DHM終劑量為100 mg/(kg·d))[8,9],DKD組灌胃等體積的生理鹽水,每周干預5 d,連續干預10周。
1.2.2.2 樣品制備與動物處理
10周干預結束后,禁食測血糖,次日取材,摘眼球取血,分離血清用于生化指標檢測,摘取雙側腎臟后,稱重,取一側腎臟于多聚甲醛固定,其余液氮凍存后轉-80 ℃冰箱保存。
1.2.2.3 小鼠體重、空腹血糖和腎功能指標檢測
實驗期間,小鼠禁食過夜,12 h后每周固定時間測小鼠體重和空腹血糖。10周干預結束后,眼球取血,靜置2 h后離心取適量血清備用。按照試劑盒提供的方法測定小鼠血清中尿素氮、肌酐、尿蛋白(urine protein,UP)表達水平。
1.2.2.4 腎臟組織病理學觀察
腎臟組織于4%的多聚甲醛固定后,石蠟切片厚度約5 μm,按照乙醇脫水、透明、浸蠟、包埋,制備石蠟切片進行HE、Masson與PAS染色,觀察各組小鼠腎組織病理學改變。
1.2.2.5 蛋白免疫印跡法(Western blot)
提取小鼠腎臟組織及細胞樣品的總蛋白,通過BCA法測定蛋白濃度后加熱變性后制備蛋白樣品。經制膠、上樣、電泳、PVDF轉膜、5%脫脂奶粉室溫封閉2 h,TBST洗膜后,加入對應的一抗,4 ℃孵育過夜,TBST洗膜,二抗室溫孵育1 h,ECL發光液顯影,凝膠成像分析儀攝取圖像,計算目標蛋白的灰度值。
1.2.2.6 統計學方法
采用GraphPad Prism 9.0軟件進行統計分析,數據采用均數±標準差(ˉx±s)表示,符合正態分布方差齊性,組間比較采用單因素方差分析;若不符合正態分布,則用非參數檢驗,以P<0.05表示差異有統計學意義。
2 結果
2.1 DHM改善db/db小鼠病理表現
2.1.1 DHM降低db/db小鼠體重和空腹血糖
每周定時測定各組小鼠體重和空腹血糖,結果顯示與NC組相比,DKD組小鼠體重、血糖均明顯升高(P<0.001、P<0.001)。與DKD組小鼠相比,DHM組小鼠的體重和血糖值下降(P<0.01、P<0.01)(見表1、表2)。
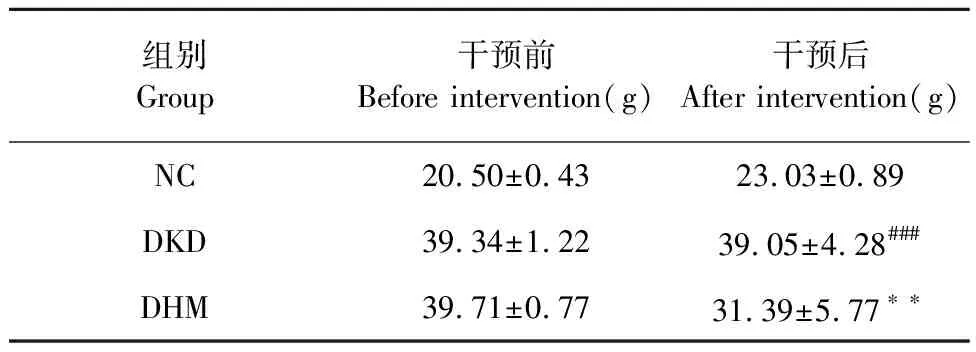
表1 DHM對db/db小鼠體重的影響(ˉx ± s,n = 8)
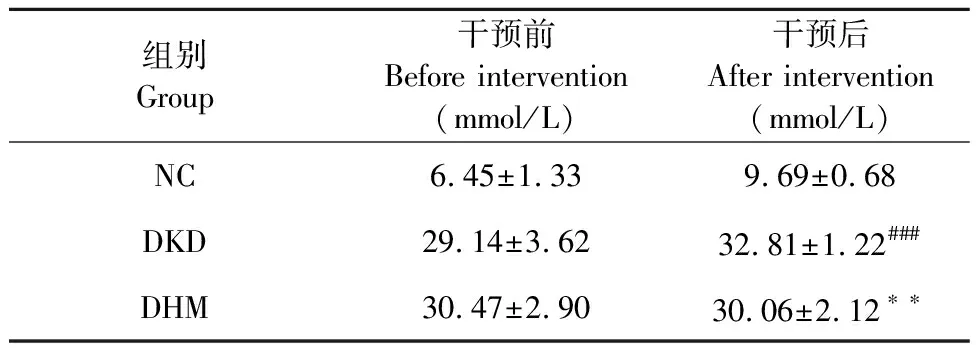
表2 DHM對db/db小鼠空腹血糖的影響(ˉx ± s,n = 8)
2.1.2 DHM改善db/db小鼠的腎功能損傷
與NC組相比,DKD組小鼠血清中肌酐、尿素氮和尿蛋白均明顯升高(P<0.001、P<0.001、P<0.05)。與DKD組相比,DHM組小鼠的肌酐、尿素氮和尿蛋白均有不同程度的下降(P<0.01、P<0.001、P<0.01)(見圖1)。表明DHM可以穩定db/db小鼠腎功能狀態,緩解腎功能損傷。
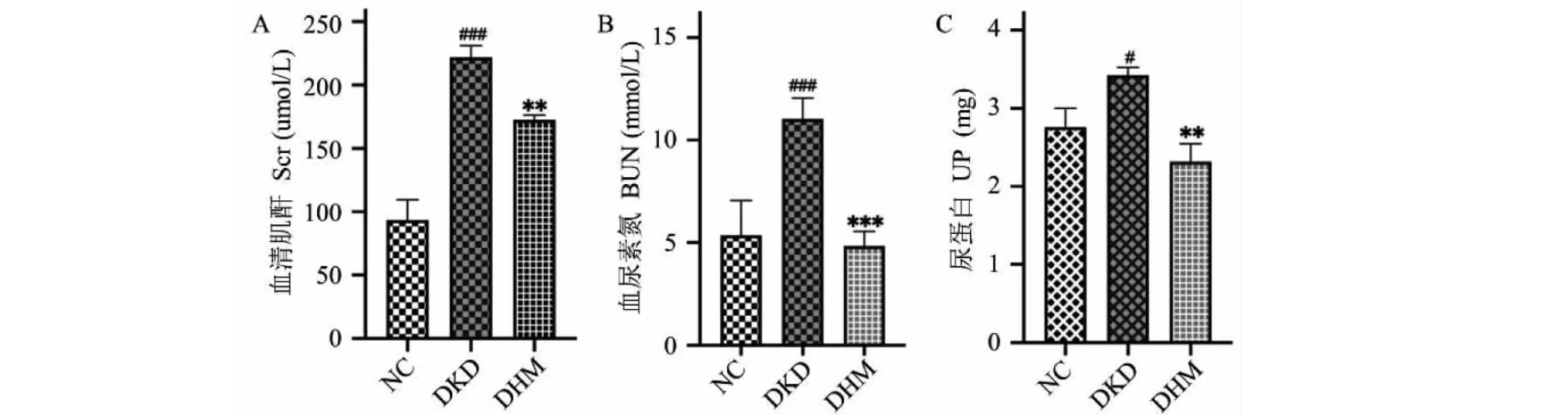
圖1 DHM對db/db小鼠血清中肌酐、尿素氮和尿蛋白的影響(ˉx ± s,n = 4)Fig.1 The expression levels ofScr,BUN and UP in serum of mice in each group (ˉx ± s,n = 4).注:與NC組相比,#P<0.05,###P<0.001;與DKD組相比,**P<0.01,***P<0.001。 Note:Compared with NC,#P<0.05,###P < 0.001;Compared with DKD, **P<0.01,***P<0.001.
2.1.3 DHM減輕db/db小鼠腎病理損傷
為了探究DHM干預對db/db小鼠腎臟病理損傷的影響,各組小鼠病理切片行HE染色、 PAS染色。結果如圖2所示,NC組小鼠腎小球結構規則,腎小管結構清晰,腎小管上皮細胞排列整齊,且基底膜完整;DKD組小鼠腎小球體積增大,腎小球系膜細胞增生,腎間質可見腎小管腫脹且呈空泡樣變性;而DHM組小鼠腎小球體積減小,腎小球系膜細胞輕度增生且基底膜增厚改善,腎間質腎小管腫脹減輕且呈空泡樣變性改善,腎病理損傷程度得到改善(見圖2)。
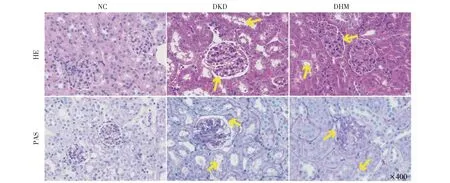
圖2 DHM對db/db小鼠腎臟組織病理學的影響(× 400)Fig.2 Effects of DHM on histopathology of mouse kidney (× 400)
2.1.4 DHM改善db/db小鼠腎纖維化
為了觀察DHM對db/db小鼠腎纖維化的影響,我們對腎臟組織切片行Masson和免疫熒光染色,可見與NC組相比,DKD組小鼠腎臟間質細胞外基質和腎小管膠原纖維蛋白明顯增多,并且小鼠腎皮質和腎髓質中α-SMA、Fibronectin、CollagenI細胞熒光染色陽性信號顯著增強、亮度較強;與DKD組比較,DHM組小鼠腎臟膠原蛋白沉積減少,并且腎臟中α-SMA、Fibronectin、CollagenI細胞熒光染色陽性信號減弱,提示DHM改善db/db小鼠腎纖維化(見圖3)。
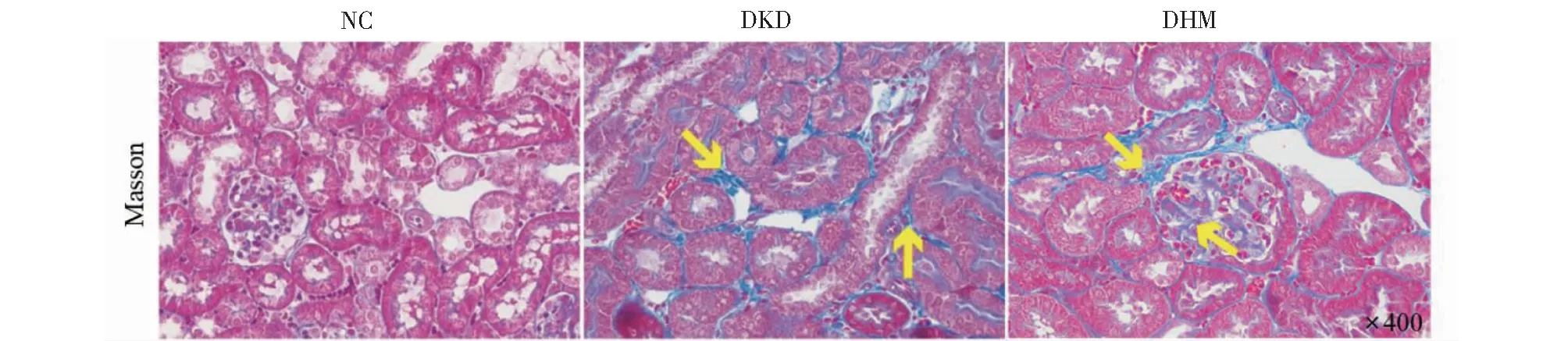
圖3 DHM對db/db小鼠腎臟組織病理學的影響(× 400)Fig.3 Effects of DHM on renal pathology in db/db mice (× 400)
2.2 DHM改善db/db小鼠腎纖維化的網絡藥理學研究
2.2.1 DHM、DKD與RF的靶點獲取與“藥物—靶點—疾病”網絡的構建
通過PharmMapper數據庫共獲取DHM相關靶點379個,分別從DisGeNET數據庫獲取DKD、RF相關靶點1 189、570個。將DHM、DKD和RF靶點取交集后得到37個交集靶點(見圖4),并進一步導入Cytoscape軟件構建“藥物—靶點—疾病”網絡圖(見圖5)。
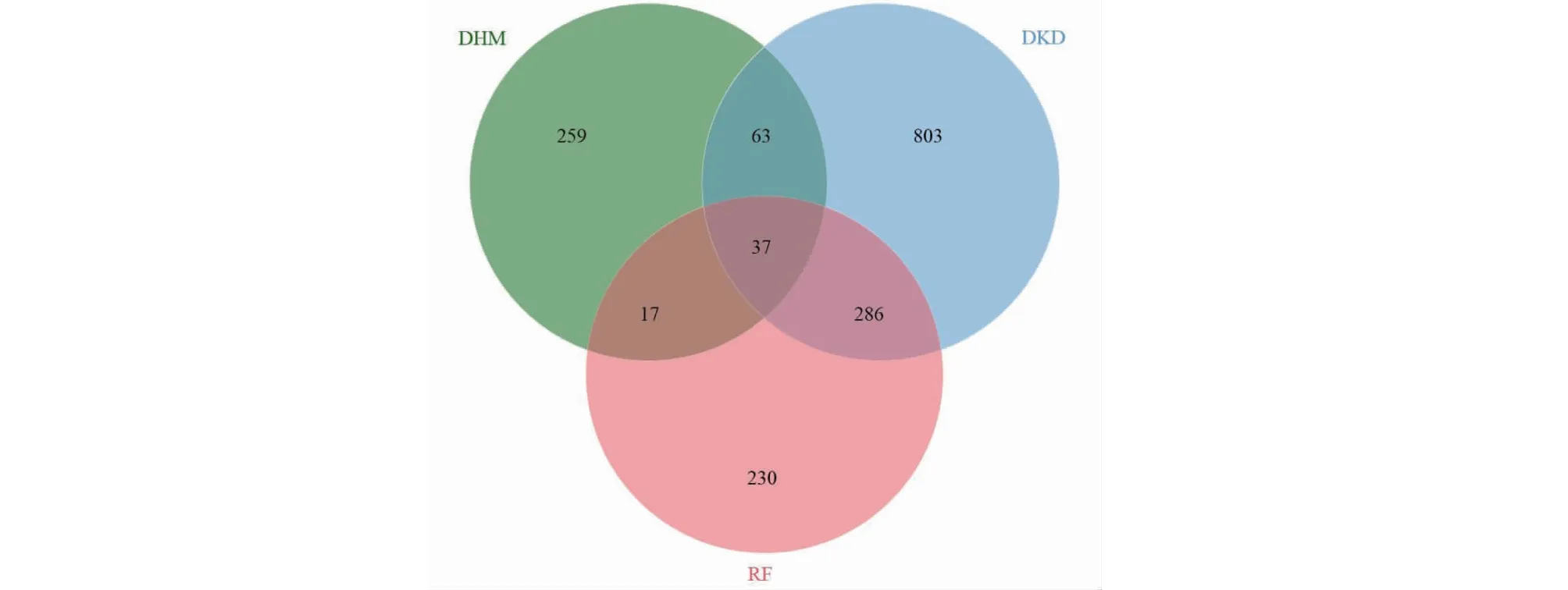
圖4 DHM、DKD與RF靶點Venn圖Fig.4 Venn diagram of intersection targets of DHM,DKD and RF
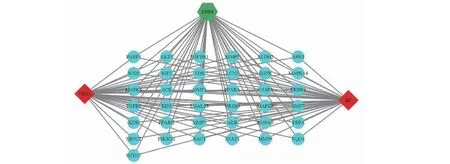
圖5 藥物—靶點—疾病網絡Fig.5 Drug-target-disease network
2.2.2 DHM、DKD與RF交集靶點相互作用的蛋白-蛋白互作PPI網絡構建
將37個交集基因導入String數據庫構建PPI互作網絡。結果顯示該網絡共包含37個節點數,邊數為241,平均節點度為13,聚類系數為0.768(見圖6)。在Cytoscape軟件中使用cytoHubba插件分析并根據度值(degree)獲取前10的靶點,分別為蛋白激酶B1(protein kinase B1,AKT1)、血清中白蛋白(albumin,ALB)、半胱氨酸天冬氨酸蛋白酶-3(cystein-asparate protease-3,CASP3)、表皮生長因子受體(epidermal growth factor receptor,EGFR)、基質金屬蛋白酶-9(matrixmetalloproteinase-9,MMP9)、胰島素樣生長因子-1(insulin-like growth factor-1,IGF1)、過氧化物酶體增殖物激活受體γ(peroxisome proliferator-activated receptor gamma,PPARG)、激酶插入區受體(kinase insert domain receptor,KDR)、MMP2、血管緊張素轉化酶(angiotensin I-converting enzyme,ACE)。隨后將前10位基因進一步可視化(見圖7)。
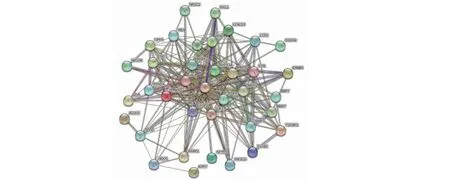
圖6 DHM、DKD與RF靶點PPI網絡圖Fig.6 PPI network diagram of targets of DHM,DKD,and RF
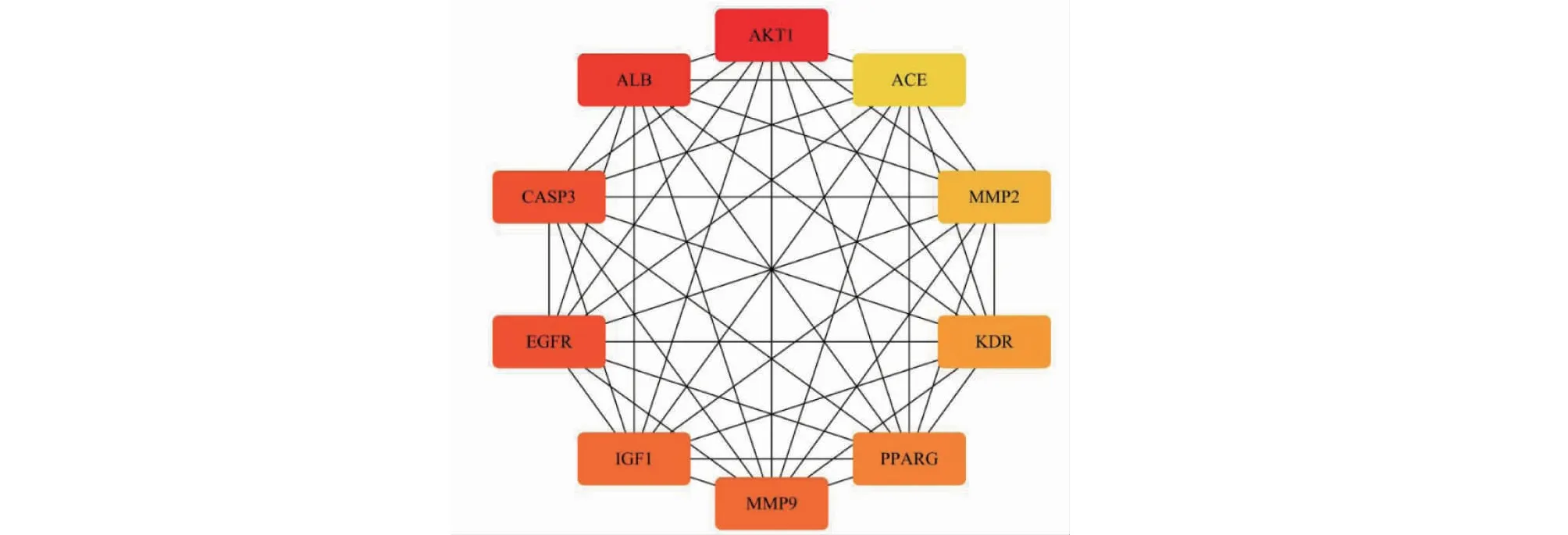
圖7 核心靶點PPI網絡圖Fig.7 PPI network diagram of core target protein
2.2.3 DHM、DKD與RF交集靶點的GO功能富集分析和KEGG通路富集分析
將37個交集基因上傳至David數據庫進行GO功能分析和KEGG富集分析,結果顯示DHM與DKD、RF的聯系涉及GO功能分析中BP 223項、CC 25項以及MF 52項。BP主要涉及凋亡的負調控與正調控、細胞對活性氧的反應以及對缺氧反應等過程(見圖8);CC主要涉及胞外區、受體復合物以及細胞外空間等細胞成分(見圖9);MF則主要集中在鋅離子結合、酶結合和RNA聚合酶II的調節等功能(見圖10)。KEGG通路富集結果顯示DHM對DKD、RF的作用通路可能涉及糖尿病并發癥中的晚期糖基化終末產物(advanced glycation end products,AGE)及其糖基化終末產物受體(receptor for advanced glycation end products,RAGE)信號通路、糖尿病心肌病以及叉頭轉錄因子O亞族(forkhead transcription factor of the O class,FoxO)信號通路等(見圖11)。
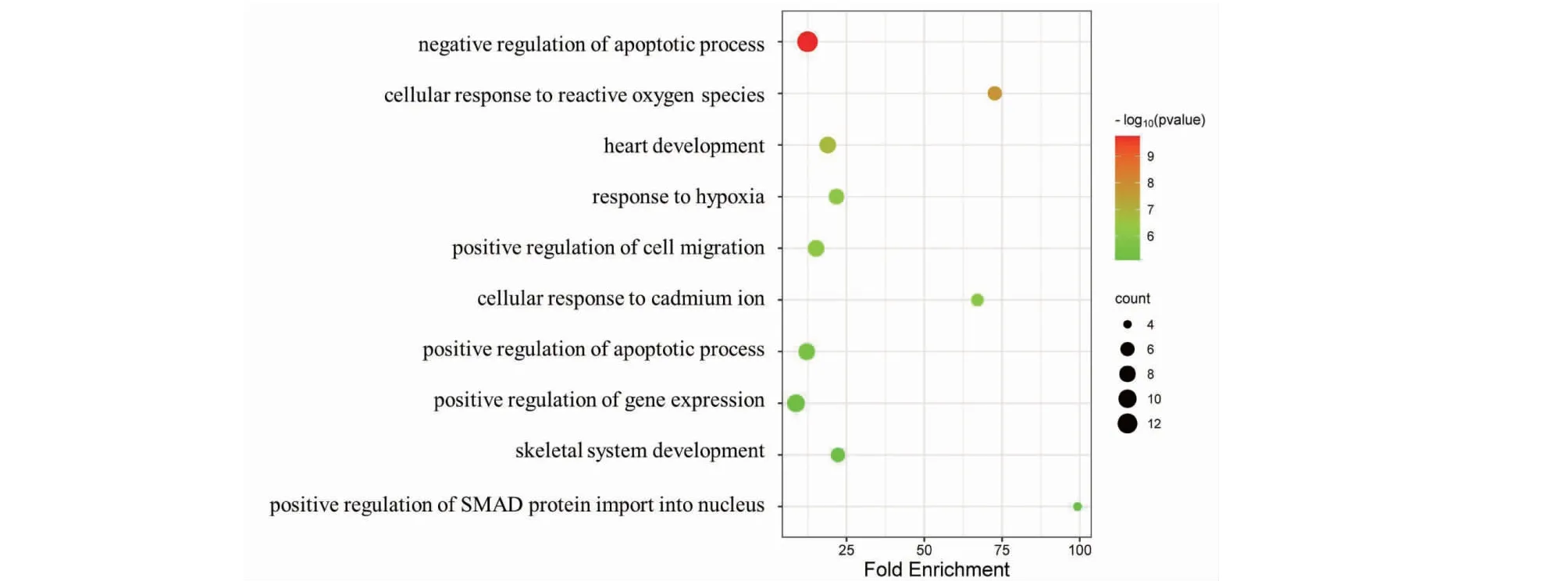
圖8 交集靶點GO功能分析(BP)Fig.8 Intersection target GO function analysis (BP)
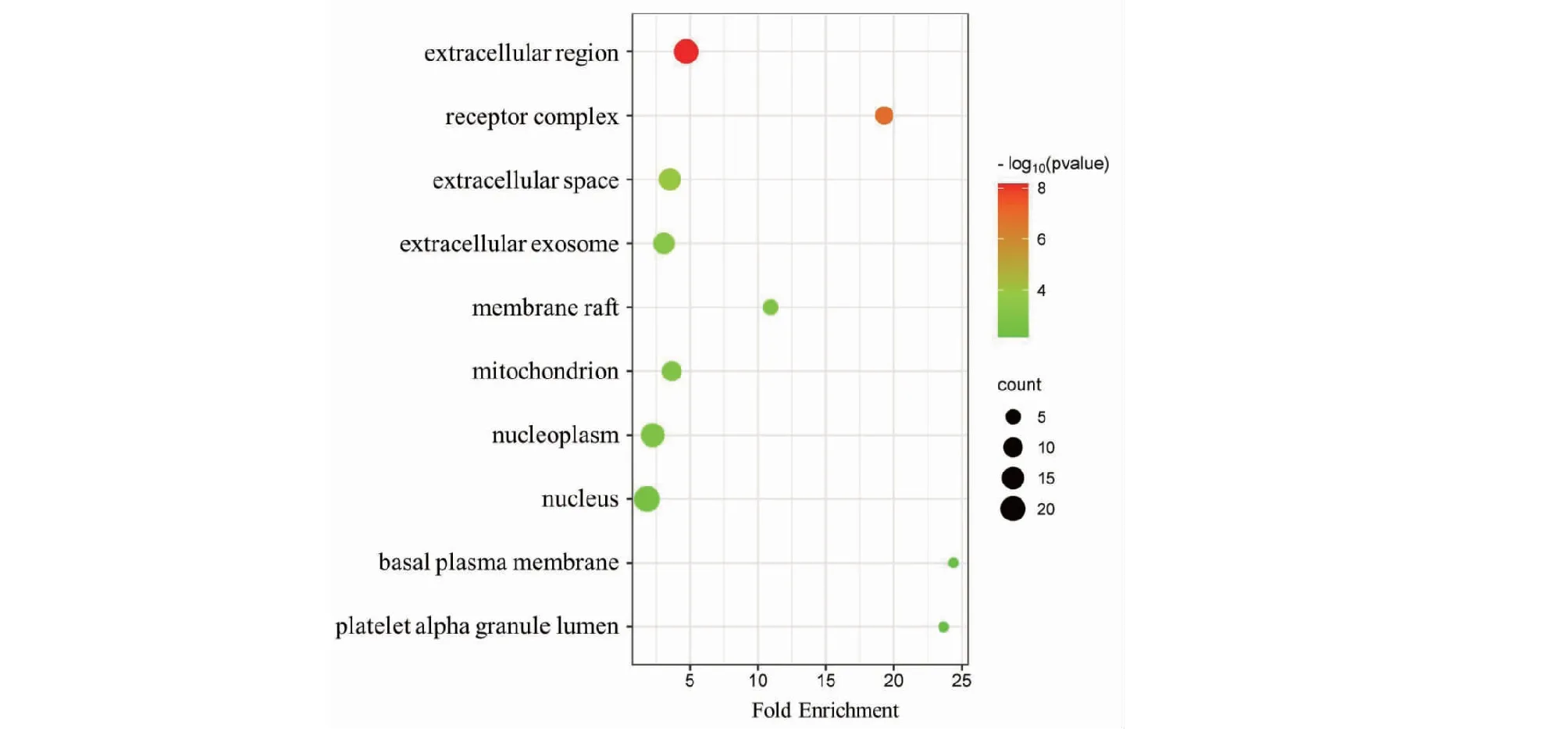
圖9 交集靶點GO功能分析(CC)Fig.9 Intersection target GO function analysis (CC)
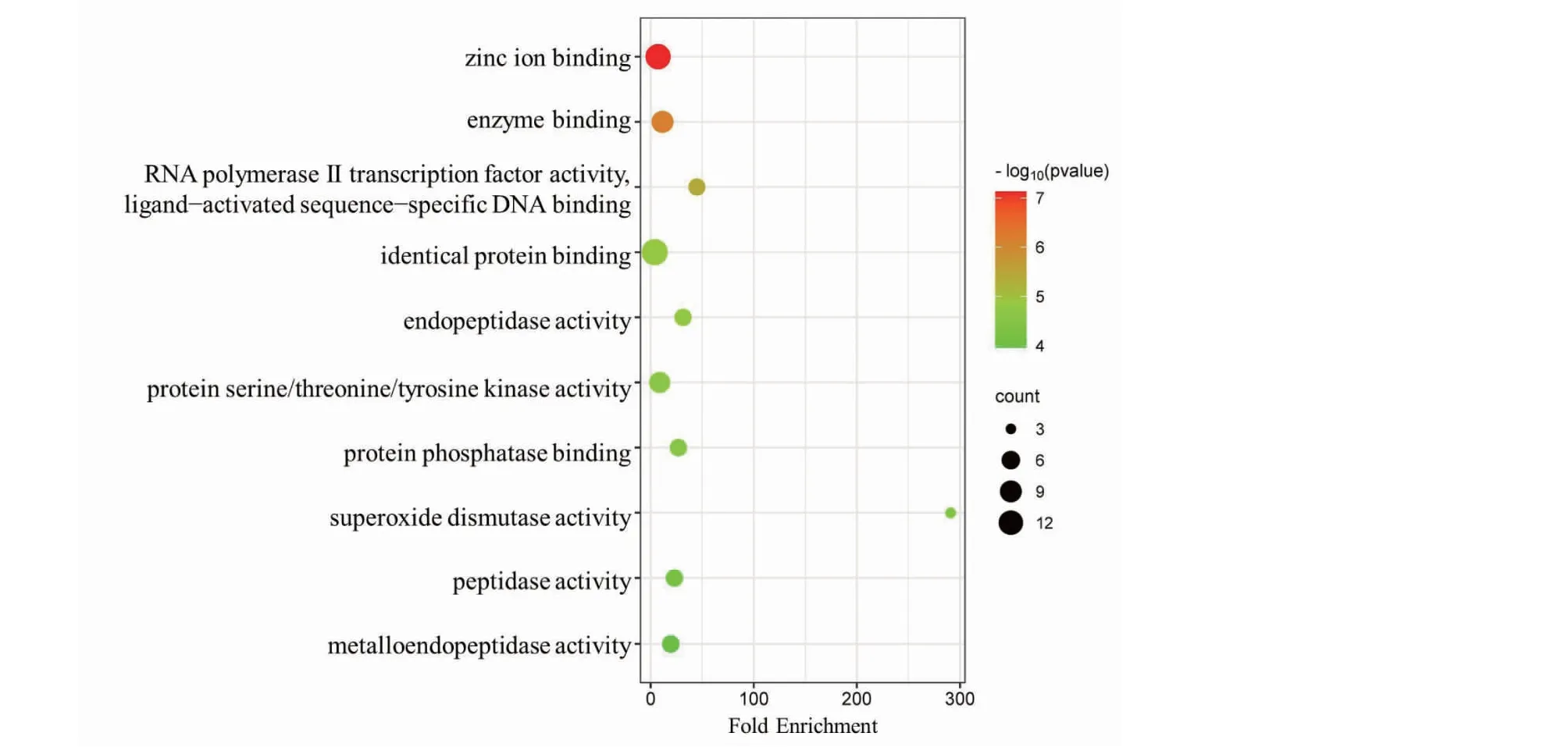
圖10 交集靶點GO功能分析(MF)Fig.10 Intersection target GO function analysis (MF)
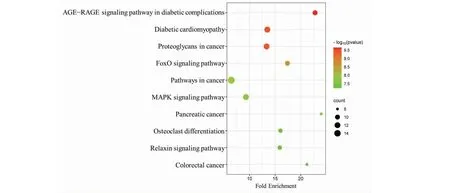
圖11 KEGG通路富集分析Fig.11 Intersection target KEGG pathway enrichment analysis
2.2.4 DHM與靶基因蛋白分子對接結果
將DHM與PPI網絡中degree值前5位的核心靶點(AKT1、ALB、CASP3、EGFR、MMP9)以及結合我們前期研究基礎所選AKT1上游靶點Notch1和PTEN進行分子對接(見圖12)。結果顯示DHM與各靶點蛋白的結合能均小于0 kcal/mol(表3),表示DHM與所選取靶點蛋白均能良好結合,意味著DHM可以通過所對接靶點蛋白進行調控進而改善db/db小鼠DKD。
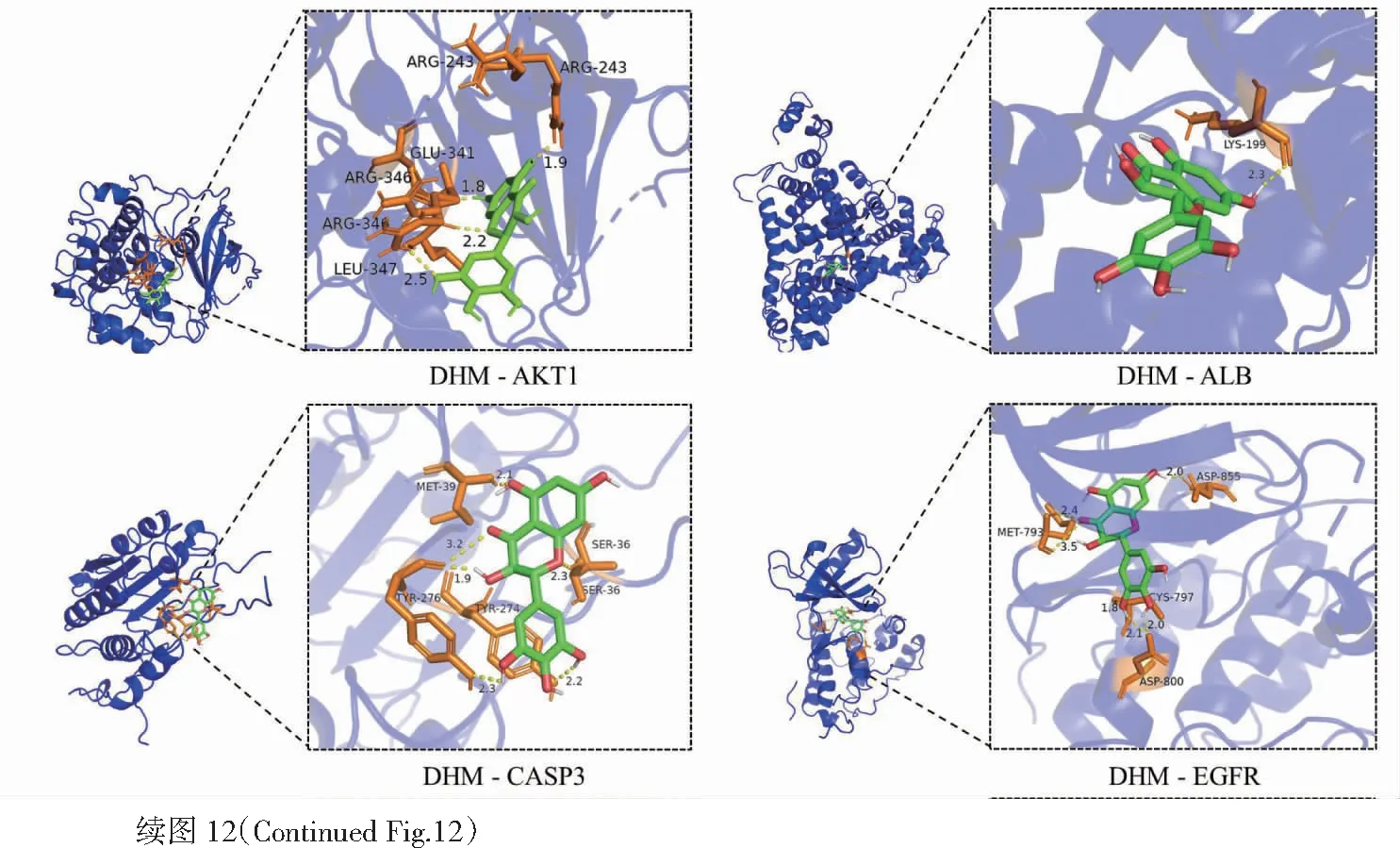
圖12 DHM與核心靶點蛋白分子對接結果模式圖Fig.12 Molecular docking result pattern of DHM and core target protein
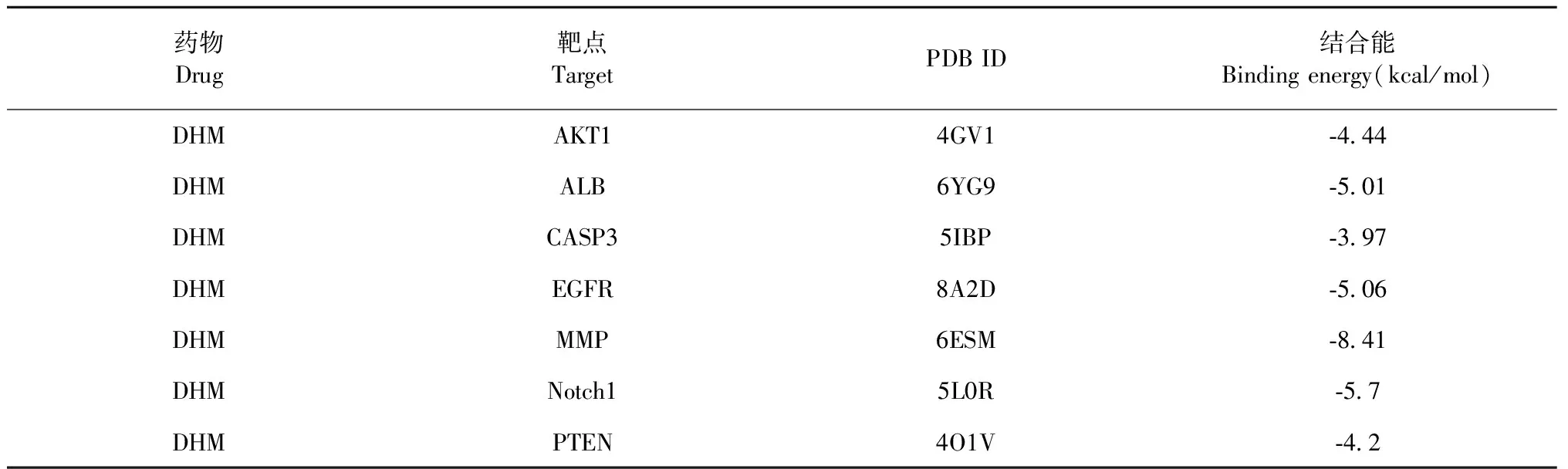
表3 DHM與核心靶點蛋白分子對接結果
2.3 DHM改善db/db小鼠腎纖維化分子機制的實驗驗證
為進一步探討DHM改善db/db小鼠腎纖維化的分子機制,基于網絡藥理學和分子對接結果,結合前期研究基礎,我們對DHM干預的db/db小鼠腎臟中Notch/PTEN/AKT通路相關蛋白的變化進行研究。Western Blot結果顯示,與NC組相比,DKD組小鼠腎組織中的Notch通路出現過度激活,表現為Notch1、NICD、Hes1、Hey1蛋白明顯上調(P<0.05、P<0.01、P<0.001、P<0.01)并抑制PTEN的表達(P<0.01),同時促進AKT的磷酸化,即p-AKT上調(P<0.01)。而DHM干預則可逆轉上述變化, DHM組Notch通路受到抑制,相關蛋白NICD、Hes1、Hey1以及p-AKT的表達均出現下降(P<0.05、P<0.01、P<0.05、P<0.01),而PTEN的表達上調(P<0.001)(見圖13)。提示DHM可能通過調控Notch/PTEN/AKT通路改善db/db小鼠腎纖維化。
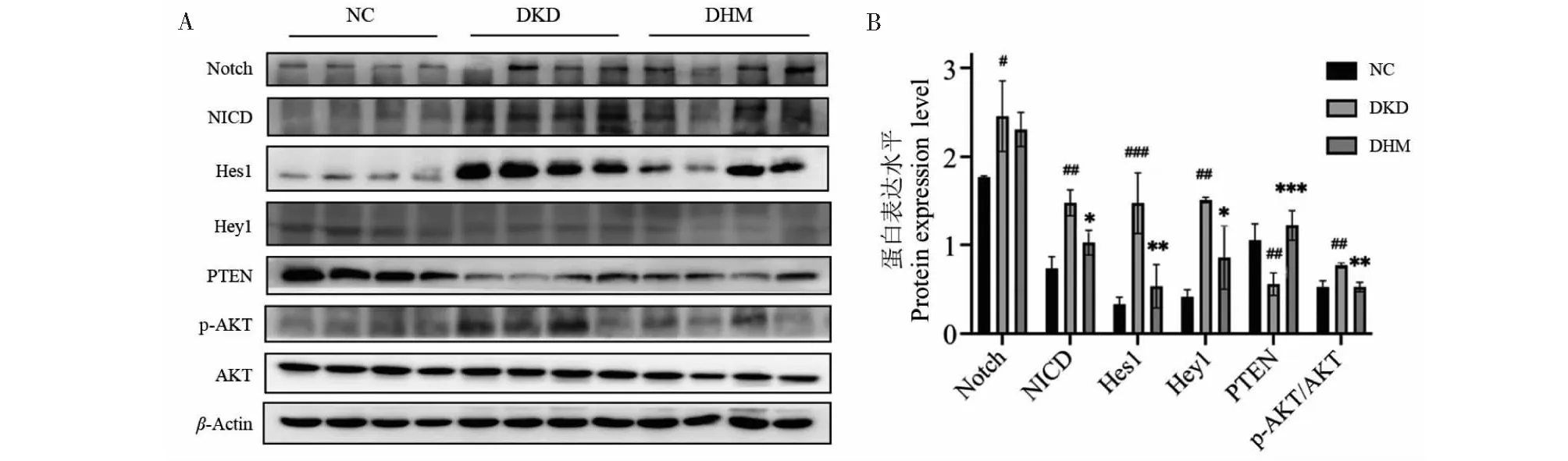
圖13 DHM對db/db小鼠腎臟Notch/PTEN/AKT通路的影響(ˉx ± s,n = 4)Fig.13 Effect of DHM on the Notch/PTEN/AKT pathway in the kidneys of db/db mice(ˉx ± s,n = 4)注:與NC組相比,#P<0.05,##P<0.01,###P < 0.001;與DKD組相比,*P<0.05,**P<0.01,***P<0.001。Note:Compared with NC,#P<0.05,##P<0.01,###P < 0.001;Compared with DKD,*P<0.05,**P<0.01,***P<0.001.
3 討論與結論
目前糖尿病普遍的治療手段主要依靠血糖的控制,而作為糖尿病最嚴重并發癥之一的DKD并無有效治療策略[10,11]。因此深入了解DKD的發病機制以及尋找有效治療策略來抑制DKD向腎纖維化發展的趨勢非常重要。天然藥物已被證實具有較少的副作用以及多靶點療效的獨特優勢,是近年來研發慢性疾病新型藥物的重要來源。對DHM進一步研究發現,DHM在改善代謝性疾病方面顯示出巨大的治療潛力。因此,本研究在DHM改善db/db小鼠的腎纖維化的基礎上,結合網絡藥理學以及分子對接技術深入探討DHM改善db/db小鼠腎纖維化的潛在治療靶點以及分子機制,并通過動物實驗驗證。
首先我們觀察發現10周的DHM干預可以使db/db小鼠血糖、體重、肌酐、尿素氮、尿蛋白及腎臟的病理表現出現有效緩解,意味著DHM可減輕db/db小鼠腎功能損傷,減緩DKD的發展。在對DHM、DKD以及RF的37個交集靶點分析篩選發現AKT1、ALB、CASP3、EGFR、MMP9、IGF1、PPARG、KDR、MMP2、ACE等10個靶點可能是DHM改善DKD的關鍵靶點。其中AKT1、CASP3、EGFR、MMP9、IGF1、MMP2、ACE已被證實在糖尿病環境中被激活,而通過特異性抑制后可改善DKD的受損狀態,減緩纖維化發展的趨勢[12-16]。PPARG、KDR則在糖尿病生理環境下受到抑制,激活后則起到腎臟保護作用[17]。ALB是觀察DKD是糖尿病發展過程中重要的觀察腎臟損傷程度的生化指標,通常表現為隨著DKD的發生而升高,DKD改善后出現下降[18]。意味著我們所篩選出10個關鍵基因不僅可以作為DKD潛在的生物標志物,也可能是進一步探討DKD發病機制以及治療手段的關鍵靶點。
KEGG通路富集分析結果顯示DHM對DKD的改善作用可能涉及AGE-RAGE信號通路、糖尿病心肌病以及FoxO信號通路。其中AGE-RAGE信號通路與FoxO信號通路在DKD發展過程中具有關鍵的調控作用。研究發現AGEs在DKD患者的內皮細胞、腎小管和系膜細胞以及足細胞等細胞出現特異性激活,并與RAGE相互作用增強,進一步加劇腎臟中的氧化應激和炎癥,導致DKD的惡化[19]。另外,活化的FoxO3a則可以抑制糖尿病大鼠腎臟中的氧化應激水平,改善炎癥,進而抑制DKD的發生[20]。表明特異性調控AGE-RAGE信號通路或FoxO信號通路可能對防治DKD具有重要意義。
分子對接結果顯示DHM與所選排名前5的靶點均能表現出良好的結合性,意味著DHM治療DKD的有效性在分子層面得到驗證。此外我們注意到所篩選排名第一的關鍵靶基因AKT1與KEGG通路富集分析得到AGE-RAGE信號通路和FoxO信號通路在DKD發展中密切相關。其中AGE-RAGE信號通路可協同PI3K/Akt信號通路誘發腎臟內的氧化應激和慢性炎癥,進而導致腎臟疾病[21]。而PI3K/Akt/FoxO3a通路的激活則可以改善糖尿病環境下腎臟的生理功能[22]。因此,我們進一步嘗試探究AKT1上游的Notch通路與DHM的相互作用并進行分子對接驗證。分子對接結果顯示DHM與Notch1、PTEN均表現出了良好的結合性。
既往研究表明,在DKD發展過程中Notch通路出現過度激活,表現為Notch1、NICD、Hes1和Hey1的表達上升[23]。Notch1的抑制劑則可以通過降低Hes1的活化來激活PTEN,進而改善自噬障礙,減緩RF的發生[24]。此外,另有研究發現PTEN的激活也可以通過抑制PI3K/AKT通路來緩解DKD的進展[25,26]。基于以上結果,我們推測DHM可以通過調控Notch/PTEN/AKT通路改善DKD。Western blot結果顯示db/db小鼠腎臟中Notch通路活化程度異常升高,PTEN表達降低以及AKT的磷酸化增加。而DHM攝入可以抑制Notch通路的活化,激活PTEN并抑制AKT的磷酸化。盡管Notch/PTEN/AKT信號軸作為整體路徑在糖尿病環境下的腎臟保護作用研究較少,但我們的研究一定程度上完善了相關研究,并豐富了DHM通過多靶點發揮其生物學保護作用的分子機制。
綜上所述,本研究以觀察DHM改善DKD病理表現的結果為基礎,結合網絡藥理學及分子對接技術初步論證了DHM改善DKD進展的作用可能通過AKT1、ALB、CASP3、EGFR、MMP9、IGF1、PPARG、KDR、MMP2、ACE等關鍵靶點來實現,并對相關通路進行了分析。最后結合動物實驗對DHM潛在的AKT靶點進行了初步驗證及分析,發現DHM可能通過調控Notch/PTEN/AKT通路起到防治DKD的作用(見圖14)。但目前關于DHM對T2DM的并發癥研究相對較少,其治療潛力仍待進一步研究。
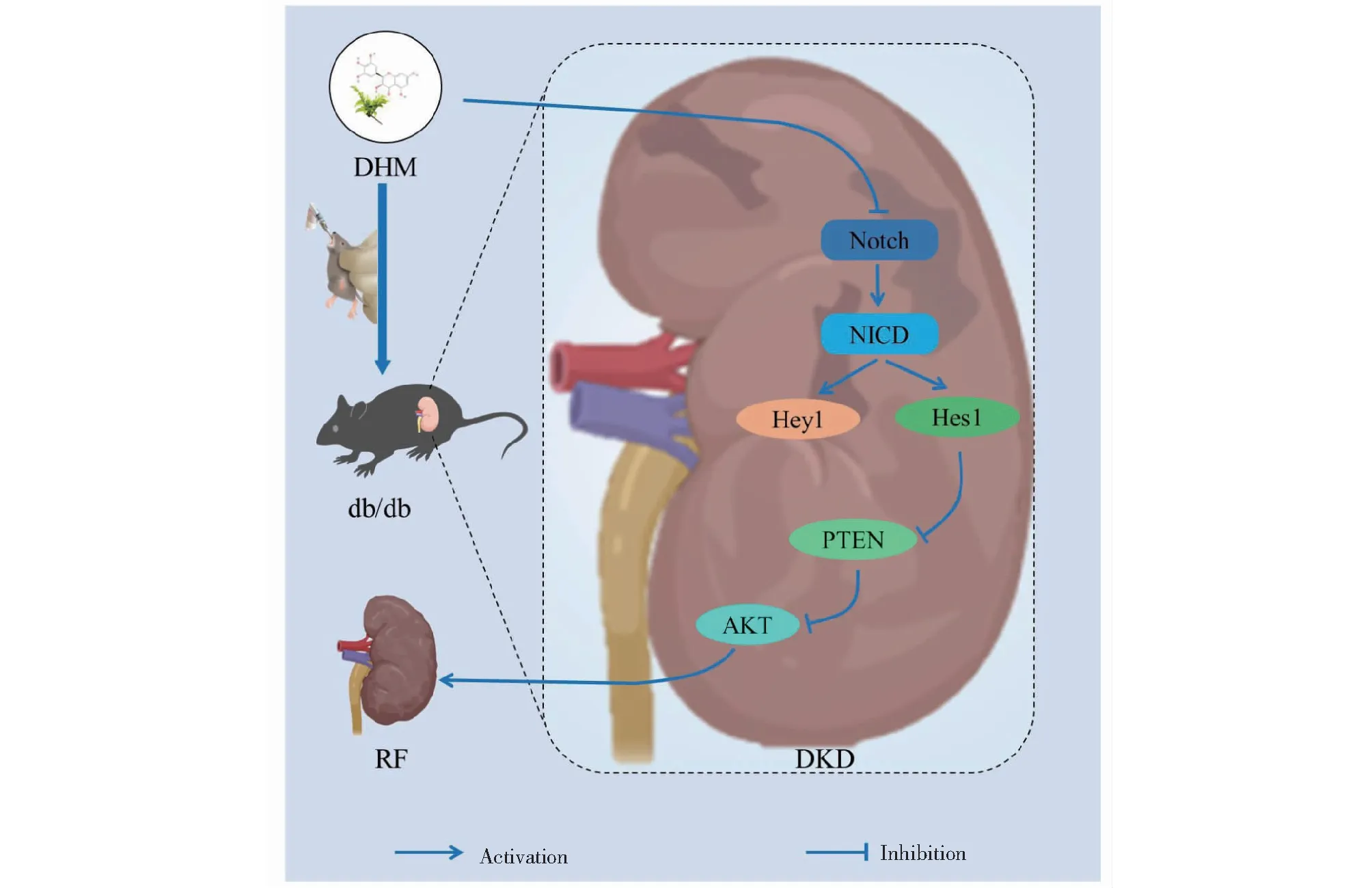
圖14 DHM通過調控Notch/PTEN/AKT通路改善db/db小鼠腎纖維化Fig.14 DHM improves renal fibrosis in db/db mice by regulating Notch/PTEN/AKT signaling pathway

