ERM蛋白在哺乳動物卵母細胞成熟和受精中的研究進展
邵 靜,張 穎,唐 毓,許保增
(中國農業科學院特產研究所,長春 130112)
卵母細胞是現階段所能觀察到的雌性哺乳動物體內最大的細胞,也是唯一的生殖細胞。和體細胞相比,卵母細胞的數量非常有限,并且不會再增殖。隨著體外受精、動物克隆與轉基因動物生產等生物學技術的快速發展,卵母細胞的重要性被體現的淋漓盡致。一顆獲得良好發育的成熟卵母細胞是保障受精的順利進行、雙倍體合子的形成和早期胚胎基因組激活的物質前提[1]。卵母細胞的成熟受到一系列機制細致精密的調控,是多種信號通路相互協同又互相拮抗的結果。在受精過程中,只有細胞核與細胞質均發育成熟的卵母細胞才會對精子的結合釋放出正確的應答反應,共同形成一個具有發育潛能的受精卵[2]。
很多研究認為,ERM蛋白參與了卵母細胞成熟和受精的過程。ERM家族是埃茲蛋白(ezrin)、根蛋白(radixin)和膜突蛋白(moesin)的統稱,幾乎所有的哺乳動物中都存在ERM蛋白,并且這3個蛋白的序列高度保守,共有序列高達75%,使它們在功能上非常相似[3]。ERM蛋白憑借其特殊的分子結構,可以直接或間接地與跨膜蛋白和肌動蛋白結合,從而作為“腳手架”,形成膜蛋白-ERM蛋白-細胞骨架蛋白復合體,參與構建并維持細胞皮層。細胞皮層通常被定義為質膜下方比較致密的肌動蛋白細胞骨架層,由微絲和微絲結合蛋白交聯成凝膠狀態的三維網狀結構,在質膜與胞質之間形成了均勻的細胞質皮質區[4]。細胞皮層可以參與細胞形態的改變、細胞間的相互作用以及細胞膜對細胞的調節作用。ERM作為細胞皮層的核心組分,廣泛分布在細胞質基質、片狀偽足、絲狀偽足和微絨毛中,控制肌動蛋白細胞骨架動力學,參與細胞膜的組成、囊泡形成、細胞遷移、信號傳遞、跨膜蛋白定位和皮質張力調節等生理過程[5]。
哺乳動物卵母細胞有高度組織化的細胞皮層,包括密集的微絨毛排列和復雜的微絲帽結構。在哺乳動物卵母細胞成熟過程中,紡錘體要靠皮質肌動蛋白的牽拉遠離細胞中心,實現胞質不對稱減數分裂[6]。在哺乳動物受精過程中,卵母細胞質膜和細胞骨架之間的關聯通路可以保障精子與卵子的成功融合,例如,精子需要與卵質膜上的微絨毛結合才能進入卵母細胞[7],而微絨毛和細胞內部的信號傳遞,需要ERM蛋白將質膜、跨膜蛋白和基底的肌動蛋白串聯起來,形成完整的調節路徑,改變膜蛋白的動力性能[8]。這類生殖活動普遍都有ERM的參與,但是ERM蛋白家族在其中發揮的具體作用機制卻很少受到深入研究。本文將以ERM蛋白為中心,概述其在哺乳動物卵母細胞減數分裂成熟和受精過程中參與的各種調控作用。
1 ERM蛋白的分子結構及特點
1.1 ERM蛋白的分子結構
ERM蛋白能夠廣泛參與細胞的多個生理過程都是依賴于它特殊的組成結構。在人類中,ezrin、radixin和moesin蛋白分別由585、583和577個氨基酸殘基組成,ERM蛋白質家族的氨基(N)末端是由大約300個氨基酸殘基組成的球狀FERM結構域,該結構域由3個子域(F1、F2和F3)一起交疊成三葉草的形狀;羧基(C)末端是由大約100個氨基酸殘基組成的C-ERMAD結構域;兩端中間是約150個氨基酸殘基組成的α-螺旋結構,不同物種間ERM蛋白的序列差異幾乎都來自于這段區域[9]。
ERM有兩種構象狀態:一種非活性狀態,大多數細胞的ERM蛋白都是這種休眠狀態,其N端的FERM結構域和C端的C-ERMAD相互抑制,以頭對尾的方式結合起來,α螺旋區盤繞在它們中間,掩蓋了它們與細胞骨架和細胞質膜的結合位點,成為閉合構象的失活狀態,在細胞質中以單體環或二聚體的形式存在;另一種是定位在質膜上的非折疊的活性狀態,其激活的標志是ezrin、radixin和moesin中第567、564、558位的蘇氨酸殘基被磷酸化,C-ERMAD從FERM結構域中釋放出來,暴露出兩端的結合位點[10](圖1)。
1.2 ERM蛋白介導質膜與肌動蛋白的連接
肌動蛋白是細胞骨架的主要成分,多以球形單體(G-肌動蛋白)和聚合纖維(F-肌動蛋白)兩種形式存在于真核生物中,肌動蛋白聚合成微絲,在細胞表面形成應力纖維、板狀偽足、絲狀偽足、黏著斑、微絨毛、分裂環等結構,參與細胞分裂和細胞遷移等許多生物學過程[12],卵母細胞的減數分裂和受精也離不開復雜的微絲網絡。
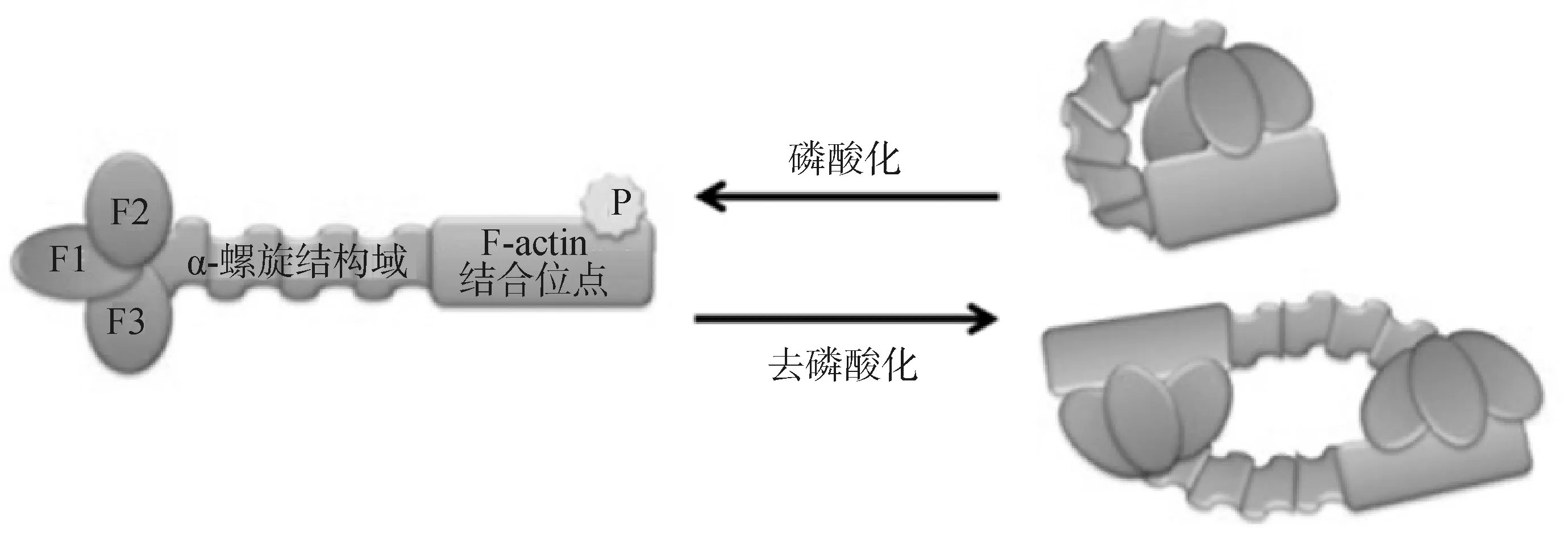
圖1 ERM蛋白的兩種構像示意圖[11]Fig.1 Diagrams of two conformations of ERM proteins[11]
ERM蛋白在磷酸化與非磷酸化狀態中的可逆轉變,是調節質膜與肌動蛋白相互作用的關鍵。能夠控制ERM活性的分子有很多,包括與肌動蛋白組裝有關的Ran GTPase[13],與細胞極化有關的趨化因子,以及針對蘇氨酸的磷酸酶、激酶和它們的抑制劑[14]。當ERM蛋白C-ERMAD結構域的蘇氨酸被去磷酸化,ERM會從細胞皮層脫離,游離于細胞質中。“開放”的ERM蛋白FERM結構域與酸性的磷脂酰肌醇-4,5-二磷酸(PI(4,5)P2)結合并經過修飾后,可以促進C末端保守的蘇氨酸殘基發生磷酸化,磷酸化的C-ERMAD結構域帶上負電,與FERM區域的負電荷發生排斥,使ERM蛋白的折疊構象打開[15]。
ERM蛋白C末端結構域包含肌動蛋白結合位點,而ERM的N末端FERM結構域可以與跨膜蛋白留在細胞質部分的帶正電荷氨基酸簇的尾部直接結合,也可以通過先與支架蛋白EBP50或E3K-ARP結合,然后利用該蛋白的PDZ結構域間接關聯到膜蛋白[16]。與ERM結合的膜蛋白很多都是粘附分子,包括CD44、CD43、PSGL-1和ICAM-1-3等[17-19]。目前的研究表明,ERM蛋白是連接整合膜蛋白與作為細胞骨架的皮質層肌動蛋白的接頭蛋白。許多跨膜蛋白都是通過與胞質中的細胞骨架蛋白結合來改變細胞形狀,并參與細胞粘附、細胞運動并維持細胞表面的信息交流,包括胞吞和胞吐作用[20-21]。ERM蛋白通過同時與整合膜蛋白、膜相關細胞質蛋白和肌動蛋白絲之間相互結合,組建專門的膜結構域,將胞外信號輸送到細胞內,從而介導細胞遷移[22]、細胞分裂[23]、信號傳導[24]、跨內皮細胞遷移[25]、微絨毛形成[26]以及細胞極性的建立[27]等重大生物學事件。
2 ERM蛋白參與卵母細胞成熟
卵母細胞的成熟指的是處于第一次減數分裂前期的雙線期,也就是生發泡期(GV)的卵母細胞經歷連續兩次減數分裂并最終停滯在減數第二次分裂中期(MⅡ)的過程(圖2)。
2.1 ERM蛋白調控卵母細胞-顆粒細胞間的雙向信號傳導
哺乳動物從出生就已經具備了一生的原始卵泡池,里面含有處于GV期的休眠卵母細胞和包裹著它的尚未分化的前顆粒細胞。原始卵泡是雌性哺乳動物的基本生殖單位[29]。卵母細胞只有接收到周圍顆粒細胞釋放的調節信號,才能突破休眠開始發育。該過程包含復雜的信號通路。前顆粒細胞受到營養、壓力、能量、生長因子等信號刺激后,激活mTORC1信號通路,進而分化為顆粒細胞[30]。mTORC1信號通路繼續促進顆粒細胞分泌生長因子KIT配體,與休眠卵母細胞表面的KIT受體結合,激活卵母細胞內的PI3K信號通路,下游FOXO3a被磷酸化并從卵母細胞的細胞核中轉移到細胞質中,使休眠的卵母細胞開始生長,原始卵泡被激活為初級卵泡[31-32]。此時的顆粒細胞開始表達縫隙連接蛋白43(CX43),將彼此相鄰的顆粒細胞連通起來;同時卵母細胞表達CX37蛋白,形成卵母細胞-顆粒細胞間的縫隙連接[33]。磷酸化的ezrin蛋白可以與CX43結合,而中間的α-螺旋區有一個AKB結構域,可以與蛋白激酶A(PKA)的調節亞基結合,ezrin蛋白將PKA錨定在下游,形成PKA-ezrin-CX43復合體,cAMP激活PKA后,使PKA釋放出兩個催化亞基將CX43在369和373位的絲氨酸殘基磷酸化[34-35]。ezrin蛋白就以這種方式參與由cAMP/PKA信號通路介導的縫隙連接。在縫隙連接的介導下,顆粒細胞將能夠調節卵母細胞pH和滲透壓的離子、氨基酸和葡萄糖等分子以及保持卵母細胞長時間停滯在GV期所需的cGMP和cAMP傳遞到卵母細胞中[36]。但是透明帶的形成使卵母細胞-顆粒細胞間有了一層物理性屏障,為了克服這層阻礙,透明帶中出現了兩種不同來源的突起狀結構(圖3)[37]。一種是由顆粒細胞發射出的跨透明帶的絲狀偽足(granulosa cell transzonal projections, GC-TZPs);另一種則是卵母細胞產生的狀似蘑菇的頂端帶囊泡的微絨毛結構(oocyte microvilli, Oo-Mvi)[38]。與顆粒細胞TZP相比,Oo-Mvi要稀疏很多。
微絨毛是細胞質伸出的微細指狀突起,表面被細胞膜包裹,內部為細胞質,軸心是肌動蛋白聚合形成的微絲,廣泛存在于動物細胞的表面,在卵母細胞和上皮細胞等吸收代謝機能旺盛的細胞中尤其常見[39]。因為微絨毛的存在可以增加細胞的表面積,同時微絨毛也可以伸縮和擺動,使細胞與外界微環境充分接觸,所以富集微絨毛的細胞一般都需要頻繁進行細胞與細胞間的物質交換和信息交流。附著在卵母細胞表面的微絨毛比體細胞還有一系列特殊的細胞行為。
微絨毛在卵母細胞不同發育階段所起的主要作用是不同的。未成熟的卵母細胞會通過微絨毛從周圍的顆粒細胞中獲取營養物質和信息分子以滿足自身的發育需求,也會通過微絨毛釋放生長分化因子9(GDF9)和骨形態發生蛋白15(BMP15)等分泌因子,促進卵泡生長和顆粒細胞增殖[40]。如果阻斷顆粒細胞對卵母細胞的聯系,微絨毛就會退化,顆粒細胞提前黃體化,這顆卵泡將來會成為不能排卵的閉鎖卵泡[41]。排卵前卵母細胞表面的微絨毛會塌陷回縮,從而切斷與卵丘細胞間的聯系,方便其從卵泡中排出[42]。排卵后2~4 h,卵母細胞表面塌陷的微絨毛又會再次樹立起來,并且變得更加細長,此時的卵子最適合與精子接觸融合。排卵后8 h還沒與精子結合的卵母細胞開始老化,卵質膜上的微絨毛退化變粗,不利于精子的粘附和細胞膜的融合。
很早就有研究認為,ERM蛋白參與微絨毛的組裝和維持,以確保其與胞質的強粘附性[43]。磷酸化的ERM蛋白通過連接肌動蛋白絲與整合膜蛋白形成微絨毛,常與微絨毛結構共定位。敲除ERM家族的radixin后卵母細胞表面微絨毛結構缺失,富集在微絨毛小泡中的卵母細胞分泌因子由于不能排出而堆積在卵母細胞中,抑制了顆粒細胞的增殖擴散,使卵泡發育水平整體降低,最終導致排卵異常,產仔率低,降低雌性哺乳動物的繁殖力[38]。小鼠卵母細胞中radixin的mRNA水平最高可達卵巢體細胞和其他組織中的700倍,其蛋白通常呈現激活狀態,radixin在卵巢組織中存在如此大的組織特異性表達,可能是因為radixin在卵母細胞中承擔著參與微絨毛形成的特殊功能[38]。
2.2 ERM蛋白調節卵母細胞的不對稱分裂
與精子的產生不同,雌性哺乳動物的減數分裂最終只能形成一個成熟的卵母細胞。初級卵母細胞需要經過兩次不對稱分裂才能在形成單倍體的基礎上保證大部分母源物質都留在卵母細胞中,以供早期胚胎的發育[44]。
卵母細胞的極性造成了紡錘體的不對稱定位,從而導致了胞質的不均等分裂[45]。GVBD之后,卵母細胞紡錘體在胞質中心組裝并向皮質區遷移,這一行為會導致覆蓋于紡錘體上方的皮層形成一個富含肌動蛋白的區域,稱為肌動蛋白帽[46]。這個區域幾乎沒有皮質顆粒存在,是極體最終排出的位置[47]。介導卵母細胞出現這種皮質區極化現象的是Ran-GTP信號通路[48]。染色體偏離中心向質膜移動使細胞出現了Ran-GTP濃度梯度,Ran-GTP濃度梯度通過CDC42激活皮質區的成核促進因子N-WASP,從而激活下游的肌動蛋白成核因子Arp2/3復合物,使紡錘體上方的皮質區積累大量肌動蛋白形成肌動蛋白帽[49]。同時肌動蛋白絲不斷地從肌動蛋白帽流出,形成細胞環流,推動紡錘體向卵質膜移動[50]。到MII時期,紡錘體就會停留在皮質區附近,且平行于細胞皮層。一旦發生受精,卵母細胞被激活,紡錘體會發生旋轉,改為垂直于細胞皮層,進而排出第二極體。但如果敲除ERM蛋白,卵母細胞的皮質張力會下降,紡錘體無法正常旋轉,導致兩極發生扭曲,向皮層頂起兩個類似極體的凸起,第二極體不能排出,卵母細胞也不能向后發育[51]。
有研究發現,Ran-GTP酶也可以誘導ERM蛋白的去磷酸化,使肌動蛋白帽缺乏ERM蛋白活性,從而造成該區域沒有微絨毛的覆蓋(圖4)[13]。微絨毛的區域性缺失也保障了卵母細胞的順利分裂。因為微絨毛上富集著精卵結合蛋白,極體從微絨毛缺失的區域排出,可以避免精子從極體排出的位置入卵,造成父本遺傳物質的丟失。這些研究結果都反映了ERM蛋白在維持卵母細胞的細胞極性,推動胞質不對稱分裂等重要的生物學事件中扮演著重要角色。
3 ERM蛋白在精卵融合中的作用
精子與卵子的結合與融合是受精過程的關鍵步驟,依賴于精子和卵子之間復雜的分子識別體系和多對配體與受體間的協作,從而促使兩個配子的質膜融合[52]。卵母細胞膜上的微絨毛是精子的初始結合點,可以捕獲并包裹靠近卵母細胞的精子,將精子拽到卵子內部。該行為在受精過程里發揮著核心作用[53]。哺乳動物成熟卵母細胞表面是不均一的,面積較大的區域覆蓋著密集的微絨毛,而減數第二次分裂中期紡錘體貼近的那小部分區域的卵質膜卻是光滑的,這是因為精卵結合和融合的位點集中在微絨毛上,該區域缺乏微絨毛可以避免精子從紡錘體方向入卵使父系染色體隨第二極體排出[54]。其實在很多體細胞中,微絨毛也同樣擔負著細胞粘附的功能,例如白細胞粘附分子L-選擇素在微絨毛頂端表達,其尾部可以通過與ERM蛋白的N-末端結合連接肌動蛋白骨架,使白細胞粘附在內皮細胞上并沿著血管內皮滾動[55]。
CD9 (cluster of differentiation 9)是四跨膜蛋白超家族的成員之一,有研究發現該蛋白可以激活卵母細胞膜上的精子與卵子的融合位點;也可以借助外泌體的形式,將自身包裹在囊泡中從卵質膜釋放到卵周隙,促進精子附著和精卵融合[56-59]。與磷酸化ERM蛋白的表達模式相似,CD9覆蓋在卵母細胞的表面,但成熟卵母細胞不發生精卵融合的無微絨毛區域則沒有CD9的表達[60]。卵母細胞敲除CD9后,微絨毛變得又短又粗[61],不易包裹精子,精子和卵子可以結合但最終無法融合,導致受精失敗[62],注射外源CD9的mRNA后,受精率大幅度提高[63]。而敲除CD9基因的小鼠雖然可以正常排卵,但是精子卻都被阻擋在卵周隙,無法與卵子融合,導致雌性的生育能力急劇降低[64]。免疫球蛋白超家族成員EWI-2和EWI-F是CD9的伙伴分子,其位于胞質的結構域中含有帶正電荷的氨基酸,可以直接與ERM蛋白氨基末端的結構域結合,共同定位于細胞表面的微絨毛區域[65]。CD9與EWI-2和EWI-F結合形成復合體后,可以借助EWI-2和EWI-F與ERM的互作進而與微絨毛核心的肌動蛋白絲偶聯在一起。也就是說,雖然CD9蛋白需要與細胞膜上的整合素等膜受體相互作用共同調控受精過程,但是只有通過CD9-EWI-2/EWI-F-ERM復合體將卵母細胞表面的精卵融合蛋白間接錨定到細胞骨架上,才能調節最適合精卵融合的微絨毛的動態結構,保障這些蛋白正常發揮作用[57]。
糖基磷脂酰肌醇錨定蛋白(GPI-APs)是一類借助自身羧基末端糖基-磷脂酰肌醇基團錨定到細胞膜外側的蛋白質,不含跨膜組分[66]。磷脂酰肌醇磷酸脂酶C(PI-PLC)可水解大多數GPI-APs。用PI-PLC剝離卵質膜上的GPI-APs,精卵可以結合但不能融合[67]。葉酸受體4(FOLR4)也是一種參與精卵融合的GPI錨定蛋白,位于卵質膜上,與精子膜上的IZUMO1是一對精卵融合蛋白,所以又被命名為IZUMO1R或JUNO,這兩種蛋白是精子和卵子能夠認出對方的“身份證”。JUNO在成熟的卵母細胞上高表達,精卵結融合后JUNO會通過微絨毛上的小泡釋放到膜外,受精40 min后就已經檢測不到了,有研究認為JUNO受精后的脫落機制可能是為了防止多精受精[68]。兩種膜蛋白的結合也需要CD9的協助,比如CD9會在受精前將JUNO招募到精卵融合位點,促進JUNO與IZUMO1的結合[69]。修飾后的GPI-APs到達內質網出口位點(ERES)由細胞質被膜復合體Ⅱ(COPⅡ)形成分泌小泡后從內質網轉運到高爾基體,再運輸到細胞膜表面,作為膜蛋白發揮功能[70]。有研究發現,ERM家族Radixin和Moesin可能通過介導細胞骨架重組參與驅動COPⅡ囊泡的運輸從而影響GPI-APs的轉運[71]。
4 ERM蛋白阻止多精受精
胎盤類哺乳動物是單精受精動物,只有一個精子與卵子結合才能保證形成二倍體受精卵。多精受精會使囊胚率降低,流產和畸形胎概率升高[72]。未成熟或老化的卵母細胞都容易多精受精,所以受精時就要求卵母細胞處于良好的胞質成熟狀態。
精子入卵后,迅速激起卵質膜下皮質顆粒的大量胞吐,該皮質反應現象是卵子阻止多精受精的重要機制。例如,小鼠卵母細胞單精注射誘發皮質反應,處理后的卵子進行體外受精會發生多精入卵。皮質顆粒是卵母細胞特有的細胞器,但目前關于它的形成機制還存在爭議,有研究認為它是由高爾基復合體分泌[73],也有相反的主張,認為皮質顆粒與滑面內質網小泡密切相關[74],但對于皮質顆粒在阻擋多精入卵方面的重要性卻是得到研究者廣泛認可的。隨著卵母細胞的生長和成熟,皮質顆粒開始形成并且數量不斷增加。在嚙齒類動物中,皮質顆粒的重新分布有明顯的極性,定位與微絨毛相似,與微絲帽的分布互補,成熟卵母細胞覆蓋紡錘體的皮層沒有皮質顆粒。而牛、豬和人等物種的MⅡ期卵母細胞中,不能看到明顯的缺失皮質顆粒的區域,有研究發現這是因為該區域太小,鏡下不能清楚觀察到[75]。未成熟卵母細胞由于皮質顆粒數目不足且尚未貼近卵質膜,不能形成完善的皮質反應來阻止多精入卵[76]。“過熟”卵子中的皮質顆粒會內遷或提前胞吐,受精時皮質顆粒不能完全釋放到卵周隙,容易造成多精入卵[77]。
皮質反應阻擋多精受精的原理是非常復雜的。精子先被透明帶的ZP3糖蛋白識別,誘發頂體反應后與ZP2糖蛋白結合才能到達卵質膜與卵子融合[78]。精子的磷脂酶C(PLC)水解卵質膜上的PI(4,5)P2,生成二酰基甘油(DAG)和1,4,5-三磷酸肌醇(IP3)兩種第二信使分子;IP3結合內質網上的IP3受體促進卵子內Ca2+釋放并激活鈣調蛋白依賴的蛋白激酶Ⅱ(CaMKⅡ),DAG則負責激活蛋白激酶C(PKC),使肌動蛋白結合蛋白MARCKS磷酸化,最終鈣調蛋白與MARCKS結合,重塑肌動蛋白網絡,使皮質顆粒發生胞吐[79]。
目前已經發現兩條皮質反應阻擋多精受精的途徑。首先,經皮質反應釋放到卵周隙的皮質顆粒內容物中富含蛋白水解酶、卵過氧化物酶、N-乙酰氨基葡萄糖苷酶、糖基化物質等[28]。這些物質會改變透明帶的結構,使其阻止其余精子入卵[80]。例如,SAS1B也叫ovastacin,是一種卵巢組織特異性表達的限制性金屬內切蛋白酶,也是皮質顆粒的一種成分,最初分布在GV期卵母細胞的胞質中,隨著卵母細胞的發育,SAS1B向邊緣移動,最終定位于MⅡ的微絨毛膜上[81],受精時與精子頂體膜的SLLP1結合,使兩層膜接觸[82]。受精后皮質顆粒發生胞吐,SAS1B的表達量逐漸下降,到囊胚期幾乎檢測不到。精子入卵后,SAS1B隨皮質顆粒排出,將透明帶上的ZP2蛋白裂解,使透明帶不能與精子結合,阻止多精受精[83]。同樣是通過透明帶反應阻止多精受精,卵母細胞與ERM蛋白家族中的ezrin蛋白共同孵育后,會增加透明帶的消化時間,減少透明帶上結合的精子數量,從而降低多精子入卵率[84]。并且,有研究發現精漿中也含有ezrin蛋白,會在第一個精子入卵后阻滯其余精子進入卵母細胞[85]。同時,精子膜、皮質顆粒膜和卵質膜都發生了復雜的融合,可能改變了卵質膜的功能元件,從而在卵質膜水平上阻止多精受精[86]。不同的物種會采用不同的方法阻擋多精入卵。例如,狗、山羊受精卵的卵周隙幾乎沒有精子,證明這些物種主要依靠透明帶反應阻止多精入卵;兔、豬受精卵的卵周隙存在大量精子,表明他們對多精受精的阻止主要在卵質膜水平上;小鼠卵周隙存在少量精子,證明小鼠可以利用兩種途徑來保障單精入卵。有研究發現,ERM蛋白家族與肌動蛋白、肌球蛋白-II共同介導卵母細胞的細胞力學,通過微絲重排牽引皮質顆粒由胞質向細胞皮層移動,到卵母細胞成熟時皮質顆粒會沿質膜呈線狀單層排列,這是皮質顆粒行使一切功能的基礎[87]。
5 問題與展望
ERM家族特有的蛋白結構讓它成為使很多膜蛋白與肌動蛋白形成互作關系的重要介質。因此,ERM蛋白能夠作為肌動蛋白骨架與膜蛋白的交聯劑參與調節減數分裂極體的排出、卵母細胞與顆粒細胞間微絨毛的動態組裝以及成熟后的精卵融合等關鍵細胞活動。雖然ERM蛋白決定著卵母細胞的成熟質量和受精卵能否正常形成。但是多年來很多研究者大都著眼于ERM蛋白在白細胞遷移和各類癌細胞增殖等病理領域的功能探索,對ERM蛋白在哺乳動物繁殖層面的研究尚有不足。近年來的文獻也只是淺顯地提到了ERM蛋白會影響卵母細胞減數分裂過程和受精指數,缺乏對該蛋白作用機制的深入挖掘。未來從分子機制和生理水平上深入研究ERM蛋白的功能可能會是提高卵母細胞體外培養成熟率、保障后續的受精卵形成和胚胎發育的關鍵。

