原細小病毒屬病毒感染及其抗腫瘤機制研究進展
商金源,閆曼平,葉京飛,程悅寧,王振軍,馮二凱,王春霞,趙 艷,朱先鵬, 廖遠軍,羅國良*
(1.中國農業科學院特產研究所 農業部經濟動物疫病重點實驗室,長春 130122;2.吉林省通化市柳河縣農業 綜合行政執法大隊,柳河 135300;3.湖南省永州市零陵區畜牧水產事務中心,永州 425199)
原細小病毒(Protoparvovirus,PtPV)屬于細小病毒科(Parvoviridae)細小病毒亞科(Parvovirinae),其屬重要病原體包括貓細小病毒(feline panleukopenia virus,FPV)、犬細小病毒(Carnivoreprotoparvovirus,CPV)、小鼠微小病毒(minute virus of mice,MVM)、豬細小病毒(porcine parvovirus,PPV)、布法病毒(bufavirus,BuPV)等。由于PtPV基因組的編碼能力有限且復制過程以及結構亞基和衣殼組裝的核易位都與宿主細胞的細胞周期緊密耦合[1],所以PtPV更容易在分裂旺盛的細胞中進行復制(如腸隱窩、心肌細胞和骨髓前體細胞)。同時,細小病毒,特別是一些嚙齒類PtPV,如H-1細小病毒(H-1 parvovirus,H-1PV)、MVM和LuIII細小病毒(LuIII virus),表現出明顯的嗜瘤性和溶瘤性,并對人類是非致病性的[2],具有抗腫瘤特性的病毒被稱為溶瘤病毒(oncolytic virus,OVs)。近年來,我國癌癥的發病率和死亡率都呈現上升趨勢,處于較高水平[3]。動物也十分容易患上癌癥,例如,10歲以上的犬中有近一半會患上癌癥。盡管目前癌癥診斷和治療方案取得了進展,但對惡性腫瘤的治療效果仍不理想。而細小病毒這一類OVs被看作是癌癥治療的新未來,OVs可以通過細胞病變作用誘導腫瘤細胞死亡,而不會對正常宿主組織造成重大傷害[4]。目前全球已有4種OVs(Rigvir、Oncorine、Talimogene laherparepvec、DELYTACT)被批準用于治療,由腺病毒改造的OV-Oncorine在中國獲批上市,是全球第一個獲批,也是我國唯一批準的溶瘤病毒藥物[4]。全面了解PtPV與宿主細胞轉運機制的動態相互作用將有助于更好地了解其感染機制和抗腫瘤特性。
1 PtPV形態特征及分類
1.1 病原體結構
PtPV具有直徑18~26 nm的無包膜蛋白衣殼,該衣殼呈T=1二十面體對稱結構。該衣殼由60個亞基組成,其中VP1和VP2組成比例近似1∶10。PtPV基因組為約5 kb單鏈DNA,DNA的5′端發夾端粒約為120 nt,呈T型結構;而3′端右端發夾約為250 nt,呈Y型結構(圖1)。PtPV在復制過程中既會產生正鏈DNA也會產生負鏈DNA,包裝正鏈的顆粒可能性較低。其中MVM主要包裝負鏈,而LUIII細小病毒兩種核酸鏈被包裝的概率相似。
1.2 編碼蛋白
細小病毒基因組在p4和p38啟動子的控制下有兩個主要的開放閱讀框(open reading frame,ORF),它們分別編碼復制所必需的非結構蛋白(non-structural protein,NS)和結構蛋白——衣殼蛋白(capsid viral protein,VP)(圖1)[5]。
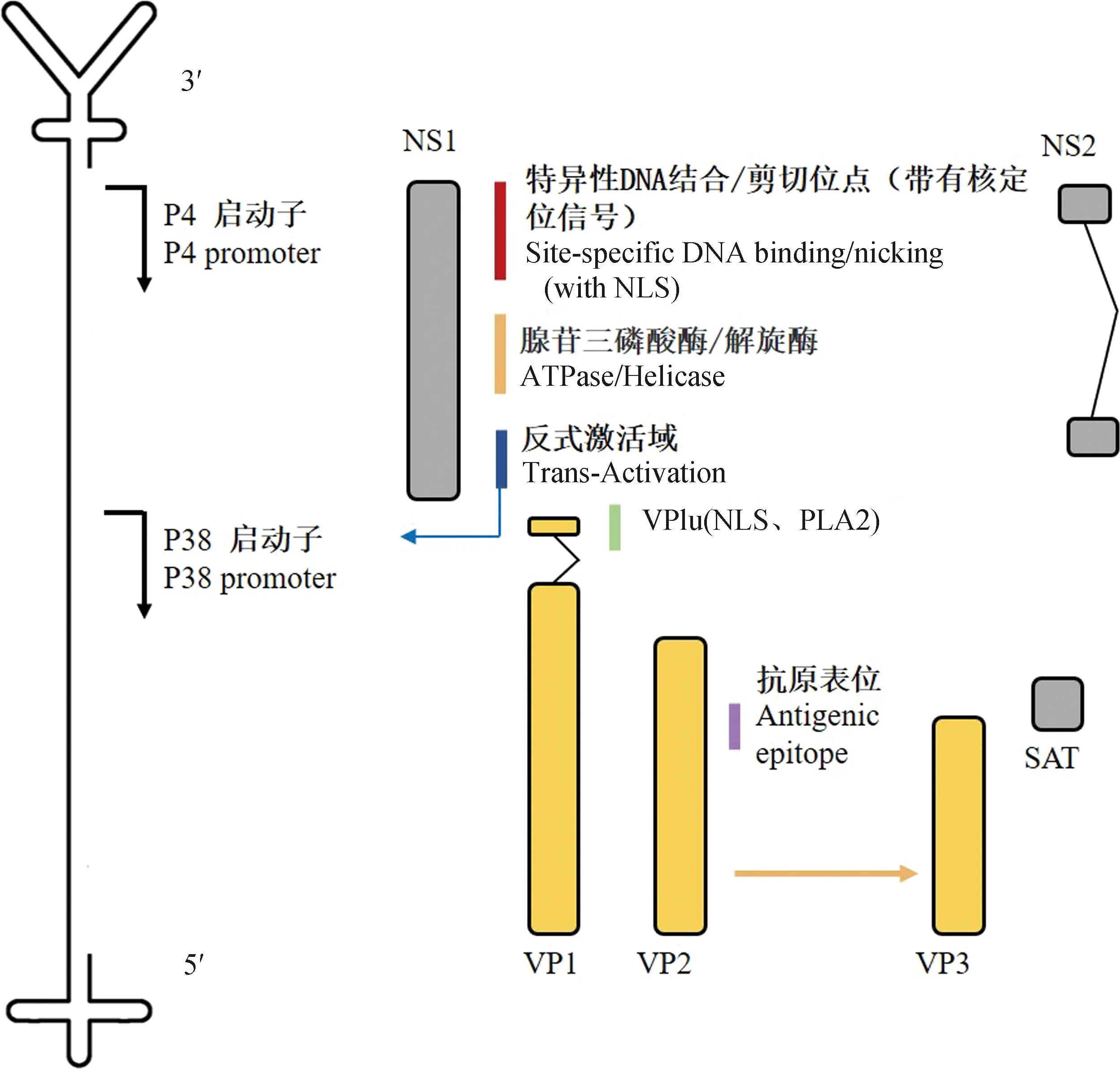
圖1 PtPV基因組及編碼蛋白Fig.1 PtPV genome and encoded proteins
NS蛋白是細小病毒復制過程中不可或缺的。NS1是一種80 ku左右的核磷蛋白、復制起始蛋白,含有N端起源結合結構域、解旋酶結構域和C末端交互結構域,具有特異性DNA結合位點以及ATP酶、切口酶和解旋酶活性[6],參與調節病毒基因表達、切割病毒DNA基因組,也是細胞毒性的主要介質,單純的NS1表達足以殺死癌細胞。NS1還參與細胞周期控制、細胞凋亡、線粒體呼吸和糖酵解相關通路[7-8]。而NS2(25 ku)的作用未被清晰確定,其可能在病毒復制、病毒mRNA轉錄、衣殼的組裝與核出口等過程中發揮作用[9]。FPV的NS2 C末端以及卷曲螺旋區域被證明可以抑制干擾素的產生(interferon,IFN),其通過靶向絲氨酸/蘇氨酸蛋白激酶(threonine-protein kinase,TBK1)并阻止其被干擾素基因刺激物(stimulator of interferon genes,STING)蛋白募集,從而破壞下游蛋白IFN調節因子3(IFN regulatory factors 3,IRF3)的磷酸化,抑制IFN以減弱先天免疫反應實現免疫逃避[10]。除了NS1、NS2,PtPV還表達另一種非結構蛋白SAT(small alternatively translated)蛋白,在PPV感染中誘導不可逆的內質網應激導致細胞的凋亡和裂解[11]。
VP蛋白ORF編碼VP1和VP2兩種結構蛋白。VP1蛋白大約80 ku,是較大但數量很少的衣殼成分,含有獨特的N端延伸,稱為VP1u;VP2蛋白大約64 ku,是主要的衣殼成分;而對于該屬的一些成員,例如PPV,會在基因組包裝后通過水解切割VP2的N末端15~18個氨基酸產生VP3[5,12]。VP1包含一個143個殘基的N末端序列(VP1u),該序列含有參與核定位的堿性氨基酸基序(nuclear localization sequence,NLS)以及會影響磷脂酶A2(phospholipase A2,PLA2)酶活性[13]。VP2與受體識別和核轉位有關[14],且含有刺激產生中和抗體的主要表位,VP2關鍵氨基酸位點的突變會影響其受體結合、抗原特征和宿主范圍[15]。
1.3 分類學
依據國際病毒分類委員會(The International Committee on Taxonomy of Viruses,ICTV)對細小病毒的分類報告[16],可以通過NS1遺傳距離標準來對細小病毒進行確認分類。細小病毒科成員的基因組序列必須是連續的,需包含具有高度保守的解旋酶超級家族3(superfamily 3,SF3)結構域的NS1的完整編碼區以及VP編碼區,且其基因組應該在4~6 kb,其轉錄因子結合域(motif pattern)也應該具有細小病毒科的特點。而劃分某個細小病毒屬于哪個屬的依據是在該病毒的SF3結構域,此外,同一屬的成員的NS1蛋白氨基酸序列應至少具有35%~40%的相似性且任何兩個成員之間的相似性應該超過80%。同一種的成員則需要NS1氨基酸序列相似性超過85%[17]。
2 PtPV感染機制
2.1 結合細胞機制
PtPV通過衣殼附著在靶細胞的特定受體上。其中唾液酸(sialic acid,SA)是MVM、H-1PV、PPV等的結合受體,結合位點位于病毒衣殼的二倍軸區域(圖2),而在腫瘤細胞中高表達的轉鐵蛋白受體(transferrin receptor,TfR)為FPV、CPV衣殼三倍軸區域的結合受體[15,18]。但體外血凝試驗顯示CPV和FPV可以通過SA與紅細胞結合,同時也有研究證明改變或消除TfR的內化信號并不能預防其感染[2]。另外CPV、FPV的血凝性都受到溶液中鈣離子濃度影響[19]。PtPV結合SA的能力也使其可以與腸黏液、組織碎片和食物中的SA結合,使其在環境中存在時間更久,也更容易傳播。
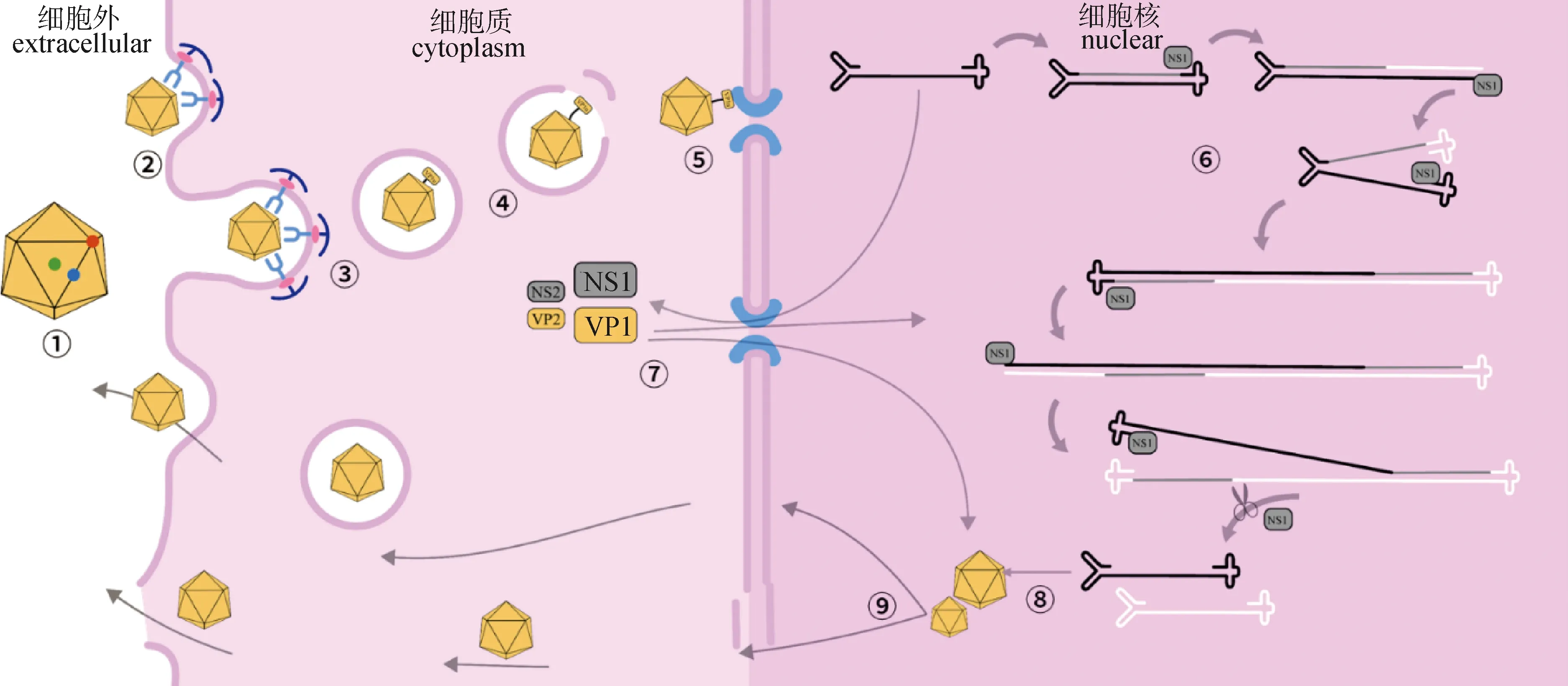
①PtPV顆粒二十面體結構(紅:五倍軸,綠:三倍軸,藍:二倍軸);②PtPV衣殼與細胞膜表面一種或多種特定受體結合;③PtPV衣殼通過網格蛋白介導的內吞作用內化;④病毒通過磷脂酶裂解內體膜從內體逃逸;⑤PtPV通過核孔復合體入核;⑥病毒基因組復制機制;⑦表達NS1蛋白并入核參與復制和衣殼組裝;⑧衣殼包裝基因組;⑨后代病毒通過胞吐或裂解擴散 ①PtPV particle has an icosahedral structure (red-colored point: pentameric axis;green-colored point: trimeric axis;blue-colored point: dimeric axis); ②PtPV capsids bind to one or more special receptors exposed on the host cell membrane; ③PtPV capsids are internalized via clathrin-mediated endocytosis; ④Escape from the endosome by cleaving the endosomal membrane with a phospholipase; ⑤PtPV entry into the nucleus through the nuclear pore complex; ⑥Replication of the viral genome; ⑦Expression of the NS1,which enter the nucleus and participate in replication and capsid assembly; ⑧The new capsids package the new genome; ⑨Release of progeny virus through cell lysis or vesicular diffusion圖2 PtPV感染與復制機制示意圖Fig.2 Illustration of the infection and replication mechanism of PtPV
PtPV在與功能受體結合后被宿主細胞的內吞作用內化[2]。一般是通過網格蛋白介導的內吞(clathrin-mediated endocytosis,CME),以CPV為例,部分病毒在形成網格蛋白包被的區域被捕獲,而另一些病毒則在結合部位誘導網格蛋白組裝[20]。雖然CME是主要的內吞途徑,但也存在其他內吞途徑,例如MVM就確定了還有至少3種不同的機制:小窩蛋白(caveolin)、脂筏(lipid-raft)和網格蛋白非依賴性載體介導的內吞途徑[21]。
2.2 入核途徑
PtPV的內體運輸過程被認為是緩慢的。pH不斷降低的內體微環境會導致病毒衣殼結構發生變化,導致VP1u序列暴露并發揮磷脂酶活性,從而分解內體膜并逃逸(圖2)。因此,一些藥物如巴佛洛霉素 A1(bafilomycin A1)和弱堿二磷酸氯喹(weak base chloroquine diphosphate)可以提高內體pH值,從而阻止PtPV的感染[2]。
從內體逃逸后,PtPV會利用細胞骨架,如微管(microtubules,MTs)、中間纖維(intermediate filament,IF),以及相關運動蛋白,如肌動蛋白(actin),轉運到細胞核。PtPV入核過程則需要暴露在外的VP1u序列中的NLS引導,NLS是一種核定位信號,有助于將病毒導航到細胞核,從而導致進一步的核易位。而在PPV中發現另一種NLS是一種新型核定位基序,在感染晚期將VP2三聚體靶向細胞核[22]。對于PtPV的入核機制目前有兩種解釋,一是通過衣殼蛋白VP1的NLS與核轉運受體輸入蛋白β(importin-β)相互作用[23],結合核孔復合物并通過核孔進入;二是病毒與核孔的直接作用或者與importin-β間接作用導致核包膜的局部解體使病毒進入細胞核[8-9,23]。在核輸入的經典途徑中,importin-β通過importin-α連接到暴露在病毒表面的NLS,病毒隨之結合核孔復合物并通過核孔進入核籃(nuclear basket),importin-β與病毒解離回到細胞質[23]。MVM在入核過程中甚至可以直接改變核膜的結構并對核外膜造成損傷[24]。
2.3 病毒的復制與釋放
PtPV復制依賴于宿主細胞有絲分裂,且嚴格依賴于S期細胞因子。在轉錄因子的作用下,p4啟動子被激活,并開始表達NS1。PtPV基因組通過滾動發夾復制(rolling hairpin replication,RHR)復制(圖2),這是一種由NS1啟動的單向、鏈置換形式的DNA復制[25],該機制依賴于發夾末端的順序展開和重新折疊[16],單向鏈置換合成產生連續的雙鏈中間體,具有核酸內切酶活性的NS1會周期性地從中切下后代單鏈[26]。同時NS1激活P38啟動子,誘導VP蛋白的表達,并指導衣殼組裝過程。
新合成的衣殼蛋白在細胞質中形成三聚體(1×VP1+2×VP2),并僅在S期通過結構依賴的運輸基序轉運到細胞核中,且該易位依賴于細胞Raf-1激酶的三聚體磷酸化。之后衣殼蛋白三聚體在細胞核中組裝為病毒衣殼。通過對AAV、MVM的研究,新產生的MVM完整衣殼可以從細胞核中有效輸出,并且受到暴露于外部的磷酸化的VP2 N端序列內的Ser和Thr調節[27-28]。PtPV后代病毒粒子可以通過囊泡主動轉運到細胞外圍,如MVM[29];或是在細胞核中積累,直到通過細胞裂解釋放,如FPV[16];亦或是同步存在的。
3 PtPV的細胞毒性與溶瘤性
3.1 PtPV誘導細胞死亡的機制
PtPV可以誘導細胞壞死或凋亡,具體機制因病毒和細胞類型而異。目前公認的是,PtPV的主要調節蛋白NS1在病毒的復制、傳播、胞吐以及誘導細胞死亡等方面發揮重要作用,但其誘導細胞死亡的分子機制尚未完全闡明。NS1是PtPV基因組早期表達產物,其積累將終止宿主細胞DNA復制和誘導DNA損傷,并使控制細胞周期的因子失調導致細胞周期停滯于在S期或G1期[30]。已有研究表明CPV、H-1PV、MVM的NS1可以通過活化多種半胱天冬酶(caspases)、引起線粒體膜去極化、引發活性氧(reactive oxygen species,ROS)的聚集導致細胞色素C的釋放、p53非依賴性細胞凋亡等內在凋亡通路[31-34]。嚙齒動物PtPV的NS1還會破壞細胞骨架,包括微絲(microfilaments)、凝溶膠蛋白(gelsolin)、IF等[30]。在MVM感染細胞相關試驗中發現NS1細的胞毒性活性似乎與蛋白激酶2(protein kinase Ⅱ,CKⅡ)復合物的形成相關,并發現NS1-CKⅡ復合物可以磷酸化原肌球蛋白、肌動蛋白等導致其重排和降解從而破壞細胞骨架并刺激和調節胞吐作用來控制病毒的傳播與細胞溶解[31,35]。此外,研究發現除了通過ROS/線粒體途徑誘導細胞凋亡外,PPV還可以通過激活TLR2-NF-κB信號通路誘導細胞凋亡[36],在感染早期,NS1激活NF-κB信號通路并誘導炎性細胞因子IL-6和TNF-α的分泌,這些炎性細胞因子進一步激活NF-κB通路,從而上調信號通路相關因子和炎性細胞因子的表達水平[37]。NS1的活性和功能已被證明受到多種信號通路的調控,包括磷脂依賴性激酶、蛋白激酶C、蛋白激酶B(PDK/PKC/PKB)等[30]。NS1上不同氨基酸殘基的磷酸化和乙酰化也被認為是蛋白質不同功能的開關。例如,研究表明H1-PV NS1的K85、K257殘基的乙酰化可以增強NS1的細胞毒性[38-39]。
3.2 PtPV的抗腫瘤機制
溶瘤病毒在抗腫瘤方面具有三個核心機制,包括對腫瘤細胞的細胞病變作用、刺激免疫系統增強抗腫瘤免疫能力以及與其他腫瘤治療方式的協同作用。從某些數據來看,PtPV與免疫系統之間存在密切的合作,可以協同抑制腫瘤生長[40]。
嚙齒動物以及食肉動物PtPV的NS1已被證明具有腫瘤毒性[39],在癌細胞中NS1可以導致細胞周期停滯、細胞凋亡、壞死、溶酶體樣程序性細胞死亡或細胞溶解[30]。此外,NS1的功能還強烈依賴于PDK/PKC/PKB信號傳導,而激活PDK/PKC/PKB通路的突變是繼P53基因失活突變之后第二常見的癌癥相關基因,在大多數癌癥中,PDK/PKC/PKB級聯反應會被上調,因此NS1的細胞毒性會特異性地靶向癌細胞[41]。NS1對細胞骨架的破壞也使得比正常細胞原肌球蛋白表達量低的癌細胞更容易被誘導死亡。隨后NS1裂解癌細胞釋放腫瘤相關抗原(tumor-associated antigens,TTA)和損傷、病原體相關分子模式(danger- and pathogen-associated molecular patterns,DAMPs and PAMPs),激活TAA特異性細胞毒性T淋巴細胞(cytotoxic T lymphocytes,CTL)反應,從而導致腫瘤細胞被識別和破壞。這種反應還引起樹突狀細胞(dendritic cells,DC)交叉遞呈,進一步促進免疫系統對腫瘤的識別和激活腫瘤特異性CTL[34]。
3.3 PtPV在抗腫瘤方面的應用案例
目前嚙齒動物原細小病毒中H-1PV在臨床試驗中表現出較好的抗腫瘤活性和安全性,含有H-1PV的藥物制劑ParvOryx在原發或復發性膠質母細胞瘤患者I/IIa期臨床試驗(ParvOryx01)證明了H-1PV的安全性和耐受性[42]。在部分膠質瘤細胞中,H-1PV可導致活性的組織蛋白酶B、L從溶酶體轉移到細胞質,同時下調細胞質中半胱氨酸蛋白酶抑制劑(cystatin)B、C的水平[43]。ParvOryx01成功后,進行了H-1PV的第二次臨床試驗(ParvOryx02),該試驗通過靜脈和瘤內注射ParvOryx來評估該療法在不能手術且存在肝轉移的胰腺癌患者中的安全性、耐受性和療效[44]。在兩項試驗中ParvOryx所有劑量水平下均表現安全,患者表現出良好的免疫學特征,包括腫瘤微環境的變化和特異性免疫反應的誘導[45],在患者血清中很少檢測出H-1PV中和抗體陽性[46]。但使用病毒仍存在一定的安全問題。有研究發現不同FPV/CPV-2毒株在不同宿主細胞培養物中體外生長時其VP2具有積累突變的現象[47],細小病毒的重復感染與多種細小病毒的共感染可能會促進病毒的重組和高遺傳異質性,使它們在新環境中具有宿主適應性[48]。雖然相對來說PtPV的遺傳突變非常有限,主要是同義突變,且由于較低的基因突變率和較強的選擇性限制氨基酸突變,使得其跨物種傳播相對困難。不過,CPV已經擴展了其宿主范圍至貓科動物,并且能導致貓出現貓泛白細胞減少綜合征[49]。不同的細小病毒共感染貓科動物可能導致病毒基因重組,使宿主范圍進一步擴大[50]。
NS1也已被證明具有抑制腫瘤細胞生長的作用,能夠靶向腫瘤細胞而不傷害正常細胞,并誘導機體產生抗腫瘤免疫應答。異位過表達NS1被視為抑制腫瘤的新策略,CPV2 NS1曾在小鼠乳腺腫瘤模型中表達并表現出抑制作用[32],因此已在肝細胞癌(hepatocellular carcinoma,HCC)中進行表達試驗[51]。
4 小結與展望
PtPV表現出廣泛的病理變化,盡管一些PtPV感染是無癥狀的,但有一些PtPV,如FPV、CPV和PPV等,具有顯著的致病性,例如,FPV可以引起貓科動物泛白細胞減少綜合征;PPV可以引起豬死產-木乃伊胎-胚胎死亡-不育綜合征。PtPV對環境因素抵抗力強,可以在環境中長期存在,并通過與感染動物或其體液的直接接觸以及與受污染的表面或物體的間接接觸傳播,對動物的健康和農業生產產生不良影響。本綜述總結了目前已知的PtPV感染和復制機制的信息,闡述了病毒如何進入宿主細胞、如何繁殖和復制、以及如何通過裂解細胞或囊泡擴散釋放后代病毒,但對于新出現的PtPV,如布法病毒、Cutavirus、Tusavirus等還知之甚少。有效的疫苗接種依舊是預防PtPV的重要手段,通過深入了解PtPV的感染機制和生物學特征,可以更好地預測和預防未來的病毒感染,進而保障公共衛生和農業安全。
PtPV在抗腫瘤方面具有很大的潛力。一方面,它可以選擇性地感染某些腫瘤細胞,而對正常細胞的影響較小,從而減少了對患者的副作用;另一方面,PtPV具有很強的細胞毒性和免疫刺激作用,能夠誘導腫瘤細胞凋亡和激活免疫系統,從而進一步增強其抗腫瘤效應。目前除了對病毒或是NS1本身的優化,也許可以進一步改善相關佐劑和載體(如脂質體、病毒載體、細胞穿膜肽等)。同時細小病毒作為生物制劑的開發還集中在其衣殼蛋白上,其衣殼蛋白可用作基因遞送應用中的病毒載體,基于細小病毒的基因工程病毒已經被設計出來用于攜帶和輸送藥物、腫瘤相關抗原和免疫調節基因等。但在具體應用時需要進一步加強對其生物學特性和安全性的研究。
因此,對PtPV的研究有助于更深入地理解它們的感染機制、病原學和分子生物學特征,從而為PtPV感染的預防和治療提供新的思路和方法。此外,對于PtPV感染的研究,以及對病毒和宿主之間相互作用的深入研究,也有望為癌癥治療提供新的策略和可能性,這些研究將為人們提供更為科學和樂觀的前景。

