血清HBsAg、HBV RNA水平對慢性乙型肝炎患者核苷(酸)類藥物治療停藥預測的價值
吳寶靈,徐 龍,余海濱,徐貞秋,吳 敏,張 偉,范聲春,李艷艷,李金明
(南昌市第九醫院肝二科,南昌 330002)
在我國,慢性乙型肝炎(CHB)患者主要使用核苷(酸)類似物(NAs)藥物治療,而臨床上多以血清乙型肝炎表面抗原(HBsAg)消失作為評價CHB“臨床治愈”和停藥的標準,但現有的NAs藥物治療很少能使血清HBsAg陰轉,為減少停藥帶來的病毒學反彈和疾病復發,各國CHB防治指南多強調患者需要長期甚至終身用藥,而實際上有部分患者停藥后并不會反彈。將血清HBsAg持續消失作為功能性治愈或臨床治愈的判定標準,可能會使一些患者繼續接受不必要的抗病毒治療[1]。目前,臨床上仍缺乏甄別和確定CHB患者安全停藥的可靠指標。本研究擬探討NAs停藥時血清HBsAg和乙型肝炎病毒核糖核酸(HBV RNA)水平與停藥復發的關系,為CHB患者安全停藥提供參考。
1 資料與方法
1.1 一般資料
回顧性分析2019年6月至2020年6月南昌市第九醫院肝病科治療的80例接受NAs治療并符合停藥標準、已停藥并配合隨訪的CHB患者臨床資料。納入標準:1)CHB治療、停藥均符合2019版《慢性乙型肝炎防治指南》[2]標準,達到乙型肝炎e抗原(HBeAg)陰性或乙型肝炎e抗體(HBeAb)陽性后,丙氨酸氨基轉氨酶(ALT)正常、乙型肝炎病毒脫氧核糖核酸(HBV DNA)<20 U·mL-1、鞏固治療至少3年,總療程不少于4年的患者;2)為初次接受單一NAs治療,無變異耐藥。排除標準:1)妊娠期及哺乳期女性;2)治療前無肝硬化或疑似肝硬化、肝衰竭的患者;3)合并惡性腫瘤或自身免疫缺陷疾病;4)合并其他病毒感染、自身免疫性肝病、藥物性肝損傷及長期吸毒、酗酒的患者。
1.2 研究方法
收集患者停藥時的性別、年齡、體重指數(BMI)、病程、HBV感染家族史、飲酒史、HBV基因型、基線ALT、基線HBV DNA、基線HBV RNA、總療程等。
選擇停藥時HBV DNA<20 U·mL-1,HBsAg定量<200 U·mL-1和HBsAg定量200~1000 U·mL-1的患者各40例進行隨訪,同時進行HBV RNA檢測。停藥后3個月內每月檢測1次血生化、HBsAg定量、HBV DNA、HBV RNA,此后每3個月檢測1次,停藥1年后,每半年檢測1次,同時每半年復查甲胎蛋白(AFP)及腹部彩超,共隨訪3年或病毒反彈(復發)時研究終止。比較HBV RNA陰性與HBV RNA陽性,HBsAg定量<200 U·mL-1和HBsAg定量200~1000 U·mL-1的患者停藥后復發情況。
本研究在充分告知停藥后風險的情況下開展,一旦確定出現病毒反彈,根據情況及時再次給予抗病毒治療并停止隨訪。病毒反彈的標準:若檢測到HBV DNA>100 U·mL-1,伴或不伴ALT升高,定義為病毒學反彈。
1.3 檢測方法
1)生化檢測:選擇日本日立7600型全自動生化分析儀進行診斷。
2)HBsAg定量:使用羅氏試劑進行化學發光法檢測,HBsAg檢測下限為0.05 U·mL-1。
3)HBV DNA定量:使用羅氏COBAS TaqMan病毒載量檢測系統進行熒光定量PCR的檢測,檢測下限為20 U·mL-1。
4)HBV RNA定量:使用湖南圣湘生物科技有限公司HBVpgRNA試劑盒進行檢測,檢測下限為100 U·mL-1。
1.4 統計學方法

2 結果
1)以隨訪期間是否出現病毒反彈分為復發組和無復發組,2組患者年齡、性別、BMI、病程、HBV感染家族史、飲酒史、HBV基因型、基線ALT、基線HBV DNA、基線HBV RNA以及總療程對比,差異均無統計學意義(P>0.05)。見表1。
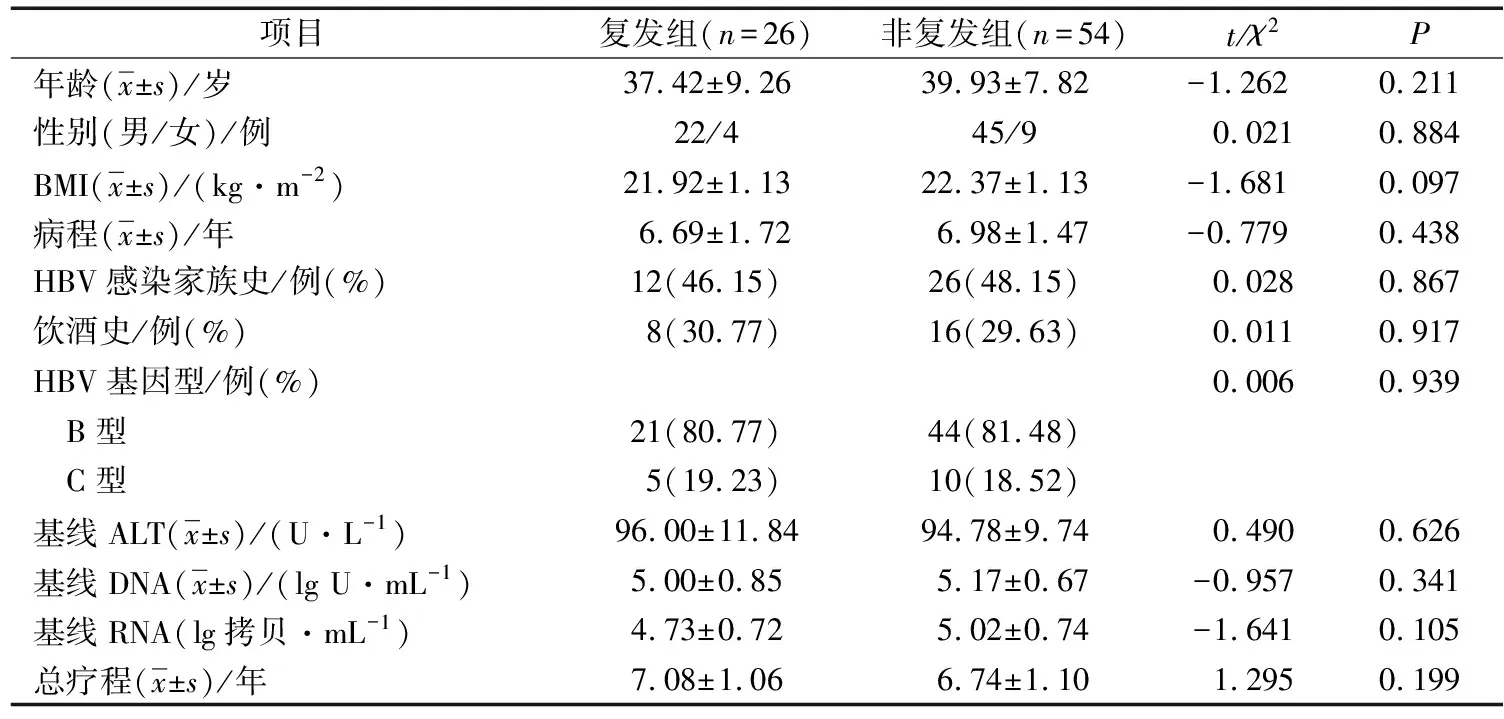
表1 2組患者一般資料以及實驗室指標比較
2)依據HBsAg定量<200 U·mL-1和HBsAg定量200~1000 U·mL-1分組,2組患者停藥3年時的復發情況比較差異有統計學意義(P<0.05)。見表2。
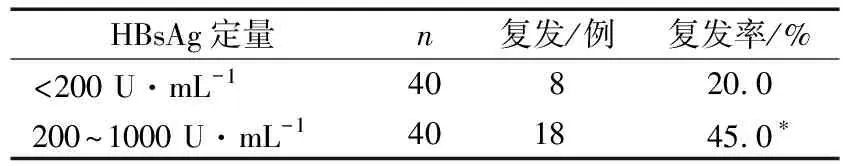
表2 停藥時HBsAg定量分組的復發情況比較
3)依據停藥時HNV RNA載量<100 U·mL-1和>100 U·mL-1分組,2組患者停藥3年時的復發情況比較差異有統計學意義(P<0.05)。見表3。
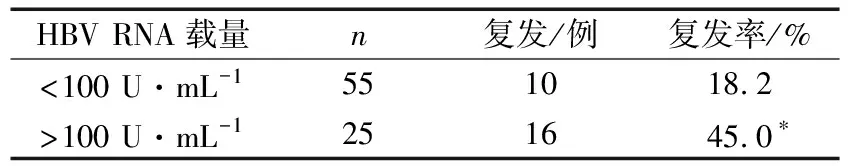
表3 停藥時HBV RNA載量分組的復發情況比較
4)依據停藥時HBsAg定量及HBV RNA載量分組,同時具備HBsAg<200 U·mL-1、HBV RNA<100 U·mL-1為A組,其余均為B組,A、B 2組停藥3年的復發情況比較差異有統計學意義(P<0.05)。見表4。
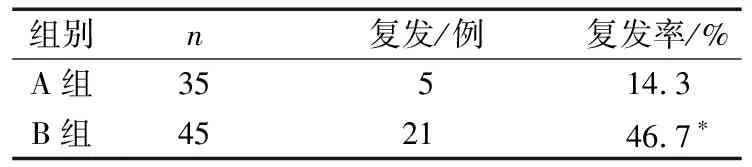
表4 停藥時HBsAg定量以及HBV RNA載量分組的復發情況比較
3 討論
隨著擴大CHB抗病毒治療逐漸推廣,越來越多的患者需要抗病毒治療,其中大多數使用NAs抗病毒治療。由于NAs治療沒有明確的停藥標準,降低了患者的依從性。近年來,很多學者圍繞NAs治療CHB患者停藥后的復發、預測因素以及安全性等問題進行研究,但有關其復發率報道存在很大差異(15%~97%)[3]。如何實現安全停藥、減少復發,需要更多的研究來優化現有的停藥標準。血清中HBsAg定量檢測,不僅反映病毒與肝細胞的免疫應答的平衡關系,也能反映共價閉合環狀DNA(cccDNA)的復制水平,NAs治療只是抑制了HBV DNA的復制,但對于肝細胞內的cccDNA沒有清除作用,停藥后會出現病毒學反彈。王昌生等[4]報道,應用HBsAg定量檢測預測恩替卡韋停藥后CHB患者復發具有較高的診斷效能。CHEN等[5]研究HBsAg水平與復發之間的關系,治療末HBsAg水平(<150 U·mL-1)與較低的病毒學復發率有關,患者HBsAg水平可用于指導治療的停藥時機。曹佳偉[6]報道,停藥時HBsAg≤200 U·mL-1的患者發生臨床復發的可能性更小。本研究顯示,停藥時血清高敏HBV DNA<20 U·mL-1,HBsAg定量<200 U·mL-1和HBsAg定量200~1000 U·mL-1的患者,停藥3年時的復發率分別為20%和45%,差異有統計學意義(P<0.05),可能是安全停藥的預測指標,指導停藥有一定的作用,但還是有局限性。
NAs的作用機制是競爭性抑制HBV DNA聚合酶的活性,從而抑制HBV復制,但不能清除肝內cccDNA,由于HBV cccDNA檢測需要進行肝組織活檢,限制了其在臨床上的應用。有研究[7]證實,血清中的HBV RNA來自感染細胞內cccDNA的活性轉錄,特別是在接受NAs治療的CHB患者,DNA合成被阻斷后,其血清中的HBV RNA能反映肝細胞內cccDNA的狀態。當血清中檢測不到HBV RNA時,提示患者肝細胞內cccDNA的消失或者轉錄靜默,預示著可以安全停藥[8-9]。張琪等[10]報道,血清HBV RNA對于預測CHB患者停藥后復發有重要意義。相比于HBsAg、HBV DNA等傳統的血清學指標,血清HBV RNA水平可以更好地反映肝內病毒復制水平,可作為CHB患者管理的新型標志物[11]。WANG等[12]報道,在治療停止后24周,21例HBV RNA陽性患者均發生病毒學反彈,然而在HBV RNA低于檢測下限的12例CHB患者中,有3例發生病毒學反彈。本研究顯示,根據HBV DNA<20 U·mL-1、HBV RNA<100 U·mL-1停藥時,停藥3年時的復發率仍有18.2%,提示可能需要多個病毒學標志物聯合指導停藥。
目前,多數學者證實NAs治療后停藥復發與多種因素有關。有研究[13]表明,監測血清HBV RNA水平也可預測經抗病毒治療后實現HBsAg消失即“臨床治愈”的CHB患者出現病毒反彈的風險。最新研究[14]提出以HBV cccDNA消失或靜默為基礎,以HBV RNA持續陰性和低HBsAg水平為標準的“準臨床治愈”,可作為抗病毒治療的新階段終點,對指導CHB患者安全用藥、停藥及療效預測等方面可能有重要意義。本研究在停藥時血清HBV DNA<20 U·mL-1的前提下,根據停藥時HBsAg定量及HBVRNA載量分組,同時具備HBsAg<200 U·mL-1、HBV RNA<100 U·mL-1為A組,其余均為B組,結果顯示停藥3年時A組有14.3%(5/35)復發,B組復發率為46.7%(21/45),2組比較差異有統計學意義(P<0.05)。提示HBV DNA<20 U·mL-1的同時,HBsAg<200 U·mL-1、HBV RNA<100 U·mL-1作為NAs治療停藥指標比較安全,HBsAg、HBV RNA水平對CHB患者停藥時機的判斷具有一定的參考意義。當然,由于本研究的樣本量較少,相關結論還有待于擴大樣本量進一步研究論證。

