SLC5A8基因過表達的炎癥性腸病細胞模型結構及IL-8、TGF-β1表達變化觀察
趙澤滿,吳育朔,劉雅涵,矯政洧,蔡思源,靳小石
1 河北大學臨床醫學院,河北保定071000;2 河北大學附屬醫院普通外科;3 河北大學附屬醫院門診部
炎癥性腸病(IBD)是一種以慢性、復發性腸道炎癥為特征的疾病,包括克羅恩病和潰瘍性結腸炎,可累及腸道的任何部分,臨床上常表現為腹痛、腹瀉、血便、體質量減輕等,還會導致嚴重并發癥[1]。SLC5A8基因作為被發現的SLC5基因家族中的第8個成員,其編碼的蛋白是與鈉離子耦聯轉運短鏈脂肪酸(SCFAs)高親和力轉運體,在結腸、回腸中大量表達[2]。SCFAs能通過SLC5A8調控的轉運蛋白進入結腸上皮細胞內,參與免疫調節,因此推測SLC5A8可能通過免疫調控參與了IBD的發生。2022年1—10月,本研究觀察了SLC5A8基因過表達后,脂多糖誘導的IBD細胞模型結構及IL-8、TGF-β1水平變化,現報告如下。
1 材料與方法
1.1 細胞與主要材料 人正常結腸上皮細胞FHC由某附屬醫院中心實驗室饋贈,置于含10%胎牛血清+1%青—鏈霉素的RPMI1640培養基中,在37 ℃、5% CO2培養箱中培養,取對數生長期細胞進行實驗。脂多糖購自北京索萊寶科技有限公司,RPMI1640培養基、青—鏈霉素溶液購自大連美侖生物技術有限公司,TRIzol Universal總RNA提取試劑購自TIANGEN公司,HiScript Ⅲ RT SuperMix for qPCR(+gDNA wiper)購自南京諾唯贊生物科技有限公司,RT-qPCR引物購自上海生工生物工程股份有限公司,SLC5A8過表達質粒購自蘇州吉瑪基因股份有限公司,Human IL-8 ELISA Kit、Human/Mouse/Rat TGF-β1ELISA Kit購自聯科生物技術有限公司。實時熒光定量PCR儀為Applied Biosystems公司產品。
1.2 細胞分組與模型制作 將FHC細胞分為對照組、模型組及實驗組。對照組轉染pcDNA3.1-GFP空載質粒;模型組轉染pcDNA3.1-GFP空載質粒,再加100 μg/mL脂多糖刺激24 h;實驗組轉染SLC5A8基因過表達質粒,再加100 μg/mL脂多糖刺激24 h。
1.3 細胞結構觀察 棄去細胞上清液,剩余細胞用PBS清洗(2 mL),重復2次;用電鏡固定液固定細胞,保存于4 ℃冰箱,透射電鏡下觀察三組細胞結構。
1.4 細胞及培養液上清中IL-8、TGF-β1檢測 提取各組FHC細胞總RNA并反轉錄為cDNA,采用RT-qPCR法檢測IL-8、TGF-β1mRNA。以TBP作為內參。TBP上游引物序列為5′-TGTATCCACAGTGAATCTTGGTTG-3′,下游引物序列為5′-GGTTCGTGGCTCTCTTATCCTC-3′;IL-8基因上游引物序列為5′-GAGAGTGATTGAGAGTGGACCAC-3′,下游引物序列為5′-CACAACCCTCTGCACCCAGTTT-3′;TGF-β1基因上游引物序列為5′-TACCTGAACCCGTGTTGCTCTC-3′,下游引物序列為5′-GTTGCTGAGGTATCGCCAGGAA-3′。PCR 反應條件:預變性95 ℃ 30 s;95 ℃ 3~10 s,60 ℃ 10~30 s,共40個循環;溶解95 ℃ 15 s,60 ℃ 60 s,95 ℃ 15 s。以2-ΔΔCt表示目的基因相對表達量。取細胞上清液入離心管,離心機離心(2 600 r/min,10 min)去除沉淀物。采用ELISA法檢測細胞培養液上清中的IL-8、TGF-β1,按試劑盒說明書操作。
1.5 統計學方法 采用SPSS26.0軟件進行統計分析,GraphPad Prism9.4軟件作圖。計量資料以表示,多組比較采用單因素方差分析,兩組比較采用最小顯著性差異法。P<0.05為差異有統計學意義。
2 結果
2.1 各組細胞結構改變 對照組細胞膜表面微絨毛無斷裂,無脫落,緊密連接結構致密呈帶狀;模型組細胞膜表面微絨毛變稀疏,脫落,緊密連接的細胞間隙增寬;實驗組細胞膜表面存在微絨毛脫落,緊密連接結構部分破壞。見圖1。
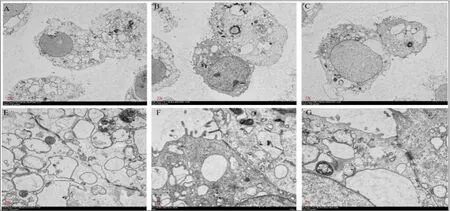
圖1 各組細胞結構變化
2.2 各組細胞及培養液上清中IL-8、TGF-β1表達比較 與對照組相比,模型組IL-8 mRNA表達及培養液上清中IL-8水平升高,TGF-β1mRNA表達及培養液上清中TGF-β1水平降低(P均<0.01);與模型組相比,實驗組IL-8 mRNA表達及培養液上清中IL-8水平降低,TGF-β1mRNA表達及培養液上清中TGF-β1水平升高(P均<0.01)。見表1。
表1 各組細胞及培養液上清中IL-8、TGF-β1表達比較()

表1 各組細胞及培養液上清中IL-8、TGF-β1表達比較()
注:與對照組相比,*P<0.01;與模型組相比,#P<0.01。
組別實驗組模型組對照組TGF-β1 1.21 ± 0.05#0.30 ± 0.04*1.00 ± 0.03 IL-8 mRNA 1.20 ± 0.10#2.46 ± 0.13*1.00 ± 0.05 IL-8 0.70 ± 0.01#2.29 ± 0.00*1.00 ± 0.01 TGF-β1 mRNA 1.40 ± 0.11#0.72 ± 0.06*1.00 ± 0.05
3 討論
調查顯示,IBD發病率在世界范圍內呈持續增高趨勢[3]。IBD發病機制復雜,病因仍不十分清楚,所以需要對IBD機制做更加深入的研究。SIVAPRAKASAM等[4]的研究顯示,IBD是由于宿主免疫系統和微生物群之間的共生關系被破壞而導致腸道慢性炎癥,各種因素會改變腸道微生物群,導致腸道菌群生態失調,其中以飲食和膳食纖維兩個因素較為關鍵。
SLC5A8可通過影響黏膜免疫系統的耐受反應從而調節腸道穩定。有研究表明,SLC5A8基因通過影響結腸組織與腸系膜淋巴結中的CD4+T淋巴細胞來調節機體免疫[5]。CD4+T淋巴細胞可通過分泌IL-10、IL-8及IL-12等因子影響IBD的發生和發展[6-7]。SLC5A8基因的表達產物是Na+-單羧酸偶聯轉運蛋白,其主要功能將細菌發酵的短鏈脂肪酸(SCFA)轉運到細胞內發揮作用。Na+-單羧酸偶聯轉運蛋白在腸道黏膜組織、尤其是在丁酸含量較高的結腸黏膜組織中含量最多。SCFA主要是由細菌在結腸中發酵膳食纖維并產生,主要包括乙酸鹽、丙酸鹽和丁酸鹽,它們不僅可以作為結腸細胞能量來源,還具有抑制免疫細胞活化的功能,其中以丁酸鹽的抗炎效果最為明顯[8-10]。丁酸可以通過SLC5A8轉運體進入細胞,然后通過促進抗炎因子表達及抑制促炎因子表達發揮抗炎作用[11]。IBD患者由于腸道環境失調,影響了丁酸的產生、氧化和吸收[12]。本研究實驗組利用脂多糖構建IBD細胞模型后,再轉染過表達SLC5A8質粒,發現炎癥因子表達呈下降趨勢,抗炎因子表達呈上升趨勢。因此,我們推測SLC5A8基因可能參與抑制IBD的發生發展。
腸道黏膜損傷是IBD患者的主要特征之一,所以促進腸道黏膜愈合可能成為減輕IBD患者臨床癥狀、抑制疾病復發的新方向[13]。腸道黏膜損傷的出現預示著腸上皮屏障破壞。腸黏膜愈合是由上皮細胞增殖和分化完成的,巨噬細胞、中性粒細胞和淋巴細胞等免疫細胞共同參與調節[14]。本研究透射電鏡觀察發現,實驗組與模型組相比,細胞膜表面微絨毛脫落減少,緊密連接結構破壞較少。可以推測出SLC5A8基因可能通過維持腸道黏膜的完整性,保護IBD腸道黏膜。
IL-8作為一種促炎細胞因子,通過介導多種信號通路,在許多炎癥性疾病包括IBD中發揮著重要作用,同時也參與了結直腸癌的發生發展[15-16]。WALANA等[17]應用IL-8拮抗劑G31P治療DSS誘導的潰瘍性結腸炎小鼠模型,顯著減低了血清IL-8水平,上調緊密連接蛋白表達,抑制了炎癥的發展,減輕了結腸纖維化。本研究結果顯示,實驗組細胞中IL-8 mRNA表達及培養液上清中IL-8水平低于模型組,推測SLC5A8基因可能通過抑制IL-8的表達來干預IBD。
人體腸黏膜系統中存在著多種的免疫細胞亞群,其活性受到細胞因子調節,其中包括TGF-β1[18]。TGF-β1是一種由多種類型細胞產生的具有多重效應的細胞因子,可控制腸黏膜免疫細胞和非免疫細胞的活化、生長、增殖和分化。TGF-β1可促進調節性T細胞、輔助性T細胞(Th)17和Th9分化的能力,從而在一些炎癥性疾病中發揮作用[19]。炎癥T淋巴細胞及其相關促炎細胞的積累是IBD患者的顯著特征之一,與IBD的發生發展密切相關[20]。本研究中實驗組細胞TGF-β1mRNA表達及培養液上清TGF-β1水平上調,提示SLC5A8基因干預IBD的機制可能還與上調TGF-β1分泌、進一步影響T細胞免疫有關。
綜上所述,SLC5A8基因過表達有助于維持IBD細胞模型的結構,抑制炎癥細胞因子IL-8表達,促進抗炎細胞因子TGF-β1表達,從而有助于減輕IBD的炎癥反應。以上研究結果為IBD的治療提供了新的思路及實驗依據。

