王朗國家級自然保護區斑尾榛雞腸道菌群多樣性初步分析
羅學群,朱 琪,周 航,黃朝霞,廖光炯,張文平,杜世章,熊先華,王金玲,花東來*
(1.綿陽師范學院資源環境工程學院,四川綿陽 621000;2.綿陽師范學院生命科學與技術學院/大熊貓國家公園岷山生物多樣性監測分析實驗室,四川綿陽 621000;3.北川羌族自治縣國有林場,四川綿陽 622700;4.大熊貓國家公園綿陽管理分局,四川綿陽 621000;5.四川小寨子溝國家級自然保護區管理處,四川綿陽 622750)
0 引言
斑尾榛雞(Tetrastessewerzowi),屬于雞形目松雞科榛雞屬鳥類,是中國特有鳥類,主要分布于青海、甘肅、四川、云南西南部和西藏東部高海拔的山林中[1].由于自然形成的斑塊生境、氣候變化以及人為干擾,斑尾榛雞的棲息地出現嚴重破碎化,其適宜區域面積呈現遞減趨勢[2].再加上狩獵、天敵、寄生蟲等多種因素,斑尾榛雞種群數量急劇減少,被中國瀕危動物紅皮書列為“瀕危”鳥類[3].斑尾榛雞的模式物種來自甘肅蓮花山,由王香亭等[4]發現并記錄,初步研究了斑尾榛雞活動規律、食性、繁殖習性、天敵等.斑尾榛雞的研究區域也多在蓮花山保護區內[1],其次是青藏高原地區[5],對四川王朗國家級自然保護區的斑尾榛雞健康狀況方面的研究鮮有涉及[6-7].由于腸道菌群與宿主的健康和習性關系密切[8],因此,為了更好地保護斑尾榛雞,本文以王朗自然保護區作為研究地點,分析斑尾榛雞菌群特征,以期為因地制宜制定該物種管理和保護策略提供科學依據.
1 材料和方法
1.1 糞便樣品收集
研究組在查閱相關資料并在巡山人員的指引下,于2022—2023年通過糞便形狀等特征對小寨子、王朗兩個保護區進行了疑似斑尾榛雞糞便樣品的收集工作,共采集了7份樣品,其中小寨子三份,王朗竹根岔兩份,王朗回頭線溝和白沙溝各一份.取樣時,為避免交叉污染均戴有一次性無菌薄膜手套,采集的糞便放入50 mL無菌離心管中,再倒入無水乙醇淹沒整個糞便,運輸回實驗室后低溫保存.
1.2 糞便宿主物種鑒定
QIAamp? Fast DNA Stool Mini Kit (Qiagen,德國)可有效減少細菌DNA的含量,增加宿主DNA的濃度.因此采用該試劑盒進行糞便DNA提取用于宿主物種鑒定,具體步驟參照該試劑盒說明書,最后溶于50 μL試劑盒自帶的TE緩沖液中.
然后用引物(Forward:5’>ATGAAGGGATGTTCTACTGGTTG<3’;Reverse:5’>AACATCTCCGCATGATGAA<3’)擴增鳥類的Cytb序列,目的片段長度為1200 bp[9-10].PCR擴增在40 μL反應混合液中進行:2×T8 High-Fidelity Mast 20 μL, Forward primer (10 μM) 2 μL, Reverse primer (10 μM) 2 μL, DNA模板2 μL, ddH2O 14 μL.PCR反應條件是:預變性98 ℃ 2 min,變性98 ℃ 10 s,退火55 ℃ 15 s,延伸72 ℃ 15 s,最后總延伸72 ℃ 5 min,4 ℃ 保溫,共37次循環.PCR產物在北京擎科生物科技股份有限公司成都分公司進行測序.最后將得到的序列上傳到NCBI進行blastn分析.在比對結果中,將在NCBI上比對得到的同源性在99%以上且同源度最高的、排序靠前的、物種信息明確的物種作為鑒定的參考物種.
1.3 糞便樣品菌群分析
為提高腸道菌群DNA的純度,采用PowerFecal? DNA Isolation Kit(MOBIO,美國)進行糞便菌群DNA提取.將大約0.25 g樣品加入到試劑盒提供的PowerBead Tubes中,其余步驟參照試劑盒,最后采用DNA溶解液(試劑盒配備)溶解DNA,并將DNA濃度調整到50 ng/μL.
糞便菌群分析采用細菌的16S rRNA V3-4的通用引物338F(5’>ACTCCTA CGGGAGGCAGCA<3’)、806R(5’>GGACTACHVGGGTWTCTAAT<3’)[11].總體積為30 μL的PCR反應體系為:2×reaction buffer (KOD FX Neo Buffer)15 μL,KOD FX Neo 0.6 μL, dNTP(2.0 mM each)6 μL,Forward primer(10 μM)0.9 μL,Reverse primer(10 μM)0.9 μL,DNA Template 1 μL,ddH2O 5.6 μL.PCR反應條件是:預變性98 ℃ 2 min,變性 98 ℃ 30 s,退火 50 ℃ 30 s,延伸 72 ℃ 60 s,最后延伸72 ℃ 5 min,4 ℃ 保溫,共30次循環.PCR產物的建庫及測序在北京擎科生物科技股份有限公司進行,采用illumina Novaseq 6000 PE250進行測序.
每份樣品的原始數據下機通過去除接頭和barcode,然后進行質量篩查得到高質量的序列.同時,從NCBI上下載了50份來自紅原雞的糞便菌群16S rDNA v3-4的數據[12]用于本研究.
對得到的雙端序列采用QIIME2(版本號2021.2,https://qiime2.org)[13]進行分析,包括利用FLASH軟件(版本號1.2.7)[14]進行配對連接,重疊區域的堿基長度大于10 bp,且不允許錯配;采用DADA2的流程進行質控和feature輸出結果(100%相似度);feature的分類信息采用SILVA參考數據庫(version 138)[15].菌群的α和β多樣性分析采用QIIME2流程,數據的可視化基于在線網站https://view.qiime2.org進行.組間菌群差異分析采用Wen[16]的方法,可視化基于該文獻提供的edgeR火山圖流程.
2 結果
2.1 糞便宿主鑒定
糞便DNA宿主的Cytb序列顯示小寨子的1個樣品來自綠尾虹雉;王朗的1個樣品來自紅喉雉鶉,2個樣品來自斑尾榛雞;剩下的3個樣品由于提取的糞便宿主DNA擴增失敗而不能鑒定物種.其中,在王朗竹根岔采集的糞便樣品雖然Cytb擴增失敗,但其糞便形態與已經確認來自斑尾榛雞的比較相似,兩樣品采集點間距在5 m左右,因此該樣品也來自斑尾榛雞,有較高可信度(見討論部分).這樣來自王朗的3份樣品用于本研究的斑尾榛雞菌群分析.
2.2 王朗斑尾榛雞腸道菌群組成
對下機序列進行拼接、質控、去除低質量序列和嵌合體后,3個樣本共獲得194 296條合格的16S rDNA序列,每個樣本的有效序列數48 704~76 068條.基于100%相似度的feature稀釋性曲線顯示各個樣本曲線均趨向平坦(圖1),說明測序所得序列能夠完全展示各個樣品細菌群落多樣性,可以進行后續分析.
王朗斑尾榛雞細菌群落分屬31個門.表1顯示了門水平的細菌群落結構組成,其中豐度占比小于0.01的物種歸為others.結果顯示王朗斑尾榛雞菌群主要的門類為變形菌門(Proteobacteria)、放線菌門(Actinobacteriota)、厚壁菌門(Firmicutes)、藍細菌門(Cyanobacteria)、擬桿菌門(Bacteroidota)、酸桿菌門(Acidobacteriota)等.王朗斑尾榛雞還有大量的未分類的菌群,平均相對豐度為11.7%,在樣本WZ07F中高達33.7%.
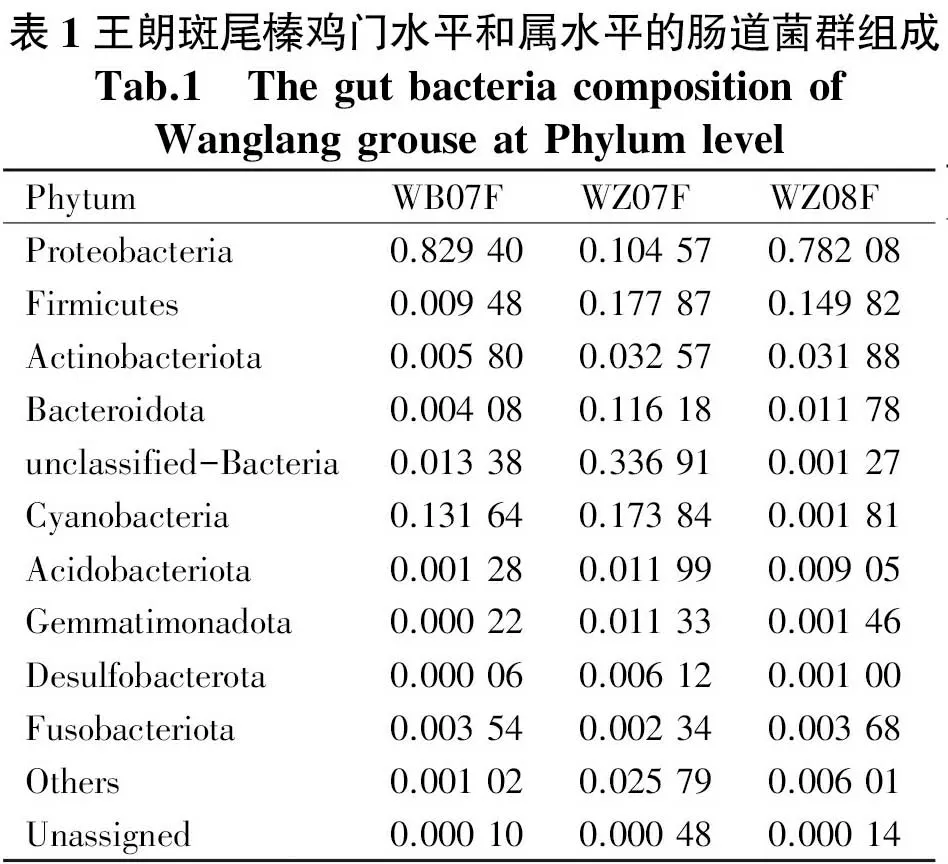
在屬分類水平上共檢測到的細菌覆蓋了582個細菌屬,如表2所示,所有樣本中豐度占比小于0.01的物種歸為others,占比為2.9%~34.6%.結果顯示平均相對豐度占比前10的優勢屬為Pseudomonas、Escherichia_Shigella、unclassified_Cyanobacteriales、Paenibacillus、unclassified_Muribaculaceae、Sporosarcina、unclassified_Lachnospiraceae、uncultured_Bacteroidales_bacterium、Lachnospiraceae_NK4A136_group和Lactobacillus.同時,大量的序列不能歸入已知屬,表2中的名稱前加-unclassified來表示,這顯示王朗斑尾榛雞中有大量的未知菌群.
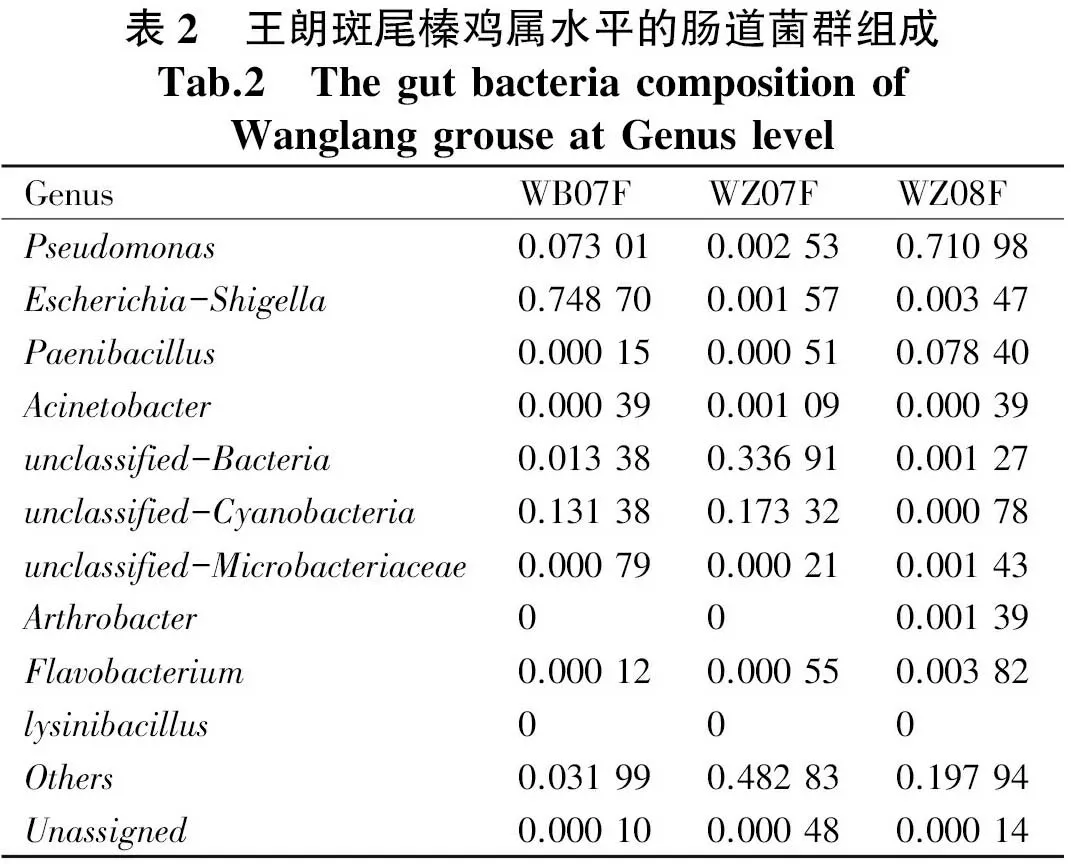
斑尾榛雞菌群的α多樣性結果顯示其多樣性覆蓋度均高于99%,表明測序結果覆蓋度較好且具有很高的可信度.三個樣本的Chao 1和ACE指數與觀察到的feature數一樣(圖2A).Shannon指數和Simpson指數反映群落分布多樣性,Shannon指數越大、Simpson指數越小,說明群落多樣性越高.本研究中樣本WZ07F的Shannon指數最高,而其Simpson與WZ08F比較接近.等級豐度曲線可直觀地反映樣本中物種的豐富度和均勻度,三個樣本中,樣本WZ07F等級豐度曲線在橫軸上的跨度最大,因此該樣品菌群的豐富度最高;同時,該樣本在垂直方向上曲線最平緩,因此其菌群分布較均勻.

圖2 王朗斑尾榛雞腸道菌群alpha多樣性(A和B)和等級豐度曲線(C)Fig.2 The Alpha diversity results (A and B) and Rank Abundance Curve (C) of gut bacteria of Wanglang grouse
2.3 王朗斑尾榛雞腸道菌群與紅原雞的差異分析
以Puetz[12]發表的紅原雞菌群作為對照,用于評估王朗斑尾榛雞菌群組成的多樣性和健康情況.為了比較群體之間的菌群差異,只在一個樣本中出現的feature被過濾,同時序列數少于3的低豐度菌群也被過濾,這樣總共1 238個feature用于比較紅原雞和斑尾榛雞之間的菌群差異.紅原雞和斑尾榛雞菌群alpha多樣性指標,包括Pielou evenness,Richness和Shannon,差異并不顯著(P>0.05).基于Bray-Curtis距離、Jaccard指數、Unweighted UniFrac距離和Weighted UniFrac距離的主成分分析(PCoA)顯示紅原雞和王朗斑尾榛雞的菌群差異顯著(圖3).Bray-Curtis距離和Weighted UniFrac距離未能區分紅原雞和斑尾榛雞(圖3A和3D),但Jaccard指數和Unweighted UniFrac距離均顯著將這兩個物種的菌群分開(permanova-pairwise,p<0.001)(圖3B和3C),表明王朗斑尾榛雞與紅原雞的菌群差異主要在于稀有菌群上.圖4顯示了紅原雞和斑尾榛雞菌群的菌群差異情況,圖中標注了差異最大的5個feature,其中斑尾榛雞富集的feature分別屬于大腸桿菌志賀菌屬(Escherichia-Shigella)、假單胞菌屬(Pseudomonas)和節桿菌屬(Arthrobacter),紅原雞富集的feature分別屬于羅斯氏菌屬(Romboutsia)和乳酸桿菌屬(Lactobacillus).
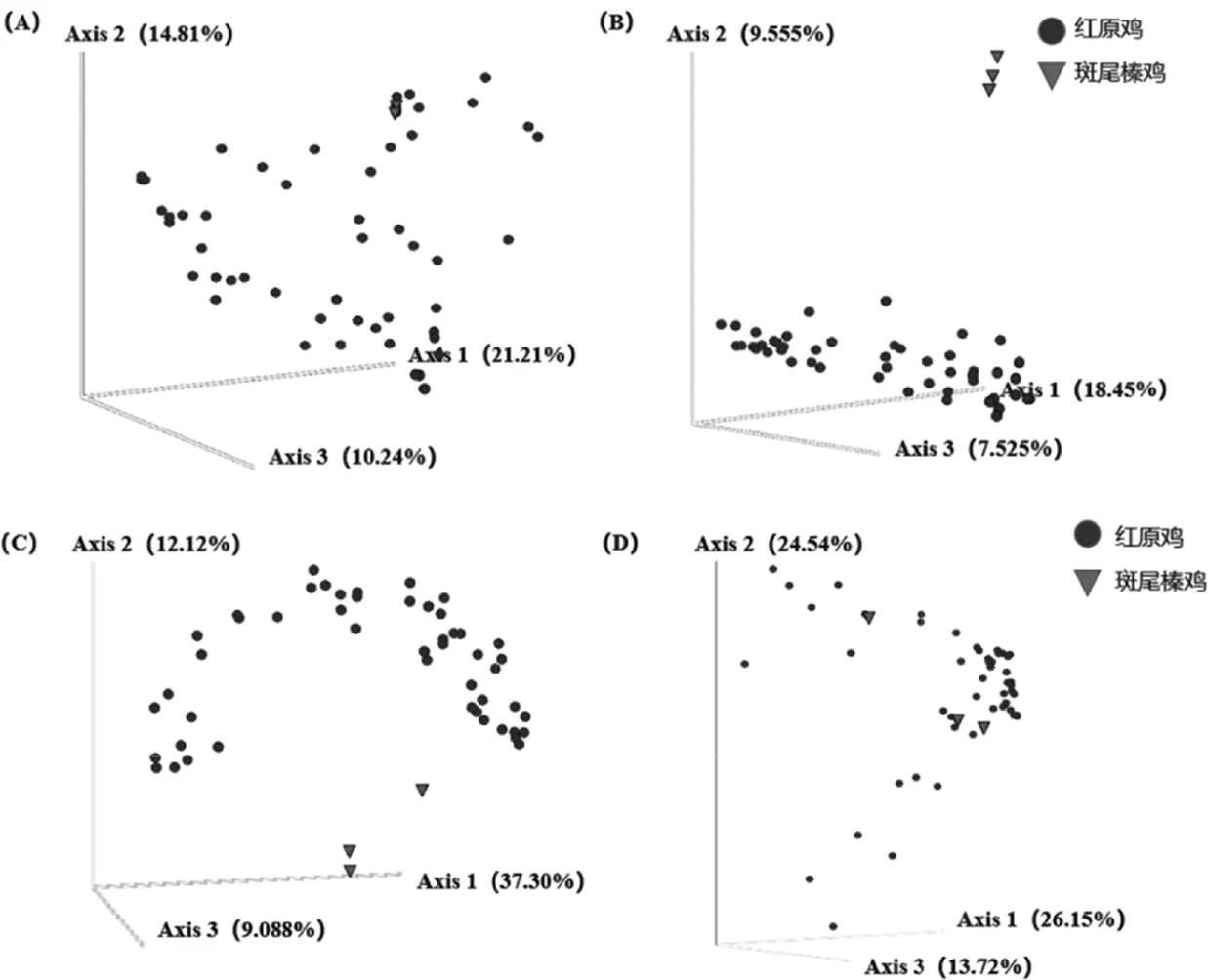
(A) Bray-Curtis距離(B) Jaccard指數(C)Unweighted UniFrac 距離(D)Weighted UniFrac 距離圖3 紅原雞和王朗斑尾榛雞腸道菌群主成分分析(PCoA)Fig.3 the PCoA results of gut bacteria of Wanglang grouse and red junglefowl in this study
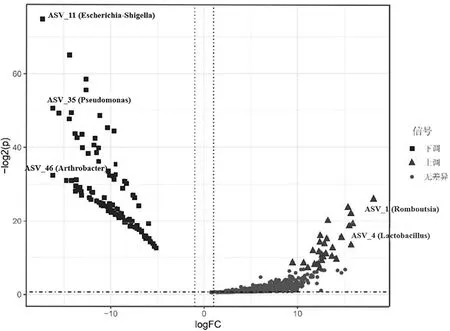
圖4 紅原雞和王朗斑尾榛雞腸道菌群差異分析火山圖Fig.4 The volcano map of gut bacteria difference analysis between red roosters and Wanglang grouse
3 討論
本研究在2023年2月和5月對王朗自然保護區斑尾榛雞主要活動區域竹根岔、白沙溝、回頭線溝進行了采樣.經過Cytb序列鑒定,發現白沙溝WB07F樣品和竹根岔采集的WZ07F樣品鑒定為斑尾榛雞,而回頭線溝的樣品鑒定為紅喉雉鶉(Tetraophasisobscurus).來自竹根岔的另外一個樣本WZ08F由于提取的宿主DNA量太少未能通過物種鑒定,該樣本與WZ07F樣本采集點距離較近且糞便形態相似.由于斑尾榛雞的遷徙能力較弱且成群活動,因此WZ08F有很大可能也來自斑尾榛雞.
食性、年齡和季節均會影響鳥類腸道菌群的多樣性.以昆蟲為食物的大山雀腸道菌群以變形菌門、厚壁菌門和軟壁菌門為主,而以種子為食物的個體腸道菌群以變形菌門、軟壁菌門和藍細菌門為主[17].王娟[18]等綜述了不同食性野生鳥類的腸道微生物特征,研究發現植食性鳥類食物組成較為單一,腸道微生物多樣性相對較低,以變形菌門、放線菌門和厚壁菌門為主,而雜食性鳥類腸道微生物因食物組成多樣,主要以厚壁菌門、變形菌門、擬桿菌門、放線菌門為主.從目前的研究結果來看,大多數研究表示斑尾榛雞是植食性鳥類,主要以柳、榛的鱗芽、葉和云杉種子以及其他植物的花、花序、葉、嫩枝梢為食[4,19],但仍有斑尾榛雞覓食昆蟲的報道,比如斑尾榛雞取食小毛蟲、偽步行蟲、金花蟲等,在5—7月的繁殖季節,雌性斑尾榛雞也經常食用無脊椎動物(主要是螞蟻)[19-20].本研究結果顯示王朗地區斑尾榛雞腸道優勢菌門含有變形菌門、厚壁菌門、擬桿菌門、放線菌門等(表1),這個結果與莫麒穎[17]的發現一致.根據王娟等[18]的結果,我們推測王朗地區的斑尾榛雞屬于雜食性.
紅原雞的腸道菌群作為對照用于評估王朗斑尾榛雞的腸道菌群健康狀況.結果顯示,與紅原雞菌群相比,斑尾榛雞富集的菌包括大腸桿菌志賀菌屬(Escherichia-Shigella)、假單胞菌屬(Pseudomonas)和節桿菌屬(Arthrobacter)(圖4).志賀氏菌屬和假單胞菌屬是腸道機會致病菌,其豐度增高可導致微生態失調,因此與消化道的多種疾病密切相關[21].節桿菌屬細菌大多存在于環境中,可以降解諸多苯衍生物、多環芳烴、N-雜環化合物等環境有機污染物[22],但其在宿主體內的作用還鮮有報道.而紅原雞中富集的菌包括羅斯氏菌屬(Romboutsia)和乳酸桿菌屬(Lactobacillus)(圖4)有助于維持腸道微生態平衡、抵抗疾病[23].因此,相對于紅原雞,斑尾榛雞腸道微生態失調的風險更高.有研究發現幼鳥和成年鳥的腸道微生物組差異較大[24].因此,為了更好地分析王朗地區斑尾榛雞的菌群特征,還需要開展更廣泛的研究工作,包括收集不同季節和不同年齡斑尾榛雞的糞便樣品.
盡管本研究只有三份樣本來自斑尾榛雞,但這三份樣本來自王朗保護區的2個斑尾榛雞主要分布地,因此在一定程度上反應了王朗保護區斑尾榛雞的菌群情況,為后續大規模研究奠定了堅實的基礎.

