川芎嗪-丹參配伍前后在急性心肌缺血模型大鼠體內的組織分布差異研究
李 容勾 健劉 亭鞏仔鵬陸 苑劉春花黃 勇孫 佳*
(1.貴州醫科大學 貴州省藥物制劑重點實驗室 省部共建藥用植物功效與利用國家重點實驗室,貴陽 550004;2.貴州醫科大學 民族藥與中藥開發應用教育部工程研究中心,貴陽 550004;3.貴州醫科大學 藥學院,貴陽 550004)
冠狀動脈心臟病是全球流行病中發病率和死亡率的主要原因,心肌缺血是冠心病的代表性病理過程,其特征是心肌血氧供需失衡,引起心臟代謝紊亂、心律失常、心肌梗死、猝死[1]。由鹽酸川芎嗪和丹參配伍組成的參芎葡萄糖注射液(Shenxiong glucose injection, SGI)在臨床上廣泛用于治療無癥狀心肌缺血、心力衰竭、心絞痛、急性缺血性中風等多種疾病,且臨床效果顯著[2-3]。藥理作用研究顯示SGI 具有抗氧化應激和抗凋亡作用[4],同時SGI可能通過環氧合酶途徑等生物過程治療缺血再灌注損傷,其主要與脂肪細胞脂解、血小板活化的調控等信號通路密切相關[5]。
中藥復方是中藥臨床應用的主要形式,配伍通過引起藥物代謝酶和轉運蛋白的改變從而導致藥物的吸收、分布、代謝和排泄(ADME)過程發生變化[6]。而機體是否處于病理狀態以及疾病的嚴重程度同樣對藥物的ADME 過程有不同的影響,因此在病理狀態下研究藥物配伍前后的體內過程具有更重要的臨床意義。目前對于丹參和川芎嗪的報道主要集中在正常狀態下單一成分的藥動學和體內分布研究[7-8],課題組前期研究發現,在單次給藥后,川芎嗪-丹參配伍組急性心肌缺血(AMI)大鼠體內川芎嗪的AUC 顯著降低,Vz 升高[9],提示配伍降低了川芎嗪的吸收而加快了分布。可見配伍改變了活性成分在體內的藥動學行為,但是對其組織分布的影響不得而知。鑒于該部分研究未見報道,本實驗基于AMI 大鼠模型,通過考察川芎嗪-丹參配伍前后各組中川芎嗪和丹參素這兩種活性成分的組織分布差異,進一步從體內過程變化的角度揭示藥物配伍的機理,對臨床合理用藥提供參考。
1 材料和方法
1.1 實驗動物
7~9 周齡SPF 級健康雄性Sprague-Dawley(SD)大鼠96 只,體重為230~270 g,由遼寧長生生物技術股份有限公司提供[SCXK(遼)2020-0001],實驗動物飼養于貴州醫科大學實驗動物中心[SYXK(黔)2018-0001],于溫度為22~25℃、相對濕度為45%~60%的動物房內適應性飼養1 周后用于后續實驗。所有實驗方案研究都得到了貴州醫科大學動物倫理委員會的批準(1801210),并按實驗動物使用的3R 原則給予人道關懷。
1.2 主要試劑與儀器
丹參浸膏(貴州景峰注射劑有限公司,批號07200801);鹽酸異丙腎上腺素(上海阿拉丁生化科技股份有限公司,批號G2028261,純度≥99%);丹參素、鹽酸川芎嗪、葛根素對照品(上海源葉生物科技有限公司; 批號分別為 H09N10S102463、X08O9C71471、S02 M9B54875,純度均≥98%);木犀草苷對照品(成都埃法生物科技有限公司,批號AF20072618,純度≥98%);甲醇(色譜純,美國Fisher 公司);乙腈、甲酸(色譜純,德國Merck 公司);其他試劑均為分析純;實驗用水為屈臣氏蒸餾水。
ACQUITY UPLC I-Class/Xevo TQ-S 型超高效液相串聯三重四極桿質譜聯用儀(TQS, 美國 Waters公司)、ACQUITY UPLC-TQD 型超高效液相串聯三重四極桿質譜聯用儀(TQD, 美國Waters 公司);低溫高速離心機(Allegra 64R,美國Beckman Coulter公司);氮吹濃縮裝置(MTN-2800D,天津奧特賽恩斯儀器有限公司);電子天平(EL204,上海梅特勒-托利多有限公司);勻漿機(T10 basic,德國IKA 公司)。
1.3 實驗方法
1.3.1 供試品的制備
臨床上SGI 的單次每日劑量為100~200 mL。因此,按物種間轉換計算后大鼠所需劑量為10.5~21.0 mL/kg。然而,實驗所需的注射量將超過大鼠的正常注射量(10 mL/kg)。因此按照參芎葡萄糖注射液國家藥品標準(WS-10001-(HD-1136)-2002)“處方”和“制法”項下進行供注射用實驗樣品的制備,川芎嗪組(LG,不含丹參提取物)、丹參組(DS,不含川芎嗪)和川芎嗪-丹參組(LD)同比例加入葡萄糖、甘油和注射用水量,調至pH=5.5~6.5,并進行過濾、滅菌。采用HPLC 測得LD 組中各成分的質量濃度為川芎嗪1.368 mg/mL、丹參素0.378 mg/mL。
1.3.2 鹽酸異丙腎上腺素溶液的配制
稱取鹽酸異丙腎上腺素0.1 g 于10 mL 容量瓶中,加入生理鹽水溶解并定容至刻度,配制成質量濃度為10 mg/mL 的鹽酸異丙腎上腺素溶液,現配現用。
1.3.3 對照品溶液的配制
精密稱取丹參素、鹽酸川芎嗪、木犀草苷(TQD內標)、葛根素(TQS 內標)對照品適量至10 mL 容量瓶,加甲醇適量,超聲溶解并定容至刻度,得丹參素、川芎嗪、木犀草苷、葛根素的濃度分別為1.030 mg/mL、0.9986 mg/mL、1.052 mg/mL、1.023 mg/mL的儲備液。分別精密吸取丹參素、川芎嗪對照品儲備液適量,加50%甲醇稀釋得8.240 μg/mL、29.958 μg/mL 的混合對照品母液,再用50%甲醇2 倍逐級稀釋得到不同濃度梯度的混合對照品工作液。
1.3.4 色譜與質譜條件
采用實驗室前期建立的色譜和質譜條件[9],保護柱:Waters Van Guard BEH C18(2.1×5 mm,1.7 μm),色譜柱:Waters BEH C18(2.1×150 mm,1.7 μm),柱溫:40℃,流速:0.35 mL/min,流動相:0.1%甲酸水-0.1%甲酸乙腈,梯度洗脫:0~1.0 min,92%A;1.0~1.5 min,92%~70% A;1.5~2.0 min,70%~60% A;2.0~2.5 min,60%~10% A;2.5~3.0 min,10% A;3.0 ~ 4.0 min,10% ~ 92% A,進樣體積:1 μL。
由于SGI 中川芎嗪與丹參素在儀器中響應差別較大,故本實驗中川芎嗪采用TQD 檢測(內標為木犀草苷),丹參素采用TQS 檢測(內標為葛根素)。采用電噴霧電離源(ESI),電毛細管電壓3 kV,離子源溫度120℃,噴霧氣與反吹氣N2,去溶劑氣溫度350℃,去溶劑氣流速650 L/hr,掃描方式為多反應監測(MRM),Masslynx 4.1 工作站進行數據采集及處理。TQS 中用于定量分析的離子對分別為丹參素為m/z197.5→162.7、葛根素(內標)m/z415.1→267.0,錐孔電壓分別為25、35 V,碰撞電壓分別為20、25 V,均為負離子掃描模式;TQD 中用于定量分析的離子對分別為川芎嗪為m/z137.1→55.1、木犀草苷(內標)m/z449.1 →250.9,錐孔電壓分別為40、30 V,碰撞電壓分別為20、25 V,均為正離子掃描模式。
1.3.5 動物分組、給藥與組織樣品收集
取96 只健康SD 大鼠,實驗前禁食12 h,自由飲水。按50 mg/kg 劑量皮下注射鹽酸異丙腎上腺素,每天給藥1 次,連續給藥2 d 制備AMI 模型大鼠[9]。造模后,隨機分為川芎嗪組(ligustrazine,LG)、丹參組(Danshen,DS) 和川芎嗪-丹參組(ligustrazine-Danshen,LD)(每組30 只)、空白組6只。除空白組大鼠給予等量生理鹽水,其余組大鼠按10 mL/kg(相當于川芎嗪13.68 mg/kg,丹參素3.78 mg/kg)劑量進行尾靜脈注射。于給藥后1、5、10、30、60 min 處死大鼠,空白組于注射60 min 后處死,在冰床上迅速剝離心臟、肝、脾、肺、腎、腦組織,各組織按w∶v=1 ∶2 加入生理鹽水在冰浴中勻漿,8000 r/min 離心10 min,分離上清液于-20℃保存備用。
1.3.6 組織樣品前處理
對實驗室前期采用的樣品處理方法[9]進行優化后用于本部分實驗。取上述組織勻漿上層液200 μL,依次加入20 μL 內標(葛根素1 μg/mL,木犀草苷150 μg/mL),60 μL 鹽酸(1 mol/L),1 mL 乙酸乙酯,渦混5 min,超聲10 min,于4℃下14 000 r/min離心10 min,取上清液a;沉淀中依次加入40 μL NaOH(1 mol/L),1 mL 乙酸乙酯,渦混5 min,超聲10 min,于4℃下14 000 r/min 離心10 min,取上清液加入100 μL 鹽酸甲醇溶液(1 mol/L),得b 液,合并a、b 液,30℃氮氣吹干,剩余殘渣用200 μL 50%甲醇溶解,于4℃下15 000 r/min 離心10 min,取上清液進樣分析。
1.4 統計學方法
采用WinNonLin 8.2(Phoenix, 美國Pharsight公司)軟件中的非房室模型計算川芎嗪和丹參素在組織中的AUC0-t參數。用SPSS 22.0 軟件對數據進行統計分析,實驗結果以平均數±標準差(±s)表示,采用獨立樣本t檢驗進行組間比較,以P<0.05計為差異具有統計學意義。
2 結果
2.1 方法學考察
通過對心臟、肝、脾、肺、腎、腦各組織間基質效應比較,質量控制樣本(QC)在不同基質中沒有明顯的基質效應影響。因此隨機抽取了心臟、肝兩個組織進行了方法學考察。
2.1.1 專屬性
取各空白組織勻漿上層液、加入一定濃度對照品溶液和內標溶液的空白組織勻漿上層液、大鼠給藥后的組織勻漿上層液各200 μL,分別按“1.3.6”方法操作,進樣分析分別得到色譜圖。在選定的色譜條件和質譜條件下,空白組織勻漿上層液中的內源性物質不干擾丹參素等成分的測定,各成分的分離度和峰形良好,提示該方法專屬性良好(圖1)。

注:A:空白組織;B:空白組織加入混合對照品;C:含藥組織。圖1 大鼠組織中兩種成分及內標的MRM 專屬性色譜圖Note.A, Blank tissue.B, Add mixed reference substance to blank tissue.C, Medicated tissue.Figure 1 MRM specific chromatograms of two components and internal standards in rat tissues
2.1.2 標準曲線和線性范圍
取各空白組織勻漿上層液200 μL,加入混合標準品溶液20 μL,配制成相當于大鼠血漿藥物濃度,其余按“1.3.6”項下方法操作,進樣分析,以2 種待測成分的峰面積與內標的峰面積之比(A/Ai)為縱坐標(Y),各物質濃度(C)為橫坐標(X),以1/X2為加權系數,求得直線方程,即為標準曲線。兩種成分在相應的線性范圍內線性關系良好,相關系數R2均大于0.9907,結果見表1。

表1 川芎嗪和丹參素在組織中的標準曲線Table 1 Standard curves of the ligustrazine and Danshensu in tissues
2.1.3 準確度和精密度
取心臟和肝空白組織勻漿上層液200 μL,加入低、中、高3 個濃度的QC 樣本,再按“1.3.6”項下方法操作,每個濃度平行5 個樣本,日內連續進樣,且與標準曲線同時進行,3 個濃度連續測定3 d,分別計算日內和日間準確度、精密度。川芎嗪和丹參素在心臟和肝組織中的日內準確度范圍為87.00%~106.66%,日間準確度范圍為89.32%~108.20%,日內、日間精密度RSD 均小于15%。提示該方法重現性好,符合生物樣品分析方法的基本要求,見表2。
表2 川芎嗪和丹參素在不同給藥組大鼠體內的分布(±s, n=6)Table 2 Distribution of the ligustrazine and Danshensu in rats among different administration groups

表2 川芎嗪和丹參素在不同給藥組大鼠體內的分布(±s, n=6)Table 2 Distribution of the ligustrazine and Danshensu in rats among different administration groups
注:與LG 組相比,*P<0.05,**P<0.01,***P<0.001;與DS 組比較,#P<0.05,##P<0.01,###P<0.001;-,未檢出。Note.Compared with LG group,*P<0.05,**P<0.01,***P<0.001.Compared with DS group,#P<0.05,##P<0.01,###P<0.001.-, Not detected.
成分Compound組織Tissue組別Groups含量(μg/g)Concentration 1 min 5 min 10 min 30 min 60 min藥時曲線下面積(μg/(g·min))AUC0-t川芎嗪Ligustrazine心臟Heart肝Liver脾Spleen肺Lung腎Kidney腦Brain LG 1.12±1.10 0.88±0.59 0.45±0.28 0.39±0.18 0.22±0.12 26.21±7.78 LD 3.51±1.38** 3.44±1.45** 10.63±4.68*** 6.74±3.33*** 1.57±0.76** 351.06±59.3***LG 0.82±0.50 0.29±0.12 0.18±0.06 0.22±0.06 0.15±0.07 13.92±3.01 LD 0.09±0.04** 0.10±0.09* 0.21±0.13 0.08±0.05** 0.05±0.02** 5.95±1.72***LG 7.45±1.10 6.44±1.47 4.76±0.79 3.79±0.64 1.15±0.47 223.18±15.48 LD 6.79±3.34 9.90±1.85* 8.77±0.96*** 3.59±1.47 1.63±0.69 288.65±44.7**LG 11.28±4.44 4.02±3.07 1.15±0.58 0.87±0.48 0.22±0.15 94.33±17.49 LD 8.07±6.48 4.41±3.75 4.27±2.62* 1.4±0.57 0.93±0.70 147.16±50.33*LG 30.58±9.48 16.30±6.52 13.34±2.02 7.38±2.58 1.71±0.92 545.14±87.5 LD 30.11±18.81 24.12±5.73 19.32±2.69** 8.04±0.92 4.09±2.20* 705.12±102.27*LG 39.42±13.93 33.75±23.95 16.64±7.03 14.42±4.07 6.20±3.09 958.3±131.65 LD 90.83±70.26 43.77±34.45 45.44±21.6* 26.75±6.70** 4.31±3.00 179.1±498.74**心臟Heart肝Liver丹參素Danshensu脾Spleen肺Lung腎Kidney腦Brain DS 0.68±0.14 0.37±0.05 - - - 2.83±0.48 LD 1.47±0.41## 0.59±0.12## - - - 5.80±1.27###DS 0.58±0.07 0.31±0.07 0.21±0.06 0.12±0.01 0.11±0.00 10.46±0.88 LD 0.99±0.42 0.6±0.21# 0.24±0.10 0.17±0.03 0.13±0.01 14.97±1.76##DS 0.57±0.25 0.27±0.07 0.15±0.07 0.07±0.01 0.05±0.01 7.44±1.53 LD 0.61±0.15 0.42±0.06# 0.28±0.04## 0.11±0.04# 0.06±0.02 10.95±0.69##DS 2.39±0.50 1.00±0.26 0.78±0.18 0.3±0.03 0.23±0.01 32.67±1.52 LD 2.47±0.25 1.09±0.05 0.81±0.16 0.3±0.05 0.27±0.02 34.35±1.51 DS 45.14±9.19 17.61±7.43 10.08±2.90 0.98±0.37 0.35±0.18 377.25±64.9 LD 40.56±13.81 30.14±11.18# 12.47±3.17 1.81±0.74# 0.49±0.23 468.27±98.86 DS 0.10±0.02 0.06±0.03 0.03±0.01 - - 0.63±0.13 LD 0.08±0.03 0.06±0.01 0.04±0.02 0.02±0.00 - 1.22±0.19###
2.1.4 提取回收率和基質效應
取心臟和肝空白組織勻漿上層液200 μL,加入低、中、高3 個濃度的QC 樣本,每個濃度平行5 份,按“1.3.6”項下操作(樣品A);另取空白組織勻漿上層液200 μL(不加混合標準溶液和內標) 按“1.3.6”項下操作,向獲得的上清液中加入低、中、高濃度的混合標準溶液和內標,氮氣吹干,殘渣以200 μL 初始流動相溶解(樣品B);另取低、中、高濃度的混合標準溶液與內標,氮氣吹干,殘渣以200 μL 初始流動相溶解(樣品C)。以A 樣品與B 樣品色譜峰面積之比為提取回收率,以B 樣品與C 樣品的色譜峰面積之比為基質效應。心臟和肝組織中川芎嗪和丹參素在低、中、高3 個濃度下的提取回收率在97.87%~112.38%, 基質效應在95.47%~106.05%,RSD 均小于15%,說明該方法提取回收率良好,不存在明顯的基質效應。
2.1.5 樣品穩定性
配制低、中、高3 個濃度的QC 樣本,每個濃度平行5 份,考察心臟和肝樣品在自動進樣器放置24 h,-20℃條件下凍存30 d 和經-20℃至室溫反復凍融3 次的穩定性。結果顯示3 種條件下心臟和肝組織樣品中川芎嗪和丹參素的穩定性良好,RSD 均小于15%,符合生物樣品體內分析方法要求。
2.2 丹參素和川芎嗪在AMI 大鼠體內的組織分布
AMI 模型大鼠靜脈注射DGI、LGI 和SGI 后,川芎嗪和丹參素在大鼠心臟、肝、脾、肺、腎、腦組織中不同時間點下的含量見表2,藥物濃度-時間曲線見圖2、圖3。除SGI 組大鼠的心臟、肝、脾組織中川芎嗪分別在給藥后10 min、10 min 和5 min 達分布峰值,其余組織中川芎嗪和丹參素在各組織中均在1 min 達分布峰值,丹參素可在心臟中快速分布并消除,10 min 后心臟中未能檢測到丹參素。川芎嗪在大鼠脾、腎、腦組織中含量較高,其中腦組織中含量最高,與LGI 組相比,SGI 組大鼠各組織中川芎嗪的AUC0-t有所增加,其中心臟、脾、肺、腎、腦組織中分別增加12.39 倍、0.28 倍、0.56 倍、0.29 倍、0.87倍,差異有統計學意義(P<0.05)。丹參素在大鼠心臟、肺、腎組織中含量較高,其中腎中含量最高;與DGI 組相比,SGI 組大鼠各組織中丹參素的AUC0-t有所增加,其中心臟、肝、脾、腦組織中分別增加1.04 倍、0.47 倍、0.83 倍,含量增加有統計學意義(P<0.05)。其中川芎嗪和丹參素在心臟中的含量均顯著增加(P<0.001),可見配伍延長了川芎嗪分布至靶器官心臟的達峰時間,同時增加了川芎嗪和丹參素在心臟中的含量。
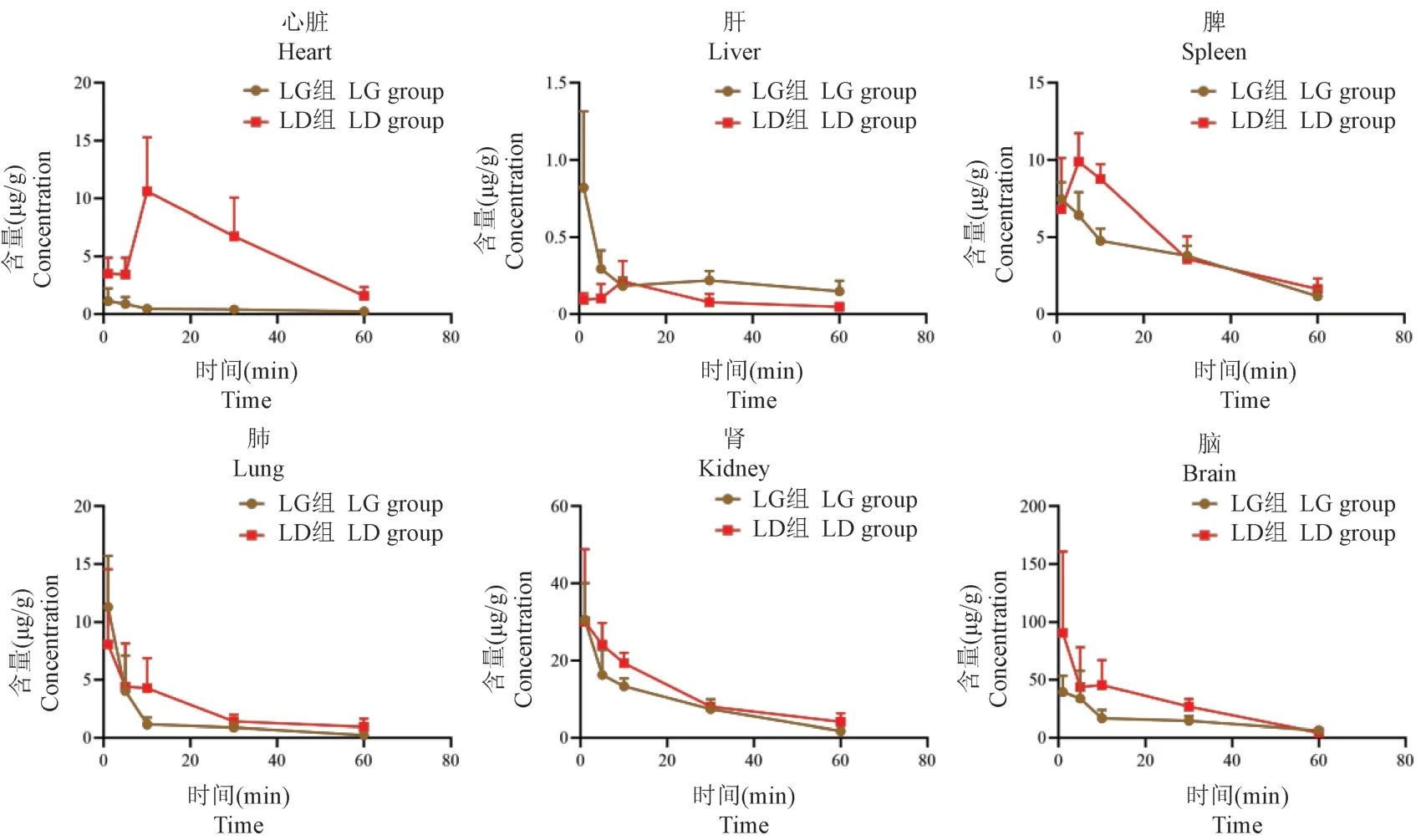
圖2 配伍前后川芎嗪大鼠體內的分布(±s, n=6)Figure 2 Distribution of ligustrazine in rats before and after compatibility

圖3 配伍前后丹參素大鼠體內的分布(±s, n=6)Figure 3 Distribution of Danshensu in rats before and after compatibility
3 討論
課題組前期對SGI 進行含量測定時發現,除丹參素外的丹酚酸類成分含量較低。每100 mL 的SGI 含藥效成分丹參素20 mg,鹽酸川芎嗪100 mg,占總成分的95%以上[10],其中含量較高的成分為川芎嗪和丹參素。前期預實驗發現注射給藥后,僅在心臟和腎中檢測到痕量迷迭香酸,在其他組織中均未檢測到,故本實驗選擇川芎嗪和丹參素作為檢測對象。
大量研究表明中藥相互作用會影響效應成分的體內分布[11-13],本研究比較了川芎嗪-丹參配伍前后在AMI 模型大鼠體內的組織分布差異。結果顯示,從組織中藥物含量的角度分析,配伍后多數組織中川芎嗪和丹參素的AUC0-t有所增加,配伍前川芎嗪在各組織中的含量順序為腦>腎>脾>肺>心臟>肝,配伍后其含量順序為腦>腎>心臟>脾>肺>肝。川芎嗪在心臟、腦組織中的含量遠高于其他組織,表明該藥物在AMI 狀態下更易于分布,且配伍后能顯著提高川芎嗪在靶器官心臟中的含量。配伍前后丹參素在各組織中的含量順序均為腎>肺>肝>脾>心臟>腦,丹參素在腎、肺、心臟等組織中含量較高,可見丹參素對上述血流較豐富的組織具有較好的親和力,也證實了丹參素的分布取決于組織器官的血流和灌流速度[14],這與其具有防治心血管疾病和肺保護作用的藥理活性相對應[15-16]。
同時有研究報道顯示丹參素主要經腎通過尿液排泄[17],與本研究中其在腎中含量較高的結論一致。現有文獻報道有機陰離子轉運蛋白1(OATP1)和3(OATP3)在腎中特異性表達,介導了許多藥物的腎積累[18],而丹參素對有OATP1 和OATP3 表現出競爭性抑制作用[19]。丹參素為酸性化合物,符合OATP1 和OATP3 的底物特性,但丹參素是否為OATP1 和OATP3 的底物,目前尚無相關報道。本研究發現,配伍后丹參素和川芎嗪在腎中含量有增加趨勢,推測可能與OATPs 的抑制有關。丹參素在給藥60 min 后基本從體內清除,沒有明顯的蓄積反應;川芎嗪消除較丹參素慢,60 min 未完全消除。現有文獻報道川芎嗪在各組織中的半衰期在39~67 min[20],本研究發現川芎嗪在病理狀態下消除較正常組更快,但其配伍后在心臟中消除明顯減慢。
結合課題組前期研究結果,鹽酸川芎嗪與丹參合用后, 介導川芎嗪Ⅰ相代謝的 CYP1A2、CYP2C11、CYP3A2 這3 種酶表達升高,使川芎嗪的代謝加快[9],AMI 大鼠體內血藥濃度降低,但是二者聯用可顯著增加川芎嗪和丹參素在靶器官心臟中的AUC,且在體內滯留更久,消除更慢,從而以協同作用增強對心腦血管疾病的治療效果。

