物質結構與性質易錯題歸類剖析
■江西師范大學附屬中學 周 瑋

物質結構與性質的常見題型為選擇題和綜合題,考查考生對結構知識體系的歸納推理能力、信息遷移能力以及綜合應用能力。物質結構與性質的知識點包括原子結構(核外電子排布、雜化方式、電負性等)、分子結構(化學鍵、電子式、結構式、官能團等)、晶體結構(晶體類型判斷、物質熔沸點高低影響因素、晶體的密度等)。本文通過對“物質結構與性質”相關易錯試題的分析,發掘知識體系中學生的易錯知識點,希望可以引導考生克服對“物質結構與性質”的畏難心理,厘清試題中知識脈絡的關系,實現“以錯題回歸知識本源”的目的,從而達成以易錯點形成避錯策略的知識掌握核心目標。
易錯點1:原子結構與性質相關知識點
原子結構與性質在試題中常見的命題角度有:原子核外電子的排布規律及其表示方法,原子結構與元素電離能和電負性的關系及其應用。試題側重原子核外電子排布式或軌道表示式,未成對電子數判斷,電負性、電離能、原子半徑和元素金屬性與非金屬性比較的考查。在書寫基態原子電子排布時,常見的易錯點為違反能量最低原理、泡利原理、洪特規則及特例;還需注意同能級的軌道半充滿、全充滿或全空狀態的原子結構穩定,如Cr:3d54s1、Mn:3d54s2、Cu:3d104s1、Zn:3d104s2;另外需理解電離能與金屬性及金屬元素價態的關系,電負性與非金屬性及組成化合物所形成的化學鍵的關系。
易錯提醒:書寫電子排布式的常見錯誤與技巧。
例1已知某原子結構示意圖為,下列有關說法不正確的是( )。
A.結構示意圖中x=2
B.該原子的電子排布式為1s22s22p63s23p2
C.該原子的軌道表示式為
D.該原子結構中共有5個能級上填充有電子
解析:由原子結構示意圖可知,K 層電子排滿時為2 個電子,故x=2,該元素為硅,故A 項正確。該原子的電子排布式為1 s22 s22 p63 s23 p2,故B 項正確;硅原子核外電子的軌道表示式為,故C 項錯誤。原子結構中共有1s、2s、2p、3s、3p 這5 個能級上填充有電子,故D 項正確。
答案:C
例2下列各項敘述中,正確的是( )。
A.鎂原子由1s22s22p63s2→1s22s22p63p2時,原子釋放能量,由基態轉化成激發態
B.價層電子排布式為6s26p3的元素位于第六周期第ⅢA 族,是s區元素
C.所有原子任一能層的s電子云輪廓圖都是球形,但球的半徑大小不同
D.24Cr原子的電子排布式是1s22s22p63s23p63d44s2
解析:鎂原子由基態轉化為激發態時吸收能量,A 項錯誤。價層電子排布式為6s26p3的元素位于第六周期第ⅤA 族,是p區元素,B 項錯誤。所有原子任一能層的s電子云輪廓圖都是球形,能層序數越大,球的半徑就越大,C項正確。原子軌道處于全空、全滿或半充滿狀態時,能量最低,故24Cr原子的核外電子排布式應是1s22s22p63s23p63d54s1,D 項正確。
答案:C
易錯點2:分子結構與性質
分子結構與性質在試題中的常見命題角度有:圍繞某物質判斷共價鍵的類型和數目,分子的極性、中心原子的雜化方式、微粒的立體構型,氫鍵的形成及對物質的性質影響等。試題側重考查微粒構型、雜化方式、中心原子的價層電子對數、配位原子判斷與配位數、化學鍵類型、分子間作用力與氫鍵、分子極性等。對σ鍵和π 鍵的判斷,要掌握好方法;對雜化軌道的判斷,要理解常見物質的雜化方式;通過三種作用力對性質的影響解釋相關現象及結論。注意以下三個誤區:不要誤認為分子的穩定性與分子間作用力和氫鍵有關,其實分子的穩定性與共價鍵的強弱有關;不要誤認為組成相似的分子,中心原子的雜化類型相同,關鍵是要看其σ鍵和孤電子對數是否相同。如BCl3中B 原子為sp2雜化,NCl3中N 原子為sp3雜化;不要誤認為只要含有氫鍵物質的熔、沸點就高,其實不一定,分子間的氫鍵會使物質的熔、沸點升高,而分子內氫鍵一般會使物質的熔、沸點降低。
易錯提醒:判斷分子中中心原子的雜化軌道類型的方法。
(1)根據VSEPR 模型、中心原子價層電子對數判斷,如(ABm型)中心原子的價層電子對數為4,中心原子的雜化軌道類型為sp3;價層電子對數為3,中心原子的雜化軌道類型為sp2;價層電子對數為2,中心原子的雜化軌道類型為sp。
(2)根據等電子體原理進行判斷,如CO2是直線形分子,SCN-、N-3與CO2是等電子體,所以分子的空間結構均為直線形,結構式類似,中心原子均采用sp雜化。
(3)根據分子或離子中有無π 鍵及π 鍵數目判斷,沒有π鍵的為sp3雜化,如CH4中的C原子;含1個π鍵的為sp2雜化,如甲醛中的C原子以及苯環中的C 原子;含2 個π鍵的為sp雜化,如二氧化碳分子和乙炔分子中的碳原子。
規律方法:“四方法”判斷中心原子的雜化類型。
(1)根據雜化軌道的空間結構判斷。
①直線形?sp,②平面三角形?sp2,③四面體形?sp3。
(2)根據雜化軌道間的夾角判斷。
①109°28'?sp3,②120°?sp2,③180°?sp。
(3)利用價層電子對數確定三種雜化類型(適用于中心粒子)。
2對?sp 雜化,3 對?sp2雜化,4 對?sp3雜化。
(4)根據σ鍵數與孤電子對數(適用于結構式已知的粒子)判斷。
①含C有機化合物:2個σ?sp,3個σ?sp2,4個σ?sp3。
②含N化合物:2個σ?sp2,3個σ?sp3。
③含O(S)化合物:2個σ?sp3。
例3(1)Cu2+處于[Cu(NH3)4]2+的中心,若將配離子[Cu(N H3)4]2+中的2 個NH3換為CN-,則有2種結構,則Cu2+是否為sp3雜化?____(填“是”或“否”),理由為____。
(2)用價層電子對互斥理論推斷甲醛中H—C—H 的鍵角____120 °(填“>”“<”或“=”)。
(3)SO2Cl2和SO2F2都屬于AX4E0型分子,S= O 之間以雙鍵結合,S—Cl、S—F之間以單鍵結合。請你預測SO2Cl2和SO2F2分子的立體構型為____。SO2Cl2分子中 ∠Cl—S—Cl____SO2F2分子中∠F—S—F(填“<”“>”或“=”)。
(4)抗壞血酸的分子結構如下所示,該分子中碳原子的雜化軌道類型為____。
解析:(1)由于將配離子[Cu(N H3)4]2+中的2個NH3換為CN-,有2種結構,說明[Cu(NH3)4]2+形成平面正方形結構,Cu2+在平面正方形對角線的交點上。若是Cu2+采用sp3雜化,由于正四面體任何兩個頂點都處于相鄰位置,那么[Cu(N H3)4]2+的空間構型為正四面體形,將配離子[Cu(NH3)4]2+中的2個N H3換為CN-,則只有1種結構,所以Cu2+不是采用sp3雜化。
(2)甲醛分子中,碳氧之間為雙鍵,根據價層電子對互斥理論可知雙鍵與單鍵之間的斥力大于單鍵與單鍵之間的斥力,所以H—C—H 的鍵角小于120°。
(3)當中心原子的價層電子對數為4時,VSEPR 模型為四面體形,硫原子無孤電子對,所以立體構型為四面體形。X 原子得電子能力越弱,A—X 形成的共用電子對之間的斥力越強,F 原子的得電子能力大于氯原子,所以SO2Cl2分子中∠Cl—S—Cl>SO2F2分子中∠F—S—F。
(4)該分子中亞甲基、次亞甲基上C原子價層電子對個數都是4,連接碳碳雙鍵和碳氧雙鍵的C 原子價層電子對個數是3,根據價層電子對互斥理論,該分子中碳原子的軌道雜化類型,前者為sp3雜化,后者為sp2雜化。
答案:(1)否 若是 sp3雜化,[Cu(NH3)4]2+的立體構型為正四面體形,將配離子[Cu(NH3)4]2+中的2 個N H3換為CN-,則只有1種結構
(2)<
(3)四面體形 >
(4)sp2、sp3
易錯點3:晶體結構與性質
晶體結構與性質在試題中常見的命題角度有晶體的類型、結構與性質的關系、晶體熔沸點高低的比較、配位數、晶胞模型分析及有關計算等考點。試題側重晶體類型判斷、物質熔沸點的比較與原因、晶胞中微粒數的判斷、配位數、晶胞密度計算、晶胞參數、空間利用率計算的考查。易錯點主要是晶胞特點的計算,如面心立方晶胞與體心立方晶胞的配位數不同;晶胞參數給定單位是nm 或pm時,忽略換算成cm。
易錯提醒:(1)判斷某種微粒周圍等距且緊鄰的微粒數目時,要注意運用三維想象法。如Na Cl晶體中,Na+周圍的Na+數目(Na+用“○”表示)如圖1 所示,每個面上有4 個,共計12個。
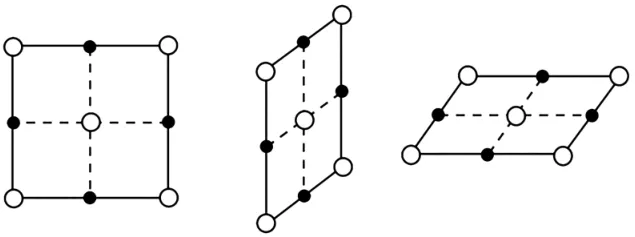
圖1
(2)常考的幾種晶體主要有干冰、冰、金剛石、SiO2、石墨、CsCl、NaCl、K、Cu等,要熟悉以上代表物的空間結構。當題中信息給出與某種晶體空間結構相同時,可以直接套用某種結構。
規律方法:晶胞密度計算的基本過程。
例4氮化鈦晶體的立方晶胞結構如圖2所示,該晶胞中N 和N 之間的最近距離為apm,以晶胞邊長為單位長度建立坐標系,原子A 的坐標參數為(0,0,0),下列說法錯誤的是( )。
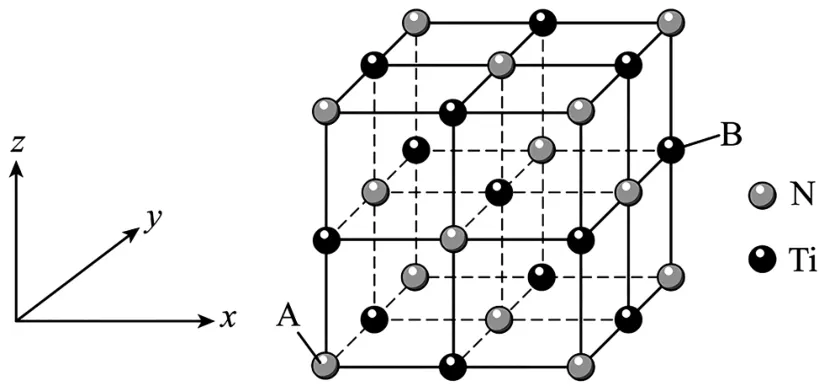
圖2
C.該物質的化學式為Ti N
D.Ti的配位數為6
解析:原子B在x,y,z軸上坐標分別為1,1,,則坐標參數為,A 項錯誤。晶胞中N 和N 之間的最近距離為面對角線的,為apm,則N 與Ti的最近距離是,則晶胞邊長為,B 項正確。該晶胞中,Ti(黑球)的個數為,N(白球)的個數為,則Ti和N 的個數比為1∶1,該物質的化學式為Ti N,C項正確。以體心鈦為例,與Ti距離相等且最近的N 有6個,則Ti的配位數為6,D項正確。
答案:A
例5芯片作為科技產業,以及信息化、數字化的基礎,自誕生以來,就一直倍受關注, 也一直蓬勃發展。芯片制造會經過六個最為關鍵的步驟:沉積、光刻膠涂覆、光刻、刻蝕、離子注入和封裝。
(1)將Mn 摻雜到Ga As的晶體中替換部分Ga得到稀磁性半導體材料,晶體結構如圖3(甲)所示。
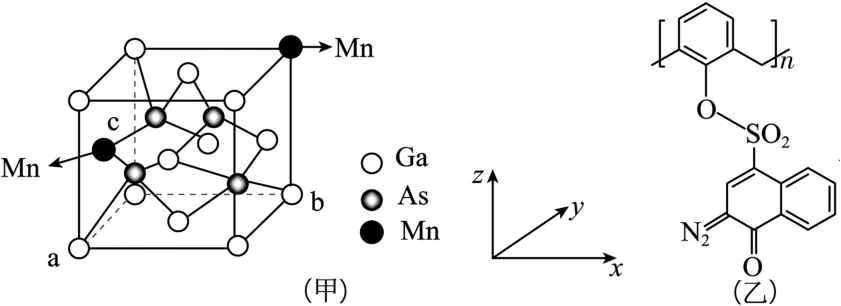
圖3
圖中a、b的坐標分別為(0,0,0)和(1,1,0),則c點Mn的原子坐標分別為_____, 摻雜Mn之后,晶體中Mn、Ga、As的原子個數比為_____。
(2)“光刻膠涂覆”中用到一種701 紫外正型光刻膠,結構如圖3(乙)所示,其S的雜化方式為____。
(3)“光刻”時,紫外負型光刻膠常含有—N3(疊氮基), 在紫外光下形成的陰離子的等電子體有____(填化學式,任寫一種),其空間構型為____。
(4)一種Ag2HgI4固體導電材料為四方晶系,其晶胞參數為apm、apm 和2apm,晶胞沿x、y、z的方向投影(如圖4所示),A、B、C 表示三種不同原子的投影。其中代表Hg原子的是____(填“A”“B”或“C”)。設NA為阿伏加德羅常數的值,Ag2HgI4的摩爾質量為Mg· mol-1,該晶體的密度為_____g·cm-3(用代數式表示)。
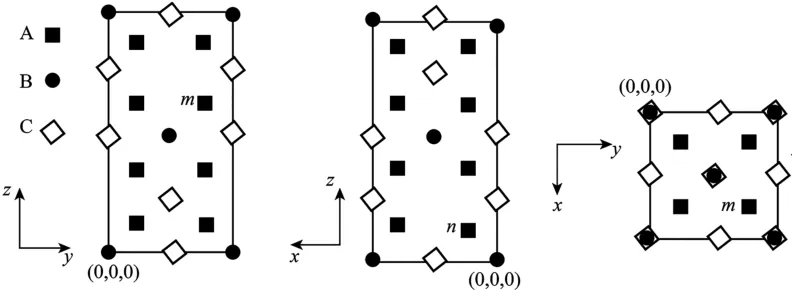
圖4
解析:(1)由圖可知,c點錳原子在x、y、z軸上的投影坐標分別為0,,,則c點Mn 的原子坐標為(0,,);根據“均攤法”,晶胞中含,4 個As,摻雜Mn 之后,晶體中 Mn、Ga、As 的原子個數比為5∶27∶32。
(2)圖中硫原子形成4 個共價鍵且無孤電子對,為sp3雜化。
(3)等電子體是指價電子數和原子數相同的分子、離子或原子團。陰離子的等電子體有N2O、CO2、CS2等。陰離子的中心原子N 原子的價層電子對數為,為sp 雜化,空間構型為直線形。
(4)由投影可知,A 位于晶胞內部,原子數為8;B 原子位于頂點和體心,根據“均攤法”,晶胞中含;C 原子位于棱上和六個面上,晶胞中含。結合化學式Ag2HgI4可知,A、B、C分別為I、Hg、Ag,晶體密度為。
答案:(1)
(2)sp3
(3)N2O、CO2、CS2(任寫一種) 直線形
總之,在“雙新”背景下,有關物質結構與性質的試題對考生結構知識體系的歸納推理能力、信息遷移能力以及綜合應用能力有較高的要求。考生在復習物質結構與性質知識時,對常見易錯題的整理是學習過程中的重要環節。復習過程中需要注重知識點的落實和模型的建構及應用,增強“以錯題引導思維辨析”的主動意識,實現“以錯題回歸知識本源”的目的,培養化學學科的核心素養和理解與辨析、分析與推測、歸納與論證的能力。

