2023年普通高等學校招生全國統一考試(新課標卷)理科綜合化學試題及考查目標分析
■廣東省佛山市順德區北滘中學 劉 巧 王潤芝 王 杰
【試題部分】(以原試卷題號為序)
可能用到的相對原子質量:H 1 C 12 N 14 O 16 F 19 Cl 35.5 Fe 56 Zn 65
一、選擇題:本題共7小題,每小題6分,共42分,在每小題給出的四個選項中,只有一項是符合題目要求的。
7.化學在文物的研究和修復中有重要作用。下列說法錯誤的是( )
A.竹簡的成分之一纖維素屬于天然高分子
B.龜甲的成分之一羥基磷灰石屬于無機物
C.古陶瓷修復所用的熟石膏,其成分為Ca(O H)2
D.古壁畫顏料中所用的鐵紅,其成分為Fe2O3
8.光學性能優良的高分子材料聚碳酸異山梨醇酯可由如下反應制備。
下列說法錯誤的是( )。
A.該高分子材料可降解
B.異山梨醇分子中有3個手性碳
C.反應式中化合物X 為甲醇
D.該聚合反應為縮聚反應
9.一種可吸附甲醇的材料,其化學式為[C(N H2)3]4[B(OCH3)4]3Cl,部分晶體結構如圖1所示,其中[C(N H2)3]+為平面結構。
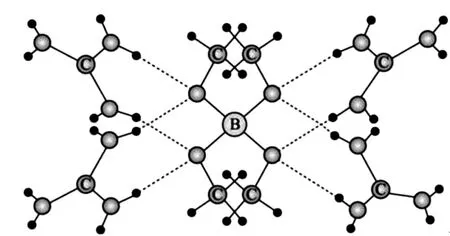
圖1
下列說法正確的是( )。
A.該晶體中存在N—H…O 氫鍵
B.基態原子的第一電離能:C<N<O
C.基態原子未成對電子數:B<C<O<N
D.晶體中B、N 和O 原子軌道的雜化類型相同
10.一種以V2O5和 Zn 為電極、Zn(CF3SO3)2水溶液為電解質的電池如圖2所示。放電時,Zn2+可插入V2O5層間形成ZnxV2O5·nH2O。下列說法錯誤的是( )。
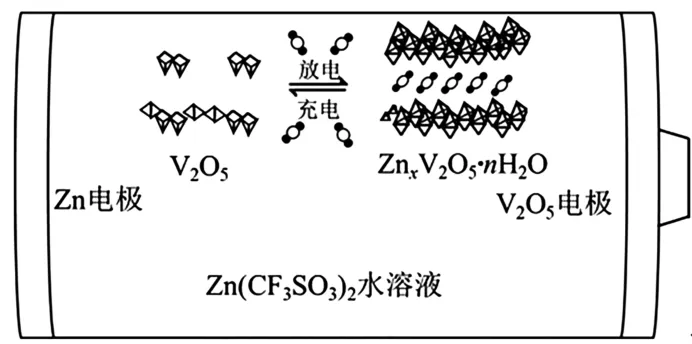
圖2
A.放電時V2O5為正極
B.放電時Zn2+由負極向正極遷移
C.充電總反應:xZn+V2O5+nH2O ==ZnxV2O5·nH2O
D.充電陽極反應:ZnxV2O5·nH2O-2xe-==V2O5+xZn2++nH2O
11.根據實驗操作及現象,下列結論中正確的是( )。
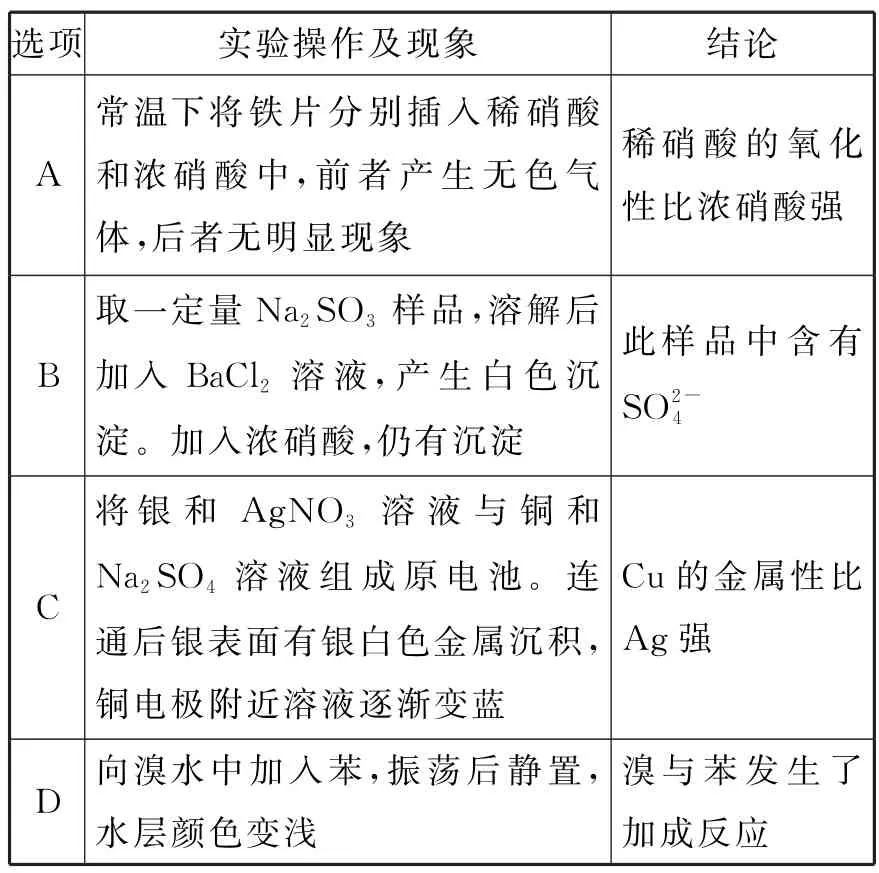
選項實驗操作及現象結論A常溫下將鐵片分別插入稀硝酸和濃硝酸中,前者產生無色氣體,后者無明顯現象稀硝酸的氧化性比濃硝酸強B取一定量Na2 SO 3 樣品,溶解后加入BaCl2 溶液,產生白色沉淀。加入濃硝酸,仍有沉淀此樣品中含有SO 2-4 C將銀和Ag NO3 溶液與銅和Na2 SO4 溶液組成原電池。連通后銀表面有銀白色金屬沉積,銅電極附近溶液逐漸變藍Cu的金屬性比Ag強D向溴水中加入苯,振蕩后靜置,水層顏色變淺溴與苯發生了加成反應
12.“肼合成酶”以其中的Fe2+配合物為催化中心,可將N H2OH 與NH3轉化為肼(N H2N H2),其反應歷程如下所示。
下列說法錯誤的是( )。
A.NH2OH、NH3和H2O 均為極性分子
B.反應涉及N—H、N—O 鍵斷裂和N—N 鍵生成
C.催化中心的Fe2+被氧化為Fe3+,后又被還原為Fe2+
D.N H2OH 替換為ND2OD,反應可得ND2ND2
13.向Ag Cl飽和溶液(有足量AgCl固體)中滴加氨水,發生反應Ag++NH3[Ag(NH3)]+和[Ag(N H3)]++N H3[Ag(N H3)2]+。lg[c(M)/(mol·L-1)]與lg[c(N H3)/(mol·L-1)]的關系如圖3所示(其中M 代表Ag+、Cl-、[Ag(NH3)]+或[Ag(N H3)2]+)。
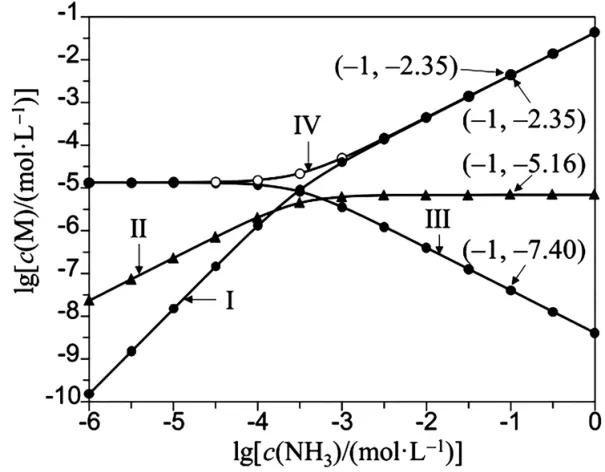
圖3
下列說法錯誤的是( )。
A.曲線Ⅰ可視為Ag Cl溶解度隨NH3濃度變化曲線
B.Ag Cl的溶度積常數Ksp=c(Ag+)·c(Cl-)=10-9.75
C.反應[Ag(NH3)]++ N H3[Ag(N H3)2]+的平衡常數K的值為103.81
D.c(N H3)=0.01 mol·L-1時,溶液中c([Ag(NH3)2]+)>c([Ag(N H3)]+)>c(Ag+)

二、非選擇題:共58分。
27.(14分)鉻和釩具有廣泛用途。鉻釩渣中鉻和釩以低價態含氧酸鹽形式存在,主要雜質為鐵、鋁、硅、磷等的化合物。從鉻釩渣中分離提取鉻和釩的一種流程如下所示。
回答下列問題:
(1)煅燒過程中,釩和鉻被氧化為相應的最高價含氧酸鹽,其中含鉻化合物主要為_____(填化學式)。
(2)水浸渣中主要有SiO2和____。
(3)“沉淀”步驟調p H 到弱堿性,主要除去的雜質是_____。
(4)“除硅磷”步驟中,使硅、磷分別以Mg SiO3和Mg NH4PO4的形式沉淀。該步需要控制溶液的p H ≈9 以達到最好的除雜效果。若p H<9時,會導致_____;p H>9時,會導致____。
(5)“分離釩”步驟中,將溶液p H 調到1.8左右得到V2O5沉淀。V2O5在p H <1時,溶解為或VO3+;在堿性條件下,溶解為或。上述性質說明V2O5具有_____(填標號)。
A.酸性 B.堿性 C.兩性
(6)“還原”步驟中加入焦亞硫酸鈉(Na2S2O5)溶液,反應的離子方程式為____。
28.(14分)實驗室由安息香制備二苯乙二酮的反應式如下:
相關信息如表1所示:
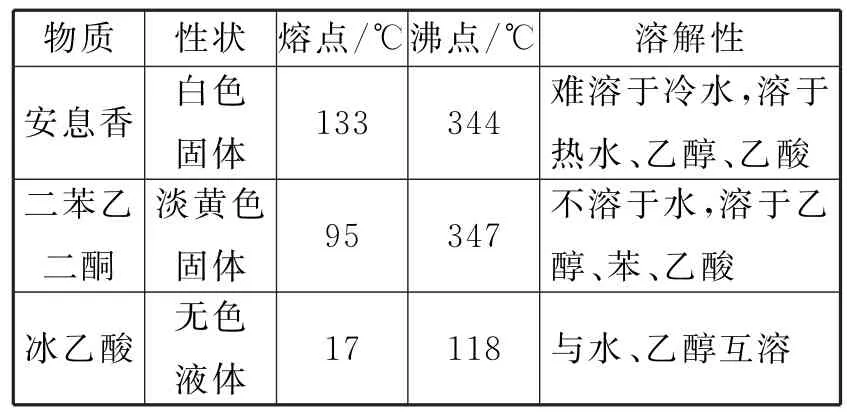
表1
裝置如圖4 所示。實驗步驟為:
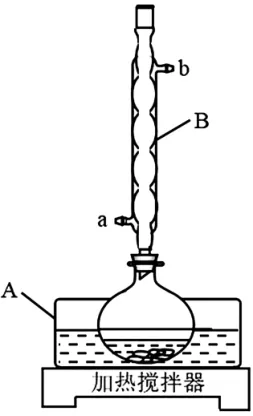
圖4
①在圓底燒瓶中加入10 m L 冰乙酸、5 m L 水及9.0 g FeCl3·6 H2O,邊攪拌邊加熱,至固體全部溶解。
②停止加熱,待沸騰平息后加入2.0 g安息香,加熱回流45~60 min。
③加入50 m L 水,煮沸后冷卻,有黃色固體析出。
④過濾,并用冷水洗滌固體3 次,得到粗品。
⑤粗品用75%的乙醇重結晶,干燥后得淡黃色結晶1.6 g。
回答下列問題:
(1)儀器A 中應加入____(填“水”或“油”)作為熱傳導介質。
(2)儀器B 的名稱是____;冷卻水應從_____(填“a”或“b”)口通入。
(3)實驗步驟②中,安息香必須待沸騰平息后方可加入,其主要目的是____。
(4)在本實驗中,FeCl3為氧化劑且過量,其還原產物為_____;某同學嘗試改進本實驗:采用催化量的FeCl3并通入空氣制備二苯乙二酮。該方案是否可行? 簡述判斷理由:___。
(5)本實驗步驟①~③在乙酸體系中進行,乙酸除作溶劑外,另一主要作用是防止_____。
(6)若粗品中混有少量未氧化的安息香,可用少量_____洗滌的方法除去(填標號)。若要得到更高純度的產品,可用重結晶的方法進一步提純。
a.熱水 b.乙酸 c.冷水 d.乙醇
(7)本實驗的產率最接近于____(填標號)。
a.85% b.80% c.75% d.70%
29.(15 分)氨是最重要的化學品之一,我國目前氨的生產能力位居世界首位。回答下列問題:
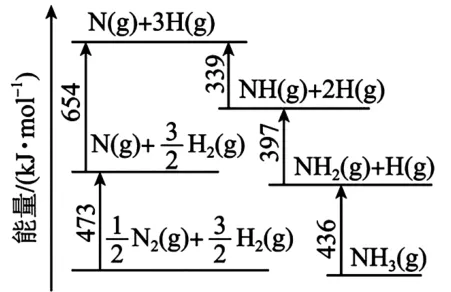
圖5 能量轉換關系
(2)研究表明,合成氨反應在Fe催化劑上可能通過圖6 機理進行(*表示催化劑表面吸附位,N2* 表示被吸附于催化劑表面的N2)。判斷上述反應機理中,速率控制步驟(即速率最慢步驟)為_____(填步驟前的標號),理由是____。
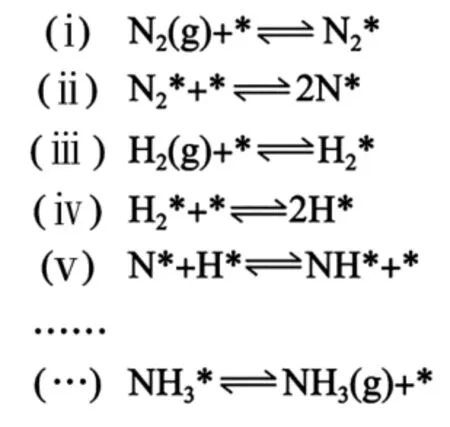
圖6 反應機理
(3)合成氨催化劑前驅體(主要成分為Fe3O4)使用前經N2還原,生成α-Fe包裹的Fe3O4。已知 α-Fe屬于立方晶系,晶胞參數a=287 pm,密度為7.8 g·cm-3,則α-Fe晶胞中含有Fe的原子數為_____(列出計算式,阿伏加德羅常數的值為NA)。
(4)在不同壓強下,以兩種不同組成進料,反應達平衡時氨的摩爾分數與溫度的計算結果如下圖所示。其中一種進料組成為xH2=0.75,xN2=0.25,另一種為xH2=0.675,xN2=0.225,xAr=0.10。(物質i的摩爾分數:
①圖中壓強由小到大的順序為_____,判斷的依據是_____。
②進料組成中含有情性氣體Ar 的圖是_____。
③圖7 中,當p2=20 MPa,xNH3=0.20時,氮氣的轉化率α=_____。該溫度時,反應的平衡常數Kp=_____MPa-1(化為最簡式)。
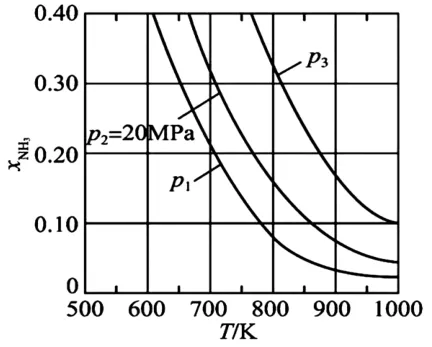
圖7
30.(15分)莫西賽利(化合物K)是一種治療腦血管疾病的藥物,可改善腦梗塞或腦出血后遺癥等癥狀。以下為其合成路線之一。
回答下列問題:
(1)A 的化學名稱是____。
(2)C 中碳原子的軌道雜化類型有_____種。
(3)D 中官能團的名稱為_____、___。
(4)E 與F 反應生成G 的反應類型為_____。
(5)F的結構簡式為____。
(6)I轉變為J的化學方程式為_____。
(7)在B的同分異構體中,同時滿足下列條件的共有_____種(不考慮立體異構)。
①含有手性碳;②含有三個甲基;③含有苯環。
其中,核磁共振氫譜顯示為6組峰,且峰面積比為3∶3∶3∶2∶2∶1的同分異構體的結構簡式為____。
【試卷整體評價】
1.弘揚學科核心價值,落實立德樹人根本任務。
第7題選取中國古代文物作為素材,主要考查文物及其修復材料中的成分及物質類別,展示中國傳統文化的同時,厚植愛國主義情懷。
試題立足學科特點,選取我國科學家的創新科研成果,在考查化學相關知識的同時,激發考生的愛國主義情懷。例如第9題介紹了一種新型的可吸附甲醇的材料的晶體結構,第10題以南開大學程方益老師課題組發表在ACS Energy Letters 期刊上的一篇水系Zn-V2O5可充電電池為情境,第12題以新穎前沿的生物酶—“肼合成酶”催化反應為背景,分別展現了我國科研工作者在物質結構、新型可充電電池以及催化反應機理領域方面的優異成果,弘揚了愛國主義情懷。
這些試題不僅凸顯了化學的學科價值,又引導考生運用化學知識去觀察和感受身邊的事物,激發考生對化學學科的熱愛的同時,落實了高考評價體系中的創新性考查要求。
2.深化基礎性考查,回歸教材。
試題圍繞高中化學基礎知識,深入考查考生對物質組成的判斷(第7 題)、縮聚反應原理(第8題)、化學反應原理基礎(第13題)等主要內容的掌握程度。
實驗是化學學科的一種重要的研究手段,第11題圍繞“硝酸的氧化性”“SO2-4的檢驗”“金屬性的強弱判斷”“溴水遇苯褪色”等教材中涉及的重要實驗內容,考查考生利用化學反應基本原理分析實驗現象,得出實驗結論的能力。第13題以向飽和Ag Cl溶液中滴加氨水的反應為背景,呈現了多個因變量隨一個自變量變化的圖像,考查考生識圖和運用實驗數據的能力。
試題在突出對化學基本概念、基本反應原理、基本實驗技能等內容考查的同時,強化對基礎知識深入理解上的綜合運用。
3.考查學科關鍵能力,促進考生全面發展。
試題第27題呈現工業上從鉻釩渣中分離提取鉻和釩的多步轉化過程,涉及溶液酸堿性對物質組分及物質分離的影響、化學(離子)反應方程式的書寫、物質的轉化等知識,考查考生信息獲取和加工以及邏輯思維等能力。第28題著重考查考生對實驗基本操作的理解及計算能力。
第29題以高中重要課程中的哈伯法合成氨反應原理為情境,試題緊密聯系工業生產實際,要求考生綜合運用蓋斯定律、化學反應機理、晶體結構、影響平衡的因素及平衡常數等相關知識進行解題,凸顯出試題鮮明的綜合性特征,促進考生整體知識框架的構建。
總的來說,試題整體貫徹落實立德樹人根本任務,充分遵循教育教學規律,并充分考慮高中生的認知特點,突出對化學學科基礎知識、關鍵能力的考查,促進考生形成化學觀并提升化學學科素養。
【參考答案與解析】
7.C
考查目標及解析:
本題以歷史文物為情境,考查生活中常見物質的組成、性質及用途。
選項A 正確,纖維素屬于多糖,是一種天然高分子化合物,其分子式為(C6H10O5)n,相對分子質量較高。
選項B正確,羥基磷灰石又稱羥磷灰石、堿式磷酸鈣,其化學式為[Ca10(PO4)6(OH)2],屬于無機物。
選項C 錯誤,熟石膏的主要成分為2CaSO4·H2O,Ca(OH)2為熟石灰的主要成分。
選項D 正確,Fe2O3呈紅色,常被用于油漆、涂料、油墨和橡膠的紅色顏料,俗稱鐵紅。
8.B
考查目標及解析:
本題以高分子材料聚碳酸異山梨醇酯為情境,考查有機分子的結構、性質以及縮聚反應。
選項A 正確,該高分子材料結構中含有酯基,可以降解。
選項C正確,根據聚碳酸異山梨醇酯的結構可以看出,反應物異山梨醇提供的羥基氫與碳酸二甲酯提供的甲氧基結合生成甲醇,故反應式中X 為甲醇。
選項D 正確,該反應在生產高聚物的同時還有小分子的物質生成,故屬于縮聚反應。
9.A
考查目標及解析:
本題通過介紹一種可吸附甲醇的材料,考查晶體結構、氫鍵、電離能及雜化類型等相關知識。
選項 A 正確,由晶體結構圖可知,[C(N H2)3]+中 的—NH2的 N—H 與[B(OCH3)4]-中的O 原子存在N—H…O氫鍵。
選項B錯誤,同一周期元素原子的第一電離能從左至右逐漸遞增,但是處于第ⅤA族的N 原子的p軌道處于半充滿狀態,結構比較穩定,故其第一電離能高于同周期的相鄰元素的原子,因此,基態原子的第一電離能從小到大的順序為C<O<N。
選項C 錯誤,B、C、O、N 原子的未成對電子數分別為1、2、2、3,因此,基態原子未成對電子數B<C=O<N。
選項D 錯誤,[C(NH2)3]+為平面結構,則其中的C 和N 原子軌道雜化類型均為sp2;[B(OCH3)4]-中B 原子形成了4 個σ鍵,B原子沒有孤電子對,則B 的原子軌道雜化類型為sp3;[B(OCH3)4]-中O 原子分別與B和C原子形成2個σ鍵,并且O 原子還有2個孤電子對,則 O 的原子軌道雜化類型為sp3。綜上所述,晶體中B、N 和О 原子軌道的雜化類型不相同。
10.C
考查目標及解析:
本題以南開大學程方益老師課題組發表在ACS Energy Letters 期刊上的一篇水系Zn-V2O5可充電電池為情境,考查可充電電池的工作原理,涉及正負極判斷、離子移動方向、電極反應式及電池反應等知識點。
根據題干信息分析,放電時,Zn2+可插入V2O5層間形成ZnxV2O5·nH2O,導致V 元素的化合價降低,因此Zn電極發生了氧化反應,V2O5電極發生了還原反應,因此,Zn 為電池的負極,電極反應式為xZn-2xe-==xZn2+,此時,生成的Zn2+帶正電,由負極向正極移動,V2O5為電池的正極,電極反應式為 V2O5+2xe-+xZn2++nH2O ==ZnxV2O5·nH2O,總反應式為xZn+V2O5+nH2O ==ZnxV2O5·nH2O。充電時,Zn電極為陰極,V2O5電極為陽極,陰極反應式為xZn2++2xe-==xZn,陽極反應式為ZnxV2O5·nH2O-2xe-==V2O5+xZn2++nH2O,總反應式為ZnxV2O5·nH2O ==xZn+V2O5+nH2O。
根據以上分析,C選項說法錯誤,A、B、D選項說法正確。
11.C
考查目標及解析:
本題以探究實驗為情境素材,以實驗操作及現象、結論為主題,考查考生運用化學知識解決問題的能力,體現科學探究學科素養。
選項A 錯誤,常溫下,鐵片遇到濃硝酸會發生鈍化反應,現象不明顯,但稀硝酸與鐵不會發生鈍化,會產生氣泡,所以不能通過該實驗現象比較濃硝酸和稀硝酸的氧化性強弱。
選項B 錯誤,濃硝酸會氧化SO2-3成SO2-4,仍然會產生白色沉淀,所以不能通過該實驗現象判斷樣品中含有SO2-4。
選項C 正確,Cu 比Ag 活潑,在形成原電池過程中,Cu作負極,發生氧化反應,生成了Cu2+,導致溶液變為藍色,Ag 作正極,溶液中的Ag+在Ag電極上得電子生成銀白色的金屬Ag,所以該實驗可以比較Cu 和Ag的金屬性強弱。
選項D 錯誤,向溴水中加入苯,苯可將溴萃取到上層,使下層水層顏色變淺,因此,苯使溴水褪色是因為發生了物理變化,不是因為溴與苯發生了加成反應。
12.D
考查目標及解析:
本題以“肼合成酶”為情境,考查極性分子的判斷以及反應歷程等知識點。
選項A 正確,N H2OH、N H3、H2O 的正負電荷中心不重合,為極性分子。
選項B正確,通過分析反應歷程可知,有N—H,N—O 鍵斷裂,還有N—N 鍵的生成。
選項C正確,由反應歷程可知,反應過程中,配合物中的Fe2+先失去一個電子被氧化成Fe3+,之后Fe3+又得到一個電子被還原成Fe2+。
選項D 錯誤,由反應歷程可知,反應過程中生成的NH2N H2有兩個H 原子來源于NH3,所以將NH2O H 替換為ND2OD,不可能得到 ND2ND2,得到的產物應該為ND2NH2和HDO。
13.A
考查目標及解析:
本題考查沉淀溶解平衡、平衡常數的求算等知識點。
根據題干信息分析,在Ag Cl飽和溶液中,Ag+和Cl-的濃度相等,向該飽和溶液中滴加氨水,由于氨水中的N H3·H2O 與Ag+結合,導致溶液中Ag+濃度減小,Cl-濃度增大,[Ag(N H3)]+濃度增大,繼續滴加氨水,[Ag(NH3)]+增大的幅度小于[Ag(NH3)2]+,則曲線Ⅰ、Ⅱ、Ⅲ、Ⅳ分別表示[Ag(NH3)2]+、[Ag(N H3)]+、Ag+、Cl-的濃度隨N H3濃度變化的曲線。
選項A 錯誤,根據以上分析,氨水的滴加導致Ag Cl飽和溶液的沉淀溶解平衡正向移動,Ag Cl溶解度增大的同時,Cl-濃度也增大,因此,曲線Ⅳ既表示Cl-濃度隨N H3濃度變化的曲線,又表示Ag Cl溶解度隨N H3濃度變化的曲線。
選項B 正確,由以上分析可知,曲線Ⅰ、Ⅱ、Ⅲ、Ⅳ 分別表示 [Ag (N H3)2]+、[Ag(N H3)]+、Ag+、Cl-的濃度隨N H3濃度變化的曲線。當c(N H3)=0.1 mol·L-1時,由圖可知,溶液中c(Ag+)=10-7.4,c(Cl-)=10-2.35,故 AgCl 的溶度積常數Ksp=c(Ag+)·c(Cl-)=10-9.75。
選項C 正確,由圖可知,當c(NH3)=0.1 mol·L-1時,溶液中c([Ag(N H3)]+)=10-5.16,c([Ag(NH3)2]+)=10-2.35,則[Ag(N H3)]++N H3[Ag(N H3)2]+的平衡常數。
選項D 正確,由以上分析可知,曲線Ⅰ、Ⅱ、Ⅲ、Ⅳ 分別表示 [Ag (NH3)2]+、[Ag(NH3)]+、Ag+、Cl-的濃度隨NH3濃度變化的曲線。當c(NH3)=0.01 mol·L-1時,c([Ag(NH3)2]+)>c([Ag(NH3)]+)>c(Ag+)。
27.本題以工業中從鉻釩渣中提取鉻和釩的工藝為情境素材,通過礦渣的煅燒、浸取、沉淀等步驟對反應過程、產物推斷等設問,考查考生綜合運用化學知識解決實際問題的能力。
【流程分析】
(1)Na2Cr O4
本問考查考生信息理解能力及鉻酸鹽的性質。
(2)Fe2O3
本問考查考生流程圖的閱讀能力及氧化鐵的性質。
根據題干中“主要雜質為鐵、鋁、硅、磷等的化合物”,經過在空氣中煅燒后,鐵轉變為其最穩定價態的氧化物,即Fe2O3。
(3)Al(O H)3
本問考查考生流程圖的閱讀能力及鋁元素化合物的相關性質。
本文考查考生運用鹽類水解等相關知識推斷實際工藝流程中調p H 可能遇到的問題。
若p H>9,可能會使Mg2+和水解程度增大,形成Mg(O H)2和NH3·H2O。
(5)C
本問考查考生信息理解能力。
由題中信息可知,V2O5既能與酸又能與堿反應生成鹽和水,故其應具有兩性。
本問考查氧化還原反應的判斷及方程書寫能力。
28.本題以安息香制備二苯乙二酮為情境素材,基于實驗試劑信息(熔沸點與溶解性等)和實驗步驟,主要考查考生對實驗基本操作的認知和理解、催化劑的催化原理及產品產率計算等知識點。
(1)油
本問考查考生對題干信息的分析能力。
由題干信息可知冰乙酸(沸點是118 ℃)是反應溶劑,且實驗操作中反應液需要加熱煮沸,故應選油作為加熱介質。
(2)球形冷凝管 a
本問考查冷凝回流相關實驗儀器名稱及操作。
根據儀器的結構特征可知,B 為球形冷凝管;冷卻水“下進上出”便于填滿冷凝管,故應從a口進,b口出。
(3)防止暴沸
本問考查添加實驗試劑時的注意事項。
步驟②中,若沸騰時加入安息香,可能會產生暴沸,進而使得安息香飛濺到圓底燒瓶上方導致反應產率降低,所以需要沸騰平息后加入。
(4)FeCl2可行;空氣中的氧氣可以將還原產物FeCl2又氧化為FeCl3,FeCl3可循環參與反應
本問圍繞Fe2+與Fe3+的相互轉化考查氧化還原反應等相關知識。
根據題給信息,在溶液中FeCl3為氧化劑,則反應過程中鐵的化合價會降低,還原產物為FeCl2;若采用催化量的FeCl3并通入空氣制備二苯乙二酮,空氣中的氧氣可以將還原產物FeCl2又氧化為FeCl3,FeCl3可循環參與反應。
(5)FeCl3水解
本問考查乙酸的性質及其在該實驗中的主要作用。
加熱條件下Fe3+更易水解,醋酸電離出H+可抑制其水解。
(6)a
本問基于物質的性質考查考生對晶體洗滌試劑的選擇。
根據題干表格信息可知,安息香溶于熱水,二苯乙二酮不溶于水,所以可以采用熱水洗滌粗品除去未氧化的安息香。
(7)b
本問考查產品產率的計算。
根據以上信息可知,用熱水洗滌粗產品并不影響產物二苯乙二酮的量,且安息香與二苯乙二酮相對質量近似相等,故2.0 g 安息香理論上可得到二苯乙二酮約2.0 g,產率約為。
29.本題以哈伯法合成氨反應原理為主體,考查蓋斯定律、反應機理、晶體結構、影響平衡的因素及平衡常數的計算等相關知識點。
(1)-45
本問考查焓變的計算。
根據圖5 數據,可列式計算ΔH=(+473+654-339-397-436)k J·mol-1=-45 k J·mol-1。
(2)(ⅱ) 第ⅱ步中N2斷裂氮氮三鍵所需要吸收的能量,比其他步驟中斷裂的化學鍵所吸收的能量要高
本問考查反應機理及速率控制的相關知識。
由圖5 中信息可知,N≡ N 的鍵能為946 k J · mol-1,H—H 鍵的鍵能為436 k J·mol-1。在化學反應中,最大的能壘為速率控制步驟,而斷開化學鍵的步驟都屬于能壘,由于N≡ N 的鍵能比H—H 鍵的大很多,因此,在上述反應機理中,速率控制步驟為(ⅱ)。
本問考查立方晶胞結構中Fe原子個數的計算。
設α-Fe晶胞中含有的Fe原子數為x,由于其為立方晶系,則密度的計算式可列為,代入數據可得。
(4)①p1<p2<p3合成氨的反應為氣體分子數減少的反應,壓強越大平衡時氨的摩爾分數越大
本問考查壓強對反應平衡的影響
合成氨的反應中,壓強越大越有利于氨的合成,因此,壓強越大,平衡時氨的摩爾分數越大。由圖中信息可知,在相同溫度下,反應達平衡時氨的摩爾分數p1<p2<p3,因此,圖中壓強由小到大的順序為p1<p2<p3。
②圖8
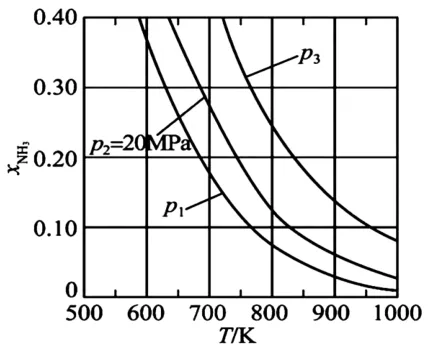
圖8
本問考查恒壓時充入惰性氣體對反應平衡的影響。
在恒壓時充入惰性氣體 Ar ,反應混合物中各組分的濃度減小,化學平衡向氣體分子數增多的方向移動,故x(N H3)應較小,圖8符合。
本問考查轉化率、平衡常數的計算。
圖7中,進料組成為xH2=0.75,xN2=0.25,兩者物質的量之比為3∶1。假設進料中氫氣和氮氣的物質的量分別為3 mol和1 mol,達到平衡時氮氣的變化量為xmol,則有:
30.本題以藥物莫西賽利的合成為情境素材,涉及物質推斷、物質命名、碳原子雜化軌道類型、反應類型、同分異構體、有機合成等相關知識點,考查考生對有機物性質及其轉化的掌握和理解、信息獲取能力、證據推理與模型認知能力、知識的遷移能力等。
(1)3-甲基苯酚(間甲基苯酚)
本問考查有機物的命名。
根據有機物A 的結構,有機物A 的化學名稱為3-甲基苯酚(間甲基苯酚)。
(2)2
本問考查碳原子的雜化軌道類型。
有機物C結構中含有苯環,苯環為平面結構,故苯環上的碳原子的雜化類型為sp2雜化,C結構中還含有甲基和異丙基,為四面體結構,故甲基和異丙基上的碳原子的雜化類型為sp3雜化。
(3)氨基 羥基
本問考查有機物的推斷及官能團的辨識與命名。
(4)取代反應
本問考查有機物的推斷、陌生有機反應的斷鍵成鍵機理分析及反應類型的判斷。
本問考查物質的推導。
本問考查有機物的推斷及反應方程式的書寫。
根據合成路線可知,I和水反應生成J,比較I和K 的結構可知,I和水的反應點為虛框處,再結合產物J的 分 子 式, 可 推 知 J 的 結 構 為,進一步根據原子守恒,可知產物還有N2和HCl。
本問考查限定條件下同分異構體的書寫,側重考查信息獲取能力與模型認知能力。
連有4個不同原子或原子團的碳原子稱為手性碳原子。在B 的同分異構體中,需同時滿足結構中含有手性碳、3個甲基以及含有苯環,因此,當苯環上的取代基是一個—CH(CH3)OCH3和一個—CH3時,有鄰、間、對三種結構,分別為;當苯環上的取代基是一個—CH(CH3)O H 和兩個—CH3時,有六種結構,分別為,故B的同分異構體共9種。其中,核磁共振氫譜顯示為6組峰,且峰面積比為3∶3∶3∶2∶2∶1的同分異構體為。

