物質結構與性質模塊的考點分析及復習建議
林增輝

從2023年開始,《物質結構與性質》模塊成為廣東高考的必考內容,長期以來,該模塊一直作為選考內容,選考的學生較少,因此無論是新授課,還是高三的復習備考,對師生來說,都有一定的挑戰性,筆者希望通過分析課標、教材及高考試題,能給同學們的復習備考帶來一點幫助。
一、認識《物質結構與性質》與必修模塊的聯系
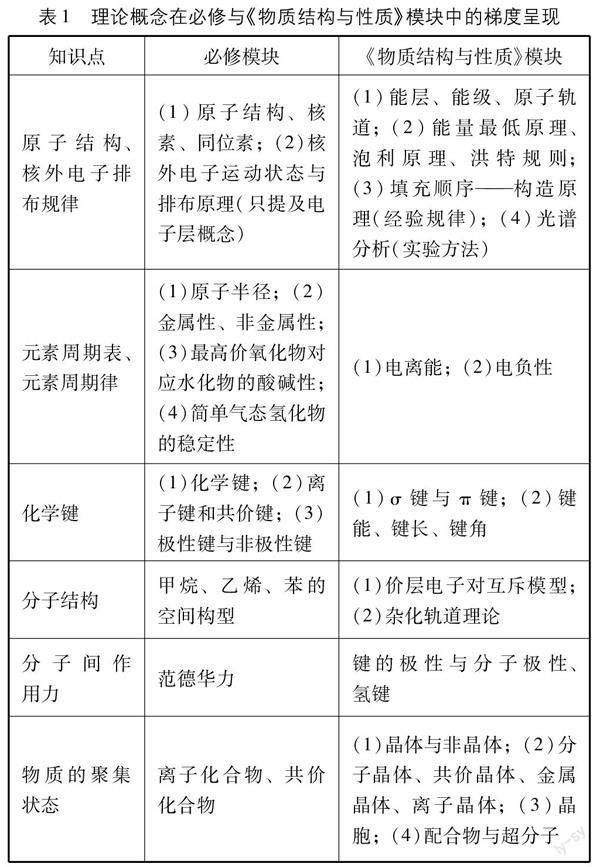
《物質結構與性質》雖然是一個獨立的模塊,但它是高中化學知識體系中不可或缺的一部分,該模塊內容與必修模塊密切聯系(如表1),是必修模塊內容的深化和提升,通過該模塊的學習,同學們能從微觀視角更加深刻地理解物質的結構與性質的關系,不會孤立地看待該模塊的知識點,而是將其作為學科思想或理論工具,解決在學習過程中遇到的問題。
二、了解《物質結構與性質》模塊在高考中的考查情況
以往《物質結構與性質》只是一個選考人數很少的模塊,因此對大多數師生來說,該模塊的備考經驗幾乎是空白的,筆者通過分析近6年廣東(含2018~2020年課標I)卷試題,從宏觀上了解該模塊的考查方式和常見考點,以期能讓同學們更有針對性地進行復習備考。
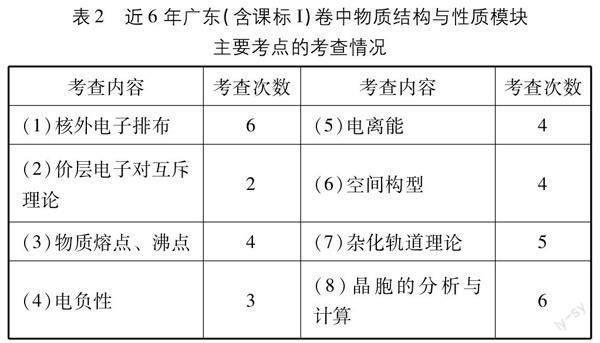
表2顯示,在近6年的廣東(含2018~2020年課標I)卷中,《物質結構與性質》模塊的主要考點是比較集中的,考點的考查頻率相對來說都比較高,多數考點在6年中出現了4次以上,特別是核外電子排布、雜化軌道理論、晶胞的分析與計算等考點更加突出,值得重點關注。
但值得注意的是,在前5年的試卷中,物質結構與性質模塊是以單獨的大題出現,在2023年試卷中,是將考點分散到選擇題和填空題中,沒有獨立的大題,這一考查方式的變化,也說明了該模塊是作為“化學思維或理論工具”的核心觀點,是同學們深入研究物質結構與性質的核心理論知識,因此,該模塊的試題考查方式也將變得更加靈活,但無論如何,只要同學們掌握核心考點的必備知識,相信也能輕松駕馭該模塊的試題。
三、《物質結構與性質》模塊核心考點分析
結合近年來考點的出現頻率,在這里重點分析基態原子(離子)核外電子排布、原子結構與元素的性質、分子(離子)的空間結構、晶體類型的判斷與晶胞的分析等核心考點。
1.基態原子(離子)核外電子排布
在高考中,常要求同學們書寫基態原子(離子)的價電子排布式,或價層電子排布圖(軌道表示式),這一考點雖然考查頻率很高,但所寫的元素基本都是同學們比較熟悉的,難度不是很大。
【例1】按要求填空。
①(2023·廣東)基態Fe2+的3d電子軌道表示式為。
②(2022·甲卷)基態F原子的價層電子排布圖(軌道表示式)為。
③(2023·乙卷)基態Fe原子的價電子排布式為。
④(2022·廣東)Se與S同族,基態硒原子價電子排布式為。
⑤(2021·廣東、2023·北京)基態硫原子價電子排布式為。
⑥(2018·課標I)下列Li原子電子排布圖表示的狀態中,能量最低和最高的分別為______、______(填標號)。
A.___ B.
C.D.
答案:① ②
③3d64s2④4s24p4 ⑤ 3s23p4 ⑥D C
在近幾年的高考中,這類題目的要求,基本都符合構造原理的規律,所以只要掌握構造原理的電子排布順序,基本都能正解作答。但在此也給同學們幾點提示:(1)要注意題目是要求書寫電子排布式,還是價層電子排布圖(軌道表示式)?(2)構造原理是一個經驗規律,1~20號元素都符合這個規律,但不是所有元素的電子排布都符合構造原理,當然,如果出現這類原子,一般都會有提示,要注意題目信息;(3)當原子失去電子形成陽離子時,總是首先失去最外層電子,例如過渡元素鐵和銅的原子、離子價層電子排布如下:Fe(3d64s2)、Fe2+(3d6)、Fe3+(3d5) 、Cu(3d104s1)、Cu +(3d10)、Cu2+ (3d9),另外,也要注意按能層的順序寫,不能寫成4s23d6。
2.原子結構與元素的性質
原子結構與元素的性質主要包含電離能、電負性或物質熔沸點等考點,由于電離能、電負性和物質熔沸點與原子結構或物質結構有關,元素核外電子的周期性變化,也使元素的電離能或電負性呈現出了一定的規律,同周期或同主族元素組成的物質的熔沸點也呈現出了一定的規律。
角度一:根據原子結構判斷電負性或電離能的大小
【例2】(2023·廣東)化合物XYZ4ME4可作肥料,所含的5種元素位于主族,在每個短周期均有分布,僅有Y和M同族。Y的基態原子價層p軌道半充滿,X的基態原子價層電子排布式為nsn-1,X與M同周期,E在地殼中含量最多。下列說法正確的是
A. 元素電負性:E>Y>Z
B. 氫化物沸點:M>Y>E
C. 第一電離能:X>E>Y
D. YZ3和YE—3的空間結構均為三角錐形
解析:由題干可知,5種元素位于主族,且在每個短周期均有分布,可知必定有H元素,而E在地殼中含量最多,為O元素,Y的基態原子價層p軌道半充滿,Y和M同族,可知Y、M分別為氮、磷元素之一,結合XYZ4ME4的化學式,可推斷Z為氫元素、M為磷元素、E為氧元素、Y為氮元素,而X元素的化合價應為+2,X的基態原子價層電子排布式為nsn-1,X與M同周期,可推斷n=3,即X為鎂元素。電負性表示原子對電子的吸引能力,一般來說,非金屬性越強,電負性也相應越強,因此可知元素電負性:O>N>H,A正確;液氨、水中都存在氫鍵,沸點高,磷化氫中沒有氫鍵,沸點低,B錯誤;短周期元素中,同周期元素第一電離能從左往右總趨勢逐漸增大,但第ⅡA族和第ⅤA族元素略高于兩側元素,所以氮元素的第一電離能大于氧元素的,而鎂是較為活潑的金屬,易失電子,第一電離能低于氧元素的,C錯誤;NH3中心原子價層電子對為3+1=4,有一對孤電子對,空間結構為三角錐形,NO—3價層電子對為3,沒有孤對電子,NO—3空間結構為平面三角形,D錯誤。
答案:A
對于這一類題目,同學們要正確理解電負性和電離能概念的本質,掌握短周期主族元素的電負性和電離能的變化規律及特殊情況,例如第ⅡA族和第ⅤA族元素因為原子軌道的全滿或半滿結構,而導致第一電離能高于兩側的元素。
角度二:分析元素電負性或電離能差異的原因
【例3】按要求填空:
①(2023·北京)比較S原子和O原子的第一電離能大小,從原子結構的角度說明理由:___。
②(2022·甲卷)圖a、b、c分別表示C、N、O和F的逐級電離能I變化趨勢(縱坐標的標度不同)。第一電離能的變化圖是______(填標號),判斷的根據是____________;
第三電離能的變化圖是______(填標號)。
解析:結合題干信息,①中,S和O為同主族元素,O原子核外有2個電子層,S原子核外有3個電子層,O原子半徑小,原子核對最外層電子的吸引力大,不易失去1個電子,即O的第一電離能大于S的第一電離能。②中,圖a表示第一電離能的變化圖,因為同周期元素第一電離能的總體趨勢是依次升高的,但由于N元素的2p能級為半充滿狀態,因此N元素的第一電離能較C、O兩種元素高; 同一周期原子的第三電離能的總體趨勢也是依次升高的,但由于C原子在失去2個電子之后的2s能級為全充滿狀態,因此其再失去一個電子時需要的能量稍高,滿足這一規律的圖像為圖b。
這類題目,不但要求同學們能正確判斷元素的電負性或電離能的大小,而且還能用簡潔的語言進行描述,為了更好地解答這類題目,同學們不但要學會“說理”,也要加強文字表達的訓練。
角度三:根據物質的宏觀性質進行推理分析
【例4】按要求填空:
①(2023·山東)已知電負性Cl>H>Si,SiHCl3在濃NaOH溶液中發生反應的化學方程式為___ 。
②(2023·甲卷)AlF3的熔點為1090℃,遠高于AlCl3的192℃,由此可以判斷鋁氟之間的化學鍵為___ 鍵。
③(2023·乙卷)已知一些物質的熔點數據如下表:
分析同族元素的氯化物 SiCl4、GeC14、SnCl4 熔點變化趨勢及其原因____________。
④(2021·浙江)已知3種原子晶體的熔點數據如下表:
解析:結合題干信息,①中,已知電負性Cl>H>Si,則SiHCl3中氯元素的化合價為-1,氫元素的化合價為-1,硅元素化合價為+4,所以SiHCl3在濃NaOH溶液中發生反應時,-1價氫被氧化生成H2,同時得到氯化鈉、硅酸鈉,化學方程式為SiHCl3+5NaOH=Na2SiO3+3NaCl+H2↑+2H2O。②中,AlF3的熔點為1090℃,遠高于AlCl3的192℃,由于F的電負性最大,其吸引電子的能力最強,因此,可推斷鋁氟之間的化學鍵為離子鍵。③中,三種氯化物熔點都比較低,可知都是由結構相似的分子構成的分子晶體,相對分子質量由SiC14至SnCl4遞增,故熔化時需克服的范德華力也遞增,導致熔點升高。④中,由于金剛石和晶體硅都屬于共價晶體,共價晶體中,原子半徑越小,共價鍵鍵能越大,熔點越高,而硅原子半徑大于碳原子,所以鍵能:C—C>Si—Si,金剛石熔點比晶體硅熔點高。
這一類題目,是根據不同物質的性質,進行推理分析,但考查點多數是立足于“同周期”或“周主族”的遞變規律,同學們要學會根據同周期或同主族元素在性質上的相似性和遞變性規律進行分析。
3.分子(離子)的空間結構
分子(離子)的空間結構主要考查價層電子對互斥模型和雜化軌道理論,在近年來的試題中考查的頻率非常高,同學們要高度重視。
角度一:雜化軌道理論
【例5】按要求填空:
①(2023·甲卷)氣態AlCl3通常以二聚體Al2Cl6的形式存在,其空間結構如下圖所示,二聚體中Al的軌道雜化類型為______。
②(2021·甲卷)SiCl4是生產高純硅的前驅體,其中Si采取的雜化類型為______。SiCl4可發生水解反應,機理如下:
含s、p、d軌道的雜化類型有:①dsp2、②sp3d、③sp3d2,中間體SiCl4(H2O)中Si采取的雜化類型為______(填標號)。
③(2021·湖南)N-甲基咪唑( )中碳原子的雜化軌道類型為______。
解析:結合①中信息可知,Al原子與其周圍的4個氯原子形成四面體結構,而且Al原子不可能存在孤對電子,因此可推斷二聚體中A1的軌道雜化類型為sp3。②中,根據SiCl4的結構式可知,Si的價層電子對數為4,故Si采取sp3雜化;根據SiCl4(H2O)的結構式可知Si的價層電子對數為5,采取sp3d雜化。③中,N-甲基咪唑分子中含有甲基和碳碳雙鍵,甲基的碳原子的雜化軌道類型為sp3,而碳碳雙鍵的為sp2。
同學們要特別注意,由于雜化軌道用于形成σ鍵或容納未參與成鍵的孤對電子,因此判斷中心原子與多少個原子成鍵,有多少對孤對電子,就可以夠輕松地判斷中心原子的雜化軌道類型。
角度二:分析分子(離子)的空間結構
【例6】(2023·湖北)價層電子對互斥理論可以預測某些微粒的空間結構。下列說法正確的是
A. CH4和H2O的VSEPR模型均為四面體
B. SO2-3和CO2-3的空間構型均為平面三角形
C. CF4和SF4均為非極性分子
D. XeF2與XeO2的鍵角相等
解析:題干明確用價層電子對互斥理論預測微粒的空間結構,甲烷分子中心原子的價層電子對為4,水分子的中心原子價層電子對也為4,所以CH4和H2O的VSEPR模型都是四面體,A正確;SO2-3的孤電子對為1,CO2-3的孤電子對為0,所以SO2-3的空間構型為三角錐形,CO2-3的空間構型為平面三角形,B錯誤;CH4為正四面體結構,是非極性分子,SF4中心原子有孤電子對,為極性分子,C錯誤;XeF2和XeO2分子中,F、O原子和中心原子結合的電子數目不同,中心原子孤電子對不相等,孤電子排斥力不同,所以鍵角也不相等,D錯誤。
答案:A
【例7】按要求填空:
①(2023·乙卷)SiCl4的空間結構為______ ,
②(2022·廣東)SeO2-4的立體構型為______,
③(2020·課標Ⅰ)磷酸根離子的空間構型為______。
解析:題①中,中心原子Si和四個氯原子成鍵,沒有孤對電子,因此SiCl4的空間結構為正四面體;②中SeO2-4中Se價層電子對數為4+1/2(6+2-2×4)=4 ,其立體構型為正四面體形;③中,PO3-4中P原子不含孤電子對,價層電子對數為4,因此其構型為正四面體形。
這一類題目的難度不大,但要求同學們要明確概念,價層電子對數等于σ鍵電子對數加上中心原子的孤電子對數,不計算π鍵,σ鍵電子對數等于中心原子結合的原子數;此外,同學們也要熟悉中心原子價層電子對數為2~4的分子或離子的空間結構,在考試時才能快速作出判斷。
角度三:分析比較鍵角大小
【例8】按要求填空:
①(2020·山東)NH3、PH3、AsH3的鍵角由大到小的順序為_________ 。
②(2022·北京)比較SO2-4和H2O分子中的鍵角大小并給出相應解釋:______ 。
③(2022·湖南)比較鍵角大小:氣態SeO3分子______SeO2-3離子(填“>”“<”或“=”),原因是______。
解析:根據題目信息,①中,NH3、PH3、AsH3的中心原子都是sp3雜化,都有1對孤電子對,中心原子的電負性越小,成鍵電子對之間的斥力越小,鍵角越小,所以鍵角由大到小的順序為NH3>PH3>AsH3;②中,SO2-4中S原子的價層電子對數為4、孤電子對數為0,離子的空間結構為正四面體形,H2O分子中O原子的價層電子對數為4、孤電子對數為2,分子的空間結構為V形,受孤對電子擠壓,H2O分子的鍵角小于SO2-4的鍵角;③中,SeO3分子中硒原子的價層電子對數為3,孤對電子對數為0,分子的空間構型為平面三角形,鍵角為120°,SeO2-3離子中硒原子的價層電子對數為4,孤對電子對數為1,離子的空間構型為三角錐形,鍵角小于120°,因此氣態SeO3分子的鍵角大于SeO2-3離子的鍵角。
鍵角的比較,一般有下幾種情況:(1)依據雜化方式和空間結構比較,鍵角大小規律:直線形>平面三角形>正四面體形>三角錐形>V形;(2)雜化方式相同,孤電子對數不同,中心原子上孤電子對越多,孤電子對對成鍵電子對的斥力越大,鍵角越小;(3)中心原子不同,配位原子相同,中心原子的電負性越大,鍵角越大,例如NH3的鍵角大于PH3的鍵角;(4)中心原子相同,配位原子不同,配位原子的電負性越大,鍵角越小,例如NF3的鍵角小于NH3的鍵角。
4.晶體類型的判斷與晶胞的分析
晶體類型的判斷與晶胞的分析是高考的熱門考點,前者相對簡單,而晶胞的分析難度較大,對同學們的計算能力和空間觀察能力有較高的要求。
角度一:晶體類型的判斷
【例9】(2021·遼寧)單質硫和氫氣在低溫高壓下可形成一種新型超導材料,其晶胞如下圖。下列說法錯誤的是
A.S位于元素周期表p區
B.該物質的化學式為H3S
C.S位于H構成的八面體空隙中
D.該晶體屬于分子晶體
解析:S元素是第ⅥA族元素,位于元素周期表的p區,A正確;應用均攤法計算,該晶胞中含S原子數為1+1/8×8=2,含H原子數為1/2×6+1/4×12=6,可知該物質的化學式為H3S,B正確;以體心的S為研究對象,其位于面心上的6個H原子構成的八面體空隙中,如圖所示,C正確;該物質為超導材料,而分子晶體不導電,D錯誤。
答案:D
【例10】(2023·山東)-40℃時,F2與冰反應生成HOF利HF。常溫常壓下,HOF為無色氣體,固態HOF的晶體類型為___ ,
解析:根據題目信息,常溫常壓下,HOF為無色氣體,可知HOF的沸點較低,可推斷固態HOF的晶體類型為分子晶體。
這類題目雖然比較簡單,但同學們還是要熟悉四種晶體類型,除了利用基本概念進行判斷,也應熟悉四類晶體的特殊性質,例如熔沸點,分子晶體相對比較低,而離子晶體、共價晶體一般都比較高;又如導電性,分子晶體不能導電,少部分共價晶體能導電,而離子晶體在熔融狀態或水溶液中能導電;縱觀近年來的高考試題,利用宏觀性質判斷晶體類型是常見的考查方式。
角度二:晶胞的分析和計算
【例11】(2023·湖北改編)鑭La和H可以形成一系列晶體材料LaHn,在儲氫和超導等領域具有重要應用。LaHn屬于立方晶系,晶胞結構和參數如圖所示。高壓下,LaH2中的每個H結合4個H形成類似CH4的結構,即得到晶體LaHx。下列說法錯誤的是
A. LaH2晶體中離La最近且等距離的H有8個
B. 晶體中H和H的最短距離:LaH2 > LaHx
C. 在LaHx晶胞中,H形成一個頂點數為40的閉合多面體籠
D. LaHx單位體積中含氫質量的計算式為40/(4.84×10-8)3×6.02×1023g·cm-3
解析:由LaH2的晶胞結構可知,La位于頂點和面心,晶胞內8個小立方體的中心各有1個H原子,若以頂點La研究,與之最近且等距離的H原子有8個,A正確;由LaHx晶胞結構可知,每個H結合4個H形成類似CH4的結構,H和H之間的最短距離變小,則晶體中H和H的最短距離:LaH2 > LaHx,B正確;在LaHx晶胞中,每個H結合4個H形成類似CH4的結構,這樣的結構有8個,頂點數為4× 8=32,且不是閉合的結構,C錯誤;1個LaHx晶胞中含5× 8=40個H原子,含H質量為40/NA g,晶胞的體積為(484.0×10-10cm)3=(4.84×10-8)3cm3,則LaHx單位體積中含氫質量的計算式為40/(4.84×10-8)3×6.02×1023g·cm-3 ,D正確。
答案:C
【例12】按要求填空:
①(2023·甲卷)AlF3結構屬立方晶系,晶胞如圖所示,若晶胞參數為a pm(即立方體邊長),晶體密度ρ=___g·cm-3 (列出計算式,阿伏加德羅常數的值為NA)。
②(2022·廣東)我國科學家發展了一種理論計算方法,可利用材料的晶體結構數據預測其熱電性能,該方法有助于加速新型熱電材料的研發進程。化合物X是通過該方法篩選出的潛在熱電材料之一,其晶胞結構如圖1,沿x、y、z軸方向的投影均為圖2。
X的化學式為______,設X的最簡式的式量為Mr,晶體密度為ρg·cm-3,則X中相鄰K之間的最短距離為______nm(列出計算式,NA為阿伏加德羅常數的值)。
③(2023·乙卷)一種硼鎂化合物具有超導性能,晶體結構屬于六方晶系,其晶體結構、晶胞沿c軸的投影圖如下所示,該物質化學式為___ ,B-B最近距離為______。
解析:題①中,AlF3結構屬立方晶系,即晶胞結構為正方體,晶胞棱上大球個數為12×1/4=3 ,頂點小球個數為8×1/8=1 ,則大球為F—,小球為Al3+,正方體晶胞邊長為a pm,則晶胞的體積為(apm)3=a3×10-30cm3 ,晶胞的質量為84g/NA ,則其晶體密度ρ=84×1030/NA·a3g·cm3 ;
題②中,分析晶胞結構,可知有8個K,個數為8×1/8+6×1/2=4 ,則X的化學式為K2SeBr6,X的最簡式的式量為Mr,晶體密度為ρg·cm-3,設晶胞參數為anm,得到
ρ=m/V=Mrg·mol-1/NA mol-1×4/(a×10-7cm)3=ρg·cm-3,
解得a=3/4Mr/NAρ×107nm ,X中相鄰K之間的最短距離為晶胞參數的一半即1/2×3/4Mr/NAρ×107nm ;題③中,由硼鎂化合物的晶體結構、晶胞沿c軸的投影(即光線平行于c軸)圖可知,Mg位于正六棱柱的頂點和面心,由均攤法可以求出正六棱柱中含有12×1/6+2×1/2=3 個Mg,B在正六棱柱體內共6個,則該物質的化學式為MgB2,由晶胞沿c軸的投影圖可知,B原子在圖中兩個正三角形的中心,根據晶胞參數(棱長和夾角),可計算出B-B最近距離為3/3a。
通過上述例題,同學們可發現晶胞的分析和計算,考查角度是很多的,但重點依然是在落在晶胞的計算上,例如晶胞密度、原子距離等的計算。在這里給同學們提幾點建議:(1)要熟悉常見的晶胞類型,例如常見的長方體形(包含立方晶系)和六方晶系(如例12③),熟悉均攤法在這些晶型中的應用;(2)對于晶胞投影,如果是沿X軸,則光線平行于X軸,如果是在某個面上投影,則光線垂直于該面。(3)平時多觀察分析實際的晶胞模型,強化空間想象能力。(4)計算過程要嚴謹細致,注意單位換算,不漏寫錯寫字母符號。
四、復習備考建議
1.熟練運用物質結構與性質的基本理論,將其作為學習化學的金鑰匙。例如在高考中,常常要求同學們運用原理分析物質的電離能變化、電負性對物質性質的影響等,如果同學們在平時的學習過程中,能經常運用這些理論去認識、解釋常見的化學現象,不但有利于同學們應對高考中的試題,也能不斷深化同學們對化學原理的理解。
2.提高復習的針對性和有效性。物質結構與性質模塊的知識線非常清晰,講授了原子、分子和晶體的相關概念和理論,同學們要把握知識的主線,同時通過歷年來的高考試題,明確核心考點和熱門考點,做到知己知彼,方能百戰不殆,但要提醒同學們的是,在新教材中,有些概念已經刪除,但一些省市的題目仍有提及,例如配位數、晶格能等概念,同學們在碰到這些題目時,可以回避這些概念,減少學習的負擔。總之,應立足教材,有針對性地挑選練習題目,明晰考點,有針對性地復習。
責任編輯 李平安

