多囊卵巢綜合征患者行拮抗劑方案發生卵巢過度刺激綜合征危險因素分析及臨床預測模型的構建
魏藝,凌秀鳳,趙純,李欣
(南京醫科大學附屬婦產醫院/南京市婦幼保健院生殖醫學中心,南京 210004)
因輔助生殖技術中促排卵藥物的使用,卵巢過度刺激綜合征(OHSS)成為一種常見的醫源性并發癥,其主要臨床表現為血雌二醇(E2)升高、多卵泡發育及卵巢增大,嚴重時可致漿膜腔積液、血管栓塞和腎衰竭,嚴重影響患者健康。多囊卵巢綜合征(PCOS)是育齡女性最常見的內分泌異常,約占無排卵性不孕患者的70%[1]。PCOS存在一系列內分泌異常如促性腺激素釋放激素(GnRH)分泌模式改變、雌孕激素負反饋異常、高雄、高胰島素血癥和肥胖等[2]。PCOS是OHSS發生的獨立危險因素[3],PCOS患者由于卵泡數量增多以及對于促性腺激素(Gn)的敏感性增加,其在促排卵過程中更易出現OHSS的傾向。近年來,促性腺激素釋放激素拮抗劑(GnRH-ant)方案因與激動劑長方案相比較,其卵巢刺激時間短、Gn用量低、可顯著降低OHSS發生率,在PCOS患者中得到廣泛應用[4-5]。但仍有研究發現,GnRH-ant方案的中重度OHSS發生率為1.2%~14.3%[4,6]。目前,治療OHSS的方法主要是對癥處理,缺乏確切有效的治療方案,所以有效預防是降低OHSS發生率的重要環節。因此,本研究擬分析PCOS患者行GnRH-ant促排卵過程中發生OHSS的影響因素,構建其發生的預測模型,旨在早期識別有OHSS高危傾向的患者并采取干預措施。
資料和方法
一、研究對象
回顧性分析2015年1月至2022年12月于我院生殖醫學中心行IVF/ICSI治療的PCOS患者。
納入標準:(1)年齡≤42周歲;(2)PCOS診斷根據2003年鹿特丹標準[7],以下3項中滿足2項即確診為PCOS:臨床表現為無排卵/稀發排卵;有高雄激素的臨床表現(或)和有高雄激素血癥;超聲檢查顯示卵巢有多囊樣改變,卵巢體積≥10 ml,和(或)一側或雙側卵巢有12個以上直徑2~9 mm的卵泡;(3)使用GnRH-ant方案促排卵。排除標準:(1)合并其他內外科疾病者;(2)男女任一方存在染色體核型異常者;(3)供精或供卵者。
本研究共納入1 052個促排卵周期。
二、研究方法
1.促排卵方案-拮抗劑方案:在月經周期第2~3天開始使用Gn(果納芬,雪蘭諾,默克,瑞士)150~225 U/d啟動。根據基礎生殖激素水平及患者年齡、體質量指數(BMI)、竇卵泡數(AFC)以及既往周期Gn用量,給予合適的Gn啟動劑量,根據卵泡發育情況及激素水平調整Gn劑量。在優勢卵泡直徑≥14 mm,或E2≥1 100 pmol/L,或LH≥10 U/L時,開始每天皮下注射拮抗劑(思則凱,雪蘭諾,默克,瑞士)0.125~0.250 mg,直至絨毛膜促性腺激素(HCG)注射日。當2~3個主導卵泡徑線≥18 mm并結合E2、LH、孕酮水平,于當晚給予艾澤(雪蘭諾,默克,意大利)250 μg 扳機,35~36 h后行超聲引導下取卵術。
2.OHSS診斷:根據Navot等[8]提出的標準:(1)輕度OHSS表現為卵巢增大(≤5 cm),腹部不適;(2)中度OHSS表現為卵巢增大(>5 cm),惡心或胃腸道反應,腹部不適,實驗室評估正常,輕度腹水,無臨床體征;(3)重度OHSS表現為卵巢增大,重度腹水,胸腔積液,血細胞比容升高(HCT>45%),白細胞計數升高(WBC>15 000個/μ1),肌酐升高,電解質紊亂(低鈉血癥,高鉀血癥),肝功能異常。
3.觀察指標:一般情況、促排卵情況及各節點(基礎生殖激素水平、開始使用拮抗劑時、開始扳機時)的激素水平,以及LH在以上3個時間節點的變化。
三、統計學分析
結 果
一、一般情況及促排卵過程中激素水平比較
本研究共納入1 052個促排卵周期,根據是否患有OHSS分為兩組:因OHSS住院治療的患者周期及符合全胚冷凍中中重度OHSS標準的患者周期為OHSS組(n=61),未發生OHSS及未因OHSS全胚冷凍的患者周期為非OHSS組(n=991)。
一般資料比較:兩組患者間平均年齡、基礎雌激素(bE2)、基礎孕酮比較均無顯著差異(P>0.05),OHSS組bLH、抗苗勒管激素(AMH)、AFC顯著高于非OHSS組(P<0.05),OHSS組BMI、基礎卵泡刺激素(bFSH)、AMH/AFC顯著低于非OHSS組(P<0.05)(表1)。
表1 兩組患者一般情況比較(-±s)
促排卵過程中激素水平比較:兩組患者間拮抗劑啟動日孕酮、扳機日LH、拮抗劑啟動日LH/基礎LH比較均無顯著差異(P>0.05);OHSS組拮抗劑啟動日(LH、E2)、拮抗劑啟動劑量、拮抗劑天數、拮抗劑總量、扳機日(E2、孕酮)均顯著高于非OHSS組(P<0.05);OHSS組Gn啟動劑量、Gn天數、Gn總量、扳機日FSH、扳機日LH/拮抗劑啟動日LH、扳機日LH/基礎LH均顯著低于非OHSS組(P<0.05)(表2)。
表2 兩組患者促排卵過程中生殖激素水平比較(-±s)
二、單因素Logistic回歸分析OHSS相關危險因素
單因素Logistic回歸分析結果顯示,BMI、bLH、bFSH、AMH、AFC、Gn啟動劑量、Gn天數、Gn總量、拮抗劑啟動日(E2、LH)、拮抗劑啟動劑量、拮抗劑天數、拮抗劑總量、扳機日(E2、孕酮、FSH)、扳機日LH/拮抗劑日LH、扳機日LH/bLH等18個因素與OHSS的發生顯著相關(P<0.05)(表3)。
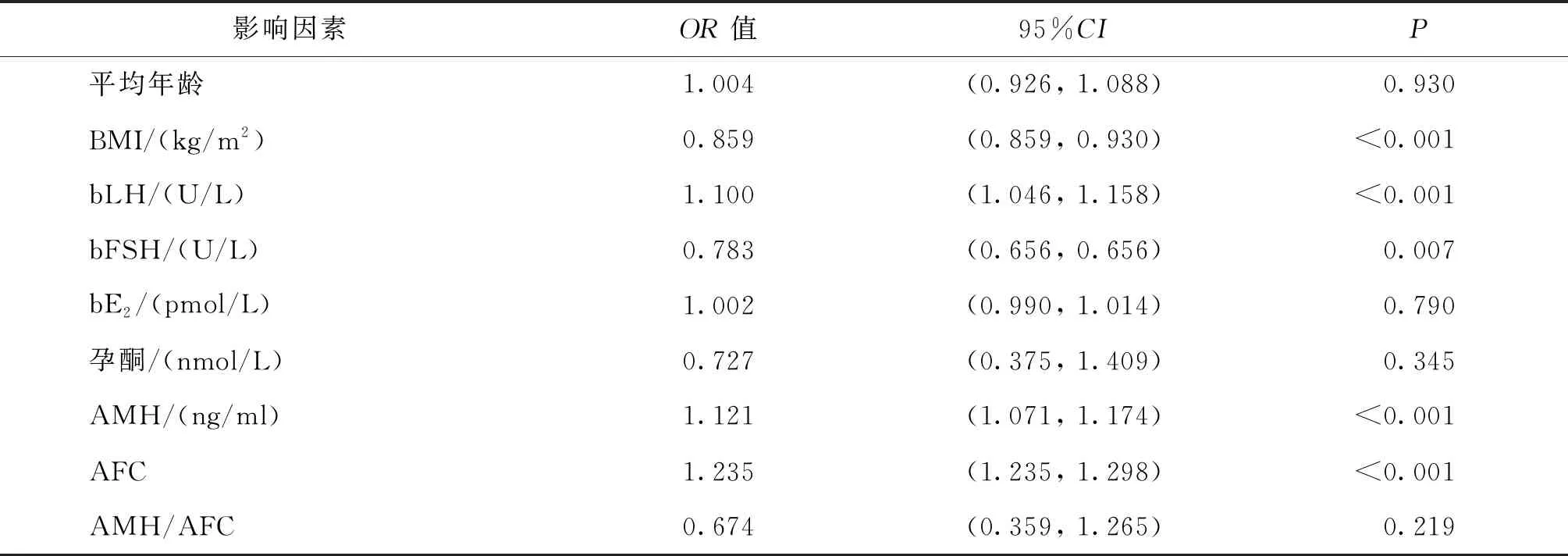
表3 單因素Logistic回歸分析OHSS相關危險因素
三、多因素Logistic回歸分析OHSS相關危險因素
使用R軟件“MASS”包以發生OHSS為因變量,以25個指標作為自變量,采用向后逐步回歸進行變量篩選,共篩選出AFC、Gn啟動劑量、Gn天數、拮抗劑啟動日LH、拮抗劑啟動日孕酮、拮抗劑總量、扳機日(E2、孕酮)8個預測變量。對上述8個變量進行多因素Logistic回歸分析,結果顯示,AFC、Gn啟動劑量、Gn天數、扳機日(E2、孕酮)為OHSS獨立危險因素(P<0.05)(表4)。
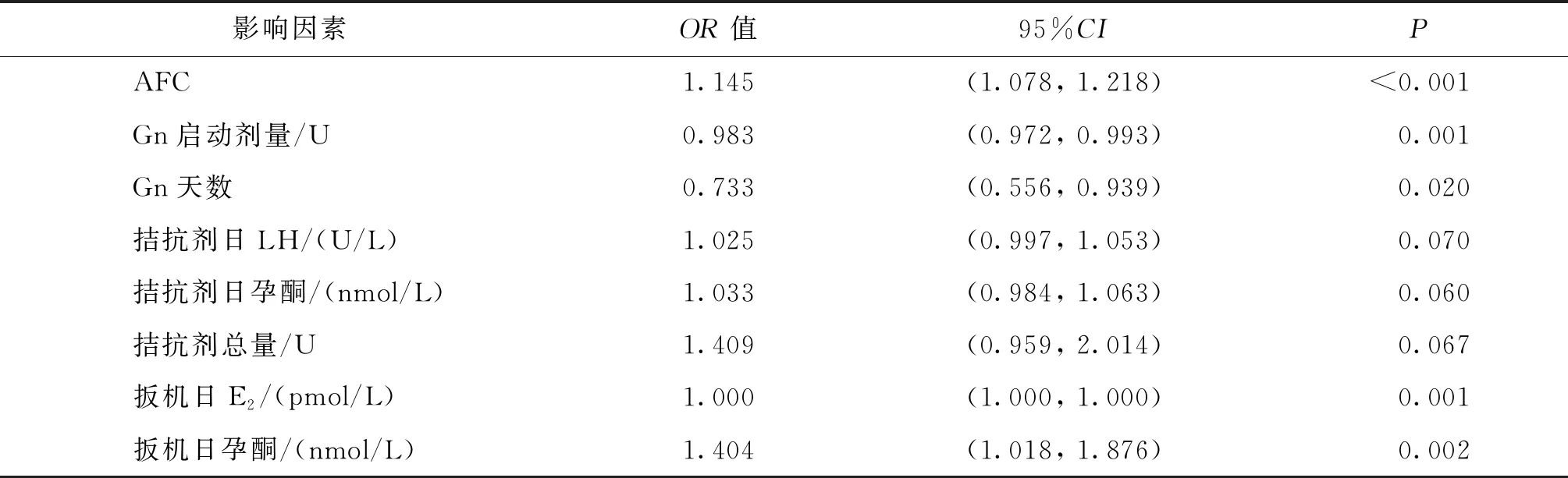
表4 多因素Logistic回歸分析OHSS相關危險因素
四、LASSO回歸分析OHSS相關危險因素
鑒于自變量之間共線性的存在,為評估危險因素篩選可靠性,利用R軟件“Corrplot”、“Glmnet”包對25個變量進行LASSO回歸篩選危險因素并進行交叉驗證,根據最優λ值(λ=0.000 048)篩選出3個預測變量(AFC、扳機日E2及扳機日孕酮),納入LASSO模型(圖1)。
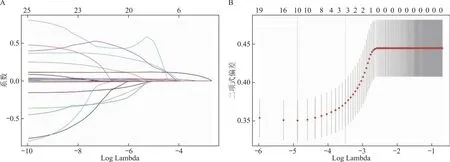
A:LASSO篩選路徑圖;B:LASSO模型交叉驗證篩選最優λ過程圖。圖1 LASSO回歸過程分析圖
五、3種模型的ROC曲線分析
采用R軟件“pROC”包繪制3種預測模型的ROC曲線,根據ROC曲線下面積(AUC)及95%置信區間(95%CI)以評價模型區分度。ROC曲線結果顯示,Logistic單因素模型[AUC=0.874,95%CI(0.834,0.914)],逐步回歸法模型[AUC=0.859,95%CI(0.816,0.902)],LASSO回歸模型[AUC=0.839,95%CI(0.791,0.887)]。根據約登指數(約登指數=敏感度+特異度)最大時選定閾值,其對應的敏感性及特異性分別為,單因素模型的敏感性為73.0%,特異性為86.9%;逐步回歸法的敏感性為68.0%,特異性為91.8%;LASSO回歸的敏感性為64.3%,特異性為91.8%(圖2)。采用R軟件“Caret”包分別對3種模型重抽樣500次進行內部驗證,結果顯示,內部驗證的C-index指數分別為0.830(Logistic單因素模型),0.848(逐步回歸法),0.835(LASSO回歸)。
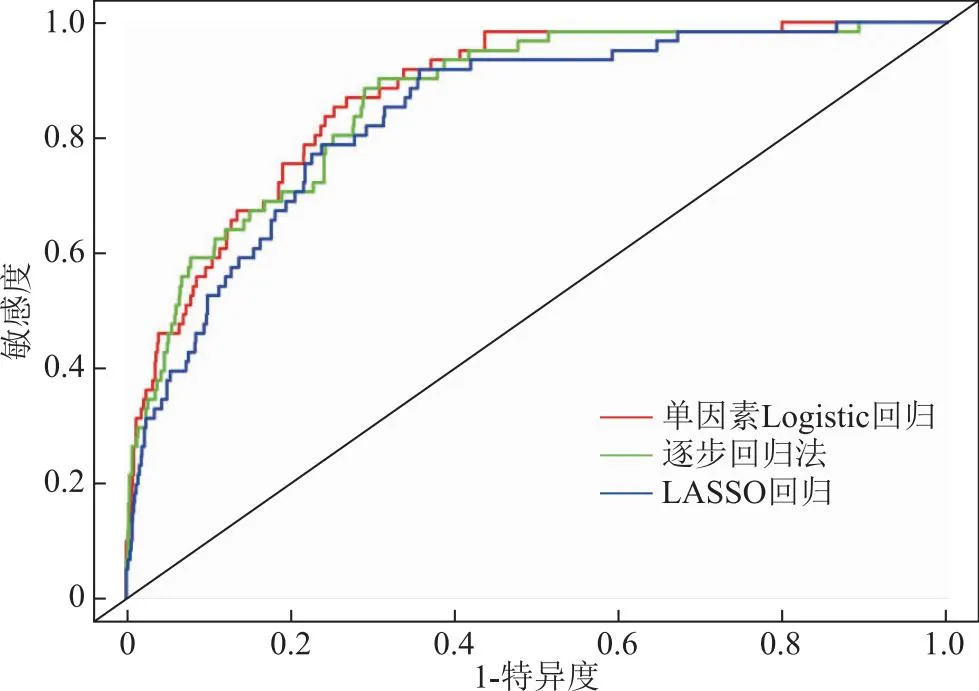
圖2 3種模型預測OHSS發生的ROC曲線
六、3種模型的OHSS預測結果校準度評價
采用R軟件“Resource Selection”、“Rms”包進行Hosmer-Lemeshow擬合優度檢驗評價模型校準度,并繪制OHSS校準曲線。OHSS校準曲線結果顯示,Logistic單因素(χ2=8.473,P=0.389),逐步回歸法(χ2=11.412,P=0.179),LASSO回歸(χ2=13.361,P=0.100),模型的擬合度均較好(P>0.05)(圖3)。
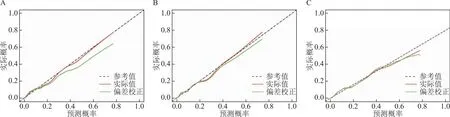
A:Logistic單因素模型;B:逐步回歸模型;C:LASSO回歸模型。圖3 OHSS校準曲線
七、預測模型區分度及校準度的綜合評價
采用R軟件“rms”包繪制Brier評分曲線以綜合評價預測模型的區分度及校準度,結果顯示,臨床預測模型的Brier評分Logistic單因素模型為0.047分,逐步回歸法模型為0.045分,LASSO回歸模型為0.043分,均<0.25分,表明模型的預測能力較好。
八、預測模型的臨床決策(DCA)曲線
采用R軟件“rmda”包繪制預測模型的DCA曲線,結果顯示,3種預測模型的DCA曲線均遠離這兩條較為極端的參考線(全陰性,None,此時凈獲益為0;全陽性,All,此時凈獲益為斜率的負值)(圖4)。
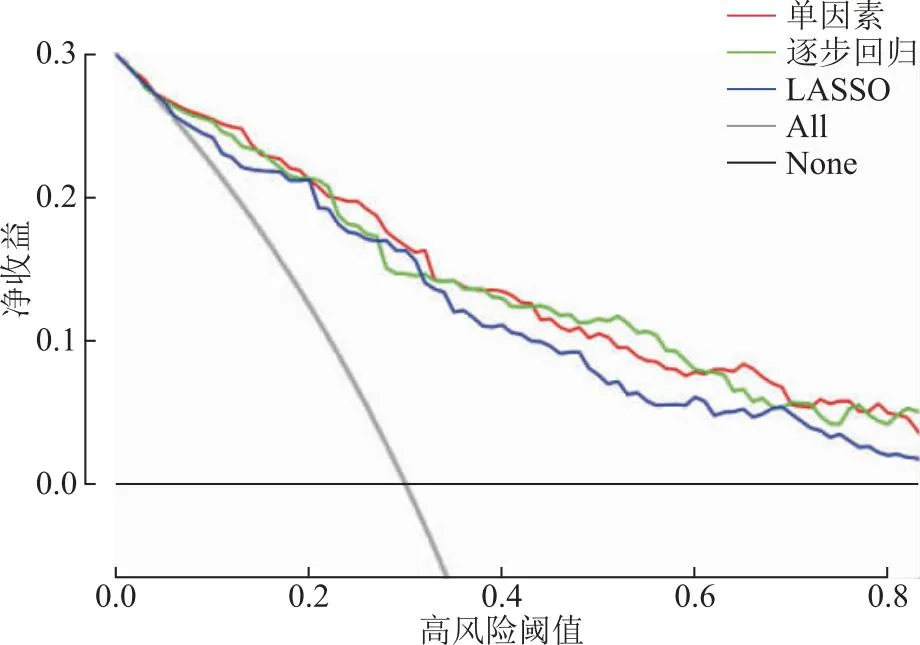
圖4 預測模型的DCA曲線
九、LASSO回歸預測模型列線圖
將LASSO回歸篩選得到的3個因素利用R語言rms包中“lrm”函數建立Logistic回歸模型,使用“Plot”函數進一步制得列線圖評分系統。AFC、扳機日E2及扳機日孕酮的具體分值均垂直對應于第1行得分,AFC、扳機日E2及扳機日孕酮的評分得分相加,即可得到第5行的總得分,每例患者的總得分再垂直對應于OHSS預測風險,即可得到每個患者發生OHSS的概率(圖5)。

圖5 根據LASSO回歸模型預測OHSS的列線圖
討 論
PCOS患者是典型的高反應人群,因其局部高雄環境放大胰島素樣生長因子信號,致其對外源性Gn的敏感性升高,從而使原本較多數量的卵泡進一步募集,致大量卵泡發育,外周血E2顯著升高,誘使OHSS發生。血管生成因子家族的原型成員內皮生長因子(VEGF),調節生理和病理血管生成,也在OHSS的病理生理學中起關鍵作用。卵巢刺激周期中給予HCG后,VEGF導致血管通透性增加,促使液體從血管床到血管外間隙的轉移,促使OHSS發生。PCOS患者卵巢及循環血管VEGF濃度升高與OHSS的發生風險升高相關[9]。
本研究針對患者基本情況、基礎內分泌、用藥各階段激素水平、LH變化量及用藥方案等因素與是否發生OHSS行Logistic單因素回歸分析,得到18個與OHSS發生顯著相關的因素。另外,利用逐步回歸、LASSO回歸進一步限制納入變量,分別構建3種預測模型。3種分別為:Logistic單因素預測模型AUC=0.874,逐步回歸法預測模型AUC=0.859,LASSO回歸法預測模型AUC=0.839,模型預測能力均為中等。其中LASSO回歸篩選獲得的3個因素(AFC、扳機日E2及扳機日孕酮)較好地解釋了OHSS的發生風險,加入逐步回歸法篩選獲得的另外2個因素(Gn啟動劑量、Gn天數)可以稍提升模型效能,單因素分析獲得的其他因素如BMI、bLH及bFSH等與OHSS發生具有顯著相關性,但對模型效能的提升并不顯著。在內部驗證中,C-index指數分別為0.830、0.848、0.835,且校準曲線中驗證組的預測值和實際值基本一致,表明3種模型的評分系統均具有較好的穩定性。擬合優度檢驗,Brier評分,臨床決策曲線結果顯示,3種模型區分度、校準度均相似;LASSO回歸模型的凈獲益稍遜于另外兩種,加入另外2個因素(Gn啟動劑量、Gn天數)分析后,凈獲益曲線與單因素模型相似。
PCOS患者下丘腦釋放的GnRH脈沖頻率改變,以致患者血清LH水平異常升高,同時早期出現LH峰的概率增加。Bosch等[10]研究發現,PCOS患者行GnRH-ant方案時早發性LH峰的概率約26.92%。LH與E2合成密切相關,其直接與卵泡膜細胞上的LH受體結合,刺激合成E2[11-12],由此誘發OHSS。因此,本研究納入拮抗劑治療3個時間節點(基礎水平、拮抗劑啟動日、扳機啟動日)的LH、E2水平進行危險因素篩選。Wang等[13]針對促排卵過程中血清LH變化幅度提出了新的結局預測指標,即扳機日與基礎LH的比值(扳機日LH/bLH)。因此,本研究同時納入拮抗劑啟動日LH/bLH、扳機日LH/拮抗劑啟動日LH、扳機日LH/bLH,分析LH變化與OHSS的相關性。本研究結果顯示,bLH、拮抗劑啟動日LH、扳機日LH/拮抗劑啟動日LH、扳機日LH/bLH均與OHSS的發生顯著相關(P<0.05),提示各階段LH水平,拮抗劑和HCG使用前后LH的變化量均與OHSS發生相關。
AMH、AFC是卵巢儲備標志物,能夠對外源性Gn產生反應[14-15]。血清AMH濃度反映了生長卵泡的數量以及顆粒細胞產生AMH的能力。PCOS患者AMH水平升高,不僅是因為AFC增多所致的累積效應,同時由于患者顆粒細胞合成分泌AMH的能力增強、單個卵泡產生AMH量增加。王馥新等[16]使用AMH/AFC比值代表平均每個卵泡產生AMH量,來反應PCOS患者的卵巢反應性。已有數篇研究證實了AMH、AFC、BMI對PCOS患者卵巢反應性及發生OHSS的風險預測作用[17-20]。因此本研究納入AMH、AFC及AMH/AFC進行危險因素篩選,結果顯示,AMH、AFC均與OHSS相關;AFC則為OHSS重要預測因素。同時扳機日E2、扳機日孕酮與OHSS風險預測顯著相關,其機制可能是卵泡晚期成熟卵泡增多致激素過度分泌。
本研究仍然存在以下局限:本研究屬于單中心回顧性研究,其預測模型還有待于多中心大樣本數據進行驗證;AFC計數具有主觀性,未計入低于所用超聲檢查靈敏度極限的卵泡數目可能導致結果產生偏倚。
綜上所述,AFC、扳機日E2及扳機日孕酮為解釋OHSS發生風險的最重要的3個因素;Gn啟動劑量、Gn天數也與預測OHSS發生風險相關;BMI、bLH、bFSH、AMH、Gn總量、拮抗劑啟動日E2、拮抗劑啟動日孕酮、拮抗劑啟動劑量、拮抗劑天數、拮抗劑總量、扳機日FSH、扳機日LH/拮抗劑啟動日LH及扳機日LH/bLH等與OHSS發生具有顯著相關性,但因對模型效能的提升并不顯著,所以可以不納入預測模型。

